AAV-ITR基因表達微載體在小鼠體內表達
李泰明許麒麟潘俊杰劉曉玫張春
(1. 中國藥科大學 生命科學與技術學院,南京 210009;2. 中國科學院蘇州生物醫學工程技術研究所 中國科學院生物醫學檢驗技術重點實驗室,蘇州 215163)
AAV-ITR基因表達微載體在小鼠體內表達
李泰明1許麒麟1潘俊杰2劉曉玫2張春2
(1. 中國藥科大學 生命科學與技術學院,南京 210009;2. 中國科學院蘇州生物醫學工程技術研究所 中國科學院生物醫學檢驗技術重點實驗室,蘇州 215163)
旨在比較AAV-ITR基因表達微載體及其單體在小鼠不同部位的表達差異,將相同拷貝數的AAV-ITR基因表達微載體和pUC57-minivector-EGFP分別轉入小鼠腦組織,另外將相同拷貝數的AAV-ITR基因表達微載體單體,AAV-ITR基因表達微載體和pUC57-minivector-EGFP轉入小鼠骨骼肌中,比較不同時期組織中的殘余分子數量。熒光定量PCR、顯微熒光觀察以及熒光平均光密度和熒光灰度值分析表明,相同拷貝數的AAV-ITR基因表達微載體單體比AAV-ITR基因表達微載體和pUC57-minivector-EGFP具有更高的轉染效率,其穩定性也優于AAV-ITR基因表達微載體。結果顯示,AAV-ITR基因表達微載體單體在動物體內具有高效表達安全穩定的特點,有望成為基因治療中一種安全可靠,穩定高效的新型載體。
基因治療;基因表達微載體;腺相關病毒(AAV);RT-PCR;組織切片
基因治療是人類治療腫瘤、傳染病、遺傳病的新方向。基因治療要依靠轉染性高、安全有效的基因載體,尋找安全有效的基因治療載體是當今基因治療領域的研究熱點。應用于基因治療的載體分為病毒載體和非病毒載體兩大類。病毒載體在基因治療方面雖然有著較高的轉染效率和很強的靶向性,但是其作為攜帶外源目的基因的載體在導入宿主細胞時,不可避免的存在致癌、致毒等風險。這些缺點使得病毒載體在基因治療領域受到了一定的限制[1-3]。在非病毒載體中,質粒載體在基因治療中一直占據重要地位,但是傳統質粒有著不可避免的缺點,包括:基因沉默化,未甲基化的序列抑制基因的表達[4];含有抗性基因序列等細菌序列[5];基因片段大等。而基因表達微載體能夠有效的避免質粒基因表達載體的外源基因沉默化,能夠穩定存在于機體組織中。
基因表達微載體是指不含有細菌復制子序列,抗菌素抗性基因序列等細菌DNA序列,而只有基因表達所需要的基本元件,如基因表達啟動子、目的基因和加尾系列(poly A),其外源基因能有效表達的環狀的DNA分子[6,7]。基因表達微載體不含或很少含細菌、病毒DNA序列,大大減少了非宿主細胞的DNA,特別是細菌DNA的CpG序列、抗菌素抗性基因等,從而可以減少基因治療過程中所引起的機體免疫反應、細胞炎癥、細胞毒性等不良副作用[8]。基因表達微載體的分子數量越小,細胞轉化效率以及基因表達效率就越高[9]。目前,針對pDNA的改造有制備成微環DNA(mini-circle DNA)和線性共價閉合微環DNA(mini-linear covalently closed,minilcc)[10-12]。二者都是盡可能的刪除潛在可能會引發機體免疫反應以及干擾載體整合效率的序列。研發一種能安全、長期、高效、穩定表達外源基因的新型基因表達載體,將大大促進基因治療在人類中應用的進程。
本實驗通過昆蟲細胞Sf9制備得到的AAV-ITR微載體是一種基于腺相關病毒倒置末端重復序列(Inverted terminal repeats,ITR)的單鏈基因表達微載體,僅含有AAV基因組的兩端的ITR序列和中間的基因表達框序列。在Sf9中制備得到的微載體無質粒中CpG序列、抗菌素的抗性基因序列,因此可以減少傳統質粒載體在基因治療過程中的各種不良副作用以及抗生素基因產生的抗藥性,并且能夠安全穩定,長期高效的表達外源基因。然而,微載體在生產過程中不僅產生單體,還極易形成二聚體和多聚體等多種形式。通過構建產生的pUC57-minivector-EGFP質粒包含pUC57質粒和AAV-ITR微載體序列。因此,本實驗以pUC57-minivector-EGFP質粒為對照研究微載體的單體和多種形式混合體在小鼠組織中的表達效率和穩定性,以期為今后該微載體攜帶治療基因在體內的表達提供依據。
1 材料與方法
1.1 材料
AAV-ITR基因表達微載體,pUC57-minivector-EGFP質粒由中科院蘇州醫學工程技術研究所檢驗室構建保存。Lipofectamine 2000 轉染試劑購自Invitrogen公司。Cole氏蘇木素染色液(常規染色)、加拿大樹膠購自北京索萊寶科技有限公司。水合氯醛、多聚甲醛、無水葡萄糖等均為國產分析純以上。瓊脂糖粉購自Biowest公司。氯化鈉注射液購自湖北天藥藥業股份有限公司。注射用頭孢哌酮鈉舒巴坦鈉購自蘇州中化藥品工業有限公司。DL5000 marker購自TaKaRa公司。質粒提取試劑盒購自Axygen公司。膠回收試劑盒購自Biomiga公司。DNeasy Blood & Tissue Kit購自QIAGEN公司。Go Taq qPCR Master Mix購自上海睿安生物科技有限公司。微量注射器購自上海高鴿工貿有限公司。5-6 周齡雄性 ICR 小鼠、高壓飼料、進口墊料、小鼠籠等購自上海斯萊克實驗動物有限公司。全自動腦立體定位儀、注射進樣器、顱骨鉆等購自Stoeltingde公司。
1.2 方法
1.2.1 載體的制備 首先制備和鑒定本研究中所涉及到的pUC57-minivector-EGFP 質粒、AAV-ITR基因表達微載體和AAV-ITR基因表達微載體單體。pUC57-minivector-EGFP 質粒已經由本實驗室構建完成,可以通過直接轉化sure 2大腸桿菌感受態細胞,然后挑選單克隆菌落培養后進行驗證并擴增,通過購自Axygen公司的質粒提取試劑盒抽提pUC57-minivector-EGFP 質粒,并通過Not I單酶切鑒定。AAV-ITR基因表達微載體的制備需將Sf9 細胞培養處于指數增長期至 2×106cells/mL時,按 MOI=2 加入兩種重組桿狀病毒P3代的 Baculovirus-inrep和Baculovirus-ITR-EGFP,繼續培養72 h后,抽提得到微載體,并通過電泳驗證AAV-ITR基因表達微載體單體與多聚體的存在。通過購自Biomiga公司的膠回收試劑盒可回收AAV-ITR基因表達微載體單體,并以Xho I單酶切鑒定AAV-ITR基因表達微載體單體。
1.2.2 基因表達微載體轉染小鼠大腦皮層 參考國內外文獻[13-16],選擇NMDA損傷動物模型,應用目前最廣泛的皮層以及紋狀體立體定向注NMDA致腦損傷模型。由文獻[13,15]可知,小鼠腦內注射,注射量不得超過5 μL,因此,將注射的拷貝數縮減為4×1011。根據公式:樣品拷貝數(copies/μL)=樣品濃度(ng/μL)×10-9×6.02×1023(阿伏伽德羅常數)/樣品分子量(堿基對數 bp×648),可計算4× 1011各樣品的注射量。將 5-6 周的 ICR 雄性小鼠隨機分成 3個組,每組20只,分別通過腦立體定位儀對小鼠進行立體定向腦皮層注射pUC57-minivector-EGFP 質粒、AAV-ITR基因表達微載體和5%的滅菌葡萄糖溶液。首先,麻醉小鼠,腹腔注射5%的水合氯醛(按0.1 mL/10 g,每只注射 0.3 mL,麻醉時間為2 h左右)。剪去頭部鼠毛,75%酒精消毒皮膚,沿中線切開頭皮長約1.5 cm,用無菌棉簽棒蘸取H2O2分離骨膜,暴露顱骨骨縫。使用腦立體定位儀確定鉆孔位置:前囟后2.5 mm,中線右側0.5 mm,進針深度2 mm,顱骨鉆開直徑約1 mm圓孔。使用皮升注射泵按照1 μL/min的速度注入5 μL溶液(4×1011相同拷貝數的pUC57-minivector-EGFP 質粒、AAV-ITR基因表達微載體用量加入1 μL 轉染試劑后用 5%的滅菌葡萄糖溶液補至 5 μL),留針5 min后,緩慢拔針。縫合頭皮,肌注青霉素鈉(25 g重小鼠為300 000 U,首次每只注射0.2 mL,隨后每天注射0.1 mL,連續3 d)。將小鼠放回鼠籠,精心飼養。
大腦皮層表達效果及穩定性檢測:上述各實驗組中的小鼠分別于3 d、7 d、14 d、一個月和兩個月的時間點各處死4只,斷頭,暴露出腦組織。其中一只取出完整的存在注射部位的右半腦,置于4%多聚甲醛中,用于制作切片觀察熒光比例,另外3只于注射部位取出約25 mg的腦組織,使用購自QIAGEN公司的DNeasy Blood & Tissue Kit提取腦組織DNA用于做qPCR。做腦組織切片觀察熒光比例,同時為了更加準確的分析,提取腦組織中的DNA通過Real-time PCR 分析二者的降解情況。
1.2.3 基因表達微載體轉染小鼠骨骼肌 將5-6 周的 ICR 雄性小鼠隨機分成4個組,每組16只,通過50 μL微量注射器將拷貝數為4×1010(由于AAVITR基因表達微載體單體由膠回收得到,得率較低,注射拷貝數縮減為4×1010)的pUC57-minivector-EGFP 質粒、AAV-ITR基因表達微載體、AAV-ITR基因表達微載體單體和5%的滅菌葡萄糖溶液注射入小鼠右后肢骨骼肌。
小鼠骨骼肌表達效果及穩定性檢測:上述各實驗組中的小鼠分別于3 d、7 d、15 d和一個月的時間點分別處死4只,暴露出后肢骨骼肌,其中一只取出完整的存在注射部位的骨骼肌,置于4%多聚甲醛中,用于制作切片觀察熒光比例。另外3只于注射部位取出約25 mg的骨骼肌組織,使用購自QIAGEN公司的DNeasy Blood & Tissue Kit提取腦組織DNA用于做qPCR。
1.2.4 制作石蠟切片及熒光顯微分析 將取材后以4%多聚甲醛溶液固定的小鼠右半腦和后肢骨骼肌進行脫水,再經純酒精和二甲苯各半的混合液浸漬1 h后轉入二甲苯中浸漬1 h來進行透明,對透明后的材料進行浸蠟處理。浸蠟完全后,將組織置于融化的固體石蠟中完成包埋。最后按4 μm厚度在小鼠腦組織注射部位及骨骼肌注射部位附近均勻切割蠟塊完成切片的制作。將切片按照注射的不同載體和時間標號后置于熒光顯微鏡下觀察并拍攝熒光圖(激發波長 488 nm,發射波長 507 nm)。
1.2.5 Image J軟件統計分析熒光切片 將拍攝得到的熒光圖通過 Image J(National institutes of health)測量其平均光密度值(Ostu 校準方法)、組織熒光面積或平均灰度值,用以反映不同載體的表達強度。平均光密度值通過灰度圖黑白反轉后校正光密度并選擇合適的閾值,排除背景干擾,使得轉染成功的腦組織細胞被全部選中,統計出所選定細胞在圖片中的面積及其IOD(所選細胞光密度的總和)值。IOD值與細胞熒光面積的比值即為平均光密度值。組織熒光面積(area)或平均灰度值(Mean gray value)的統計方法與平均光密度值相似。再將所得數值進行方差分析(SPSS 17.0 Inc,Chicago,USA)并繪制折線圖以比較各載體的表達效率。
1.2.6 Real-time PCR 比 較 分 析DNA存留分子數分別收取不同時間點各組載體注射的小鼠的腦組織或骨骼肌,然后用QIAGEN全基因組提取試劑盒進行總 DNA 抽提。設計并由上海生工生物工程合成一對 EGFP 片段引物,上游引物5'-CGGAATTCATGGT GAGCAAGGGCGAGG-3'和下游引物 5'-GCTCTAGAT TACTTGTACAGCTCGTCCAT-3'以 SYBGreen 為熒光染料進行 Real-time PCR,比較上述各載體的不同時間段的分子殘留量。并將所得各組數據以 表示,采用多個樣本均數間方差分析及兩兩比較的 t檢驗進行統計學分析。對組內不同時間段的比較與相同時間段內各組間比較,可分析各載體在不同時間段內的殘余分子量大小及不同載體間的降解情況,以比較上述3種載體在小鼠體內穩定性和轉染效率之間的差異。
2 結果
2.1 載體的鑒定
pUC57-minivector-EGFP 質粒通過Not I單酶切鑒定,可得到約2 000 bp和2 700 bp兩條條帶,與預期相符(圖1-C)。通過電泳驗證AAV-ITR基因表達微載體單體與多聚體結果(圖1-A)顯示,2000與3 000 bp之間的條帶約為2.7 kb,與預期AAVITR基因表達微載體單體條帶大小相符,由于AAVITR基因表達微載體單體在細胞內極易形成二聚體和多聚體,而在5 000-6 000 bp處的條帶則符合其二聚體5.4 kb的大小,由此推算得到其余條帶依次為三聚體以及多聚體。用Xho I單酶切鑒定,應得到2 048 bp,670 bp的條帶,大小與預期相符(圖1-B)。
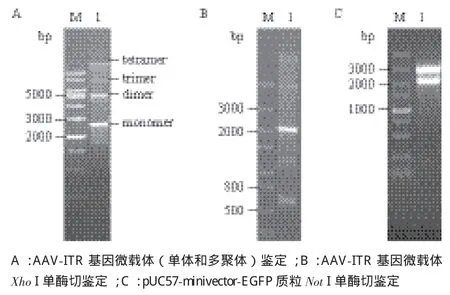
圖1 AAV-ITR基因微載體與pUC57-minivector-EGFP的鑒定
2.2 各載體注射小鼠腦部的結果分析
2.2.1 載體注射小鼠腦部的表達效率分析 在小鼠腦部注射4×1011copies的AAV-ITR基因表達微載體和pUC57-minivector-EGFP后的3、7和14 d的腦組織切片熒光顯微鏡分析(圖2-I)顯示,可明顯看出pUC57-minivector-EGFP在14 d時的表達情況下降非常明顯,低于AAV-ITR基因表達微載體14 d時的表達,差異顯著(圖2-I中Cb、Cc),說明此時,pUC57-minivector-EGFP在小鼠組織中已大量降解。圖2-I D為小鼠腦部注射AAV-ITR基因表達微載體和pUC57-minivector-EGFP一個月后的腦組織切片熒光顯微圖,由于圖2-I中D與圖2-I中的A、B、C所示切片不屬于同一批次且此次切片更接近于注射針孔,不能將其進行共同比較。但是可以明顯看出一個月以后AAV-ITR基因表達微載體在小鼠腦組織中的表達效率依然較高且顯著高于pUC57-minivector-EGFP的表達。將通過熒光顯微境觀察拍攝得到的熒光圖(圖2-I中A、B、C)通過 Image J(National institutes of health)做半定量分析,測量其平均光度值(Ostu 校準方法),用以反映不同載體的表達強度。將計算所得平均光密度值通過折線圖表示(圖2-II)。可以明顯看出小鼠腦部注射AAV-ITR基因表達微載體后3 d(圖2-II中Ab)、7 d(圖2-II中Bb)和14 d(圖2-II中Cb)時AAV-ITR基因表達微載體表達情況均高于pUC57-minivector-EGFP的表達情況(圖2II中Ac、Bc、Cc),且AAV-ITR基因表達微載體的表達效果在7-14 d內沒有明顯變化(圖2II中Bb、Cb),表明AAV-ITR基因表達微載體此段時間較為穩定。由此可推斷AAV-ITR基因表達微載體較pUC57-minivector-EGFP 在小鼠大腦皮層中的表達效率更高且表達更穩定。
2.2.2 Real-time分析大腦皮層中載體分子的殘余量 4×1011copies的AAV-ITR基因表達微載體和pUC57-minivector-EGFP在小鼠腦部不同時間段的表達Real-time PCR 分析結果(表1)顯示,AAV-ITR基因表達微載體的CT值在3、7、14、30和60 d的時間點均小于pUC57-minivector-EGFP,說明AAVITR基因表達微載體轉染效果較pUC57-minivector-EGFP更好,大腦皮層內殘余分子數量更多。隨著時間的延長,pUC57-minivector-EGFP和AAV-ITR基因表達微載體的CT值均有逐漸增加的趨勢。pUC57-minivector-EGFP在14 d時的CT值已基本接近空白對照,AAV-ITR基因表達微載體在兩個月時的CT值與空白對照相比仍有差異。可初步判斷pUC57-minivector-EGFP和AAV-ITR基因表達微載體在腦組織中的殘余分子數量在60 d內均有不同程度的降解,但AAV-ITR基因表達微載體在小鼠腦組織中比pUC57-minivector-EGFP具有更高的轉染效率,而且AAV-ITR基因表達微載體在小鼠腦組織中要更加穩定,不易降解。
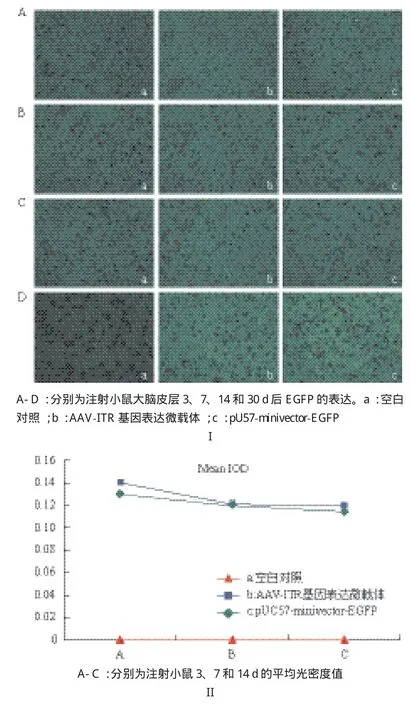
圖2 AAV-ITR基因表達微載體、pUC57-minivector-EGFP注射小鼠大腦皮層的EGFP表達(I)及平均光密度值(II)
對表1中的小鼠腦組織中AAV-ITR基因表達微載 體、pUC57-minivector-EGFP 3、7、14、30和 60 d的殘留分子數RT-PCR所得的CT值分別使用函數TTEST進行t檢驗。結果(表2)顯示,小鼠腦組織中的pUC57-minivector-EGFP 和AAV-ITR基因表達微載體殘余分子數量在注射后3-7 d的時間段內的t檢驗所得數值表明在此時間段內小鼠腦組織中的pUC57-minivector-EGFP 和AAV-ITR基因表達微載體殘余分子數量的下降量并無顯著差異。在3-14 d的時間段內,小鼠腦組織中的AAV-ITR基因表達微載體殘余分子數量下降有顯著的差異,而pUC57-minivector-EGFP的殘余分子數量下降極其顯著。由表3可以明顯的看出AAV-ITR基因表達微載體和pUC57-minivector-EGFP在小鼠腦部直到14 d時的轉染效率與空白相比分別有極顯著差異和無明顯差異。AAV-ITR基因表達微載體在小鼠腦部的殘余分子數量在30 d時與空白對照依然有著顯著差異,表明AAV-ITR基因表達微載體相對于pUC57-minivector-EGFP有著更高的轉染效率和更好的穩定性。

表1 小鼠腦組織中AAV-ITR基因表達微載體、pUC57-minivector-EGFP殘留分子數RT-PCR的CT值

表2 小鼠腦組織中AAV-ITR基因表達微載體和pUC57-minivector-EGFP各時間段的RT-PCR的CT值分析
2.3 各載體注射小鼠骨骼肌的結果分析
2.3.1 載體注射小鼠骨骼肌的表達效率分析 小鼠骨骼肌注射AAV-ITR基因表達微載體單體、AAVITR基因表達微載體和pUC57-minivector-EGFP后3、7和15 d組織切片熒光顯微境觀察拍攝得到的熒光圖片(圖3-I),通過 Image J(National institutes of health)處理,調整閾值范圍,使得轉染成功的肌肉組織被全部標記,勾選軟件測量工具中的面積統計功能,統計出被標記的肌肉組織面積以充分說明各微載體的轉染效率(圖3-II)。或者通過計算其平均灰度值來表示不同載體的表達強度(圖4)。結果顯示,骨骼肌注射后3 d時AAV-ITR基因表達微載體單體的表達量(圖3-II中Ab)明顯高于AAVITR基因表達微載體(圖3-II中Ac)和pUC57-minivector-EGFP(圖3-II中Ad)。而此時AAV-ITR基因表達微載體的表達量(圖3II中Ac)同pUC57-minivector-EGFP(圖3-II中Ad)相當,這點從其灰度值分析(圖4中Ac、Ad)也能很好的體現。7 d時AAV-ITR基因表達微載體單體的表達量(圖3-II中Bb)有一定程度地降低,但仍然明顯高于AAVITR基因表達微載體(圖3-II中Bc),此時pUC57-minivector-EGFP的表達量已顯著降低(圖3-II中Bd)。15 d時AAV-ITR基因表達微載體單體的表達量依然較高(圖3-II中Cb),此時pUC57-minivector-EGFP(圖3-II中Cd)和AAV-ITR基因表達微載體(圖3-II中Cc)大部分已降解。計算平均灰度值分析結果也明顯表示出AAV-ITR基因表達微載體單體在3、7和15 d(圖4中Ab、Bb、Cb)時均保持較高水平,且明顯高于AAV-ITR基因表達微載體(圖4中Ac、Bc、Cc)和pUC57-minivector-EGFP(圖4中Ad、Bd、Cd)。充分表明AAV-ITR基因表達微載體與pUC57-minivector-EGFP相比表達時間更長且轉染效率更好,但卻不及AAV-ITR基因表達微載體單體。
表3 AAV-ITR基因表達微載體和pUC57-minivector-EGFP注射不同時間后的RT-PCR的CT值分析
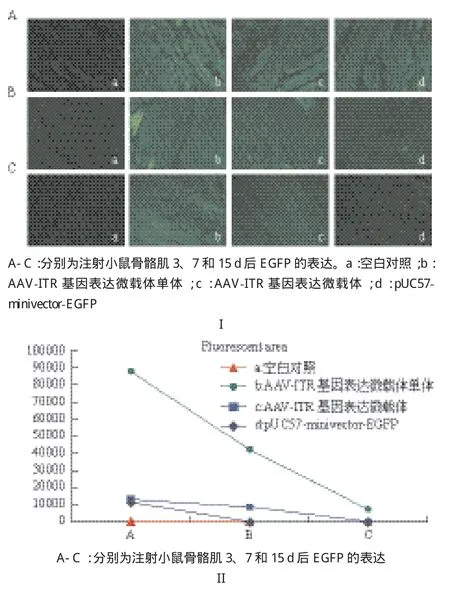
圖3 AAV-ITR基因表達微載體單體、AAV-ITR基因表達微載體和pUC57-minivector-EGFP注射小鼠骨骼肌EGFP表達結果(I)及EGFP成功表達的骨骼肌面積(II)
2.3.2 Real-time分析骨骼肌中載體分子的殘余量 為了比較AAV-ITR基因表達微載體單體在小鼠體內的轉染效率和穩定性是否優于AAV-ITR基因表達微載體,將4×1010copies的AAV-ITR基因表達微載體及其單體和pUC57-minivector-EGFP注射入小鼠骨骼肌后3、7、15和30 d后對其進行Realtime PCR。所得CT值結果(表4)顯示,AAV-ITR基因表達微載體單體、AAV-ITR基因表達微載體和pUC57-minivector-EGFP在30 d內CT都有較為明顯的增長,AAV-ITR基因表達微載體單體增長幅度較低,且各時間段CT值均最低,前7 d內CT值無明顯變化,一個月后,其數值仍低于空白對照。AAVITR基因表達微載體30 d內增加幅度次之,一個月后,其數值與空白對照相當。pUC57-minivector-EGFP的CT值增加更加明顯,一周時已與空白對照無明顯差異。可以初步判斷AAV-ITR基因表達微載體單體相比于AAV-ITR基因表達微載體和pUC57-minivector-EGFP具有更好的穩定性,更加不易降解。
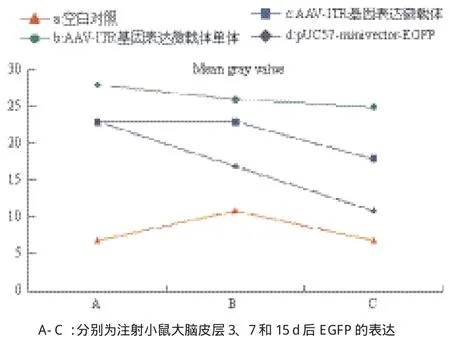
圖4 AAV-ITR基因表達微載體單體、AAV-ITR基因表達微載體和pUC57-minivector-EGFP注射小鼠大腦皮層EGFP表達灰度值
為了進一步說明AAV-ITR基因表達微載體單體在小鼠體內的轉染效率和穩定性是否優于AAVITR基因表達微載體,將4×1010copies的AAV-ITR基因表達微載體及其單體和pUC57-minivector-EGFP注射入小鼠骨骼肌后3、7、15和30 d的Real-time PCR所得CT值進行配對t檢驗分析。表5顯示,在小鼠肌肉注射后的3-7 d的時間段內,AAV-ITR基因表達微載體單體在小鼠骨骼肌中殘余分子數量沒有下降;AAV-ITR基因表達微載體的殘余分子數量有顯著下降;pUC57-minivector-EGFP的殘余分子數量下降極顯著。從表6中可以明顯的看出AAV-ITR基因表達微載體單體在小鼠骨骼肌中的殘余分子數量在注射后一個月時與空白相比仍然有著極顯著差異,而AAV-ITR基因表達微載體在15 d時與空白已表現出顯著差異。AAV-ITR基因表達微載體單體與AAV-ITR基因表達微載體相比隨著時間的增長,雖然差異有所減小,但是在一個月時仍有著顯著差異,而與pUC57-minivector-EGFP相比,30 d內的各個時間段均有著極顯著的差異。由此可以充分表明AAVITR基因表達微載體在小鼠骨骼肌中雖然比pUC57-minivector-EGFP有著更好的穩定性和更高的表達效率,但卻均不及AAV-ITR基因表達微載體單體。
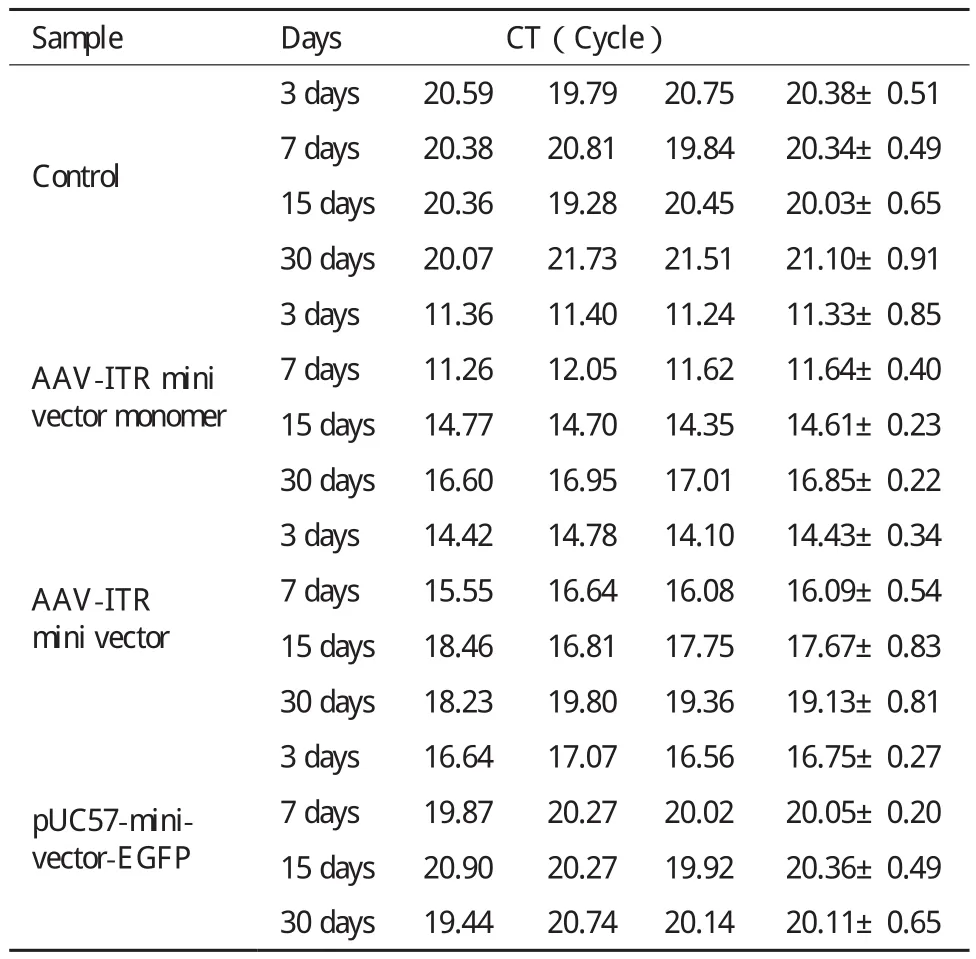
表4 小鼠骨骼肌中AAV-ITR基因表達微載體、pUC57-minivector-EGFP 的殘留分子數RT-PCR的CT值
3 討論
目前,病毒基因表達載體是用于基因治療的主要基因表達載體,AAV病毒載體在基因治療中得到廣泛應用[18-20]。通過腺相關病毒本身結構方面所具有的優越性[21-23]和線性共價閉合微環狀DNA 載體[24-26]的構造特點。構建出AAV-ITR 單鏈 DNA 微載體,具有結構簡單且安全高效等優點[27]。AAVITR單鏈DNA微載體高效表達效率的主要因素在于微載體兩端的AAV-ITR結構。AAV-ITR為一段125 bp的核苷酸序列,能自我互補形成倒T型發卡結構。末端所形成的穩定的環狀結構使得整個微載體的結構更加的穩定[23],末端發夾結構的ITR不僅可以引發AAV單鏈基因組合成第二條鏈,還可幫助其在細胞中形成穩定的環狀多聚體和類染色質結構,從而使外源基因能穩定表達,所以 ITR 結構的存在又賦予此載體較高的穩定性和表達效率[28]。
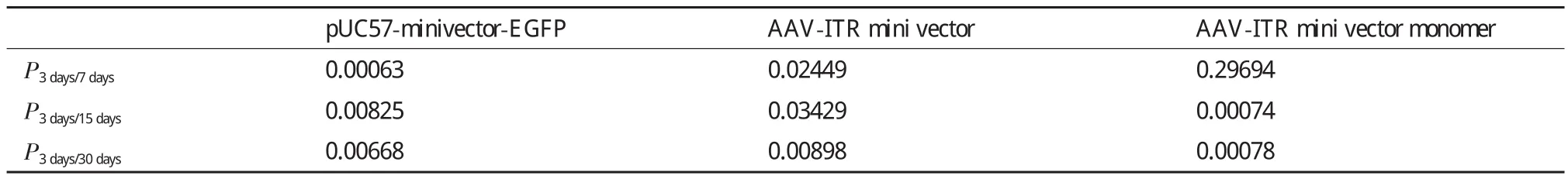
表5 小鼠骨骼肌中AAV-ITR基因表達微載體單體、微載體和pUC57-minivector-EGFP各時間段的RT-PCR的CT值分析
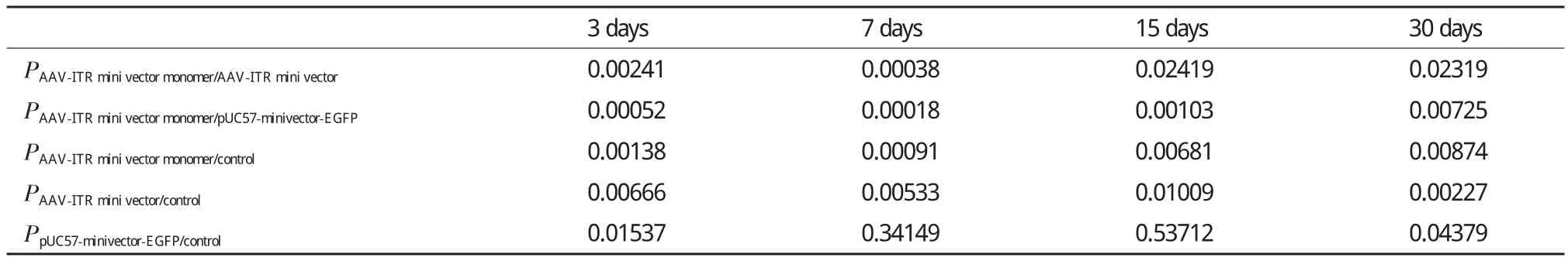
表6 AAV-ITR基因表達微載體單體、微載體和pUC57-minivector-EGFP注射后的RT-PCR的CT值分析
但是由于制備得到的AAV-ITR基因表達微載體是單體、二聚體以及多聚體的混合物,轉染進入細胞之后,單聚體可以更快的進行表達,而二聚體以及多聚體的存在使微載體DNA降解比質粒降解要緩慢持續時間更久。本研究通過對AAV-ITR基因表達微載體和pUC57-minivector-EGFP在小鼠大腦皮層的表達結果分析可以明顯看出,14 d時AAV-ITR基因表達微載體的降解有著顯著差異,而pUC57-minivector-EGFP的降解差異極顯著,此時pUC57-minivector-EGFP與空白對照已無明顯差異。AAVITR基因表達微載體在一個月時與空白相比還有顯著差異,兩個月時雖然差異不顯著但仍然有著一定的差異。可以充分說明AAV-ITR基因表達微載體在小鼠大腦皮層中比pUC57-minivector-EGFP有更高的穩定性和更好的表達效率。AAV-ITR基因表達微載體單體、AAV-ITR基因表達微載體和pUC57-minivector-EGFP在小鼠骨骼肌中的表達結果分析表明,在一個月的時間內,pUC57-minivector-EGFP最早在一周時已顯示出與空白對照無明顯差異,AAVITR基因表達微載體在半個月時還表現出與空白對照的顯著差異,而AAV-ITR基因表達微載體單體直到一個月時仍然與空白對照有著極顯著差異。而且,在同時間段內,AAV-ITR基因表達微載體單體的CT值總是最低。由此可見,AAV-ITR基因表達微載體單體在體內的表達效率和穩定性都明顯優于AAVITR基因表達微載體和pUC57-minivector-EGFP質粒。分析其原因,可能是由于二聚體與多聚體兩端的AAV-ITR結構處于線性狀態,不易形成倒T型發卡結構,在動物體內主要以游離狀態存在,對其穩定性有一定的影響。而單體在動物體內以 ITR 3'末端作為引物合成第二條鏈,形成一個穩定的環狀結構。此外還有可能通過末端重復序列進一步形成環狀多聚體,提高載體的穩定性。所以,AAV-ITR基因表達微載體單體在體內的表達效率和穩定性均更有優越性。但是由于實驗中AAV-ITR基因表達微載體單體必須通過膠回收得到,收率較低。目前已有報道可以在酵母和昆蟲細胞中成功表達制備AAV-ITR 單鏈 DNA[29,30],后續實驗除了進一步研究AAV-ITR基因表達微載體的價值外,還將著力研究如何能有效的避免多聚體的生成,得到含量更高的單體。
4 結論
通過本研究充分證明了AAV-ITR基因表達微載體是一種具有較高轉染、表達效率以及穩定性高的基因轉移載體。
[1]Seow YQ, Wood MJ. Biological gene delivery vehicles:beyond viral vectors[J]. Molecular therapy, 2009, 17(5):767-777.
[2]郭勇, 曾慶平. 基因治療藥物的研究進展[J]. 藥物生物技術, 1996(3):181-186.
[3]Marshall E. Gene therapy death prompts review of adenovirus vector.[J]. Science, 1999, 286(5448):2244-2245.
[4]Chen ZY, He CY, Meuse L, et al. Silencing of episomal transgeneexpression by plasmid bacterial DNA elements in vivo[J]. Gene Therapy, 2004, 11(10):856-864.
[5]Pang AS. Production of antibodies against Bacillus thuringiensis delta-endotoxin by injecting its plasmids. [J]. Biochem Biophys Res Commun, 1994, 202(3):1227-1234.
[6]Bartlett JS. Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors[J]. J Virol, 2000, 74(6):2777-2785.
[7]Sanlioglu S. Endocytosis and nuclear trafficking of adeno-associated virus type 2 are controlled by rac1 and phosphatidylinositol-3 kinase activation[J]. J Virol, 2000, 74(19):9184-9196.
[8]Akache. A two-hybrid screen identifies cathepsins B and L as uncoating factors for adeno-associated virus 2 and 8[J]. Mol Ther, 2007, 15(2):330-339.
[9]Zaiss AK. Differential activation of innate immune responses by adenovirus and adeno-associated virus vectors[J]. J Virol, 2002, 76(9):4580-4590.
[10]Weindler FW, Heilbronn R. A subset of herpes simplex virus replication genes provides helper functions for productive adenoassociated virus replication[J]. J Virol, 1991, 65(5):2476-2483.
[11]Summerford. AlphaVbeta5 integrin:a co-receptor for adenoassociated virus type 2 infection[J]. Nat Med, 1999, 5(1):78-82.
[12]Qing K. Human fibroblast growth fa ctor receptor 1 is a co-receptor for infection by adeno-associated virus 2[J]. Nat Med, 1999, 5(1):71-77.
[13]Bakowska JC, Di Maria MV, C amp SM, et al. Targeted transgene integration into transgenic mouse fibroblasts carrying the full-length human AAVS1 locus mediated by HSV/AAV rep(+)hybrid amplicon vector[J]. Gene Ther, 2003, 10(19):1691-1702.
[14]Huttner NA, Girod A, Schnittqer S, et al. Analysis of site-specific transgene integration following cotransduction with recomb inant adeno-associated virus and a rep encodingplasmid[J]. J Gene Med, 2003, 5(2):120-129.
[15]Manno CS. AAV-mediated factor IX gene transfer to s keletal muscle in patients with severe hemophilia B[J]. Blood, 2003, 101(8):2963-2972.
[16]Maguire AM, High KA, Auricchio A, et al. Safety and efficacy of gene transfer for Leber’s congenital amaur osis[J]. N Engl J Med, 2008, 358(21):2240-2248.
[17]李泰明, 潘俊杰, 祁靜, 等. 昆蟲細胞制備 AAV-ITR 基因表達微載體[J]. 生物工程學報, DOI:10. 13345/j. cjb. 140485.
[ 18]Alberts B. The breakthroughs of 2009. [J]. Science, 2009, 326(5960):1589.
[19]Yla-Herttuala S. Endgame:glybera finally recommended for approval as the first gene therapy drug in the European union[J]. Mol Ther, 2012, 20(10):1831-1832.
[20]Miller N. Glybera and the future of gene therapy in the European Union[J]. Nat Rev Drug Discov, 2012, 11(5):419.
[21]Henckae rts E, Linden RM. Adeno-associated virus:a key to the human genome? [J]. Future Virol, 2010, 5(5):555-574.
[22]Coura Rdos S, Nardi NB, The state of the art of adeno-associated virus-based vectors in gene therapy[J]. Virol J, 20 07, 4:99.
[23]Grieger JC, Samulski RJ. Adeno-associated virus as a gene therapy vector:vector development, production and clinical applicati ons[J]. Adv Biochem Eng Biotechnol, 2005, 99:119-145.
[24]Kobelt D, Schleef M, Schmeer M, et al. Performance of high quality minicircle DNA for in vitro and in vivo gene transfer[J]. Mol Biotechnol, 2013, 53(1):80-89.
[25]Mayrhofer P, Iro M. Gene Vaccines[M]. Thalhamer J, Weiss R, Scheiblhofer S, Editors. Springer Vienna, 2012:297-310.
[26]Maniar LEG, Maniar JM, Chen ZY, et al. Minicircle DNA vectors achieve sustained expression reflected by active chromatin and transcriptional level[J]. Mol Ther, 2013, 21(1):131-138.
[27]Mayrhofer P, Schleef M, Jechlinger W. Gene Therapy of Cancer[M]. Methods in Molecular BiologyTM, 2009:87-104.
[28]Duan D, Yan Z, Yue Y, et al. Structural analysis of adenoassociated virus transduction circular intermediates[J]. Virology, 1999, 261(1):8-14.
[29]Cervelli T, Backovic A, Galli A. Formation of AAV single stranded DNA genome from a circular plasmid in Saccharomyces cerevisiae[J]. PLoS One, 2011, 6(8):e23474.
[30]Li L, Dimitriadis EK, Yang Y, et al. Production and characterization of novel recombinant adeno-associated virus replicative-form genomes:a eukaryotic source of DNA for gene transfer[J]. PLoS One, 2013, 8(8):e69879.
(責任編輯 馬鑫)
Gene Expression of AAV-ITR Mini Vector in Mice vivo
LI Tai-ming1XU Qi-lin1PAN Jun-jie2LIU Xiao-mei2ZHANG Chun2
(1. School of Life Science and Technology,China Pharmaceutical University,Nanjing 210009;2. Key Laboratory of Biomedical Inspection Technology,Suzhou Institute of Biomedical Engineering and Technology,Chinese Academy of Sciences,Suzhou 215163)
In order to compare the expression difference between AAV-ITR expression mini vector and its monomers in different parts of mice,the same copy number of AAV-ITR mini vector and pUC57-minivector-EGFP were separately transferred into the brain of mice. In addition,the same copy number of monomers of AAV-ITR mini vector and pUC57-minivector-EGFP were transferred into mouse skeletal muscle,and the number of residual molecules were compared in the different tissues at different periods. Analysis by florescence quantitative PCR,microscope observation,average optical density,and gray value showed that monomers of AAV-ITR mini vector in the same copy number had higher transfection efficiency and more stable than AAV-ITR mini vector and pUC57-minivector-EGFP. The comprehensive results suggest that the monomers of AAV-ITR mini vector present the feature of efficient,secure and stable expression,which may be expected to become a novel,secure,reliable,stable,and efficient vector in gene therapy.
gene therapy;gene expression mini vector;adeno-associated virus(AAV);RT-PCR;skeletal muscle section
10.13560/j.cnki.biotech.bull.1985.2016.05.033
2015-08-03
國家自然科學基金項目 (81371670) ,江蘇省自然科學基金項目(BK20140381)
李泰明,女,博士,研究方向:對糖尿病有治療作用的功能肽研究;E-mail:taimingli@163.com
劉曉玫,女,博士,研究方向:基因治療;E-mail:liuxm@sibet.ac.cn
張春,男,博士,研究方向:基因治療;E-mail:zhangchun@sibet.ac.cn

