固定化漆酶在循環冷卻水系統除油中的應用
劉 芳, 張 雙, 呂玉翠, 樊豐濤, 陸津津, 趙朝成, 王永強, 孫 娟
(中國石油大學 化學工程學院,山東 青島 266555)
固定化漆酶在循環冷卻水系統除油中的應用
劉芳, 張雙, 呂玉翠, 樊豐濤, 陸津津, 趙朝成, 王永強, 孫娟
(中國石油大學 化學工程學院,山東 青島 266555)
摘要:采用包埋法、交聯法和包埋-交聯法固定化漆酶,對比了3種固定化漆酶與游離酶的酶學性質。將最佳固定化漆酶投加于柴油泄漏循環水中,考察其對泄漏油品的去除效果。結果表明,交聯法固定化漆酶活性最好,為0.66 U/g,包埋-交聯法固定化酶最差,為0.38 U/g;固定化提高了漆酶酸堿穩定性和熱穩定性。在100 mL柴油質量濃度為120 mg/L、pH值為6的循環水中,加入9 g固定化酶量,反應6 h,包埋法固定化漆酶除油率僅為24%,而交聯法固定化漆酶除油率高達77%。
關鍵詞:漆酶; 固定化; 活性; 循環水; 石油; 降解
物料泄漏入循環冷卻水系統,會影響循環冷卻水水質,加劇設備腐蝕和微生物孳生[1-2],增加企業的生產及維護成本[3],是石油煉化企業面臨的共性問題。因此,研制新型材料,消除物料泄漏造成的不利影響,是石油煉化企業積極推進清潔發展、節約發展的迫切需要。
漆酶(Laccase, EC1.10.3.2)是一種含銅多酚氧化還原酶,可以催化各種酚型和非酚型的化合物發生氧化反應,同時將氧還原成水。最早由日本學者Yoshida在樹漆中發現了漆酶的成分,隨后法國人Bertrand正式確定為漆酶[4]。漆酶大多來自真菌、高等植物和細菌[5],作為生物催化劑,具有高效、專一、溫和、環保等特點[6],已經得到國內外的廣泛關注。漆酶的作用底物非常廣泛,能夠催化氧化多種難降解的有機污染物,在食品工業、染料脫色、廢水處理、生物傳感器等方面具有重要的應用價值[7]。然而,游離的漆酶蛋白在作用過程中易受環境條件影響而變性失活,限制了其工業化應用,提高漆酶的穩定性是研究漆酶必不可少的過程。羅開昆等[8]提出了漆酶的固定化技術,將水溶性漆酶以物理或化學的方法固定在有機或無機載體上,形成不溶于水的具有酶活性的酶衍生物。這樣,在極端的環境中,既能保持酶的催化活性,又能克服游離酶的缺點,具有穩定、易分離、可重復利用等優點。
漆酶在不同載體上成功固定的研究很多。例如,Lloret等[9]將酶共價固定在Eupergit(一種共聚物)上,獲得的酶活性較好,但是酶底物親和力較差。張書祥等[10]將漆酶固定在尼龍網載體上,用戊二醛交聯,但酶活回收率需要提高。此外,也有納米材料固定化漆酶[11]用于生物傳感器,活性炭吸附與海藻酸鈉凝膠結合固定漆酶對二氯酚脫氯[12]等的研究。
王偉宸[13]、尚偉龍[14]和陳新芳[15]分別采用酶法(包括辣根過氧化物酶和漆酶)處理含油廢水的相關研究,并且取得了較好的除油效果。筆者分別采用海藻酸鈉包埋法、殼聚糖交聯法和包埋-交聯法固定化漆酶,比較了這3種方法獲得的固定化漆酶的酶學性質,選出最優的固定化方法,并將固定化漆酶用于去除循環冷卻水系統泄漏的油品,研究固定化漆酶的應用效果。
1實驗部分
1.1樣品
漆酶(10000 U),生化試劑,夏盛實業集團有限公司產品。海藻酸鈉、愈創木酚,化學純;殼聚糖,生化試劑;戊二醛(25%質量分數)、琥珀酸、無水氯化鈣、無水硫酸鈉,分析純,均為國藥集團化學試劑有限公司產品。石油醚(60~90℃)、乙酸、氫氧化鈉、95%(體積分數)乙醇、濃硫酸、氯化鈉,分析純,均為西隴化工股份有限公司產品。
直餾柴油,購于江蘇新海石化有限公司。實驗用循環水,取自青島某煉化企業的循環冷卻水系統。
1.2漆酶活性的測定方法
1.2.1游離酶的活性測定
取8 mL摩爾濃度為50 mmol/L的琥珀酸鈉(pH值為4.5)緩沖液,加入0.04 mmol愈創木酚(1 mL 95%乙醇中溶有4.5 μL愈創木酚)和1 mL稀釋的漆酶溶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液),組成10 mL反應體系,25℃恒溫水浴中反應30 min后,采用上海元析儀器有限公司UV6000-PC紫外可見分光光度計,于465 nm波長處測定吸光度。
定義1 min內催化氧化1 μmol愈創木酚的酶量為酶活單位(U/mL),游離酶的酶活B1可由式(1)計算。
(1)
式(1)中,V為反應體系總體積,mL;V1為加入酶液體積,mL;A為吸光度;t為反應時間,min;ε為愈創木酚吸光系數,ε465=1.21×104L/(mol·cm);L為比色光徑,cm,本實驗中L=1 cm。
1.2.2固定化酶的活性測定
采用上述反應體系,加入1 g固定化酶,在25℃恒溫水浴中反應30 min,取出后測定465 nm處吸光度。以每g載體的酶活力(U/g) 表示固定化酶酶活B2,由式(2)計算。
(2)
式(2)中,m為加入固定化酶的質量,g。
1.3固定化漆酶的制備
1.3.1包埋法
稱取4 g的海藻酸鈉溶于200 mL蒸餾水中,攪拌使海藻酸鈉完全溶解成為均勻的膠體。在海藻酸鈉膠體中加入總酶活為50 U的酶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液),攪拌使混合均勻。使用規格為10 mL的一次性注射器將混合好的海藻酸鈉酶液逐滴滴到2%質量分數的氯化鈣溶液中,形成球狀。靜置20 min后,放于25℃的恒溫水浴搖床上振蕩固定4 h,取出過濾,用蒸餾水進行3~5次抽濾,室溫下干燥,得到的球狀物就是包埋法固定化酶,按照固定化漆酶的測定方法測定其酶活性。
1.3.2交聯法
稱取6 g的殼聚糖粉末溶于200 mL 1%質量分數的乙酸中,玻璃棒攪拌,使其成為均勻膠體。用注射器將殼聚糖膠體逐滴加到2 mol/L的NaOH溶液中,使膠體形成球狀顆粒,在滴球的過程中注意不要讓球滴間接觸,避免球滴之間相互黏在一起。靜置使其全部成為球狀顆粒后,用蒸餾水洗去NaOH溶液,抽濾至中性,在室溫下干燥,得到球狀殼聚糖載體。
取2 g殼聚糖載體放入1.5%質量分數戊二醛溶液中,在25℃的水浴搖床上振蕩10 min,靜置交聯20 h。交聯完畢后用蒸餾水抽濾洗去多余的戊二醛,室溫干燥,得到交聯后殼聚糖載體。
將殼聚糖載體按照每g需1 mL漆酶液的比例放入總酶活為50 U的漆酶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液)中,25℃恒溫水浴搖床中以150 r/min速率固定8 h。蒸餾水洗去載體表面的酶液,抽濾,室溫下干燥,得到交聯法固定化酶,按照固定化漆酶的測定方法測其酶活性。
1.3.3包埋-交聯法
在2%質量分數的海藻酸鈉凝膠內加入總酶活為50 U的漆酶溶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液),包埋。海藻酸鈉凝膠無氣泡后用10 mL 注射器滴入0.5%質量分數的CaCl2溶液中形成球狀載體,固定6 h后,洗凈抽濾。然后將球狀載體放到1.5%質量分數的戊二醛中,恒溫水浴振蕩10 min,交聯靜置20 h。交聯完畢后用蒸餾水洗去多余的戊二醛,抽濾,室溫干燥,得包埋-交聯法固定化酶,按照固定化漆酶的測定方法測其酶活性。
1.4固定化漆酶的酶學性質的測定
1.4.1最適pH值及酸堿穩定性的測定
在pH值介于2.5~7.0之間的8 mL琥珀酸鈉系列緩沖溶液中分別加入1 mL 總酶活為50 U的酶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液)或 1 g 固定化酶,室溫下放置30 min后,再按照漆酶活性測定方法分別測定各組酶活性。
1.4.2最適溫度及熱穩定性的測定
在含有8 mL琥珀酸鈉緩沖溶液(pH=4.5)的小燒杯中加入1 mL總酶活為50 U的酶液(pH=4.5的琥珀酸鈉緩沖液稀釋的酶溶液)或1 g固定化酶,分別放入溫度為15、25、35、45、55、65℃的恒溫水浴中30 min,取出,按照漆酶活性測定方法分別測定酶活性。
1.5固定化酶處理含油循環冷卻水實驗
前期研究表明,當循環水中含油質量濃度為120 mg/L時,掛片腐蝕率最大,故在含油質量濃度120 mg/L的100 mL循環水樣中加入1.5~9 g固定化酶,調節水樣pH值(3~8),置于25℃恒溫水浴搖床反應1.5~9 h。結束后先將水樣中的固定化酶全部撈出,中止反應。測剩余油質量濃度。
循環水樣中的泄漏油為柴油,在20℃時密度0.839 g/cm3,屬輕質柴油;35℃下黏度較小,為3.26 mm2/s;柴油中的Zn和Fe的質量分數分別為2.38 μg/g和0.91 μg/g 。采用紫外分光光度法測定水樣中柴油含量[16],測定波長225 nm,石油醚為參比溶液,用10 mm石英比色皿測定吸光度,根據實驗得出的標準曲線Y=0.0374X+0.0221(R2=0.9991)及式(3)計算柴油質量濃度c。然后由式(4)計算除油率X。
(3)
(4)
式(3)中,c0為待測溶液柴油質量濃度,mg/L;V1為水樣體積,mL;V2為待測溶液體積,mL;n為溶液稀釋倍數。
循環水樣取自青島某煉化企業,按《水和廢水監測分析方法》[17]分析水質指標,分析結果如表1所示。根據循環水水質特點,確定處理含油循環水的控制條件。

表1 實驗使用的循環水水質
1) Based on CaCO3
2結果與討論
2.1漆酶的3種固定化方法對比
圖1為包埋法、交聯法以及包埋-交聯法3種方法得到的固定化漆酶的活性對比。由圖1看到,包埋法、交聯法和包埋-交聯法所得固定化漆酶活性分別為0.52 、0.66 和0.38 U/g,交聯法固定化漆酶活性最好,包埋法次之,包埋-交聯法最差。圖2為3種酶的固定化形成過程,所得固定化漆酶外觀如圖3所示。
由圖3可見,包埋法所得的固定化漆酶顆粒大小均勻,彈性較大,機械強度好,邊緣光滑;交聯法所得的固定化漆酶活性高,彈性大,邊緣十分光滑,固定化漆酶較殼聚糖載體變色效果明顯,顏色越深所固定酶越多,但施加較大壓力會破碎,機械強度差;包埋-交聯法所得固定化漆酶活性低,彈性小,但穩定性好,這個結果與徐國英等[18]的研究相同。由此可以得出,3種方法都有各自的優缺點。油的降解與酶活的高低有直接的關系[19]。包埋-交聯法與包埋法原理基本相同,由于采用的交聯劑戊二醛在載體表面形成了致密的保護膜而使載體強度增大,從而使固定化漆酶穩定性增強,酶不易流失,造成酶活性不高。因此,只采用了包埋和交聯兩種固定化漆酶用于含油循環水的除油研究。
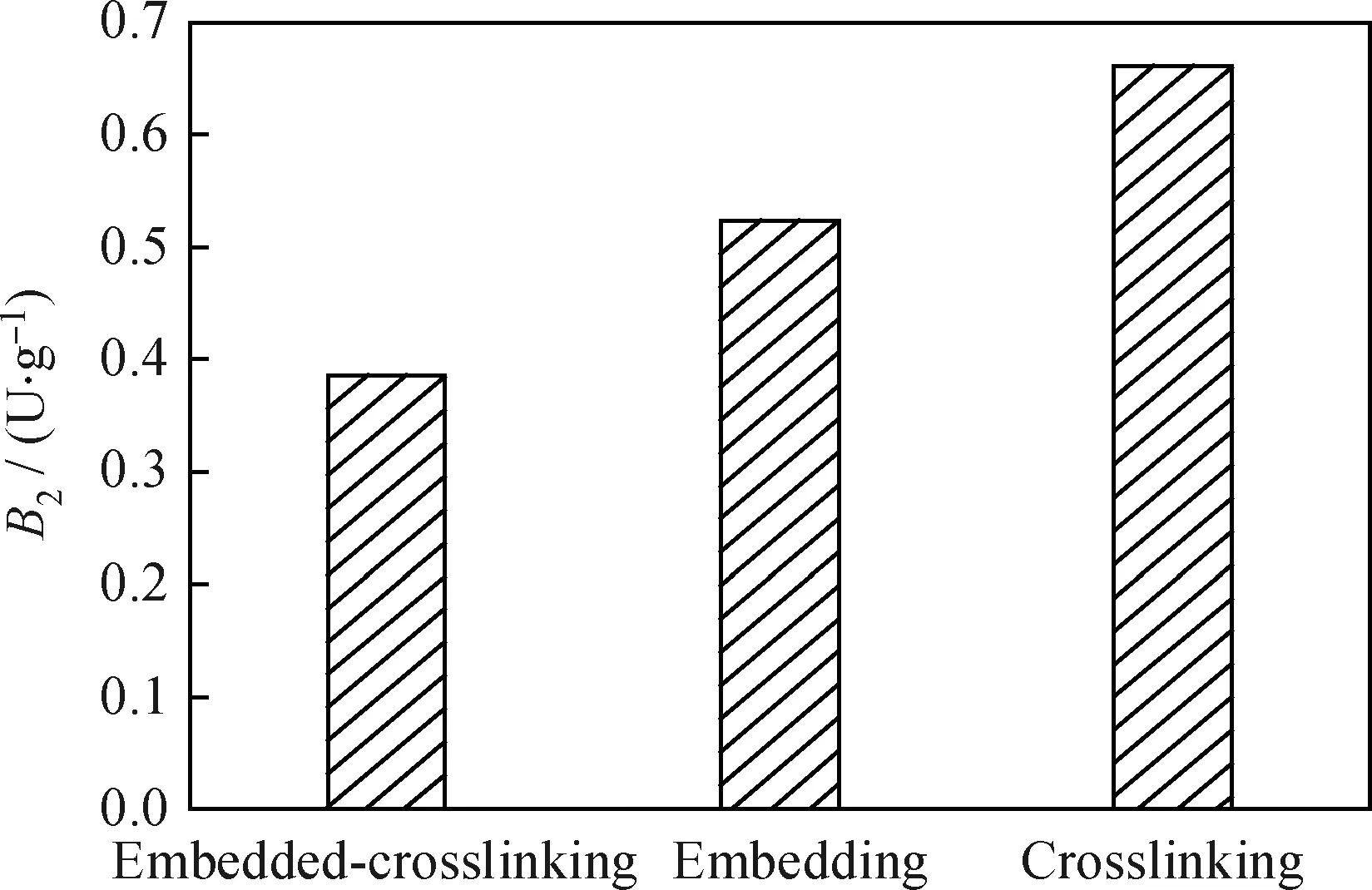
圖1 3種不同方法制備的固定化漆酶活性對比
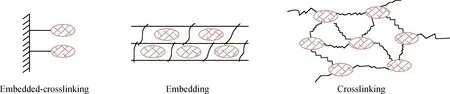
圖2 3種不同方法制備固定化酶的形成機理

圖3 3種不同方法制備的固定化漆酶的外觀
2.2固定化漆酶的酶學性質
2.2.1最適pH值及酸堿穩定性
pH值的變化可以改變漆酶分子和底物的帶電狀態,從而影響漆酶活性部位及底物的解離狀態,對催化反應造成影響[20]。圖4為游離漆酶和包埋法、交聯法固定化漆酶的相對酶活隨pH值的變化。圖4表明,游離漆酶的最適pH值為3.5,交聯法固定化漆酶最適pH值為3,包埋法固定化漆酶最適pH值為4.5。交聯法固定化漆酶的pH值向酸性偏移,對酸的適應性增強;包埋法固定化漆酶的pH值向堿性偏移,對堿的適應能力增強。最適pH值的變化是由載體的靜電荷決定的,殼聚糖為陽離子型載體,其表面具有游離氨基,使得固定化酶周圍的微環境內呈弱堿性,因而要求溶液必須較自由漆酶最適pH 值低,才能達到交聯法固定化漆酶的最適pH值[21]。
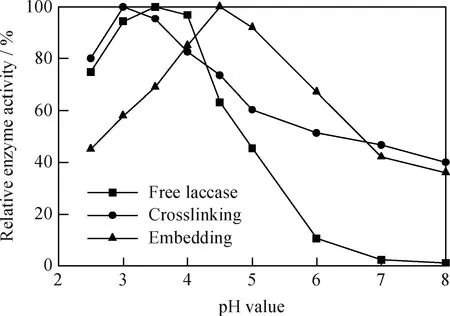
圖4 游離漆酶和包埋法、交聯法固定化漆酶的
由圖4還看到,pH值在4.5~8時,固定化漆酶和游離漆酶的相對活性隨pH值的增加而降低,固定化漆酶的相對活性變化比游離漆酶緩慢,交聯法固定化漆酶的活性降低速率小于包埋法固定化漆酶的降低速率;兩種固定化漆酶的相對活性都比游離漆酶高,游離漆酶在pH=8時,相對活性幾乎為零,而兩種固定化漆酶的活性都在40%左右。由此可知固定化漆酶對酸堿的適應性比游離漆酶增強了。
2.2.2最適溫度及熱穩定性
圖5為游離漆酶和包埋法、交聯法固定化漆酶的相對酶活隨溫度的變化。由圖5看到,隨著溫度的升高,固定化漆酶和游離漆酶相對活性均先增大后減小,兩種固定化漆酶相對活性在45℃時達到最大值,而游離漆酶相對活性在35℃達最大值。與游離漆酶相比,固定化漆酶的最佳反應溫度提高了10℃,說明固定化漆酶的耐熱能力較游離漆酶強。實驗所得最適溫度與張書祥等[22]的固定化漆酶55℃、游離漆酶50℃的結果不同,可能是漆酶來源不同產生的差別。溫度為35~65℃時,游離漆酶的相對活性降低速率大于固定化漆酶,固定化漆酶的相對活性高于游離漆酶;65℃時,游離漆酶相對活性接近零,而兩種固定化漆酶的相對活性還剩60%左右。由此可得,固定化漆酶較游離漆酶具有一定的熱穩定性。酶固定化后,分子之間、酶與載體之間的相互作用使得漆酶分子結構鋼性增強[23],因而熱穩定性得到了明顯提高。
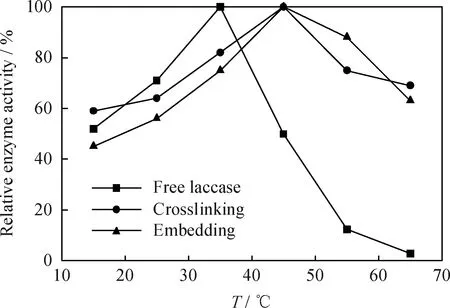
圖5 游離漆酶和包埋法、交聯法固定化漆酶的
2.3影響固定化漆酶處理含油循環冷卻水除油率的因素
2.3.1固定化漆酶給酶量的影響
固定化漆酶量的多少會直接影響除油效果。給酶量太少時,固定化酶與含油水樣接觸不充分,除油效果差;給酶量太多,催化氧化反應會有抑制作用,破壞酶的活性中心,使酶失去催化功能。對含油質量濃度120 mg/L的100 mL水樣,結合固定化酶的性質與循環水水質特點調節其pH值為6,25℃下恒溫水浴搖床反應6 h,考察交聯法與包埋法固定化漆酶量與除油率的關系,結果示于圖6。圖6表明,交聯法固定化漆酶的除油效果隨給酶量的增加而增大,9 g的給酶量時,除油率可以達到77%左右,除油效果較好;而包埋法固定化漆酶的除油效果不明顯,也沒有規律,除油率最高只能達到24%左右。包埋法固定化漆酶的除油效果差,可能是水樣中的油附在了載體表面,堵塞了載體上的空隙,使得酶大部分不能釋放出來,能發揮作用的酶量有限,與給酶量關系不大。從交聯法固定化漆酶和包埋法固定化漆酶處理含油循環水的成本看,前者為0.016 RMB/mg油,后者為0.018 RMB/mg油(4.905 RMB/g殼聚糖,1.764 RMB/g海藻酸鈉;實驗中漆酶為液體溶液,價格便宜,少量使用可忽略成本),所以除油因素考察以交聯法固定化漆酶為主。
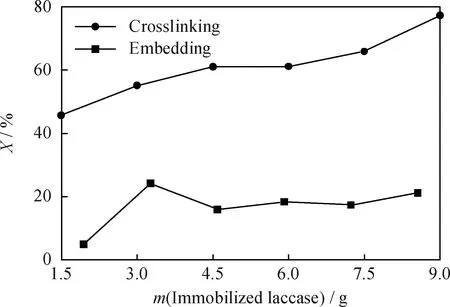
圖6 除油率(X)與交聯法和包埋法固定化漆酶量的關系
2.3.2反應時間的影響
反應時間長可以使固定化漆酶與水樣中的油充分接觸,除油效果更佳,缺點是長時間的反應可能會使酶失活變性。考慮到經濟性,選用給酶量分別為1.5 g和3 g,調節水樣pH值為6,25℃下恒溫水浴搖床反應,對100 mL含油質量濃度120 mg/L的水樣除油,考察反應時間與除油率的關系,結果示于圖7。由圖7看到,除油率隨著反應時間的增加而增大,反應時間從1.5 h增到7.5 h時,給酶量為1.5的除油率從8%升到60%;給酶量為3 g的除油率從10%增加到77%;反應時間從7.5 h增到9 h時,除油率增加變得緩慢,這是漆酶的活力降低、底物濃度下降以及生成物對酶活性的抑制作用的結果[23]。
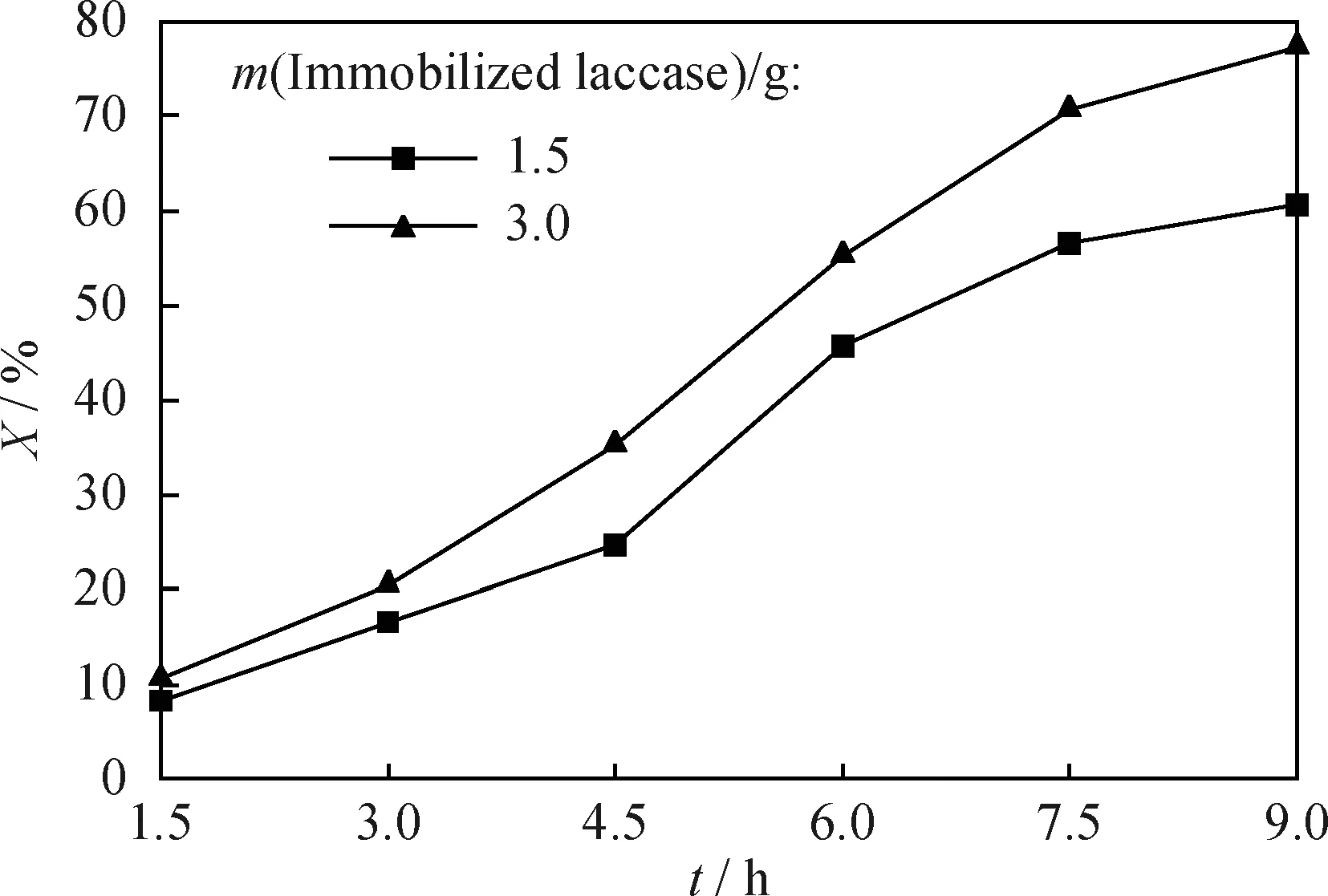
圖7 不同固定化漆酶給酶量下除油率(X)與
2.3.3水樣pH值的影響
漆酶在最佳pH值條件下可以最大程度地降解水中的油,而循環冷卻水的pH值變化很大, 一般在6~9,所以需確定合適的pH值。在交聯法固定化漆酶3 g、25℃下恒溫水浴搖床反應6 h的條件下,對100 mL含油質量濃度120 mg/L的水樣進行除油,考察水樣pH值對除油率的影響,結果示于圖8。圖8表明,不同pH值時除油率變化沒有明顯規律,但在pH值為6時最好,除油率為55%左右;pH值大于6時,除油率相對較低。雖然實驗結果與陳新芳[15]的研究結果相同,但是與本實驗所得交聯法固定化漆酶的最適pH值有很大的差距,可能是底物的濃度、化學結構等的差別引起[24],也可能是反應條件改變了漆酶的pH值所致。
2.3.4殼聚糖載體的影響
調節水樣pH值為6,在 25℃下恒溫水浴搖床反應6 h,采用殼聚糖載體對含油質量濃度120 mg/L的100 mL水樣除油,考察殼聚糖載體量與除油率的關系,結果示于圖9。圖9表明,殼聚糖沒有除油效果,少量的除油率可能是油附著在載體而得。由此得出,交聯法固定化漆酶除油效果好完全是漆酶直接與油發生了催化氧化反應的結果。
漆酶的催化氧化反應機理主要表現在底物自由基的生成和漆酶分子中4個銅離子的協同作用[19,25],其過程如圖10所示。底物先結合于酶活性中心的Ⅰ型Cu2+位點,然后通過Cys-His途徑傳遞給三核位點,該位點進一步把電子傳遞給活性中心的第2底物氧分子,使之還原成水,實現漆酶作用過程。
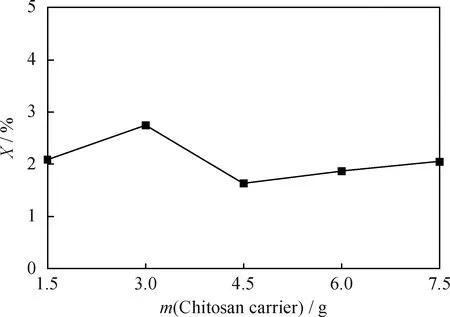
圖9 除油率(X)與殼聚糖載體質量的關系
2.3.5固定化酶操作次數的影響
在調節水樣pH值為6、固定化酶量3 g、25℃下恒溫水浴搖床反應6 h的條件下,對100 mL 含油質量濃度120 mg/L的水樣除油,取出固定化酶重復操作10次,考察相對除油率與固定化漆酶重復操作次數的關系,結果示于圖11。圖11 表明,操作7次時,相對除油率仍能達到50%,隨著操作次數的增加,固定化酶與底物反應,活性部分損失,使得除油率降低;10次操作后,相對除油率降到20%左右。由此可得漆酶固定化可以增加使用率,且重復使用小于等于7次可以達到較好除油效果。
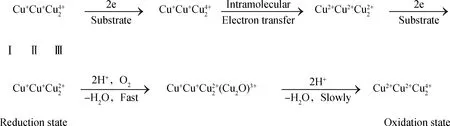
圖10 漆酶催化氧化反應示意圖
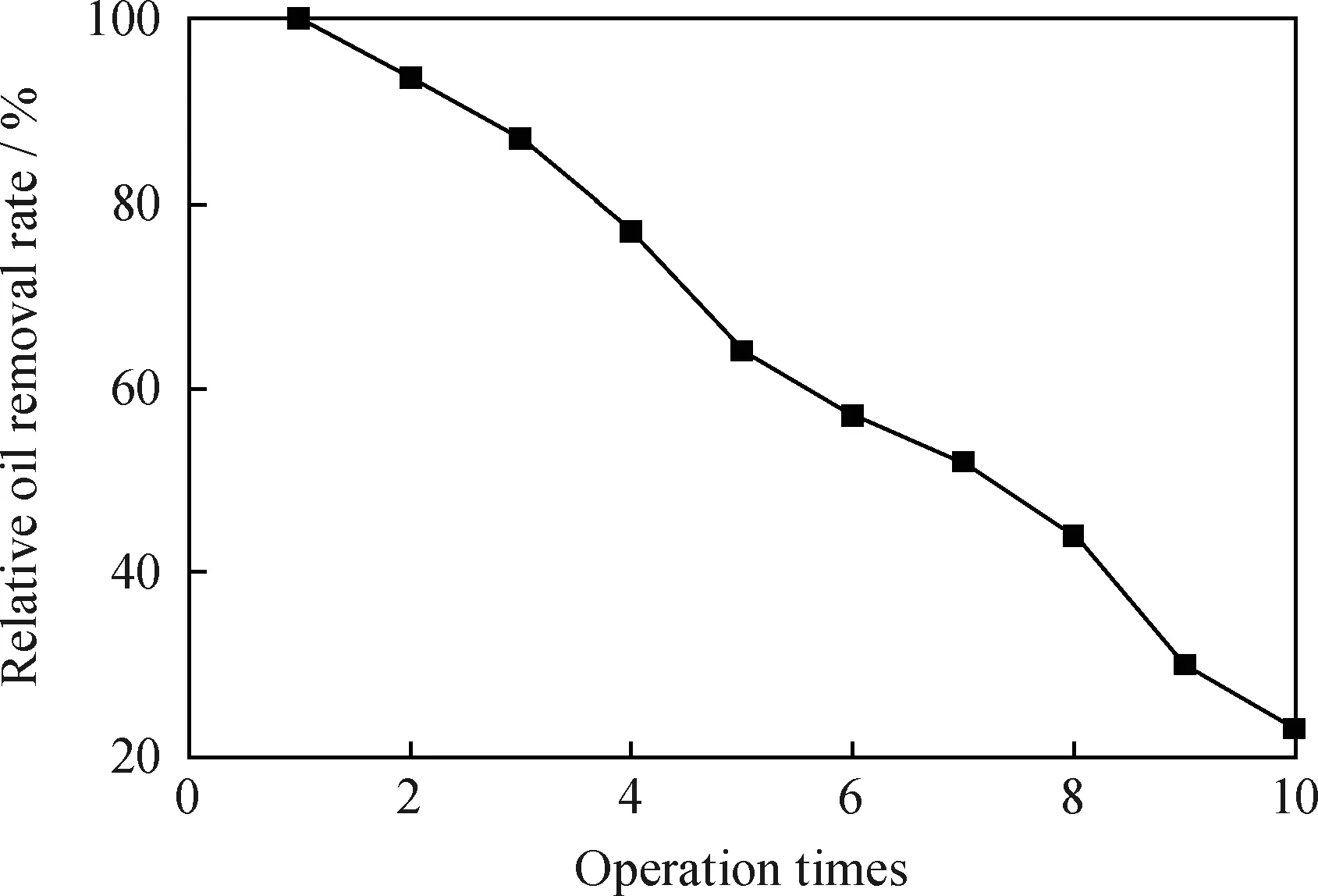
圖11 相對除油率與固定化漆酶重復操作次數的關系
3結論
(1)采用包埋法、交聯法和包埋-交聯法3種方法固定化漆酶,包埋法固定化漆酶活性為0.52 U/g,交聯法固定化漆酶活性較高,為0.66 U/g,包埋-交聯法所得固定化酶活性低,為0.38 U/g。包埋法和交聯法固定化漆酶的酸堿穩定性和熱穩定性都較游離漆酶的高。
(2)交聯法固定化漆酶的除油效果較好,在100 mL pH值為6的循環水樣中,加入9 g固定化漆酶,反應6 h,能達到77%的除油率,而且殼聚糖載體對除油貢獻很小,處理成本為0.016 RMB/mg油;包埋法固定化漆酶最高只能達到24%的除油率,成本0.018 RMB /mg油。交聯法固定化酶重復操作7次后,相對除油率仍達到50%。
參考文獻
[1] LIU F, ZHANG L, YAN X, et al. Effect of diesel on corrosion inhibitors and application of bio-enzyme corrosion inhibitors in the laboratory cooling water system[J].Corrosion Science, 2015, 93:293-300.
[2] ZHONG H Y, LIU F, LU J J, et al. Effect of diesel leakage in circulating cooling water system on preponderant bacteria diversity and bactericidal effect of biocides[J].Environmental Technology, 2015, 36(9):1147-1159.
[3] 伊帆, 李德豪, 郎春燕, 等. 煉油廠循環冷卻水的腐蝕機理及緩蝕技術綜述[J].廣東石油化工學院學報, 2011, 21(6):12-15.(YI Fan, LI Dehao, LANG Chunyan, et al. Review of erosive mechanism and inhibitory technology of circulating wastewater from oil refinery[J].Journal of Guangdong University of Petrochemical Technology, 2011, 21(6):12-15.)
[4] CHRISTIAN M, CLAUDE J, PIERRE B, et al. Fungal laccases: From structure-activity studies to environmental applications[J].Environ Chem Lett, 2003, 1(2):145-148.
[5] JOLANTA B, PAULINA K, ADRIANA R, et al. Laccase immobilization on copolymer of butyl acrylate and ethylene glycol dimethacrylate[J].Biochemical Engineering Journal, 2007, 35(3):325-332.
[6] 楊波, 杜丹, 孫也. 固定化漆酶的研究進展[C]//上海:環境污染與公共衛生會議論文集, 2012:617-620.
[7] COUTO S R, HERRERA J L T. Industrial and biotechnological applications of laccases: A review[J].Biotechnology, 2006, 24(5):500-513.
[8] 羅開昆, 彭紅, 龔躍法. 漆酶的固定化及其在廢水處理中的應用[J].工業水處理, 2005, 25(5):14-17.(LUO Kaikun, PENG Hong, GONG Yuefa. Immobilization of laccase and its application to waste treatment[J].Industrial Water Treatment, 2005, 25(5):14-17.)
[9] LLORET L, HOLLMANN F, EIBES G, et al. Immobilization of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J].Biodegradation, 2012, 23(3):373-386.
[10] 張書祥, 肖亞中, 王怡平, 等. 白腐真菌漆酶的固定化及其應用研究[J].微生物學通報, 2004, 31(5):85-88.(ZHANG Shuxiang, XIAO Yazhong, WANG Yiping, et al.Immobilization of fungal laccase on nylon net and application of the immobilized enzyme[J].Microbiology China, 2004, 31(5):85-88.)
[11] HOU Jingwei, DONG Guangxi, YE Yun, et al. Laccase immobilization on titania nanoparticles and titania-functionalized membranes[J].Journal of Membrane Science, 2014, 452:229-240.
[12] 張樹江, 高恩麗, 夏黎明. 固定化漆酶對二氯酚的脫氯作用[J].化工學報, 2006, 57(2):359-362.(ZHANG Shujiang, GAO Enli, XIA Liming. Dechlorination of dichlorophenol in waste water by immobilized laccase[J].Journal of Chemical Industry and Engineering, 2006, 57(2):359-362.)
[13] 王偉宸. 辣根過氧化物酶在改性陶瓷載體上固定化及其在含油廢水治理中的研究[D].北京:北京化工大學, 2010:43-61.
[14] 尚偉龍. 漆酶在陶瓷-殼聚糖復合載體上固定化及在含油廢水治理中的應用研究[D].北京:北京化工大學, 2009:45-57.
[15] 陳新芳. 油對水質穩定劑性能的影響及酶法處理含油污水的研究[D].北京:北京化工大學, 2007:30-64.
[16] 展慧英.紫外分光光度法測定廢水中油的含量[J].甘肅聯合大學學報, 2007, 21(1):65-67.(ZHAN Huiying. UV spectrophotometric determination of oil content in waste water[J].Journal of Gansu Lianhe University, 2007, 21(1):65-67.)
[17] 國家環境保護局.水和廢水監測分析方法[M].第四版. 北京:中國環境科學出版社, 2002:88-490.
[18] 徐國英, 朱啟忠, 董學衛. 海藻酸鈉-殼聚糖固定化漆酶的研究[J].西南師范大學學報, 2008, 33(3):90-94.(XU Guoying, ZHU Qizhong, DONG Xuewei. The research of sodium alginate and chitosan immobilized laccase[J].Journal of Southwest China Normal University, 2008, 33(3):90-94.)
[19] 靳蓉, 張飛龍. 漆酶的結構與催化反應機理[J].中國生漆, 2012, 31(4):6-16.(JIN Rong, ZHANG Feilong. The structure and catalytic reaction mechanism of laccase[J].Journal of Chinese Lacquer, 2012, 31(4):6-16.)
[20] IREN M, ANTONELLA G, SLIVIA. Crystal structure of the blue multicopper oxidase from the white-rot fungus Trametes trogii complexde withp-toluate[J].Inorganica Chimica Acta, 2008, 361(14):4129-4137.
[21] 左瑩. 殼聚糖對漆酶的固定化研究[D].楊凌:西北農林科技大學, 2008:42.
[22] 張書祥, 房偉. 包埋法固定化真菌漆酶及其應用研究[J].生物學雜, 2005, 12(6):44-46.(ZHANG Shuxiang, FANG Wei. Immobilization of fungal laccase with the embedding method and application of the immobilized enzyme[J].Journal of Biology, 2005, 12(6):44-46.)
[23] 王穎, 張笛, 茹加, 等. 殼聚糖固定化漆酶酶學性質及其催化氧化水中2,4-二氯酚的效能與途徑[J].環境化學, 2013, 32(10):1901-1907.(WANG Ying, ZHANG Di, RU Jia, et al. Immobilization of laccase enzymatic properties and catalytic oxidation of 2,4-dichlorophenol in water efficiency and the ways[J].Environmental Chemistry, 2013, 32(10):1901-1907.)
[24] GHOSH J P, TAYLOR K E, BEWTRA J K, et al. Laccase-catalyzed removal of 2,4-dimethylphenol from synthetic wastewater: Effect of polyethylene glycol and dissolved oxygen[J].Chemosphere, 2008, 71(9):1709-1717.
[25] JOSéE-ANNE M, SATINDER K B, RAJESHWAR D T.Laccases for removal of recalcitrant and emerging pollutants[J].Bioresource Technology, 2010, 101(7):2331-2350.
Application of Immobilized Laccase in Diesel Degradation of Circulating Water
LIU Fang, ZHANG Shuang, Lü Yucui, FAN Fengtao, LU Jinjin, ZHAO Chaocheng, WANG Yongqiang, SUN Juan
(CollegeofChemicalEngineering,ChinaUniversityofPetroleum,Qingdao266555,China)
Abstract:The laccase was immobilized by embedding method, crosslinking method and embedded-crosslinking method, respectively. The enzymatic properties of immobilized laccase and free laccase were comparatively investigated. The diesel was selected as the petroleum product. The immobilized laccase prepared by optimal method was used in cooling circulating water with diesel leakage in order to investigate its effect on the diesel removal. The results showed that among the activities of the three immobilized laccase, the one prepared by crosslinking method was the highest (0.66 U/g), while the one prepared by embedding-crosslinking method was the lowest (0.38 U/g). The pH value stability and thermal stability of laccase were all enhanced by immobilization. In 100 mL circulating water containing diesel mass concentration of 120 mg/L and with the pH value of 6, addition of 9 g immobilized laccase and reacted for 6 h, the diesel removal ratios were 77% and 24%, respectively, of the immobilized by crosslinking method and embedding method.
Key words:laccase; immobilization; activity; circulating water; petroleum; degradation
收稿日期:2015-03-30
基金項目:國家自然科學基金項目(21077133)資助
文章編號:1001-8719(2016)03-0637-08
中圖分類號:TQ085
文獻標識碼:A
doi:10.3969/j.issn.1001-8719.2016.03.027
通訊聯系人: 劉芳,女,教授,博士,從事水污染控制方面的研究;E-mail:liufangfw@163.com

