腫瘤氧化還原代謝與干預
楊夢祺,劉盼盼,黃蓬
(中山大學腫瘤防治中心 華南腫瘤學國家重點實驗室,廣東 廣州 510060)
腫瘤氧化還原代謝與干預
楊夢祺,劉盼盼,黃蓬Δ
(中山大學腫瘤防治中心 華南腫瘤學國家重點實驗室,廣東 廣州 510060)
受腫瘤相關基因信號通路和代謝改變的影響,腫瘤細胞的氧化還原狀態經常處于失衡狀態,表現為活性氧(reactive oxygen species,ROS)水平異常增高及氧化脅迫(oxidative stress)。很多與腫瘤發生相關的信號通路都可直接或間接調節活性氧的代謝。異常升高的ROS在腫瘤細胞中的作用至今仍然備受爭議,ROS一方面可促進細胞生長和腫瘤耐藥,另一方面也能引起細胞的損傷甚至死亡。腫瘤細胞為適應高氧化應激而上調自身抗氧化能力,最終適應并維持存活。氧化應激的調節在腫瘤發生發展和對治療的應答上都起著重要的作用。越來越多的研究提示通過靶向氧化還原調節機制的干預策略可以抑制腫瘤生長和消除腫瘤的耐藥性。本文將闡述腫瘤細胞氧化還原代謝的改變和氧化應激及其調控機制,并討論利用腫瘤這一生物化學特性進行干預的潛在治療策略。
活性氧;腫瘤細胞;氧化應激;氧化還原適應
利用腫瘤細胞的生物學特征設計高效和高選擇性藥物及治療策略一直是腫瘤研究的主要目標之一。近年來分子靶向藥物的出現為提高腫瘤療效和特異性帶來了新希望,特異性針對正常細胞和腫瘤細胞之間基因差異的靶向治療不僅能有效殺滅腫瘤細胞,而且對正常細胞的毒性也較小[1-2]。然而,獲得性耐藥和基因組的不穩定性使靶向治療面臨新的挑戰[3-4]。腫瘤細胞內常有多個基因的改變,因此聯合應用多種有針對性的特異性藥物才有可能有效殺滅腫瘤細胞。然而,該聯合策略的成功應用有賴于對腫瘤細胞賴以存活的多個關鍵基因組合的鑒定和認識,目前仍然需要多層次多角度深入的基礎理論研究。由于大多數腫瘤細胞表現出有氧糖酵解的增加(Warburg效應)和高氧化應激狀態[5],靶向這些特征性改變可望成為一種特異針對腫瘤細胞的治療方法。
許多類型的腫瘤細胞都具有較正常細胞高的ROS水平[6]。細胞內的ROS主要來源于線粒體,其次是內質網和過氧化物酶體。另外,ROS也可來自細胞內其他涉及電子傳遞的生化反應及某些金屬離子所介導的氧化還原反應。ROS主要包括兩大類型,一是其外電子層含有不成對電子的自由基(free radical),另一類是外電子層不含不成對電子但化學性質活躍的非自由基活性氧(non-radical ROS)。ROS在生物機體中具有重要功能,包括氧化還原調節和生物信息傳遞等。適度的ROS增加可以促進細胞增殖和分化,但一旦過度升高則導致脂質、蛋白質和DNA的損傷[7]。維持ROS動態平衡是正常細胞存活和增殖的關鍵。細胞通過自身的活性氧代謝系統維持ROS的產生和清除的平衡而控制其合適的水平。利用基因技術和藥物手段擾亂細胞的氧化還原平衡可導致腫瘤的發生和發展。Piskounova等[8]最近研究提示,增高的ROS對于促進和維持腫瘤細胞高轉移表型可能具有關鍵作用。然而高氧化應激狀態的腫瘤細胞更容易受外源性ROS誘導劑的損傷。因此,靶向氧化還原調節控制ROS水平可以作為一種有效的方式選擇性的殺死腫瘤細胞[9]。
需要指出的是,腫瘤細胞中氧化還原代謝的改變非常復雜,應激反應和氧化還原調節機制涉及眾多因素。在持續的氧化應激狀態下,細胞可通過多種機制調節氧化應答功能,包括增強細胞內抗氧化系統的能力從而適應這種氧化脅迫[10],以及調節細胞存活過程中的轉錄因子和信號轉導分子的活性和表達[11]。為了提高腫瘤治療療效和克服與氧化還原適應相關的耐藥,必須闡明腫瘤細胞中復雜的氧化還原改變和潛在的機制。此外,由于腫瘤干細胞在腫瘤耐藥和疾病復發中起著重要作用,檢測腫瘤干細胞的活性氧代謝和氧化還原狀態并制定相應的干預策略對腫瘤的有效治療至關重要。
1 氧化應激在腫瘤中的作用和機制
大部分血液腫瘤和實體腫瘤,如慢性髓細胞白血病、慢性淋巴細胞白血病、腎癌、乳腺癌以及前列腺癌中都可以觀察到ROS水平的明顯升高[12-13]。此外,Valencia等[14]研究顯示腫瘤相關成纖維細胞中ROS水平較正常成纖維細胞亦明顯增高。雖然導致腫瘤細胞氧化應激的確切機制仍不很清楚,但目前認為以下內在和外在因素是腫瘤細胞高氧化應激的主要原因。
內在因素包括:①癌基因激活。早期研究發現MYC的異位高表達可以導致線粒體基因表達上調,增加ROS的產生[15]。最近對白血病干細胞的研究提示癌基因BCR-ABL的表達產物可誘導ROS產生[16]。腫瘤基因RAS的異常表達或突變可通過影響NADPH氧化酶而增加ROS的產生[17]。另一方面,MYC和RAS又可激活抗氧化機制而下調ROS[18],使腫瘤細胞達到新的氧化還原平衡;②能量代謝異常。多數腫瘤細胞具有較高的代謝活性,需要更多的三磷酸腺苷(ATP)作為能量以維持各項細胞活動。這高能量需求導致線粒體呼吸持續活躍,從而引起過量ROS的產生和累積[6];③線粒體結構功能異常。線粒體DNA編碼電子傳遞鏈中的13種蛋白質,線粒體DNA的突變可導致呼吸鏈功能失調而造成電子異常滲漏。游離電子與分子氧反應產生超氧陰離子自由基(superoxide),隨后可被轉化為其他類型的ROS[19];④內質網功能異常。新生蛋白質在內質網(ER)中正確折疊才能保證其正常生理功能。錯誤折疊的蛋白質將引起內質網應激和未折疊蛋白質應答反應(unfolded protein response,UPR),導致ROS的產生和積聚[20]。另外,內質網應激誘導的鈣釋放和隨后的線粒體內膜去極化亦可刺激線粒體ROS的產生[21];⑤抑癌基因失活。抑癌基因產物p53在感應和清除氧化損傷的核DNA和線粒體DNA,預防氧化基因突變和遺傳物質不穩定中具有重要作用[22]。另外,p53作為轉錄因子可調控諸多抗氧化基因的表達[23]。因此,p53的缺失或突變可導致細胞的氧化還原失衡。
外在因素包括:炎性細胞因子、營養不平衡和乏氧環境[24]。腫瘤細胞增殖快,部分細胞常處于缺氧和營養不足的環境中,這將刺激線粒體產生ROS,異常增高的ROS又可反過來進一步激活缺氧誘導轉錄因子1(HIF1)。后者可促進血管生成、細胞存活和糖酵解[25]。
已有研究評估了細胞在不同環境下的ROS水平改變及其生理病理意義,旨在闡明ROS致瘤作用或抑瘤作用的環境條件。在適度的范圍內,ROS可以刺激促有絲分裂原激活蛋白激酶(MAPK)和細胞外信號調節激酶(ERK)的磷酸化,細胞周期蛋白cyclin D1的表達和JUN氨基末端激酶(JNK)的活化,這些信號分子都與腫瘤的生長相關[26]。已有證據表明腫瘤細胞中一定水平的ROS增高有助于細胞增殖和存活、分化和遷移[27],并可促進免疫逃逸及耐藥[28]。而當ROS嚴重升高而超過細胞抗氧化機制所能耐受的水平時,則可導致細胞損傷乃至死亡。需要回答的問題是,腫瘤細胞如何通過自身的調節機制維持一個比正常細胞高的ROS水平但又不至于影響細胞的各項生理功能,即腫瘤細胞的氧化應激適應?
2 腫瘤細胞對氧化應激的適應
早在20年前就有研究顯示低劑量持續的外源性氧化劑預處理正常上皮細胞可賦予細胞抵抗后續高水平氧化應激的能力[29]。如圖1所示,腫瘤細胞能夠通過自身調控機制將ROS控制在合適的范圍內。腎腫瘤細胞中磷酸戊糖代謝途徑尤為活躍,以產生更多的還原當量NADPH。另外,多數腫瘤細胞的谷胱甘肽(GSH)合成能力增強。在惡性腫瘤細胞株和原代腫瘤組織中,活性氧清除酶超氧化物歧化酶(SOD1、SOD2和SOD3)、谷胱甘肽過氧化物酶、過氧化物酶體、硫氧還原蛋白(TRX)的水平均有不同程度的增高,還原型GSH和TRX也明顯增多[30]。腫瘤細胞增強其氧化應激的能力主要是通過高表達負責清除ROS的酶系及產生GSH、NADPH、TRX等一系列的抗氧化分子。最近的研究也表明,某些誘導氧化應激的條件也會促進腫瘤細胞的抗氧化機制的激活[10]。

圖1 細胞內氧化還原平衡示意圖細胞內活性氧主要來源于線粒體電子傳遞鏈,內質網和NADPH氧化酶(NOX)復合物等。各種類型的活性氧在圖中用紅色標記出。過高的活性氧可導致蛋白質、脂質和DNA氧化損傷。為防止活性氧帶來的損傷,細胞通過平衡活性氧的生成和消除而將ROS維持在一個適度的范圍內。由于處于高度氧化應激狀態,腫瘤細胞更加依賴抗氧化系統,包括氧化物酶體、谷胱甘肽過氧化物酶、過氧化氫酶、硫氧還原蛋白和谷氧還原蛋白等以對抗活性氧并減少其氧化損傷。一些藥物如SSZ、BSO和AUR等可通過不同的機制干預細胞內活性氧清除系統Fig.1 Schematic illustration of cellular redox homeostasisCellular reactive oxygen species(ROS) are mainly generated from the mitochondrial electron transport chain, the endoplasmic reticulum(ER) system, and the NADPH oxidase(NOX) complex.Various types of ROS are highlighted in red color.The increases in ROS may lead to oxidative damage of protein, lipid, and DNA.To prevent the harmful effects of ROS, cells regulate ROS at a proper level by maintaining the balance between ROS generation and elimination.Due to high levels of intracellular ROS, cancer cells highly rely on antioxidant systems including peroxiredoxins, glutathione peroxidases, and catalase to counteract oxidative stress and minimize their damage.Several drugs such as sulfasalazine(SSZ), buthioninesulfoximine(BSO), and auranofin(AUR) could disrupt these ROS-scavenging systems
腫瘤細胞的氧化適應可能涉及多種信號途徑以激活氧化還原敏感的轉錄因子,如NF-κB、NRF2、c-JUN和HIF-1等。這些轉錄因子的激活可促進超氧化物歧化酶、過氧化氫酶、硫氧還蛋白和谷胱甘肽等抗氧化系統的基因表達。例如,轉錄因子NRF2可激活多種能夠降低活性氧的應激基因表達[31]。NRF2的獲得性功能突變可賦予細胞高氧化應激能力和對一些抗腫瘤藥物的抵抗能力,這有助于增強腫瘤細胞對某些化療藥物的抵抗[32]。NRF2還可以促進細胞的谷胱甘肽合成和利用,而谷胱甘肽具有促進烷化劑代謝和解毒的作用,還原型GSH可以逆轉3溴丙酮酸(3-BrPA)對腫瘤的抑制作用[33]。因此,異常的藥物代謝和細胞保護機制的激活可共同導致腫瘤細胞耐藥。除了促進細胞的存活,這些氧化還原敏感的轉錄因子也可調節細胞增殖、細胞永生化、血管生成和腫瘤轉移相關蛋白質的表達[34]。
另外,基因組的不穩定性也是腫瘤細胞氧化還原適應的重要機制之一。基因的不穩定性使其所編碼蛋白質的功能改變或異常表達成為可能,并為細胞適應氧化應激環境及其在腫瘤微環境中獲得生存優勢提供了條件。
腫瘤細胞可通過氧化還原適應提高內源性的抗氧化系統的能力和激活細胞存活通路,從而將ROS維持在一個較穩定且可耐受的范圍內(見圖2)。上調的抗氧化系統,如GSH和NADPH等賦予細胞更強的抗氧化能力,增強DNA修復能力,從而減少了細胞凋亡。關于不同類型腫瘤細胞的氧化還原狀態及其生理病理意義,目前尚缺乏系統研究。因此,人們對各種不同類型腫瘤細胞的氧化還原改變如何影響細胞表型的理解并不完整。對腫瘤細胞活性氧的代謝調控的深入研究,將為通過調控細胞的氧化還原狀態而影響腫瘤細胞的行為提供潛在的治療策略。
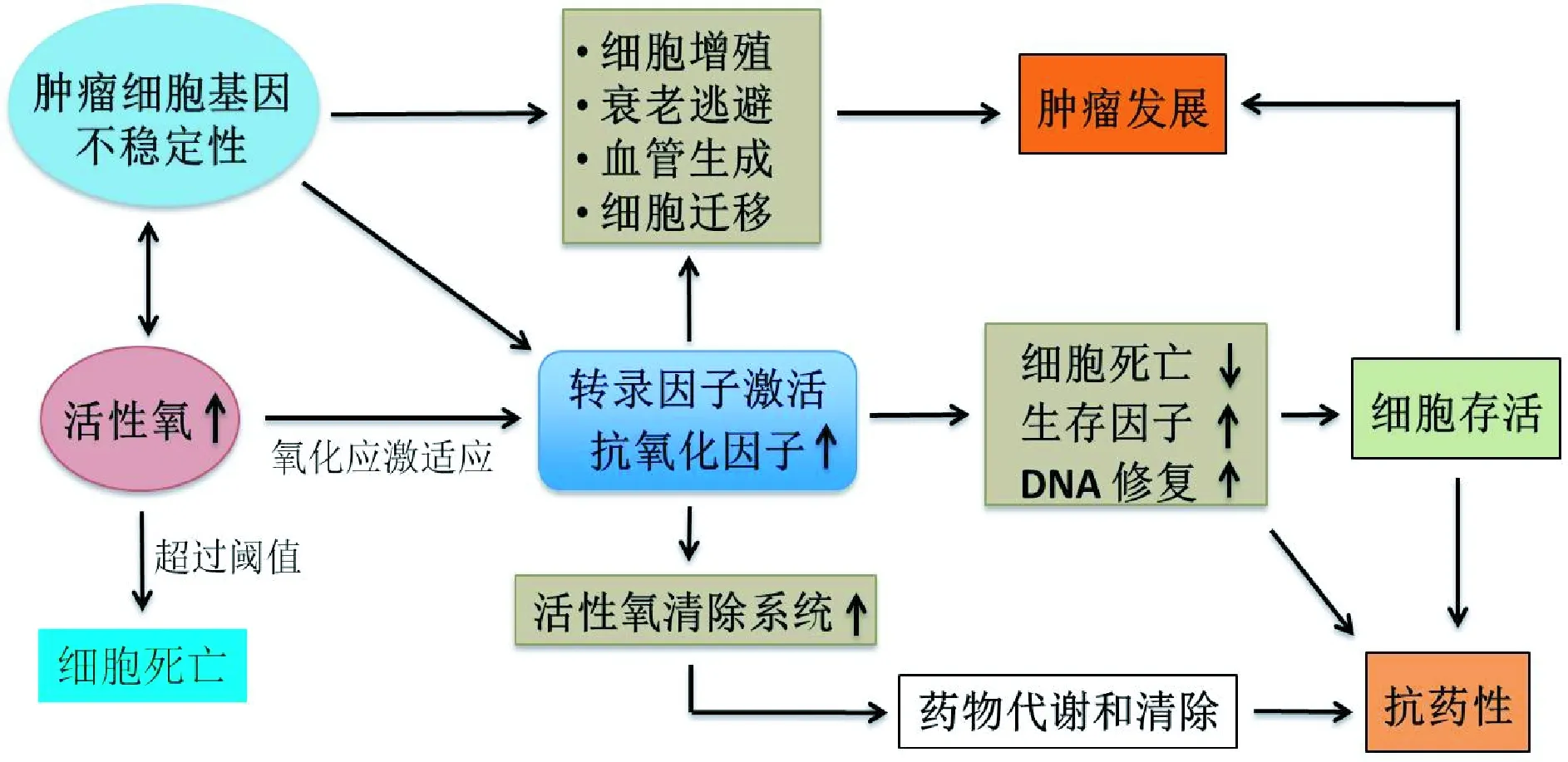
圖2 腫瘤細胞中的氧化還原適應在持續的氧化應激下,腫瘤細胞激活氧化還原敏感性轉錄因子如NRF2等,導致抗活性氧系統(超氧化物歧化酶和谷胱甘肽等)的增加,存活因子表達升高和細胞死亡因子表達的抑制。這些轉錄因子可以調節與細胞增殖、衰老逃避、血管生成和腫瘤轉移等相關基因的表達,促進腫瘤的發展。另一方面,ROS介導的DNA突變或缺失可促進基因組的不穩定性,這為異常基因表達提供了條件,有助于氧化應激的適應。此外,谷胱甘肽在應激適應過程中的增高能促進腫瘤細胞耐藥。上述各種因素使腫瘤細胞在高氧化應激的情況下適應并存活Fig.2 Redox adaptation in cancer cellsIn response to persistent ROS stress, activation of redox-sensitive transcription factors, such as Nrf2, leads to an increase in the expression of ROS-scavenging molecules(such as superoxide dismutase and glutathione), elevation of survival factors, and anti-apoptotic factors.As these transcription factors also have roles in regulating the expression of genes that are responsible for proliferation, senescence evasion, angiogenesis and metastasis, these processes may promote cancer development.On the other hand, ROS-mediated DNA mutations promote genomic instability and this in turn contributes to stress adaptation.Furthermore, increased glutathione synthesis during adaptation can promote drug resistance.These together with enhanced cell survival may render cancer cells more resistant to chemotherapy.All these events enable cancer cells to survive with increased ROS and maintain their viability
3 靶向干預腫瘤細胞的氧化還原平衡狀態
處于高氧化應激狀態的腫瘤細胞相對于正常細胞更加依賴細胞的抗氧化系統,因此腫瘤細胞可能對活性氧誘導劑或抑制細胞抗氧化系統的化合物高度敏感。這一觀點在二十年前就已經被提出,并為后來的研究結果所支持[35]。如圖3所示,與正常細胞相比,腫瘤細胞可能因增高的ROS基礎產率而對ROS的進一步誘導累積更為敏感。使用ROS誘導劑可使腫瘤細胞內ROS的含量升高,超過腫瘤細胞所能承受的閾值時,則導致腫瘤細胞的損傷和死亡。而正常細胞因自身ROS的基礎水平較低,即使使用ROS誘導劑也不足以使其升高到致死閾值。盡管活性氧誘導劑在許多情況能有效殺滅腫瘤細胞,但亦有報道顯示其療效的局限性和腫瘤細胞對活性氧誘導劑的抵抗性[35]。因此,理解不同氧化還原調控策略的利弊以及腫瘤細胞內在的氧化應激狀態和氧化還原適應機制對設計有效的干預策略十分重要。目前干預腫瘤細胞氧化還原狀態主要有以下4種常用策略(見圖4)。

圖3 活性氧介導選擇性治療的生物學基礎在生理情況下,正常細胞維持較低的基礎活性氧水平并能夠耐受一定程度的氧化應激。而腫瘤細胞處于較高的氧化應激狀態但其活性氧水平尚未達到損傷細胞的水平。因此,腫瘤細胞對抗氧化系統更加依賴,對內外源性的氧化刺激更加敏感。進一步升高腫瘤細胞的ROS可以使其超過細胞所能承受的閾值并最終導致腫瘤細胞的死亡。而在同等程度的氧化刺激下,正常細胞較低的基礎ROS即使繼續升高也達不到細胞損傷死亡的閾值。正常細胞與腫瘤細胞之間這一差異可為活性氧介導選擇性抗腫瘤治療提供生化依據Fig.3 A biological basis for ROS-mediated therapeutic selectivity Under physiological conditions, normal cells maintain a low basal ROS level and can tolerate a certain level of further ROS stress owing to their low ROS output and intact antioxidant capacity, which together prevent the ROS level from reaching the cell-death threshold under ROS stimulation.In contract, cancer cells have higher ROS output just below the threshold level, and would be more dependent on the antioxidant system and more vulnerable to further oxidative stress induced by ROS stimuli.A further increase of ROS stress in cancer cells is likely to cause a severe elevation of ROS above the threshold level, leading to cell death.This might provide a biochemical basis to design selective therapeutic strategies using ROS-mediated mechanisms

圖4 通過活性氧介導機制靶向殺滅腫瘤細胞細胞內活性氧水平是由活性氧產生和消除所決定的。適度增加活性氧可以通過氧化還原適應機制來調節并不對細胞產生毒性作用。然而,顯著增加ROS產生和/或抑制其消除能誘導腫瘤細胞內ROS顯著積累,超過細胞的應激適應能力時將導致氧化損傷和細胞死亡。圖中標出4種能導致活性氧嚴重積累的潛在抗腫瘤策略Fig.4 Targeting cancer cells through ROS-mediated mechanismsCellular ROS level is determined by ROS generation and elimination.A moderate ROS increase can by balanced by redox adaptation mechanisms and thus avoid cytotoxicity.However, a severe increase in ROS generation and/or inhibit ROS elimination can induce significant accumulation of ROS in cancer cells,which cannot be reversed by redox adaptation mechanisms.This will lead oxidative damage and cell death.Four potential intervention strategies to induce severe ROS accumulation as potential therapeutic approaches are indicated in the figure
3.1 促進ROS的產生 盡管腫瘤細胞具有較強的抗氧化系統,其ROS仍然維持在比正常細胞更高的水平。因此,腫瘤細胞可能比正常細胞對ROS的進一步累積更敏感,這就為選擇性殺滅腫瘤細胞提供了一個治療窗。細胞的氧化還原狀態由活性氧的生成和消除速率的精細調節以維持平衡。增加ROS產生或減少ROS清除會破壞氧化還原平衡,導致ROS水平升高,當ROS超過細胞耐受的閾值時就會導致細胞損傷乃至細胞死亡。很多藥物都可以升高ROS水平進而選擇性殺傷腫瘤細胞。治療白血病的有效藥物三氧化二砷可通過干預呼吸鏈的功能增加ROS的產生[36]。紫杉烷類(紫杉醇和多西他賽)、長春花生物堿(長春新堿和長春堿)和抗代謝物(抗葉酸)能促進細胞色素c從線粒體釋放進而誘導細胞死亡,這一過程也干擾了電子傳遞鏈,造成超氧自由基的產生[37]。鉑類藥物(順鉑、卡鉑和奧沙利鉑)和蒽環類(阿霉素、表柔比星和柔紅霉素)也通過不同的機制誘導產生大量的ROS[38]。有報道認為,臨床廣泛應用的5-氟尿嘧啶(5-FU)可通過p53依賴途徑誘導線粒體活性氧的生成[39]。此外,放射治療可導致ROS的顯著增加[40]。內質網應激亦可誘導氧化應激而殺傷腫瘤細胞,蛋白酶抑制劑硼替佐米正是通過此機制誘導ROS的異常增高[41]。
3.2 干擾活性氧代謝 細胞內ROS的消除依靠多個抗氧化系統,包括還原型谷胱甘肽(GSH)系統,硫氧還原蛋白系統和過氧化氫酶等。可以通過靶向這些抗氧化系統中的關鍵酶,進而抑制細胞的抗氧化能力和消除氧化應答所造成的抗藥性。目前作用于細胞內谷胱甘肽的藥物有丁硫氨酸砜(BSO)、異硫氰酸酯和氮丙啶衍生物等。BSO是谷胱甘肽合成的限速酶谷氨酰半胱氨酸合成酶(γ-GCS)的抑制劑,該化合物已被證明在多種類型的腫瘤細胞中可導致GSH減少進而體現其抗癌活性[42]。異硫氰酸酯能與GSH結合而導致GSH的快速耗盡。此外,胱氨酸/谷氨酸轉運蛋白抑制劑,如柳氮磺胺吡啶,可通過抑制谷胱甘肽合成中的限速底物半胱氨酸的前體胱氨酸的攝入而導致細胞內GSH的減少[43]。對于硫氧還原蛋白系統,1-甲基丙基2-咪唑基二硫化物(PX-12)是硫氧還原蛋白1(TRX-1)的抑制劑,在體內具有抗腫瘤活性[44]。然而,細胞質中的抗氧化劑并不能有效清除線粒體中的ROS,有研究表明在動物模型中使用線粒體特異性的抗氧化劑可以顯著減少成瘤率[45]。
考慮到氧化應激在腫瘤發生發展過程中的重要作用,通過干預氧化還原代謝消除氧化應激反應已被認為是預防和治療腫瘤的重要策略。然而,氧化還原干預在腫瘤治療中的作用非常復雜,因而存在不少爭議。曾有報道顯示,抗氧化劑N-乙酰葡糖胺(NAC)可以抑制淋巴瘤在小鼠體內的生長[46],但后來的研究又發現NAC可增加小鼠黑色素瘤的轉移病灶[8]。大多數抗氧化劑在臨床試驗中并未顯示出有效的治療效果。一個可能的解釋是,細胞為了存活啟動了有效的氧化還原調控,即使外源性給予抗氧化劑,對體內細胞的氧化還原平衡狀態影響也相對有限。需要特別指出的是,因為多數腫瘤細胞處于高氧化應激狀態,給予抗氧化劑可能利于腫瘤的細胞存活并增強其抗藥性。因此,這方面的臨床研究必須十分慎重。
3.3 克服與氧化應激相關的耐藥性 鑒于正常細胞與惡性細胞之間ROS含量的差異,給予外源性活性氧誘導劑可優先殺傷腫瘤細胞。然而,腫瘤細胞在持續高氧化應激的環境下可能上調細胞的抗氧化系統,表現在上調的細胞內GSH含量,增高某些抗氧化酶的表達等。例如,耐藥的白血病細胞HL-60可抵抗過氧化氫的細胞毒作用,這很可能是由于該細胞高表達過氧化氫酶所致[47]。腫瘤細胞對三氧化二砷的抵抗與細胞內HMOX1、SOD1和GSH的上調有關[48]。同樣,研究表明ROS誘導劑,如紫杉醇,阿霉素或鉑類藥物的耐藥與細胞抗氧化能力的升高相關[49]。因此,耐藥與腫瘤細胞對內源性氧化應激的適應有密切關系。
基于上述原因,消除腫瘤細胞對氧化應激的適應機制是克服腫瘤耐藥的重要措施。一種策略是靶向干預控制ROS和氧化還原敏感性的關鍵分子。谷胱甘肽,硫氧還原蛋白和過氧化物酶被認為是氧化還原干預的潛在靶標。以往研究顯示,天然化合物苯乙基異硫氰酸酯(PEITC)能夠優先殺傷RAS誘導的惡性轉化的卵巢細胞和來自患者的原代白血病細胞,并有效克服其對格列衛的耐藥性。PEITC可使腫瘤細胞內的谷胱甘肽迅速耗盡,有效破壞氧化應激的適應機制并導致對氧化還原敏感的MCL-1等生存蛋白的降解[50]。前已述及,單獨使用活性氧誘導劑對腫瘤可能療效不佳,故更好的策略可能是活性氧誘導劑與能夠消除氧化應激適應機制的化合物聯用。最近的研究顯示,PEITC和其他抗腫瘤藥物聯合可產生更強的抗腫瘤能力[51]。隨著該領域研究的進展,越來越多的新型化合物能有效的破壞腫瘤細胞內的氧化還原機制從而實現有效殺滅腫瘤細胞并克服腫瘤耐藥。
3.4 氧化還原干預的聯用藥物策略 在腫瘤治療中,單獨使用某一特定的藥物較容易出現耐藥,療效也相對較差。因此,臨床上大多采用聯合用藥的治療方案。由于細胞的氧化還原平衡狀態由ROS的產生和活性氧的消除率2個方面所決定,這為聯合用藥干預腫瘤細胞的氧化還原平衡提供了合適的生化基礎。上述的聯合ROS誘導劑和抑制細胞抗氧化能力的化合物PEITC就是該聯合用藥方案的一個例子。活性氧誘導劑三氧化二砷和超氧化物歧化酶抑制劑聯合應用對原發性慢性淋巴細胞白血病(chronic lymphocytic leukemia,CLL)有顯著療效,對CLL細胞的毒性明顯增強[52]。聯合三氧化二砷和消耗GSH的抗壞血酸在治療復發或難治的多發性骨髓瘤中也有明顯治療效果[53]。在鼻咽癌中使用硼替唑米聯合SAHA(辛二酰苯胺異羥肟酸)具有協同作用,導致ROS介導的細胞死亡[54]。最近的研究顯示,聯合靶向線粒體呼吸鏈的藥物和抑制清除線粒體ROS的藥物可以阻止原發性肝細胞腫瘤在小鼠體內的轉移[45]。
此外,研究發現聯合抑制GSH代謝和硫氧還蛋白代謝的藥物可增強腫瘤細胞對17-烯丙基氨基-17-去甲氧基格爾德霉素(17-AAG)的治療敏感性[55]。熱休克蛋白90(HSP90)的上調是腫瘤細胞重要的保護機制,而17-AAG能結合HSP90并對其產生抑制作用。HSP90抑制劑與mTOR抑制劑雷帕霉素聯合可導致內質網應激和線粒體損傷,從而增強由活性氧介導的殺滅腫瘤細胞的活性,并明顯降低腫瘤在小鼠體內的生長[56]。因此,HSP90抑制劑與誘導氧化應激的藥物聯合能有效殺滅腫瘤細胞。另外,有研究顯示聚腺苷二磷酸-核糖聚合酶(PARP)抑制劑,如veliparib或olaparib與卡鉑聯用對多種不同類型的腫瘤都有較好的治療效果[57]。放射治療和傳統的細胞毒性抗癌藥物大都可以直接或間接地增加腫瘤細胞中ROS水平,因此聯合放療或傳統化療與抑制抗氧化系統的藥物有望取得治療腫瘤的良好療效。
4 腫瘤干細胞的氧化還原狀態
化療或放療后腫瘤復發的重要原因之一是未能徹底殺滅具有高度抗藥性的腫瘤干細胞[58]。考慮到氧化還原適應在腫瘤耐藥中的重要作用,因此推測腫瘤干細胞耐藥也與氧化還原調控機制密切相關。與一般腫瘤細胞相比,腫瘤干細胞的ROS水平較低,這有利于腫瘤干細胞維持自我更新能力和干性。腫瘤干細胞有較低的ROS水平的主要原因之一是抗氧化物質GSH的合成增高和磷酸戊糖途徑的高活性,后者產生較多還原物質NADPH。另外,腫瘤干細胞的線粒體活性氧的產生可能下降(見圖5)。有研究發現CD44+的胃腸腫瘤干細胞通過激活胱氨酸谷氨酸轉運載體而增加GSH的合成。腫瘤干細胞中低水平的ROS有助于其抵抗放射治療,因為放射線主要通過誘導自由基的產生而發揮其對細胞的毒性作用,而腫瘤干細胞中的高GSH和低ROS水平不利于放射線對細胞的損傷作用[59]。另外,腫瘤干細胞在體內常處于相對缺氧的環境中,這些缺氧的環境可能限制其分化和維持其干性[60]。缺氧可能會限制內源性活性氧的產生,不利于放射線對腫瘤干細胞的殺滅。殘留的腫瘤干細胞會導致日后腫瘤的復發。

圖5 腫瘤干細胞內低水平ROS的可能機制線粒體呼吸下調導致ROS生成減少,磷酸戊糖途徑代謝活躍使NADPH生成增加以及增高的GSH合成能力等因素使腫瘤干細胞內的ROS水平降低。這些因素可促進腫瘤干細胞細胞存活和耐藥性Fig.5 Possible mechanisms for maintaining a low level of ROS in cancer stem cellsDecreased ROS production from low mitochondrial respiration, increased NADPH production through pentose phosphate metabolism, and increased GSH synthesis together result in a low level of ROS in cancer stem cells.This can promote cancer stem cell survival and resistance to therapy
考慮到腫瘤干細胞的生物學特性,可以推測這群特殊的細胞能夠通過較高的抗氧化能力將ROS維持在一個較低的范圍內以保持其干性和腫瘤形成的能力。腫瘤干細胞的存活和耐藥可能歸因于高度上調的抗氧化機制。在這個重要的研究領域中,首先確定腫瘤干細胞相比于正常干細胞和一般腫瘤細胞的氧化還原狀態是很重要的。明確腫瘤干細胞中維持氧化還原平衡的關鍵分子機制是設計有效殺滅這些細胞以徹底清除腫瘤的關鍵。破壞腫瘤干細胞的抗氧化系統是否能夠增加對其他抗腫瘤藥物的敏感性?外源性的活性氧應激是否能夠導致腫瘤干細胞失去其干性?氧化還原調節策略聯合傳統抗癌藥物是否能夠更有效殺滅腫瘤干細胞?這些問題尚需進一步深入研究。
5 結論和展望
腫瘤細胞的高ROS水平可能促進細胞增殖,而對高氧化應激的適應可能促進細胞存活和抗藥性。這2種現象體現了氧化應激在腫瘤發生發展及耐藥中的關鍵作用。通過氧化還原調節策略靶向干預腫瘤細胞的這些生化特征可望提高抗腫瘤的選擇性和克服抗藥性。氧化應激一方面促進腫瘤發展,另一方面導致氧化損傷,這為腫瘤治療提供了2種可能的干預策略。一種策略是通過抗氧化劑來增加ROS清除的能力,以期抑制腫瘤生長。然而,大規模的前瞻性隨機臨床試驗發現在長期服用抗氧化劑維生素E的健康男性人群中前列腺癌的發生率升高,這提示抗氧化劑可能促進某些腫瘤的發生[7]。也有實驗數據顯示抗氧化劑NAC和維生素E通過減少ROS從而降低DNA損傷和p53的表達,有利于腫瘤細胞的增殖。此外,由于非干細胞在一定條件下可以向干細胞轉化,如果低水平的ROS利于維持細胞的干性,那么抗氧化劑將有可能促進腫瘤干細胞的生成[59]。一些研究者推測,補充抗氧化劑可用于預防腫瘤或者增強化療和放療療效。然而,最近的研究亦顯示出相反的結果,提示抗氧化劑能夠促進腫瘤細胞的存活和增殖。
另一種治療策略是用具有氧化作用或能夠抑制抗氧化系統的藥物來進一步升高ROS從而殺滅腫瘤細胞。在實驗模型中,ROS誘導劑通過升高胞內的ROS,使這一氧化應激超過細胞抗氧化系統所能承受的閾值而殺滅腫瘤細胞[61]。GSH作為細胞內主要的抗氧化劑,干預其代謝可望成為抗腫瘤藥物的重要靶標。然而,其他具有抗氧化能力的酶對腫瘤細胞的存活也是至關重要的,是潛在的治療靶標。進一步探究細胞內抗氧化分子的代謝和調控將利于設計更有效的抗腫瘤治療策略。聯合使用ROS誘導劑和抑制ROS清除的藥物能引起腫瘤細胞內ROS嚴重升高,可能是提高抗腫瘤作用的有效策略。然而這一策略也可能促進正常細胞突變。因此,通過調節ROS治療腫瘤是否獲益目前仍有一定的爭議。
近年來大量的研究表明改變細胞氧化還原代謝在不同類型腫瘤的發展中起著至關重要的作用。對高氧化應激的適應在一定程度上解釋了腫瘤細胞在持續內源性高氧化狀態下的存活和抗藥性。腫瘤細胞普遍具有增強的抗氧化能力,這與放療化療抵抗相關。因此,通過藥物消除這一適應機制并聯合傳統化放療可望提高療效和克服腫瘤細胞的抗藥性。由于腫瘤干細胞在腫瘤的發生發展及耐藥性過程中起關鍵作用,通過氧化還原調節的手段消除腫瘤干細胞在腫瘤治療中具有重要意義。目前對腫瘤干細胞的的氧化還原狀態及其調控的認識尚屬初期階段,有許多不明確及爭議之處。隨著新技術的發展,特別是代謝組學分析技術與活性氧實時檢測及細胞內活性氧的定位分析技術將大幅度推進對腫瘤氧化應激和代謝適應及其調控機制的研究,并據此設計出更有效的干預策略,以期提高腫瘤療效。
[1] Tolaney SM,Barry WT,Dang CT,et al.Adjuvant paclitaxel and trastuzumab for node-negative,her2-positive breast cancer[J].New Engl J Med,2015,372(2):134-141.
[2]Hunger SP,Mullighan CG.Acute lymphoblastic leukemia in children[J].New Engl J Med,2015,373(16):1541-1552.
[3]McDermott U,Downing JR,Stratton MR.Genomics and the continuum of cancer care[J].New Engl J Med,2011,364(4):340-350.
[4]Bosbach B,Deshpande S,Rossi F,et al.Imatinib resistance and microcytic erythrocytosis in a kitv558Δ;t669I/+ gatekeeper-mutant mouse model of gastrointestinal stromal tumor[J].Proc Natl Acad Sci U S A,2012,109(34):E2276-2283.
[5]Pavlova NN,Thompson CB.The emerging hallmarks of cancer metabolism[J].Cell Metab,2016,23(1):27-47.
[6]Cairns RA,Harris IS,Mak TW.Regulation of cancer cell metabolism[J].Nat Rev Cancer,2011,11(2):85-95.
[7]Schumacker PT.Reactive oxygen species in cancer: a dance with the devil[J].Cancer Cell,2015,27(2):156-157.
[8]Piskounova E,Agathocleous M,Murphy MM,et al.Oxidative stress inhibits distant metastasis by human melanoma cells[J].Nature,2015,527(7577):186-191.
[9]Schumacker PT.Reactive oxygen species in cancer cells: Live by the sword,die by the sword[J].Cancer Cell,2006,10(3):175-176.
[10]Diehn M,Cho RW,Lobo NA,et al.Association of reactive oxygen species levels and radioresistance in cancer stem cells[J].Nature,2009,458(7239):780-783.
[11]Hossain MS,Dietz KJ.Tuning of redox regulatory mechanisms,reactive oxygen species and redox homeostasis under salinity stress[J].FrontPlant Sci,2016,7:548.
[12]Singh AK,Awasthi D,Dubey M,et al.High oxidative stress adversely affects nfkappab mediated induction of inducible nitric oxide synthase in human neutrophils: Implications in chronic myeloid leukemia[J].Nitric Oxide,2016,58:28-41.
[13]Cancer Genome Atlas Research N.Comprehensive molecular characterization of clear cell renal cell carcinoma[J].Nature,2013,499(7456):43-49.
[14]Valencia T,Kim JY,Abu-Baker S,et al.Metabolic reprogramming of stromal fibroblasts through p62-mtorc1 signaling promotes inflammation and tumorigenesis[J].Cancer Cell,2014,26(1):121-135.
[15]Tanaka H,Matsumura I,Ezoe S,et al.E2f1 and c-myc potentiate apoptosis through inhibition of nf-kappab activity that facilitates mnsod-mediated ros elimination[J].MolCell,2002,9(5):1017-1029.
[16]Capala ME,Pruis M,Vellenga E,et al.Depletion of sam50 specifically targets bcr-abl-expressing leukemic stem and progenitor cells by interfering with mitochondrial functions[J].Stem Cells Dev,2016,25(5):427-437.
[17]Keeling MJ,Danon L,Vernon MC,et al.Individual identity and movement networks for disease metapopulations[J].Proc Natl Acad Sci U S A,2010,107(19):8866-8870.
[18]Vafa O,Wade M,Kern S,et al.C-myc can induce DNA damage,increase reactive oxygen species,and mitigate p53 function: A mechanism for oncogene-induced genetic instability[J].Mol Cell,2002,9(5):1031-1044.
[19]Brandon M,Baldi P,Wallace DC.Mitochondrial mutations in cancer[J].Oncogene,2006,25(34):4647-4662.
[20]Pagliassotti MJ,Kim PY,Estrada AL,et al.Endoplasmic reticulum stress in obesity and obesity-related disorders: an expanded view[J].Metabolism,2016,65(9):1238-1246.
[21]Bravo R,Gutierrez T,Paredes F,et al.Endoplasmic reticulum: Er stress regulates mitochondrial bioenergetics[J].Int J Biochem Cell B,2012,44(1):16-20.
[22]Achanta G,Sasaki R,Feng L,et al.Novel role of p53 in maintaining mitochondrial genetic stability through interaction with DNA pol gamma[J].The EMBO journal,2005,24(19):3482-3492.
[23]Sablina AA,Budanov AV,Ilyinskaya GV,et al.The antioxidant function of the p53 tumor suppressor[J].Nat Med,2005,11(12):1306-1313.
[24]Vyas S,Zaganjor E,Haigis MC.Mitochondria and cancer[J].Cell,2016,166(3):555-566.
[25]Semenza GL.Oxygen sensing,homeostasis,and disease[J].New Engl J Med,2011,365(6):537-547.
[26]Song JS,Kim EK,Choi YW,et al.Hepatocyte-protective effect of nectandrin b,a nutmeg lignan,against oxidative stress: Role of nrf2 activation through erk phosphorylation and ampk-dependent inhibition of gsk-3beta[J].Toxicol Appl Pharm,2016,307:138-149.
[27]Rhee SG.Cell signaling.H2o2,a necessary evil for cell signaling[J].Science,2006,312(5782):1882-1883.
[28]Zhong Y,Zhang F,Sun Z,et al.Drug resistance associates with activation of nrf2 in mcf-7/dox cells,and wogonin reverses it by down-regulating nrf2-mediated cellular defense response[J].Mol Carcinogen,2013,52(10):824-834.
[29]Choi J,Liu RM,Forman HJ.Adaptation to oxidative stress: Quinone-mediated protection of signaling in rat lung epithelial l2 cells[J].Biochem Pharmacol,1997,53(7):987-993.
[30]Liu HW,Zhu X,Zhang J,et al.A red emitting two-photon fluorescent probe for dynamic imaging of redox balance meditated by a superoxide anion and gsh in living cells and tissues[J].Analyst,2016.
[31]Kato J,Lanier-Smith KL,Currie MG.Cyclic gmp down-regulates atrial natriuretic peptide receptors on cultured vascular endothelial cells[J].J Biol Chem,1991,266(22):14681-14685.
[32]Sullivan LB,Martinez-Garcia E,Nguyen H,et al.The proto-oncometabolite fumarate binds glutathione to amplify ros-dependent signaling[J].Mol cell,2013,51(2):236-248.
[33]Rodrigues-Ferreira C,da Silva AP,Galina A.Effect of the antitumoral alkylating agent 3-bromopyruvate on mitochondrial respiration: Role of mitochondrially bound hexokinase[J].J Bioenerg Biomembr,2012,44(1):39-49.
[34]Chen EI,Hewel J,Krueger JS,et al.Adaptation of energy metabolism in breast cancer brain metastases[J].Cancer Res,2007,67(4):1472-1486.
[35]Hileman EO,Liu J,Albitar M,et al.Intrinsic oxidative stress in cancer cells: A biochemical basis for therapeutic selectivity[J].Cancer Chemo Pharm,2004,53(3):209-219.
[36]You BR,Park WH.Arsenic trioxide induces human pulmonary fibroblast cell death via increasing ros levels and gsh depletion[J].Oncol Rep,2012,28(2):749-757.
[37]Kaufmann SH,Earnshaw WC.Induction of apoptosis by cancer chemotherapy[J].Expe Cell Res,2000,256(1):42-49.
[38]Conklin KA.Chemotherapy-associated oxidative stress: Impact on chemotherapeutic effectiveness[J].Integr Cancer Ther,2004,3(4):294-300.
[39]Hwang PM,Bunz F,Yu J,et al.Ferredoxin reductase affects p53-dependent,5-fluorouracil-induced apoptosis in colorectal cancer cells[J].Nat Med,2001,7(10):1111-1117.
[40]Kobashigawa S,Kashino G,Suzuki K,et al.Ionizing radiation-induced cell death is partly caused by increase of mitochondrial reactive oxygen species in normal human fibroblast cells[J].Radiat Res,2015,183(4):455-464.
[41]Kardosh A,Golden EB,Pyrko P,et al.Aggravated endoplasmic reticulum stress as a basis for enhanced glioblastoma cell killing by bortezomib in combination with celecoxib or its non-coxib analogue,2,5-dimethyl-celecoxib[J].Cancer Res,2008,68(3):843-851.
[42]Hass C,Belz K,Schoeneberger H,et al.Sensitization of acute lymphoblastic leukemia cells for lcl161-induced cell death by targeting redox homeostasis[J].Biochem Pharmacol,2016,105:14-22.
[43]Lewerenz J,Hewett SJ,Huang Y,et al.The cystine/glutamate antiporter system x(c)(-) in health and disease: From molecular mechanisms to novel therapeutic opportunities[J].Antioxid Redox Sign,2013,18(5):522-555.
[44]Welsh SJ,Williams RR,Birmingham A,et al.The thioredoxin redox inhibitors 1-methylpropyl 2-imidazolyl disulfide and pleurotin inhibit hypoxia-induced factor 1alpha and vascular endothelial growth factor formation[J].Mol Cancer Ther,2003,2(3):235-243.
[45]Porporato PE,Payen VL,Perez-Escuredo J,et al.A mitochondrial switch promotes tumor metastasis[J].Cell Rep,2014,8(3):754-766.
[46]Gao P,Zhang H,Dinavahi R,et al.Hif-dependent antitumorigenic effect of antioxidants in vivo[J].Cancer cell,2007,12(3):230-238.
[47]Suzuki T,Spitz DR,Gandhi P,et al.Mammalian resistance to oxidative stress: A comparative analysis[J].Gene expression,2002,10(4):179-191.[48]Nishimoto S,Suzuki T,Koike S,et al.Nrf2 activation ameliorates cytotoxic effects of arsenic trioxide in acute promyelocytic leukemia cells through increased glutathione levels and arsenic efflux from cells[J].Toxicol Appl Pharm,2016,305:161-168.
[49]Ramanathan B,Jan KY,Chen CH,et al.Resistance to paclitaxel is proportional to cellular total antioxidant capacity[J].Cancer Res,2005,65(18):8455-8460.
[50]Zhang H,Trachootham D,Lu W,et al.Effective killing of gleevec-resistant cml cells with t315i mutation by a natural compound peitc through redox-mediated mechanism[J].Leukemia,2008,22(6):1191-1199.
[51]Kasukabe T,Honma Y,Okabe-Kado J,et al.Combined treatment with cotylenin a and phenethyl isothiocyanate induces strong antitumor activity mainly through the induction of ferroptotic cell death in human pancreatic cancer cells[J].Oncol Rep,2016,36(2):968-976.
[52]Zhou Y,Hileman EO,Plunkett W,et al.Free radical stress in chronic lymphocytic leukemia cells and its role in cellular sensitivity to ros-generating anticancer agents[J].Blood,2003,101(10):4098-4104.
[53]Dalton WS.Targeting the mitochondria: An exciting new approach to myeloma therapy.Commentary re: N.J.Bahlis et al.,Feasibility and correlates of arsenic trioxide combined with ascorbic acid-mediated depletion of intracellular glutathione for the treatment of relapsed/refractory multiple myeloma.Clin.Cancer Res.,8: 3658-3668,2002[J].Clin Cancer Res,2002,8(12):3643-3645.
[54]Hui KF,Lam BH,Ho DN,et al.Bortezomib and saha synergistically induce ros-driven caspase-dependent apoptosis of nasopharyngeal carcinoma and block replication of epstein-barr virus[J].Mol Cancer Ther,2013,12(5):747-758.
[55]Scarbrough PM,Mapuskar KA,Mattson DM,et al.Simultaneous inhibition of glutathione- and thioredoxin-dependent metabolism is necessary to potentiate 17aag-induced cancer cell killing via oxidative stress[J].Free Radical Bio Med,2012,52(2):436-443.
[56]De Raedt T,Walton Z,Yecies JL,et al.Exploiting cancer cell vulnerabilities to develop a combination therapy for ras-driven tumors[J].Cancer cell,2011,20(3):400-413.
[57]Clark CC,Weitzel JN,O'Connor TR.Enhancement of synthetic lethality via combinations of abt-888,a parp inhibitor,and carboplatin in vitro and in vivo using brca1 and brca2 isogenic models[J].Mol Cancer Ther,2012,11(9):1948-1958.
[58]Yoshida GJ,Saya H.Therapeutic strategies targeting cancer stem cells[J].Cancer Sci,2016,107(1):5-11.
[59]Schieber MS,Chandel NS.Ros links glucose metabolism to breast cancer stem cell and emt phenotype[J].Cancer cell,2013,23(3):265-267.[60]Rivera A,Maxwell SA.The p53-induced gene-6(proline oxidase) mediates apoptosis through a calcineurin-dependent pathway[J].J Biol Chem,2005,280(32):29346-29354.
[61]Yu T,Sheu SS,Robotham JL,et al.Mitochondrial fission mediates high glucose-induced cell death through elevated production of reactive oxygen species[J].Cardiovasc Res,2008,79(2):341-351.
(編校:吳茜)
作 者 簡 介

黃蓬,教授,博士生導師。畢業于美國德州大學休斯頓生物醫學研究生院,獲博士學位。2007年成為美國德州大學M.D.Anderson癌癥中心終身教授;2008年教育部長江學者講座教授,2010年國家“千人計劃”特聘專家,任中山大學腫瘤防治中心教授。主要研究方向為腫瘤代謝,腫瘤細胞線粒體功能改變,活性氧應激調控及代謝靶向抗癌藥物。代表性論文發表于Nature,CancerCell,NatureCellBiology,JNCI,NatureRevDrugDiscovery等學術刊物,現為MolecularCancer副主編及多家專業雜志的編委。
ROS-mediated mechanisms: an anticancer strategy
YANG Meng-qi, LIU Pan-pan, HUANG PengΔ
(Department of Experimental Research, SunYat-sen University Cancer Center, Guangzhou 510060, China)
Under the influence of oncogenic signals and abnormal metabolism, the redox status of cancer cells often differs from that of the normal cells, manifesting as elevated generation of reactive oxygen species(ROS) and oxidative stress.Many signaling pathways involved in tumorigenesis can directly or indirectly regulate ROS metabolism.Currently, the biological significance of increased ROS in cancer cells is still somewhat controversial.ROS on the one hand can promote cancer development and drug resistance, and on the other hand can also cause cell injury and even cell death.To maintain cell viability and proliferation, cancer cells usually up-regulate their antioxidant capacity in adaptation to the intrinsic oxidative stress.Such adaptive mechanisms to oxidative stress are highly important in both cancer development and also play a major role in cancer cell response to therapy.Compelling evidences from recent studies have suggested that targeting the redox regulation mechanisms through proper intervention strategies may have significant therapeutic implications in cancer treatment.This article will focus on alterations of redox status in cancer cells, their adaptation to oxidative stress, and the underlying mechanisms.Potential therapeutic strategies based on such biochemical characteristics of cancer cells will also be discussed.
reactiveoxygen species; cancer cells; ROS stress; redox adaptation
10.3969/j.issn.1005-1678.2016.09.004
國家自然科學基金(81430060;81502573);廣東省自然科學基金(2014A030310421)
楊夢祺,女,博士在讀,E-mail:yangmq@sysucc.org.cn;黃蓬,通信作者,男,教授,博士生導師,研究方向:腫瘤代謝,腫瘤細胞線粒體功能改變,活性氧應激調控及代謝靶向抗癌藥物,E-mail:huangpeng@sysucc.org.cn。
R73
A

