腫瘤患者機體組成及肌肉減少癥的調查
吳 焱, 凌軼群, 丁慧萍, 錢 泳, 汪 瓊
復旦大學附屬腫瘤醫院營養科,上海 200032
?
·論著·
腫瘤患者機體組成及肌肉減少癥的調查
吳焱, 凌軼群*, 丁慧萍, 錢泳, 汪瓊
復旦大學附屬腫瘤醫院營養科,上海200032
[摘要]目的: 觀察腫瘤患者的機體組成和肌肉減少癥(sarcopenia)的發生情況,為盡早監測腫瘤患者的營養狀況提供依據。方法: 采用生物電阻抗法(bioelectrical impedance analysis, BIA)分析224例腫瘤患者的機體組成,利用四肢骨骼肌指數(appendicular skeletal mass index , ASMI)觀察肌肉減少癥的發生情況,并探究腫瘤患者體質指數(BMI)與肌肉減少癥的關系。結果: 224例腫瘤患者中13.4%(30/224)為消瘦,60.7%(136/224)為正常體質量,25.9%(58/224)為超重或肥胖。肌肉減少癥發生率為58.04%(130/224),77.7%(101/130)的肌肉減少癥患者為體質量正常、超重或肥胖。結論: 腫瘤患者肌肉及其功能的變化與體質量下降同樣值得關注,應及時監測患者人體成分,以便優化營養風險的篩查,開展個體化營養支持,制定最佳耐受性的治療方案。
[關鍵詞]腫瘤;機體組成;四肢骨骼肌指數;肌肉減少癥
隨著對腫瘤惡病質(cachexia)及肌肉減少癥(sarcopenia)相關研究的開展,腫瘤相關性肌肉減少逐漸得到研究者的重視。2010年歐洲老年肌肉減少癥工作組(The European Working Group on Sarcopenia in Older People, EWGSOP)將肌肉減少癥定義為“進行性、廣泛性骨骼肌質量減少和力量下降及由此造成機體功能和生活質量下降甚至死亡的綜合征”[1]。根據發病原因,肌肉減少癥可分為原發性肌肉減少癥及繼發性肌肉減少癥,前者特指年齡相關性肌肉減少癥,后者包括活動相關性肌肉減少癥、疾病相關性肌肉減少癥及營養相關性肌肉減少癥,本研究主要分析腫瘤相關性肌肉減少癥。
腫瘤相關性肌肉減少癥不僅可以增加抗腫瘤藥物的毒性反應、術后并發癥,且會降低患者生活質量,甚至增加病死率[2]。因此,如何有效地做好腫瘤患者的營養評估,及時發現腫瘤相關性肌肉減少癥,并加以干預,已成為腫瘤患者治療的當務之急。
1資料與方法
1.1研究對象回顧性分析2014年3月至2014年6月就診于我院營養科,符合惡性腫瘤診斷標準的224例患者的體成分測試數據。1.2體成分測定方法及指標采用多頻生物電阻抗(segmental multi-frequency bioelectrical impedance analysis, SMFBIA)分析儀Inbody S10(Biospace Co.)進行測量。測量指標包括:骨骼肌(skeletal mass,SM)、脂肪組織(fat mass,FM)、去脂組織(fat-free mass,FFM)、四肢肌肉量(appendicular skeletal mass, ASM)等。
參照Kyle等[3]推薦,根據BIA測評結果,脂肪組織指數(fat mass index, FMI)高標準:男≥5.2 kg/m2,女≥8.2 kg/m2;去脂組織指數(fat-free mass index, FFMI)低標準:男≤17.4 kg/m2,女≤15.0 kg/m2。脂肪組織指數和去脂組織指數的計算方法:FMI=脂肪組織(kg)÷身高(m)2;FFMI=去脂組織(kg)÷身高(m)2。
1.3肌肉減少癥的判定標準參照2014年亞洲肌減少癥工作組(Asian Working Group for Sarcopenia, AWGS)專家共識[4]推薦,采用四肢骨骼肌指數(appendicular skeletal mass index, ASMI)作為肌肉減少癥判定指標,根據BIA測評結果:男性<7.0 kg/m2、女性<5.7 kg/m2定為異常。ASMI=四肢骨骼肌質量(kg)/身高(m)2。

2結果
2.1基本資料腫瘤患者基本資料見表1。224例腫瘤患者平均年齡為(54.10±13.30)歲;男119例,女105例;疾病種類包括:鼻咽癌49例,肺癌11例,腸癌101例,淋巴癌7例,食管癌5例,胃癌45例,胰腺癌6例。
2.2腫瘤患者人體成分分析腫瘤患者人體成分分析見表2。研究對象中,13.4%的腫瘤患者為消瘦(BMI<18.5),60.7%的腫瘤患者為正常體質量(BMI 18.8~24.9 ),25.0%為超重或肥胖(BMI>25);腫瘤患者高FMI的發生率為50%;低FFMI的發生率為20.1%。腫瘤患者肌肉減少癥發生率為58.0%。
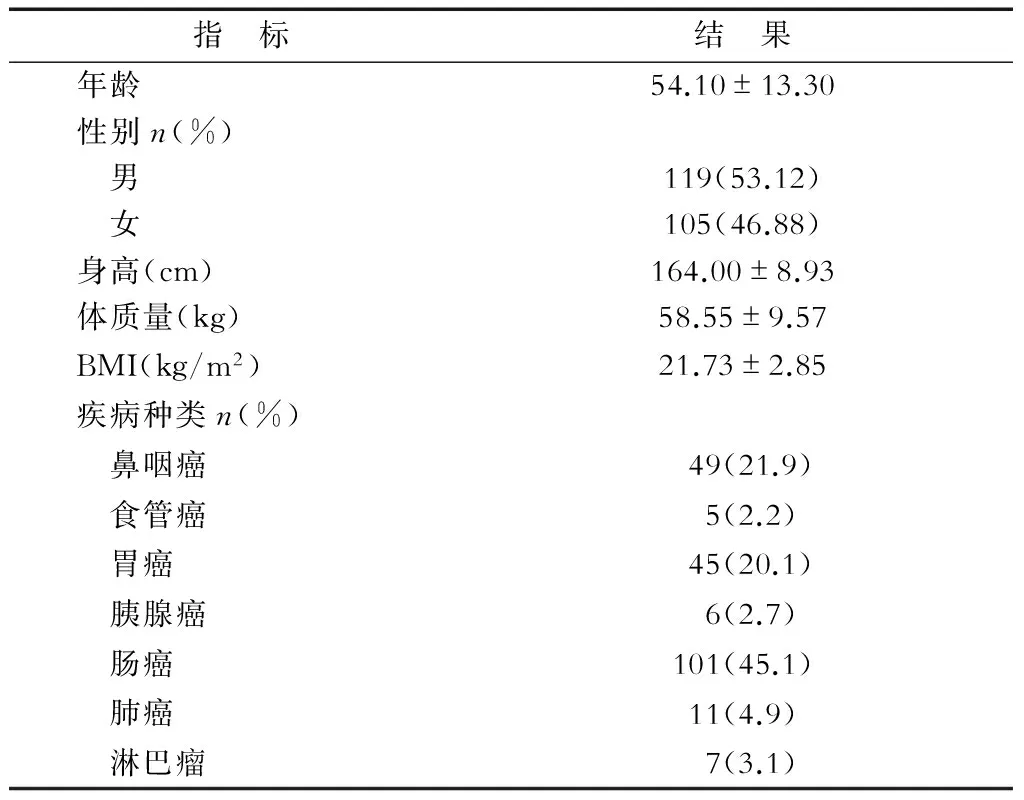
表1 腫瘤患者基本資料
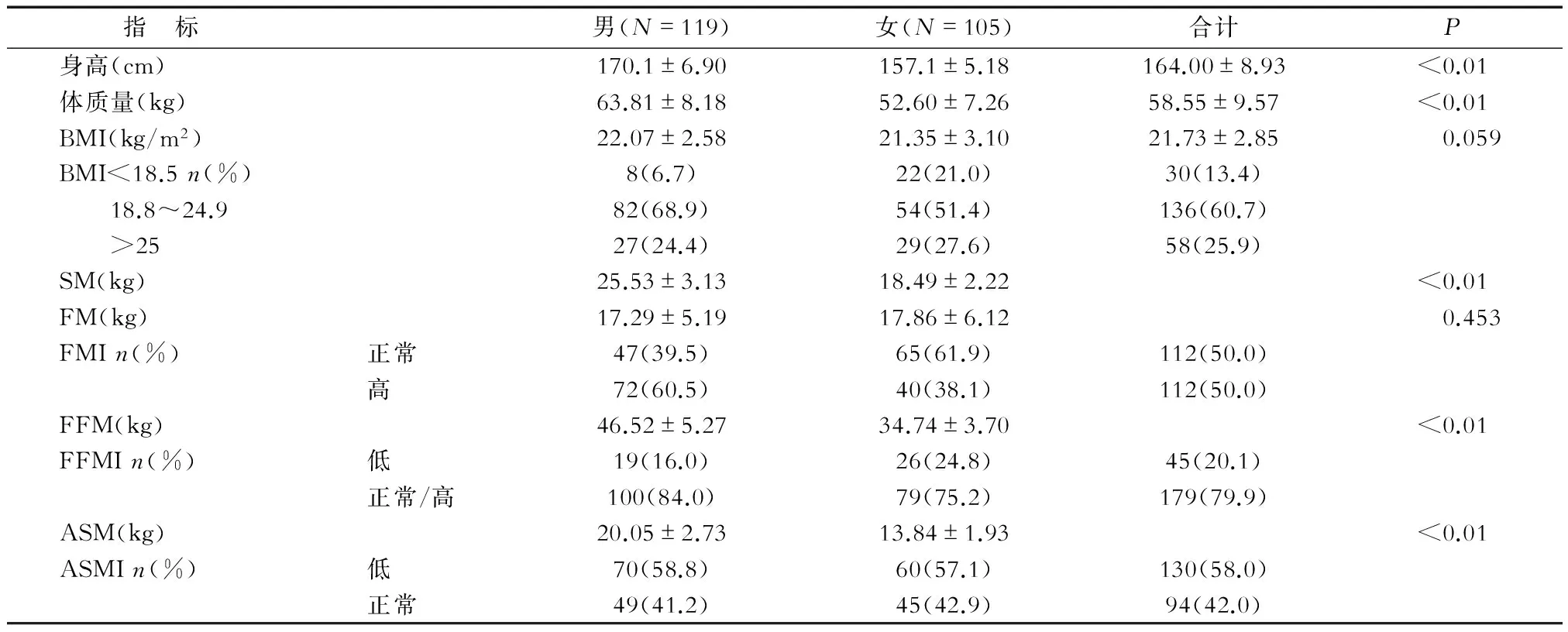
表2 腫瘤患者人體成分分析
2.3不同體質量腫瘤患者肌肉減少癥發生情況分析結果(表3)發現:224例腫瘤患者肌肉減少癥發生率為58.04%(130/224)。消瘦組、正常組、超重/肥胖組腫瘤患者肌肉減少癥發生率分別為96.7%(29/30)、63.2%(86/136)、25.9%(15/56)。不同體質量組腫瘤患者肌肉減少癥發生率差異有統計學意義(P<0.01)。
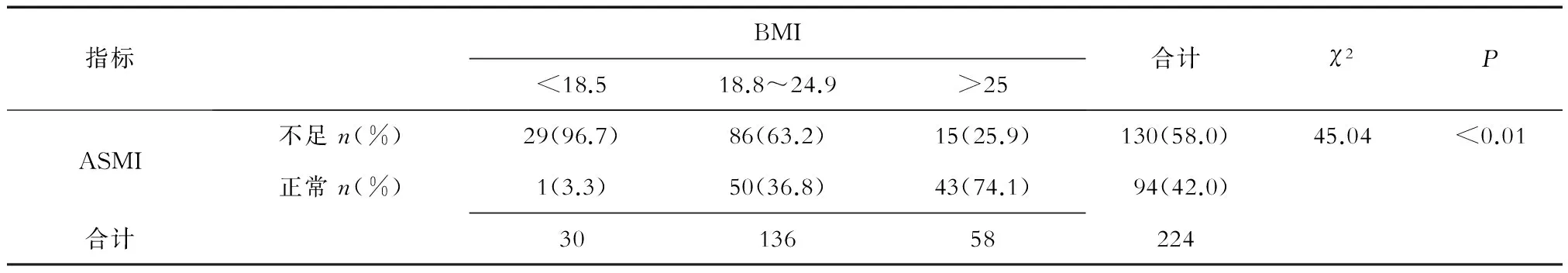
表3 不同體質量腫瘤患者肌肉減少癥發生情況
3討論
關于腫瘤患者的身體成分組成,一些研究認為瘦體組織減少;而一些研究認為脂肪組織丟失顯著;一些研究提出生活質量下降可能是身體功能下降而身體組成沒有變化[5]。引起這些爭論,主要因為不同技術有各自局限性,或者是不同患者有不同的動態變化。
劉寒青等[6]利用機體組成分析儀對54例進展期惡性腫瘤患者進行研究,結果表明:與一般饑餓所導致的營養不良相比,腫瘤患者在中至重度營養不良,甚至是惡病質的情況下,不僅出現體質量和脂肪群的丟失,更有瘦肉群和體細胞群的明顯減少,同時伴有細胞內、外液、肌肉群、蛋白質群、骨及礦物質等多項機體組成成分不同程度的消耗。吳國豪等[7]研究也發現,中等以上營養不良時,機體的體脂肪群和瘦組織群存在不同程度的消耗,其中以體脂肪群丟失最為明顯。本研究發現,經身高校正后,腫瘤患者FFMI降低發生率較高(20.1%),提示與一般饑餓或攝入不足所導致的營養不良患者相比,腫瘤患者在處于營養不良,甚至惡病質的情況下,不僅出現體質量和脂肪群的丟失,更會出現瘦組織群、體細胞群的下降。同樣發現:50.0%(112/224)的患者FMI偏高,這可能是因為腫瘤患者去脂組織過度消耗導致脂肪組織含量相對較高,也有可能因為腫瘤組織代謝特點,導致腫瘤患者脂肪組織體內儲存相對較高。此外,外源性脂肪攝入過多也可能導致體脂肪儲存。考慮到本研究選取研究對象有限,采用的FMI評判標準也為國外標準,可能會導致誤差,腫瘤患者體脂肪過剩現象有待進一步研究證實。
目前對于營養不良的評估主要建立在對患者BMI的評估上,BMI<18.5 kg/m2已經成為公認的評估個體處于嚴重營養不良的指標。但與此同時,國外有研究[8]表明,BMI定義的肥胖可能由于不能反映全身脂肪組織情況或反常的脂肪累積,而誤導患者的營養評估結果。本研究發現,消瘦組腫瘤患者肌肉減少癥發生率為96.7%;正常體質量組肌肉減少癥發生率為63.2%;超重/肥胖組肌肉減少癥發生率為25.9%。不同體質量組腫瘤患者肌肉減少癥發生率差異有統計學意義(P<0.01)。結果提示,存在肌肉減少的腫瘤患者可能表現為一種體質量正常、超重或肥胖的假象,而這部分腫瘤患者并不能通過BMI篩選出來。
近年來,腫瘤相關性肌肉減少癥近年來逐漸成為研究熱點,歐洲姑息治療研究協作組建議將肌肉減少癥與體質量丟失、體質量指數一樣作為惡病質診斷的一項標準[9]。Tan等[10]利用CT對111例姑息性治療期間的胰腺癌患者進行測量,發現肌肉減少癥的發生率為55.9%(62/111),39.6% (44/111)的患者存在超重情況,16.2%(18/111)的患者同時存在超重和肌肉減少癥。Murphy等[11]利用CT測量41例非小細胞肺癌進展期腫瘤患者,發現肌肉減少癥發生率為男性63%、女性59%。本研究以AWGS推薦肌肉減少癥的評判標準,結果發現:58.04%(130/224)的腫瘤患者可診斷為肌肉減少癥,與上述國外文獻結果一致。
肌肉損失作為腫瘤患者體質量減輕情況的一部分,是腫瘤惡病質的核心特征。Lieffers等[12]對234例結直腸腫瘤患者的分析表明:腫瘤患者的肌肉減少癥情況可以預測患者術后感染、住院康復治療,并會因此延長住院時間。Huillard等[13]對61例腎癌患者的分析研究表明:腎癌合并肌肉減少癥的患者會在第一輪化療出現更明顯的劑量依賴性毒性(DLTs)。Gonzalez等[14]對于175例腫瘤患者的COX回歸分析也發現,肌肉減少癥是高死亡率的獨立風險因子。繼發于炎癥和身體功能下降,肌肉量和肌力的變化可能早于明顯惡病質癥狀出現[15],從而在明確診斷為惡病質之前,肌肉減少癥就可能已經對腫瘤患者的治療及預后產生影響。本研究觀察有77.7%(101/130)存在肌肉減少的腫瘤患者體現體質量正常、超重/肥胖,可能導致這些腫瘤患者無法及時接受阻止或逆轉肌肉減少癥的治療,從而影響這部分患者的治療效果及預后。結果提示在臨床工作中,腫瘤患者肌肉及其功能的變化(主要是下降)與體質量下降同樣值得注意。
通過本分析提示,BMI<18.5的腫瘤患者存在各項機體組成成分不同程度的消耗。然而,正常體質量的進展期腫瘤患者也可能存在腫瘤相關性肌肉減少情況,從而對腫瘤患者的治療效果、預后和生活質量產生不利影響。因此,對腫瘤患者進行營養評價時,常規測量人體成分對及時發現腫瘤相關性肌肉減少起著重要作用,腫瘤患者的機體組成成分需在臨床實踐中及治療的不同階段測量,在腫瘤疾病過程中,常規測量人體成分意義優于常規監測體質量。
綜上所述,本研究發現腫瘤患者存在體成分丟失,與正常體質量組腫瘤患者相比,消瘦組腫瘤患者存在各項體成分的丟失,正常體質量的腫瘤患者也可能存在腫瘤相關性的肌肉減少。因此,在臨床工作中,腫瘤患者肌肉及其功能的變化與體質量下降同樣值得關注,應及時對腫瘤患者的身體成分進行監測,以便優化營養風險的篩查和處理,開展個體化營養支持,并且制定最佳耐受性的治療方案,從而減少肌肉減少癥相關的并發癥、毒副作用和總治療費用,提高治療的反應性、耐受性及患者的生活質量。
參考文獻
[1]Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People[J]. Age Ageing,2010,39(4):412-423.
[2]Barret M, Antoun S, Dalban C, et al. Sarcopenia is linked to treatment toxicity in patients with metastatic colorectal cancer[J]. Nutr Cancer,2014,66(4):583-589.
[3]Kyle UG, Pirlich M, Lochs H, et al. Increased length of hospital stay in underweight and overweight patients at hospital admission: a controlled population study[J]. Clin Nutr,2005,24(1):133-142.
[4]Chen LK, Liu LK, Woo J, et al. Sarcopenia in Asia: Consensus Report of the Asian Working Group for Sarcopenia[J]. J Am Med Dir Assoc,2014,15(2):95-101.
[5]Roubenoff R, Heymsfield SB, Kehayias JJ, et al. Standardization of nomenclature of body composition in weight loss[J]. Am J Clin Nutr, 1997,66(1):192-196.
[6]劉寒青,江志偉,姜軍,等.癌性惡液質病人機體組成成分的研究[J].中國實用外科雜志,2002,22(11):669-670.
[7]吳國豪,吳肇漢,吳肇光.應用雙能源X線吸收法測定營養不良病人機體組成[J].腸外與腸內營養,2001,(2):63-66.
[8]Pischon T. Commentary: Use of the body mass index to assess the risk of health outcomes: time to say goodbye?[J]. Int J Epidemiol,2010,39(2):528-529.
[9]Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus[J]. Lancet Oncol,2011,12(5):489-495.
[10]Tan BH, Birdsell LA, Martin L, et al. Sarcopenia in an overweight or obese patient is an adverse prognostic factor in pancreatic cancer[J]. Clin Cancer Res,2009,15(22):6973-6979.
[11]Murphy RA, Mourtzakis M, Chu QS, et al. Skeletal muscle depletion is associated with reduced plasma (n-3) fatty acids in non-small cell lung cancer patients[J]. J Nutr,2010,140(9):1602-1606.
[12]Lieffers JR, Bathe OF, Fassbender K, et al. Sarcopenia is associated with postoperative infection and delayed recovery from colorectal cancer resection surgery[J].Br J Cancer,2012,107(6):931-936.
[13]Huillard O, Mir O, Peyromaure M, et al. Sarcopenia and body mass index predict sunitinib-induced early dose-limiting toxicities in renal cancer patients[J]. Br J Cancer,2013,108(5):1034-1041.
[14]Gonzalez MC, Pastore CA, Orlandi SP, et al. Obesity paradox in cancer: new insights provided by body composition[J]. Am J Clin Nutr,2014,99(5):999-1005.
[15]Collins J, Noble S, Chester J, et al. The assessment and impact of sarcopenia in lung cancer: a systematic literature review[J]. BMJ Open,2014,4(1):e003697.
[本文編輯]葉婷, 賈澤軍
[收稿日期]2016-02-26[接受日期]2016-05-15
[作者簡介]吳焱,初級營養師. E-mail:47305277@qq.com *通信作者(Corresponding author). Tel: 021-64175590-88118, E-mail: catty71@hotmail.com
[中圖分類號]R 730.6
[文獻標志碼]A
Observational research on body composition and sarcopenia in patients with tumor
WU Yan, LING Yi-qun*, DING Hui-ping, QIAN Yong, WANG Qiong
Department of Nutrition, Tumour Hospital, Fudan University, Shanghai200032, China
[Abstract]Objective: To observe body composition and the occurrence of sarcopenia in tumor patients so as to provide evidence for the early monitoring of their nutritional status. Methods: Bioelectrical impedance analysis(BIA) was adopted to analyze the body composition and appendicular skeletal muscle mass index(ASMI) was used to observe the occurrence of sarcopenia to explore the relationship between BMI and sarcopenia in 224 patients with tumor. The body composition of 224 cases of tumor patients was analyzed by bioelectrical impedance analysis(BIA). The occurrence of sarcopenia was observed with appendicular skeletal mass index (ASMI), and the relationship between body mass index (BMI) and sarcopenia was also explored. Results: In 224 tumor patients, 13.4% (30/224) were underweight, 60.7% (136/224) were normal weight and 25.9% (58/224) were overweight or obese. The incidence of sarcopenia was 58.04% (130/224), and 77.7% (101/130) of the patients with sarcopenia were normal, overweight or obese. Conclusions: The change of the muscle and its function in cancer patients is as noteworthy as weight loss. Body composition of cancer patients should be timely monitored in order to optimize nutritional risk screening, establish individualized nutritional support, and develop the treatment plan with best tolerance.
[Key Words]tumor; body composition; appendicular skeletal mass index; sarcopenia

