早熟禾細胞膜脂肪酸衍生化方法比較
王 維, 黃亞亞, 王 娜, 崔浪軍
( 陜西師范大學 生命科學學院 藥用資源與天然藥物化學教育部重點實驗室, 西安 710062 )
?
早熟禾細胞膜脂肪酸衍生化方法比較
王維, 黃亞亞, 王娜, 崔浪軍*
( 陜西師范大學 生命科學學院 藥用資源與天然藥物化學教育部重點實驗室, 西安 710062 )
摘要:脂肪酸是生物膜的重要組成部分,由于植物細胞不同生物膜特性也不同,同一種酯化方法對不同生物膜脂肪酸酯化后測定分析的結果很難獲得滿意效果。為了尋找一種比較簡單、可靠的衍生化方法,該研究以早熟禾葉片為材料,采用三種衍生化方法分別對其葉綠體、線粒體、液泡及細胞質膜這4種膜脂肪酸衍生化,隨后進行GC定量測定分析。結果表明:相對于BF3-甲醇和HCl-甲醇兩種酯化法對部分膜脂肪酸衍生化程度較低,氯乙酰酯化法對這4種膜脂肪酸的衍生化效率高、程度完全,GC測定結果重復性好、準確率高。該研究結果為其他相關植物細胞的不同膜脂肪酸測定分析提供了一定的理論借鑒。
關鍵詞:細胞膜, 脂肪酸, 氣相色譜法, 氯乙酰
脂肪酸是植物膜系統(tǒng)的重要組成部分,各脂肪酸的含量及其之間的比例決定著膜的流動性,而膜的流動性與植物的物質運輸、信息傳遞、能量轉換和代謝調節(jié)等生理功能密切相關(Liang et al,2005)。植物膜系統(tǒng)包括葉綠體膜、線粒體膜、細胞質膜和液泡膜等。膜系統(tǒng)中不同的生物膜其生理學功能與脂肪酸的組成及結構有很大的關系(Shaikh & Edidin,2008)。細胞膜是植物逆境傷害的首要發(fā)生地,而細胞膜的穩(wěn)定性又主要決定于膜脂肪酸不飽和性,不飽和性越高,膜穩(wěn)定性越高,植物抗逆性就越強(趙金梅等,2009)。因此研究植物細胞膜的脂肪酸組分與比例已成為當前抗逆生理學的熱點問題(Quartacci,2001;Jiang & Gao,2004)。
目前,測定膜脂肪酸組成和含量的方法很多,但總體上主要步驟為有機溶劑對脂類抽提、脂肪酸衍生化與氣相色譜的定量測定(陳炳超,2012)。衍生化是將脂肪酸轉變成為揮發(fā)性物質,即脂肪酸的酯化,其中甲酯化是目前采用較多的衍生化方法。甲酯化可分為三大類:由鹽酸、硫酸或三氟化硼等的酸催化和由甲氧基鈉等的堿催化或由二者結合共同來完成的甲酯化方法(Rodríguez-Palmero,1997)。由于不同生物膜的脂肪酸組成特性不同,研究植物不同細胞膜系統(tǒng)脂肪酸的含量及其之間的比例時,不同生物膜的脂肪酸酯化采用同一種酯化方法難以得到滿意效果,但如果采用不同的酯化方法,則費時費力。近年來,甲酯化法衍生脂肪酸在測定脂肪酸含量中的應用已有不少報道。已有的研究表明對于不同植物的膜系統(tǒng)脂肪酸、甚至對于同種植物的不同膜系統(tǒng)脂肪酸的衍生化采取的方法也不盡相同。藺冬梅等(2001)在測定豌豆葉綠體膜脂肪酸時先用KOH-甲醇溶液對其皂化后,再使用HCl-甲醇甲酯化(Zhang et al,2009 )。刁豐秋(1997)對大麥葉片類囊體膜脂肪酸測定時采用乙酸-甲醇甲酯化。楊秀梅等(2008)測定番茄類囊體膜脂肪酸時用KOH-甲醇溶液堿催化甲脂化。而Ramalho et al(1998)對咖啡類囊體膜、葉綠體膜脂肪酸衍生化時,先使用KOH-甲醇溶液皂化,再用BF3-甲醇完成甲酯化。Rousch et al(2003)對海洋硅藻脂肪酸和陳鵬等(2007)用鹽酸酸催化后再加入HCl-甲醇溶液完成脂肪酸甲酯化。張敏等(2009)在研究構樹根與葉片內(nèi)質網(wǎng)膜脂肪酸組成時采用BF3-乙醚-甲醇溶液酯化。因此,若能篩選出一種對植物不同細胞膜系統(tǒng)的脂肪酸衍生化效果均好的方法,其意義重大。
草地早熟禾(Poapratensis)是禾本科早熟禾屬植物,廣泛分布于世界各地,是園林綠化、運動場及牧場的主要草種,因而受到高度關注(方強恩等,2011)。本研究以早熟禾為材料,在提取獲得其葉片的葉綠體膜、線粒體膜、細胞質膜以及液泡膜脂肪酸的基礎上,分別用三種酯化方法對膜脂肪酸酯化,再利用氣相色譜法進行比較分析,旨在選擇出一種同時適用于這四種膜脂肪酸酯化的方法,從而為相關植物的細胞膜脂肪酸測定提供借鑒。
1材料與方法
1.1 材料
1.1.1 實驗材料選擇健康的早熟禾(Poapratensis)種子播種在裝有混合培養(yǎng)基質(蛭石∶營養(yǎng)土,1∶1)的花盆中。日常管理培養(yǎng)20 d后采集葉片。1.1.2 試劑甲醇、異丙醇、氯仿、鹽酸、氫氧化鉀、正己烷、三氟化硼等均為天津市科密歐化學試劑公司;氯乙酰∶分析純;7種脂肪酸(16∶0、16∶1、17∶0、18∶0、18∶1、18∶2、18∶3)購買于Nu-Chek Prep (Elysian,MN)。17∶0脂肪酸用作內(nèi)標物。
1.1.3 儀器和設備超聲波細胞破碎儀(Biosafer 4D)、離心機(eppendorf 5810R)、氣相色譜儀(GC-system,HP-6890):美國Agilent公司;AB135-S型精密電子分析天平:瑞士梅特勒-托利多公司;Mili-Q Synthesis超純水系統(tǒng):美國Millipore公司。
1.2 方法
1.2.1 膜的提取葉片葉綠體和線粒體膜的提取參照張娟(2009)的方法。葉片細胞質膜與液泡膜的提取與純化分別參照Liang et al(2005)和Quartacci et al(2001)的方法。獲得的膜懸浮液置于-80 ℃保存待用。
1.2.2 膜脂肪酸的提取與測定取相同量的膜懸浮液(平均約2 mL),先加入4 mL沸騰異丙醇,后加入12 mL氯仿∶甲醇∶水=1∶1∶1(v/v/v),搖勻超聲波破碎,4 500 ×g離心10 min,N2吹干下層的氯仿層獲得脂肪酸。取少量提取純化后的膜脂,加入已知量的內(nèi)標(17∶0),分別用以下三種方法酯化。
方法一:參照Ramalho et al(1998)的方法。取少量提取的膜脂,先加入3 mL 0.5 mol/L KOH-甲醇溶液65 ℃水浴30 min,進行皂化反應,再用2 mL BF3-甲醇(體積比為1∶4)65 ℃酯化30 min,完成脂肪酸甲脂化。
方法二:參照Rousch et al(2003)的方法。稱取少量提取的膜脂肪酸,采用鹽酸酸催化后,加入2 mL 2.5%(w/w)HCl-甲醇溶液,80 ℃水浴2 h,脂肪酸甲脂化完成。
方法三:參照Masood et al(2005)對動物血紅細胞膜脂肪酸測定方法。考慮到植物細胞膜系統(tǒng)與血紅細胞質膜之間組成上的差異,本研究首先提取獲得早熟禾細胞膜系統(tǒng)脂肪酸,再對上述衍生化方法進行簡單優(yōu)化。用預先制備的酯化反應儲備液(1.8 mL甲醇,100 μL內(nèi)標),分別配制3%、5%、7%、9%(v/v)的氯乙酰-甲醇酯化反應液。取少許等量的膜脂,密封80 ℃水浴1 h完成脂肪酸甲脂化。GC檢測結果顯示,用3%氯乙酰-酯化反應液衍生化后,GC檢測色譜峰面積較小,出現(xiàn)部分齊肩峰,但5%、7%和9%(v/v)氯乙酰-酯化反應液衍生化后,GC色譜峰形及分離效果均好。因此選擇5%(v/v)氯乙酰-甲醇酯化反應液進行酯化反應。
經(jīng)以上三種方法完成脂類水解的脂肪酸甲脂化后,冷卻至室溫,先加入1 mL雙蒸水和2 mL正己烷,搖勻,吸出正己烷層,N2吹干,再加入一定量的正己烷定容后得到供試品溶液,取樣2 μL,用氣相色譜儀(GC-system,HP-6890)檢測。色譜檢測條件為進樣口:分流/不分流進樣器,260 ℃,分流比為50∶1;檢測器:FID,280 ℃;色譜柱:HP-INNOWAX柱(30 m × 0.25 mm × 0.25 μm);載氣:氦氣(平均限速36 cm·s-1);柱溫:50 ℃保持1 min,25 ℃·min-1升溫至200 ℃,而后3 ℃·min-1升溫至230 ℃,再10 ℃·min-1升溫至250 ℃。
1.2.3 脂肪酸含量的計算根據(jù)色譜圖數(shù)據(jù)按以下公式進行計算。
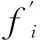
2結果與分析
2.1 葉綠體膜脂肪酸酯化氣相色譜檢測
圖1顯示,三種方法酯化葉綠體膜脂肪酸后獲得的氣相色譜檢測圖基線平穩(wěn),7種脂肪酸16∶0、16∶1、17∶0、18∶0、18∶1、18∶2和18∶3分離效果好(圖1:A,B,C)。但在相同的進樣量下,方法二的各個峰面積比方法一和方法三的大,表明方法二對早熟禾葉綠體膜脂肪酸的酯化程度比后兩者的更高。本研究以17∶0為內(nèi)標,計算結果表明葉綠體膜脂肪酸經(jīng)三種方法酯化后所測定的6種脂肪酸含量無顯著性差異,但方法一對葉綠體膜中幾種脂肪酸含量測定的數(shù)據(jù)相對偏差較大,酯化不穩(wěn)定,表明衍生化程度不完全(表1)。

圖 1 三種方法酯化后葉綠體膜脂肪酸的氣相色譜圖A. 方法一; B. 方法二; C. 方法三 1=16∶0; 2=16∶1; 3=17∶0; 4=18∶0; 5=18∶1; 6=18∶2; 7=18∶3。下同。Fig. 1 Typical chromatogram of a fatty acid profile of chloroplast membranes from bluegrass processed by three methods A. Method I; B. Method Ⅱ; C. Method Ⅲ. 1=16∶0; 2=16∶1; 3=17∶0; 4=18∶0; 5=18∶1; 6=18∶2; 7=18∶3. The same below.
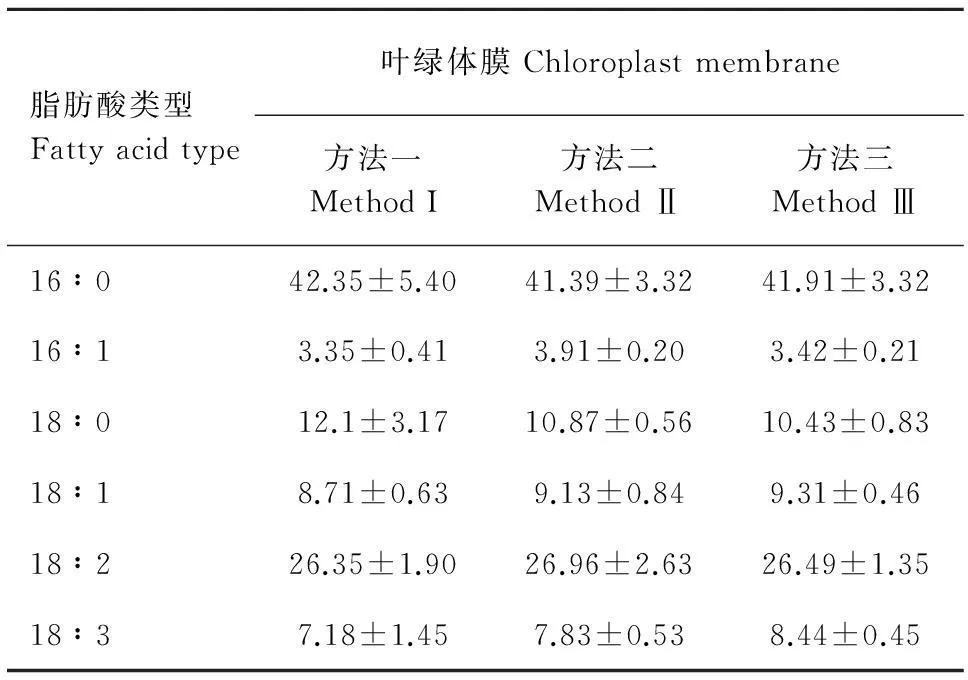
脂肪酸類型Fattyacidtype葉綠體膜Chloroplastmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶042.35±5.4041.39±3.3241.91±3.3216∶13.35±0.413.91±0.203.42±0.2118∶012.1±3.1710.87±0.5610.43±0.8318∶18.71±0.639.13±0.849.31±0.4618∶226.35±1.9026.96±2.6326.49±1.3518∶37.18±1.457.83±0.538.44±0.45
注:數(shù)據(jù)為4個重復的平均值± SD。下同。
Note:Data are presented as means ± SD,n=4. The same below.
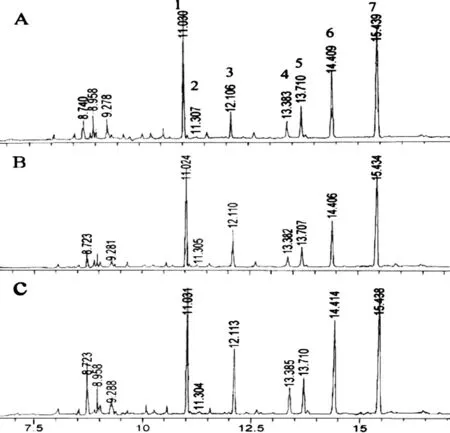
圖 2 三種方法酯化后線粒體膜脂肪酸的氣相色譜圖Fig. 2 Typical chromatogram of a fatty acid profile of mitochondrial membranes from bluegrass processed by three methods

脂肪酸類型Fattyacidtype線粒體膜Mitochondrialmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶043.53±4.8948.87±1.4542.9±2.9816∶12.03±0.541.88±0.271.98±0.1218∶010.24±1.0233.83±0.7310.89±0.1218∶19.17±0.927.52±0.839.24±0.4318∶230.92±4.117.32±0.9031.35±1.0718∶34.11±0.440.18±0.125.28±0.34

圖 3 三種方法酯化后液泡膜脂肪酸的氣相色譜圖Fig. 3 Typical chromatogram of a fatty acid profile of tonoplast membranes from bluegrass processed by three methods
2.2 線粒體膜脂肪酸酯化氣相色譜檢測結果
與葉綠體膜脂肪酸酯化不同的是,在相同進樣量下,線粒體膜脂肪酸經(jīng)方法二酯化后的各個峰面積比方法一和方法三的小(圖2)。經(jīng)方法一對線粒體膜中幾種脂肪酸酯化后,測定的數(shù)據(jù)相對偏差較大,衍生化效果不穩(wěn)定。經(jīng)方法三酯化后分離效果好,所測定的6種脂肪酸含量差異不顯著(圖2:A,C;表2)。用方法二酯化后色譜圖表明,脂肪酸18∶1和18∶2含量很低,18∶3幾乎檢測不到(圖2:B;表2)。說明用方法二酯化早熟禾葉片線粒體膜脂肪酸時有可能18∶1,18∶2和18∶3有時不能完全衍生化。
2.3 液泡膜和質膜脂肪酸酯化氣相色譜檢測結果
由圖3和圖4可知,用這三種方法分別對液泡膜和細胞質膜的6種脂肪酸酯化,所得色譜圖中各脂肪酸峰分離效果均好。圖3結果表明,方法二酯化后的各個峰面積比方法一和方法三的大,而在質膜氣相色譜檢測圖中,三種酯化方法下各個峰面積基本接近(圖4)。此外,測定二者本身的6種脂肪酸含量在方法之間差異不顯著(表3,表4)。
3討論與結論
脂肪酸衍生化程度的高低直接影響后續(xù)氣相色譜的分離效果與脂肪酸含量的準確測定。本研究結果表明相同進樣量、相同色譜條件下檢測得到的幾種脂肪酸分離效果均好,但色譜圖峰面積大小有時不同,表明不同的酯化方法對同一種膜脂肪酸的酯化程度不同。在三種酯化方法中,我們所采用的均為內(nèi)標法(以17∶0為內(nèi)標)。內(nèi)標法結合峰面積歸一法和外標法的優(yōu)點,在加入內(nèi)標后,按峰面積歸一法的分析方法進行分析,避免了由于進樣的一致性及樣品歧視效應導致的偶然誤差。結果表明三種酯化方法對同一種膜脂肪酸的酯化程度有差異。

圖 4 三種方法酯化后細胞質膜脂肪酸的氣相色譜圖Fig. 4 Typical chromatogram of a fatty acid profile of plasma membranes from bluegrass that was processed by three methods
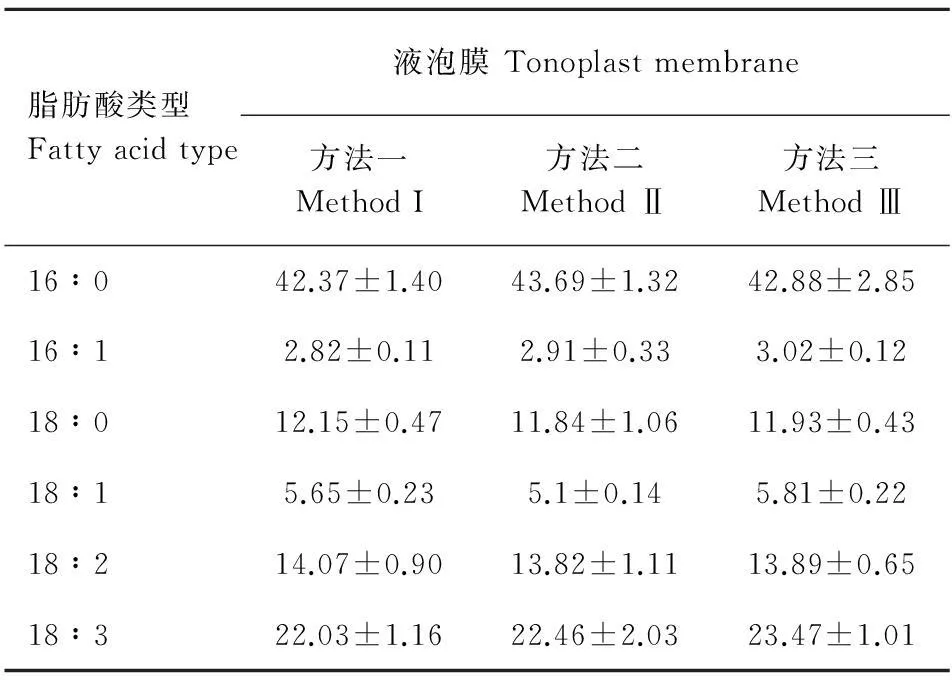
脂肪酸類型Fattyacidtype液泡膜Tonoplastmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶042.37±1.4043.69±1.3242.88±2.8516∶12.82±0.112.91±0.333.02±0.1218∶012.15±0.4711.84±1.0611.93±0.4318∶15.65±0.235.1±0.145.81±0.2218∶214.07±0.9013.82±1.1113.89±0.6518∶322.03±1.1622.46±2.0323.47±1.01
酯化方法的不同,可能會影響脂肪酸定量的準確度。本研究結果表明,對早熟禾葉綠體用BF3-甲醇酯化后測得的脂肪酸16∶0和18∶0的含量數(shù)據(jù)相對偏差較大,說明方法一對該膜系統(tǒng)的這部分脂肪酸甲酯轉化率不穩(wěn)定,與方法二和方法三在衍生生化程度上存在差異。對線粒體而言,通過HCl-甲醇酯化后獲得的脂肪酸18∶1、18∶2和18∶3的氣相色譜峰面積相對過小,說明方法二對某些脂肪酸衍生化程度不高,而方法一和方法三酯化后的分離效果好, 脂肪酸含量測定差異不顯著。但方法一對咖啡類囊體膜,葉綠體膜(Ramalho et al,1998)、方法二對海洋硅藻(Rousch et al,2003)脂肪酸衍生化程度高。造成這種差異可能與材料本身來源及特性有關。植物細胞生物膜中脂肪酸常以磷脂、糖脂、脂蛋白等形式存在,在外界影響下其含量配比會發(fā)生變化,如在鋁脅迫下,小麥根液泡膜磷脂和半乳糖脂含量會增加(何飛龍,2000)。脂肪酸飽和程度會影響膜脂的流動性,在各種因素影響下,膜脂肪酸的存在形式并非固定不變,常處于液晶轉換的動態(tài)平衡中。當受到紫外線B輻射時,小麥葉綠體膜類脂組分配比及脂肪酸不飽和度指數(shù)常會發(fā)生變化(楊景宏等,2000)。低溫逆境下,水稻劍葉葉綠體類囊體膜內(nèi)產(chǎn)生的大量氧自由基,引起膜脂過氧化及不飽和類脂和脂肪酸含量的變化(王靜,2006)。所以材料中脂肪酸的結合形式與存在狀態(tài)都可能會造成衍生化上的差異。就液泡膜和細胞質膜而言,除了方法二酯化液泡膜脂肪酸后氣相測得的六種脂肪酸色譜峰面積相對大些外,總的來說用三種方法酯化后檢測分離效果均好。
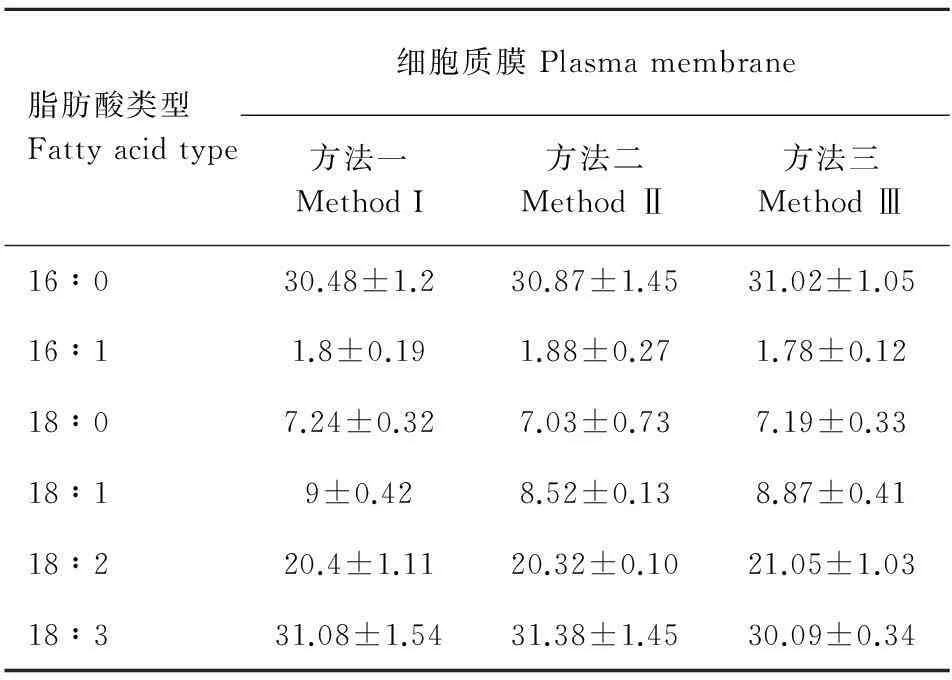
表 4 三種方法酯化后細胞質膜脂肪酸含量
綜合比較分析這三種酯化的衍生化方法,發(fā)現(xiàn)方法三用氯乙酰對脂肪酸酯化而后進行氣相色譜測定更能同時適用于早熟禾的這四種膜脂肪酸含量測定。方法三是Masood et al(2005)在Griffiths et al(2010)傳統(tǒng)的酯化方法基礎上,將許多補充的反應環(huán)節(jié)簡化成的一步法,在與脂肪酸樣品反應之前,先制備一種甲醇、乙酰氯儲備液,然后再與脂肪酸樣品反應。該方法更多是用來檢測動物或人體血紅細胞膜脂肪酸含量,在植物細胞膜脂肪酸酯化上的應用還很少。本研究結果表明,雖然植物細胞膜系統(tǒng)與動物血紅細胞質膜之間組成上存在差異,但將氯乙酰與反應儲備液(內(nèi)標、甲醇)的配比優(yōu)化后,用該方法能準確同時測定早熟禾四種不同細胞器膜脂肪酸含量,且效果顯著。該方法與傳統(tǒng)植物膜脂肪酸衍生化相比具有步驟少、操作簡單、能同時準確測定幾種膜系統(tǒng)脂肪酸等優(yōu)勢,這為其他相關植物的細胞膜脂肪酸測定提供借鑒。
參考文獻:
CHEN BC,LIU HX,CUI YF,et al, 2012. Main chemical compositions with volatility in peel essential oil and seed oil ofPittosporumpentandrumvar.formosanumcapsule[J]. Guihaia,32(3):419-423. [陳炳超,劉紅星,崔亞飛,等, 2012. 臺瓊海桐蒴果皮油及籽油的主要揮發(fā)性化學成分 [J]. 廣西植物,32(3):419-423.]
CHEN P,JIANG WD,LIU YY,et al, 2007. Main physical chemistry characteristics and fatty acid composition of three plant oils and their bio-diesel fuels [J]. Guihaia,27(3):448-452. [陳鵬,蔣衛(wèi)東,劉穎穎,等, 2007. 三種植物油及其生物柴油中脂肪酸組成的比較研究 [J]. 廣西植物,27(3):448-452.]
DIAO FQ,ZHANG WH,LIU YL, 1997. Changes in composition and function of thylakoid membrane isolated from barley seedling leaves under salt stress [J]. Acta Phytophysiol Sin,23(2):105-110. [刁豐秋,章文華,劉友良, 1997. 鹽脅迫對大麥葉片類囊體膜組成和功能的影響 [J]. 植物生理學報,23(2):105-110.]
FANG QE,SUN Y,BAI XM,et al, 2011. Study on the distribution of wild species ofPoaL. in Gansu [J]. Chin J Grassl,6:39-45. [方強恩,孫英,白小明,等, 2011. 甘肅早熟禾屬野生植物資源分布研究 [J]. 中國草地學報,6:39-45.]
GRIFFITHS MJ,VAN HILLE RP,HAMISON STL, 2010. Selection of direct transesterification sa the preferred method for assay of fatty acid content of microalgae [J]. Lipids,45(11):1 053-1 060.
JIANG HM,GAO KS, 2004. Effects of lowering temperature during culture on the production of polyunsaturated fatty acids in the marine diatomPhaeodactylumtricornutum(Bacillariophygeae) [J]. J Phycol,40(4):651-654.
LIANG YC,ZHANG WH,CHEN Q,et al, 2005. Effects of silicon on H+-ATPase and H+-PPase activity,fatty acid composition and fluidity of tonoplast vesicles from roots of salt-stressed barley(HordeumvulgareL.) [J]. Environ Exp Bot,1(53):29-37.
LIN DM,XU SJ,ZHANG XF,et al, 2011. Effects of excess iron stress on photosynthetic characteristics and chloroplast membranes in pea seedling leaves [J]. Partac Sci, 28(11):1 950-1 956. [藺冬梅,徐世健,張新芳,等,2011. 過量鐵脅迫對豌豆幼苗光合特性和葉綠體膜的影響[J]. 草業(yè)科學,28(11):1 950-1 956.]
MASOOD A,STARK KD,JR NS, 2005. A simplified and efficient method for the analysis of fatty acid methyl esters suitable for large clinical studies [J]. Lipid Res,46:2 299-2 305.
QUARTACCI MF,COSI E,NAVARI-IZZO F, 2001. Lipids and NADPH-dependent superoxide production in plasma membrane vesicles from roots of wheat grown under copper deficiency or excess [J]. J Experim Bot,52(354):77-84.
RAMALHO JC,CAMPOS PS,TEIXEIRA M,et al, 1998. Nitrogen dependent changes in antioxidant system and in fatty acid composition of chloroplast membranes fromCoffeaarabicaL. plants submitted to high irradiance [J]. Plant Sci,2(135):115-124.
RODRíGUEZ-PALMERO M,LOPEZ-SABATER MC,CASTELLOTE-BARGALLO AI,et al, 1997. Comparison of two methods for the determination of fatty acid profiles in plasma and erythrocytes [J]. J Chromat A,1-2(778):435-439.
ROUSCH JM,BINGHAM SE,SOMMERFELD MR, 2003. Changes in fatty acid profiles of thermo-intolerant and thermo-tolerant marine diatoms during temperature stress [J]. Exp Mar Biol Ecol,295:145-156.
SHAIKH SR,EDIDIN M, 2008. Polyunsaturated fatty acids and membrane organization:elucidating mechanisms to balance immunotherapy and susceptibility to infection [J]. Chem Physics Lipids,153(1):24-33.
WANG J,ZHANG CJ,CHEN GX,et al, 2006. Effect of low temperature on photosynthetic pigments and thylakoid membrane fatty acid in flag leaves of rice at the milky stage [J]. Chin J Rice Sci,20(2):177-182. [王靜,張成軍,陳國祥,等, 2006. 低溫對灌漿期水稻劍葉光合色素和類囊體膜脂肪酸的影響 [J]. 中國水稻科學,20(2):177-182.]
YANG JH,CHEN T,WANG XL, 2000. The influence of enhanced ultraviolet-bradiation on chloroplast membrane composition and membrane fluidity in wheat leaves [J]. Acta Phytoecol Sin,24(1):102-105. [楊景宏,陳拓,王勛陵, 2000. 增強紫外線B輻射對小麥葉綠體膜組分和膜流動性的影響 [J]. 植物生態(tài)學報,24(1):102-105.]
YANG XM,LIU XY,DONG XC,et al, 2008. Effect of increase in unsaturation of thylakoid membrane lipids on salt tolerance in tomato plants [J]. Sci Agric Sin,41(10):3 177-3 183. [楊秀梅,劉訓言,董新純,等, 2008. 類囊體膜脂不飽和度的增加對番茄耐鹽性的影響 [J]. 中國農(nóng)業(yè)科學,41(10):3 177-3 183.]
ZHANG J,HAN Y, 2009. Effects of He-Ne laser and UV-B radiation on Na+/K+-ATPase activity in organelles of wheat seedling [J]. Chin Bull Bot,44(4). [張娟,韓榕, 2009. He-Ne激光輻照與UV-B輻射對小麥幼苗細胞器中Na+/K+-ATP酶活性的影響 [J]. 植物學報,44(4).]
ZHAO JM,ZHOU H,SUN QZ, et al, 2009. Study on the influence of plant fatty acid desaturation on cold tolerance [J]. Pratac Sci,26(9):12-134. [趙金梅,周禾,孫啟忠,等, 2009. 植物脂肪酸不飽和性對植物抗寒性影響的研究 [J]. 草業(yè)科學,26(9):12-134.]ZHANG M,LI RJ, HUANG LB,et al, 2009. Physiological and biochmical response of tonoplast vesicles isolated fromBroussonetiapapyriferato Nael stress [J]. Sci Sil Sin, 45(8):50-55. [張敏,李榮錦,黃利斌,等,2009. Nael 脅迫下構樹幼苗液泡膜生理生化響應[J]. 林業(yè)科學,45(8):50-55.]
ZHANG Y,ZHAO Z,ZHANG M,et al, 2009. Seasonal acclimation of superoxide anion production,antioxidants,IUFA,and electron transport rates in chloroplasts of two Sabina species [J]. Plant Sci,176(5):696-701.
Comparison of three derivatization methods for the determination of fatty acid profiles in cell membranes for bluegrass (Poapratensis)
WANG Wei, HUANG Ya-Ya, WANG Na, CUI Lang-Jun*
(KeyLaboratoryofMedicinalResourcesandNaturalPharmaceuticalChemistry,MinistryofEducation,CollegeofLifeSciences,ShaanxiNormalUniversity, Xi’an 710062, China )
Abstract:The characteristic difference in bio-membrane in plant cells makes it difficult to use the same esterification method to determine the fatty acids contents,which are the important component of cell biological membrane. In order to establish a simple and reliable esterification method,in the present study,we isolated four kinds of cell membranes,chloroplasts,mitochondria,vacuoles and cytoplasm membrane respectively. Their fatty acids were extracted,esterified and determined by gas chromatography (GC) following three different methods. The results showed that both BF3-methanol and HCl-methanol esterification methods could not effectively esterify some of the fatty acids in mitochondria. Compared with the two approaches,acetyl chloride method could trans-esterify fatty acids completely and efficiently. Our data on fatty acids analysis with GC determination indicated that the third method had a high repeatability and accuracy. The current study provides valuable information for fatty acid determination on the plant cell membranes from different species.
Key words:cell membrane, fatty acid, gas chromatography, acetyl chloride
DOI:10.11931/guihaia.gxzw201306017
收稿日期:2014-08-10修回日期:2014-11-26
基金項目:國家科技部科技惠民計劃項目(2012GS610102)[Supported by the National Planning Program Beneficial to People of Ministral of Science and Technology(2012GS610102)]。
作者簡介:王維(1989-),女,陜西興平人,碩士研究生,主要從事植物生物化學和化學生物學研究,(E-mail)wangwei89825@163.com。 *通訊作者:崔浪軍,碩士生導師,從事天然產(chǎn)物的研究與開發(fā),(E-mail) ljcui@snnu.edu.cn。
中圖分類號:Q946
文獻標識碼:A
文章編號:1000-3142(2016)06-0741-06
王維,黃亞亞,王娜,等. 早熟禾細胞膜脂肪酸衍生化方法比較[J]. 廣西植物,2016,36(6):741-746
WANG W,HUANG YY,WANG N,et al. Comparison of three derivatization methods for the determination of fatty acid profiles in cell membranes for bluegrass (Poapratensis)[J]. Guihaia,2016,36(6):741-746

