小麥谷胱甘肽S-轉移酶基因的克隆及原核表達
張 蕾,于永昂,2,楊天佑
(1.河南科技學院生命科技學院,現代生物育種河南省協同創新中心,河南新鄉 453003;2.西北農林科技大學農學院,陜西楊凌 712100)
小麥谷胱甘肽S-轉移酶基因的克隆及原核表達
張 蕾1,于永昂1,2,楊天佑1
(1.河南科技學院生命科技學院,現代生物育種河南省協同創新中心,河南新鄉 453003;2.西北農林科技大學農學院,陜西楊凌 712100)
為了進一步研究小麥谷胱甘肽-S-轉移酶基因(TaGST)的功能,采用RT-PCR方法分離了小麥谷胱甘肽-S-轉移酶基因(TaGST)的ORF全長cDNA,并進行了生物信息學分析。結果表明:小麥TaGST基因的ORF全長690 bp,編碼229個氨基酸;TaGST蛋白分子質量為25.81 kDa,p I為5.29。系統進化分析表明,該基因編碼蛋白與水稻OsGST蛋白的氨基酸同源性最高,與已知植物GST家族成員的氨基酸序列聚類分析將TaGST聚為Phi類GST。構建原核表達載體pET32-TaGST,對TaGST基因進行原核表達,SDS-PAGE結果表明,其所表達蛋白與預期蛋白大小一致。為進一步研究該基因的特性和功能奠定了理論基礎。
小麥;谷胱甘肽過S-轉移酶;基因克隆;原核表達
谷胱甘肽-S-轉移酶(Glutathione-S-transferase,GSTs)是普遍存在于動植物中的一種多基因編碼的多功能蛋白酶,在清除生物和非生物脅迫產生的氧化損傷中起著重要的作用[1-2],其一般是由同源或異源二聚體蛋白組成的2個亞基來催化還原型谷胱甘肽與親電的化合物進行結合反應,降低其親電活性,最終達到脫毒作用[3-4]。目前,已經在擬南芥、水稻、楊樹、玉米和大豆等植物中發現了多種GST蛋白,其中在擬南芥、水稻和楊樹中就分別發現了53,59,81個GST蛋白[5-7]。根據蛋白的相似性,將GST主要分為7類:Phi(F)、Tau(U)、Theta(T)、Zeta(Z)、Lambda(L)、DHAR(Dehydroascorbate reductase)和TCHQD(Tetrachlorohydroquinone dehalopgenase),其中,Phi、Tau、Lambda和DHAR類是植物所特有的[8-10]。
GSTs在不同組織、不同發育時期的表達量有差異,并且其表達能夠受多種環境因子的誘導,如低
溫[11]、脫水[12]、傷害[13]和病原菌的侵染[14]等,在植物的生長發育、次生代謝和脅迫耐受中起著重要作用。許多研究表明,GST在植物抗性中起著重要的作用[15-18]。煙草中過量表達煙草GST基因提高了轉基因煙草的耐鹽和抗低溫能力[15],而將棉花GST基因轉入煙草增強了轉基因煙草的抗氧化脅迫能力[16]。在水稻中過量表達鹽地堿蓬GST基因可以提高轉基因水稻的抗低溫能力[17],而在擬南芥中過量表達鹽地堿蓬GST基因可以提高轉基因擬南芥的抗旱能力[18]。小麥是我國重要的糧食作物,但由于干旱、低溫和鹽堿等非生物脅迫嚴重影響了小麥產量。克隆小麥抗逆基因TaGST對于進一步利用該基因提高小麥抗逆性具有重要意義。為此,從小麥葉片中克隆了TaGST基因全長序列,并利用生物信息學技術對該基因編碼蛋白的理化性質進行了分析。同時,構建了pET32-TaGST原核表達載體,在宿主菌E.coli BL21(DE3)中成功進行了誘導表達,為小麥TaGST蛋白的進一步分離純化以及結構和功能研究奠定理論基礎。
1 材料和方法
1.1 試驗材料
供試小麥品種為新麥26,將小麥種子置于鋪有濾紙的培養皿中,置于培養箱中培養,三葉期時,取新鮮幼嫩葉片用液氮速凍待用;原核表達載體pET-32a購自德國Novagen公司;E.coli DH5α感受態細胞為河南科技學院發酵工程實驗室保存;限制性內切酶Bam HⅠ和Hin dⅢ、T4DNA連接酶購自大連TaKaRa公司;表達菌株E.coli BL21(DE3)購自北京全式金生物技術有限公司;其他試劑均為國產分析純。
1.2 試驗方法
1.2.1 TaGST基因的克隆 采用TRIzol-A+(Tiangen,北京)試劑提取樣品總RNA,按說明書使用Prim Script RT Reagent Kit(TaTaRa,大連)反轉錄合成第一鏈cDNA。根據小麥TaGST(GenBank登錄號:X56012)基因序列,用Primer Premier 5.0設計特異性引物GST-F1:5′-ATGTCTCCGGTGAAGGTG-3′,GST-R1:5′-CTAGTACTGCGCACCTAG-3′。以合成的cDNA第一鏈為模板進行PCR擴增。PCR反應條件為:94℃預變性3 min;94℃30 s,56℃30 s,72℃40 s,35個循環;72℃延伸5 min。PCR反應結束后產物經電泳檢測,回收與目標片段大小一致的條帶,將其連接到pGM-T載體(Tiangen,北京),轉化E.coli DH5α感受態細胞,挑取白色菌斑搖菌,進行菌液PCR擴增,將鑒定正確的陽性菌株進行測序。
1.2.2 小麥TaGST序列的生物信息學分析 通過Protparam分析其編碼蛋白的理化性質;將TaGST基因序列和推導的氨基酸序列在NCBI(http://www. ncbi.nlm.nih.gov)上用BLASTX進行同源性搜索和比對;用DNAMAN 6.0進行多重序列比對;用TMHMM預測蛋白質跨膜區結構;用SingnalP4.1軟件進行信號肽預測;用Mega 5.0軟件構建系統發育樹。
1.2.3 TaGST基因原核表達載體的構建 根據原核表達載體pET-32a和TaGST基因序列設計帶有Bam HⅠ和Hin dⅢ酶切位點的特異性引物用于TaGST基因原核表達載體的構建,引物序列如下:GST-F2:5′-CGGGATCCATGTCTCCGGTGAAGGTG-3′(下劃線為Bam HⅠ酶切位點),GST-R2:5′-CCCAAGCTTGTACTGCGCACCTAGCTT-3′(下劃線為Hin dⅢ酶切位點)。
PCR產物經回收后連接到pGM-T載體,轉化E.coli DH5α感受態細胞,涂布于含有Amp的LB固體培養基上,37℃培養過夜,挑取單克隆進行PCR擴增和雙酶切鑒定,并進行測序鑒定,以獲得重組質粒pGM-TaGST。將測序鑒定正確的pGM-TaGST質粒與原核表達載體pET-32a分別用Bam HⅠ和Hin dⅢ進行雙酶切,酶切產物經T4DNA連接酶連接后熱擊轉化E.coli DH5α感受態細胞,在LB(Amp+)固體培養基上培養12 h后,挑取陽性克隆提取質粒,進行PCR擴增和雙酶切鑒定,以獲得原核表達載體pET32-TaGST。
1.2.4 TaGST基因的原核表達 將原核表達載體pET32-TaGST轉化E.coli BL21(DE3)感受態細胞,挑取單克隆至10 m L LB(Amp+)液體培養基中,200 r/min 37℃振蕩培養12 h。然后按照1∶100(V/V)轉接到新鮮LB液體培養基中培養2~3 h至OD600達到0.6~0.8,取1 mL重組質粒菌液加IPTG至終濃度為0.5 mmol/L,37℃、200 r/min誘導培養1,2,3,4 h。誘導表達完成后,取1 m L菌液,12 000 r/min離心10 min收集菌體,進行SDS-PAGE電泳,檢測融合蛋白的表達情況。凝膠用考馬斯亮藍R-250染色并脫色至條帶清晰。
2 結果與分析
2.1 TaGPX基因的克隆
根據NCBI中小麥GST基因的序列設計特異性擴增引物,采用RT-PCR技術擴增得到1條大約700 bp的條帶(圖1),測序結果顯示該序列長690 bp,與預期片段大小一致,編碼229個氨基酸,起始密碼子為ATG,終止密碼子為TAG(圖2)。
2.2 小麥TaGST序列的生物信息學分析
利用Protparam分析TaGST的理化性質,推測TaGST蛋白的分子式為C1188H1816N296O326S11,分子質量為25.81 kDa,理論等電點(p I)為5.29。TaGST蛋白不穩定系數為46.10(高于域值40),屬于不穩定蛋白。總的帶負電荷的殘基(Asp+Glu)為28,總的帶正電荷的殘基(Arg+Lys)為21。TMHMM和SignalP 4.1在線分析結果表明,該蛋白沒有跨膜結構域和信號肽,屬于非分泌蛋白。TaGST蛋白的結構域預測發現其保守結構域分為N端(位于3-78氨基酸殘基)和C端(位于95-216氨基酸殘基)兩部分(圖3)。

圖1 TaGST基因的PCR擴增Fig.1 PCR am p lification of TaGST gene
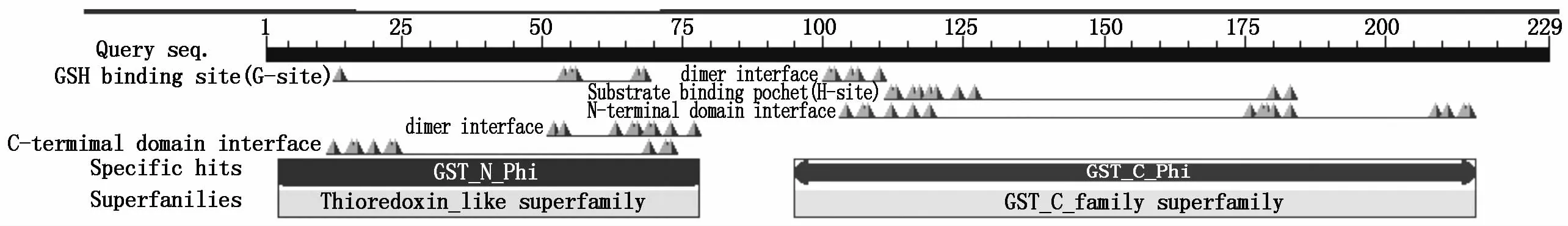
圖3 TaGST保守結構域分析Fig.3 Conserved dom ain analysis of TaGST
利用DNAMAN 6.0軟件,將克隆的TaGST基因編碼的氨基酸序列與GenBank中其他植物的GST氨基酸序列進行比對,發現該基因編碼蛋白與已知的水稻(BAB39939)、大麥(AAL733940)、玉米(AAA33469)、擬南芥(CAB83126)的Phi類GST具有較高的同源性,氨基酸相似性分別達到61.57%,61.14%,49.78%,43.67%(圖4)。進一步利用Mega 5.0軟件對小麥TaGST蛋白與水稻、擬南芥的Phi、Theta、Zeta、Lambda、Tau類GST蛋白序列構建系統發育樹,結果表明,本研究所克隆的TaGST基因編碼的蛋白和水稻、擬南芥的Phi類GST的親緣 關系最近(圖5)。

圖4 TaGST基因編碼的氨基酸序列與其他作物GST氨基酸序列的比對Fig.4 M u ltip le alignm ent of the deduced am ino acid sequences of TaGST and GST p roteins from other p lants
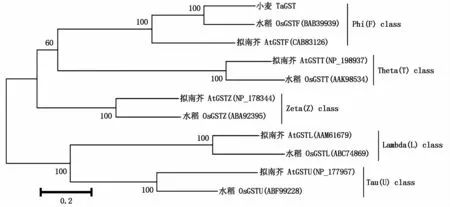
圖5 五類GSTs進化樹分析Fig.5 A phy logenetic tree constructed based on the am ino acid sequences of five classes of GSTs
2.3 TaGST基因原核表達載體的構建及酶切鑒定
通過Bam HⅠ和Hin dⅢ雙酶切重組質粒pGMTaGST和pET-32a空載體,回收目的基因片段和線性載體進行連接,得到重組質粒pET32-TaGST,轉化E.coli DH5α感受態細胞,抽提質粒進行雙酶切鑒定,結果顯示,TaGST基因成功連接到pET-32a載體上(圖6)。重組質粒再次測序,結果表明,插入片段與克隆序列完全一致。由此表明pET32a-TaGST原核表達載體構建成功。

圖6 小麥TaGST基因重組質粒pET32a-TaGST的雙酶切鑒定Fig.6 Identification of the recom binan t vector pET32a-TaGST by Bam HⅠand H in dⅢdouble digestion
2.4 TaGST基因重組蛋白的誘導表達
由圖7可知,經IPTG誘導的pET32a-TaGST重組質粒在E.coli BL21(DE3)中表達,分子質量約45 kDa,與預期的目標融合蛋白大小一致,目的蛋白約25.81 kDa,標簽蛋白20.4 kDa,且隨著誘導表達時間的增加融合蛋白表達量增多。
3 結論與討論
植物在不利的非生物逆境脅迫條件下如高溫、低溫、干旱、鹽漬等,會造成細胞代謝過程異常,積累大量的活性氧(ROS),影響植株的生長發育。在正常情況下,植物體內ROS的產生和清除處于一種動態的平衡狀態,而當植物受到逆境脅迫時,大量積累的ROS能夠對植物體內的脂質、蛋白質以及核酸等生物大分子產生傷害[19-21]。GST利用還原型谷胱甘肽的還原作用來清除逆境脅迫下細胞中產生的ROS,同時也能夠對受到氧化損傷的細胞進行修復,從而維持植物體內的正常代謝過程。在瞿麥(Dianthus superbus L.)中過量表達煙草GST基因能夠增加轉基因瞿麥在干旱和不同光照條件下的光合作用[22]。火把梨的GST基因能夠參與維持火把梨果實發育過程中的氧化還原平衡和應答逆境脅迫[23]。在模擬酸雨脅迫下,青花菜GST基因的表達量在脅迫初期顯著增加,隨著時間延長開始下降,表明GST基因參與了青花菜抗酸雨的應答反應[24]。這一系列研究表明,植物GSTs對抵抗逆境脅迫具有重要作用。
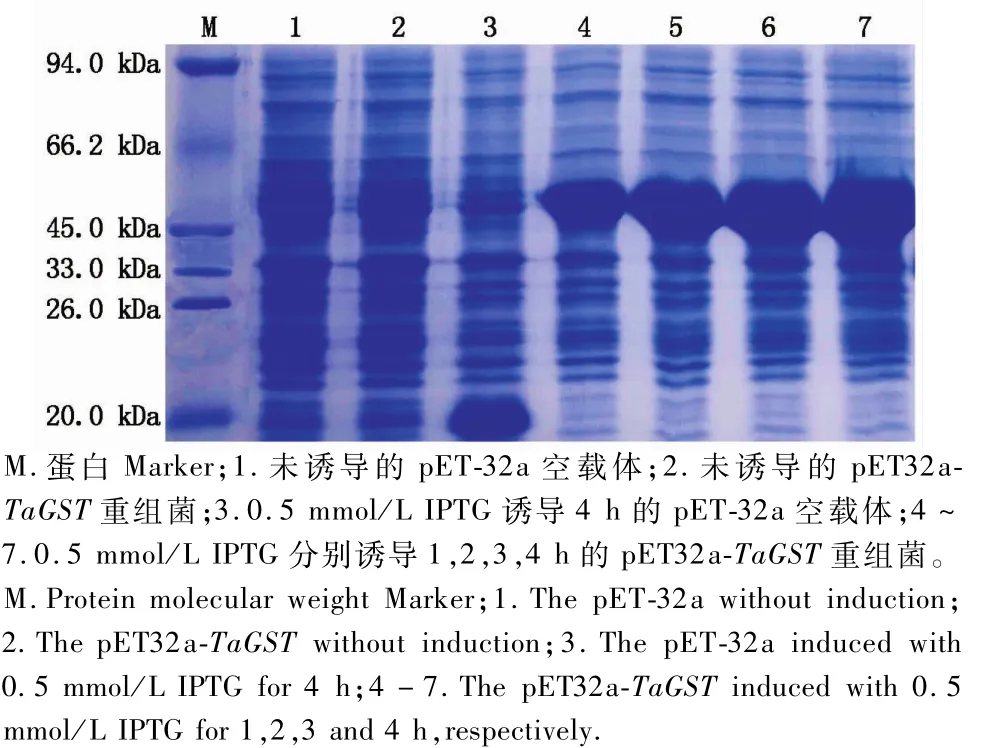
圖7 pET32a-TaGST融合蛋白的表達分析Fig.7 Analysis of pET32a-TaGST p rotein exp ression in by SDS-PAGE
本試驗根據NCBI中小麥TaGST基因序列,設計特異性引物,采用RT-PCR方法從小麥葉片中成功克隆得到具有完整ORF的TaGST基因序列;生物信息學分析表明,該基因所推導的氨基酸序列與已知的水稻、大麥、玉米和擬南芥的GST蛋白序列具有較高的相似性;保守結構域分析結果表明,所克隆的TaGST蛋白序列含有GST_N和GST_C,屬于Phi類,同時聚類分析也將本試驗中的TaGST歸于Phi類GST。
原核表達技術常用于一些重要蛋白質的結構和功能研究。目前,在原核表達技術中應用最為廣泛的表達宿主菌是大腸桿菌,其具有結構簡單、操作方便以及對外源目的蛋白表達量高等多種優點[25-26]。本試驗采用目前應用最廣泛的pET系列原核表達載體進行目的蛋白的表達分析,成功構建了TaGST基因的原核表達載體pET32a-TaGST,并進一步將其轉化E.coli BL21(DE3)感受態細胞進行目的蛋白的誘導表達。SDS-PAGE凝膠電泳分析表明,成功誘導出1條分子質量約為45 kDa的蛋白條帶,與預測分子質量大小一致,為進一步純化蛋白質以及進行生物學功能分析提供了基礎資料。
綜上所述,本試驗從小麥葉片中成功地克隆了TaGST基因,利用原核表達技術成功誘導表達TaGST蛋白,為進一步研究TaGST蛋白的結構和功能以及通過遺傳轉化提高植物的抗逆性提供試驗理論基礎。
[1] Frova C.The plant glutathione transferase gene family:genomic structure,functions,expression and evolution[J]. Physiologia Plantarum,2003,119(4):469-479.
[2] George S,Venkataraman G,Parida A.A chlorop last-localized and auxin-induced glutathione S-transferase from phreatophyte Prosopis juliflora confer drought tolerance on tobacco[J].Journal of Plant Physiology,2010,167(4):311-318.
[3] Diao G P,Wang Y C,Wang C,et al.Cloning and functional characterization of a novel glutathione S-Transferase gene from limonium bicolor[J].Plant Molecular Biology Reporter,2011,29(1):77-87.
[4] Kumar S,Asif M H,Chakrabarty D,et al.Expression of a rice Lambda class of glutathione S-transferase,OsGSTL2,in Arabidopsis provides tolerance to heavy metal and other abiotic stresses[J].Journal of Hazardous Materials,2013,248-249,228-237.
[5] 范玉潔,林飛鵬,安澤偉,等.一個橡膠樹谷胱甘肽-S-轉移酶基因的克隆和表達特性分析[J].中國農業科學,2011,44(20):4150-4158.
[6] Soranzo N,Gorla A M,M izzi L,et al.Organisation and structural evolution of the rice glutathione S-transferase gene family[J].Molecular Genetics and Genomics,2004,271:511-521.
[7] Lan T,Yang Z L,Yang X,et al.Extensive functional diversification of the Populus glutathione S-transferase supergene family[J].The Plant Cell,2009,21:3749-3766.
[8] Edwards R,Dixon D P.Plant glutathione transferases[J]. Methods Enzymol,2005,401:169-186.
[9] 陳秀華,王臻昱,李先平,等.谷胱甘肽S-轉移酶的研究進展[J].東北農業大學學報,2013,44(1):149-153.
[10] 易樂飛,郝 偉,李信書,等.條斑紫菜Mu型谷胱甘肽S-轉移酶基因克隆與分析[J].水產科學,2016,35(1):67-71.
[11] Lo Piero A R,Puglisi I,Rapisarda P,et al.Anthocyanins accumulation and related gene expression in red orange fruit induced by low temperature storage[J].Journal of Agricultural and Food Chem istry,2005,53(23):9083-9088.
[12] Bianchi M W,Roux C,Vartanina N,et al.Drought regulation of GST8,ncodes the Arabidopsis homologue of ParC/Nt107 glutathione transferase/peroxidase[J]. Physiol Plant,2002,116:96-105.
[13] Vollenweider S,Weber H,Stolz S,et al.Fatty acid ketodienes and fatty acid ketotrienes:M ichael addition acceptors that accumulate in wounded and diseased Arabidopsis leaves[J].Plant Journal,2000,24(4):467-476.
[14] Mauch F,Dudler R.Differential induction of distinct glutathione S-transferases of wheat by xenobiotics and by pathogen attack[J].Plant Physiol,1993,102:1193-1201.
[15] Roxas V P,Roger K,Smith JR,et al.Over expression of glutathione S-transferase/glutathione peroxidase enhances the growth of transgenic tobacco seedlings during stress[J].Nat Biotech,1997,15:988-991.
[16] 於丙軍,劉友良.鹽脅迫對一年生鹽生野大豆幼苗活性氧代謝的影響[J].西北植物學報,2003,23(1):18-22.
[17] 趙鳳云,王曉云,趙彥修,等.轉入鹽地堿蓬谷胱甘肽轉移酶和過氧化氫酶基因增強水稻幼苗對低溫脅迫的抗性[J].植物生理與分子生物學學報,2006,32(2):231-238.
[18] 戚元成,張小強,劉衛群.過量表達谷胱甘肽轉移酶基因對轉基因擬南芥抗旱能力的影響[J].植物生理學通訊,2008,44(2):268-270.
[19] Chi Y H,Chen Y S,Vanitha J,et al.Expansion mechanisms and functional divergence of the glutathione stransferase family in Sorghum and other higher plants[J].DNA Research,2011,18:1-16.
[20] 毛小輝,魏毅東,張建福,等.粳稻品種云引谷胱甘肽S-轉移酶基因OsGST的克隆及序列分析[J].福建農業學報,2014,29(3):197-203.
[21] Mohsenzadeh S,Esmaeili M,Moosavi F A,et al.Plant glutathione S-transferase classification,structure and evolution[J].African Journal of Biotechnology,2011,10(42):8160-8165.
[22] Lim JD,Hang S J,Yu C Y,et al.Expression of the glutathione S-transferase gene(NT107)in transgenic Dianthus superbus[J].Plant Cell Tissue Organ Cult,2005,80:277-286.
[23] 劉迪秋,王光勇,王繼磊,等.火把梨谷胱甘肽S-轉移酶基因的克隆與表達[J].西北植物學報,2012,32(1):29-34.
[24] 高世超,林義章,鐘鳳林,等.青花菜谷胱甘肽-S-轉移酶基因克隆及其表達分析[J].西北植物學報,2014,34(4):651-657.
[25] Chen R.Bacterial expression systems for recombinant protein production:E.coli and beyond[J].Biotechnology Advances,2012,30(5,SI):1102-1107.
[26] 張曉東,李彩霞,王連春,等.滇龍膽GrSLS1基因的克隆與原核表達[J].西北植物學報,2014,34(7):1311-1317.
Cloning and Prokaryotic Expression of TaGST from Triticum aestivum L.
ZHANG Lei1,YU Yongang1,2,YANG Tianyou1
(1.School of Life Science and Technology,Henan Institute of Science and Technology,Collaborative Innovation Center of Modern Biological Breeding of Henan Province,Xinxiang 453003,China;2.College of Agronomy,Northwest A&F University,Yangling 712100,China)
To investigate the function of TaGST gene,RT-PCR was used to obtain TaGST gene open reading frame sequence from wheat and analyzed by bioinformatics method.The sequence analysis results showed that the ORF of TaGST gene had a length of 690 bp coding for 229 amino acid,and the relative molecular weight of TaGST protein was 25.81 kDa and its theoretical isoelectric pointwas 5.29.Homology analysis showed that the amino acid sequence of TaGST was highly homologous with Oryza sativa,and phylogenetic analysis of the relationship of the newly identified TaGST with some known plant GSTs grouped the TaGST into the class of PhiGSTs.The prokaryotic expression of TaGST gene was done after construction of its prokaryotic expression vector pET32-TaGST,and the SDS-PAGE results displayed that the expressed protein was consistentwith the anticipated size.The resultswere expected to lay a foundation for further studies on the properities and function of this gene.
Wheat;Glutathione-S-transferase;Gene clone;Porkaryotic expression
Q78;S512.03 文獻標識碼:A 文章編號:1000-7091(2016)03-0038-06
10.7668/hbnxb.2016.03.006
2015-11-26
國家自然科學基金項目(1305047);河南省教育廳科學技術研究重點項目(12A180011);河南省高等學校青年骨干教師資助計劃項目(2014GGJS-100)
張 蕾(1987-),女,河南新鄉人,助理實驗師,碩士,主要從事植物分子生物學研究。

