植物乳桿菌C88聯合香菇多糖對腸道微生態的調節作用
羅 宏,段翠翠,趙玉娟,高 磊,李盛鈺
(1.長春大學教育學院,長春130022;2.吉林省農業科學院產品加工研究所,長春130124)
植物乳桿菌C88聯合香菇多糖對腸道微生態的調節作用
羅 宏1,段翠翠2,趙玉娟2,高 磊2,李盛鈺2
(1.長春大學教育學院,長春130022;2.吉林省農業科學院產品加工研究所,長春130124)
研究了植物乳桿菌(Lactobacillus plantarum)C88和香菇多糖合生元組合物對正常小鼠腸道微生態的調節作用。結果表明,植物乳桿菌C88聯合香菇多糖能降低糞便中水分、氨及pH值,降低血清中DAO、D-LA、ET和TNF-α的水平,促進腸道中乳桿菌(Lactobacilli)、雙歧桿菌(Bifidobacteria)等有益菌的生長,降低腸桿菌(Enterobacteria)、腸球菌(Enterococci)等有害菌的數量,提高短鏈脂肪酸的產量,且植物乳桿菌C88與香菇多糖聯合使用效果優于二者單獨使用。上述結果揭示植物乳桿菌C88與香菇多糖形成的合生元組合物具有調節腸道微生態平衡和改善腸道功能的作用。
植物乳桿菌;香菇多糖;短鏈脂肪酸;合生元
0 引言
益生菌(probiotic)是指對宿主健康有促進作用的活的微生態制劑,具有增強機體免疫力、緩解不耐乳糖癥狀、促進腸道消化系統健康等功能[1]。一些不被人體消化或難被消化的碳水化合物可選擇性促進腸道內雙歧桿菌、乳桿菌等有益微生物的生長和增殖,促進宿主向健康方向發展的有益物質統稱為益生元(prebiotic)[2]。益生元和益生菌聯合使用的制劑稱為合生元(synbiotic),同時兼具益生元和益生菌的功能特點[3]。近年來國內外對于合生元微生態制劑的研究和的開發都十分活躍,合生元微生態制劑在改善特異性免疫、高脂血癥、腸道微生態環境等發面發揮重要的生理作用[4-6]。本實驗研究植物乳桿菌(Lactobacillus plantarum)C88、香菇多糖及二者合生元組合物對正常小鼠腸道微生態的調節作用,為開發具有改善腸道平衡狀態的微生態制劑提供理論基礎。
1 實驗
1.1 材料與方法
1.1.1 菌株及培養方法
植物乳桿菌(L.plantarum)C88分離自內蒙古傳統發酵奶豆腐,是一株具有優良功能特性和發酵特性的益生菌株。該菌株在含20%(體積分數)甘油的MRS培養基中,-80℃凍存[8]。使用前連續活化傳代后,按1%量接種于MRS液體培養基中,37℃培養16 h,離心(6 000 r/min,10 min,4℃),菌泥用滅菌生理鹽水洗滌2次,離心(6 000 r/min,10 min,4℃),用滅菌生理鹽水調整菌數1010mL-1備用。
香菇原料由吉林省琿春市神怡菌業提供。
1.1.2 試劑
乙酸,丙酸,丁酸標準品(色譜純),小鼠血清二胺氧化酶(diamine oxidase,DAO)ELISA檢測試劑盒,D-乳酸(D-lactate,D-LA)ELISA檢測試劑盒,內毒素(endotoxin,ET)ELISA檢測試劑盒,抗腫瘤壞死因子-α(TNF-α)ELISA檢測試劑盒;本實驗所用的其余試劑均為分析純。
LBS瓊脂培養基(檢測乳桿菌)、胰胨-亞硫酸鹽-環絲氨酸瓊脂(TSC)培養基(檢測產氣莢膜梭菌)、雙歧桿菌瓊脂(NNLP)培養基、腸桿菌計數瓊脂(VRBDA)培養基、膽鹽-七葉苷-疊氮鈉瓊脂(BEA)培養基(檢測腸球菌)。
1.1.3 主要儀器
ELx800型全自動酶標儀,Sorvall Evolotion RC型高速冷凍離心機,HZQ-Q型電熱恒溫培養箱,GC 7890A型氣相色譜儀,Cary 300紫外可見分光光度計,PB-10數顯pH計。
1.2 方法
1.2.1 香菇多糖的制備
將香菇原料干燥、粉碎(20目)后,加入10倍量經熱水(100℃)提取2次,每次2 h,過濾,濾液減壓濃縮,2倍體積無水乙醇沉淀,室溫放置過夜,離心(6 000 r/min,10 min,4℃),濾液減壓回收乙醇,離心(6 000 r/min,10 min,4℃),凍干得香菇多糖粗品。粗多糖經DEAE-纖維素純化,以蒸餾水洗脫,收集含香菇多糖洗脫液,透析(截留分子量為3 500 ku),凍干后得到香菇多糖(lentinan)[9]。
1.2.2 動物分組及處理
4周齡雄性昆明種小鼠,體重18~22 g,購自長春市高新醫學動物中心。飼喂常規飼料,飲用蒸餾水。動物室溫度22℃±2℃,濕度55%±5%,每天更換墊料,12 h晝/夜循環。適應性喂養1周后,隨機分為4組,每組25只:空白對照組(灌胃生理鹽水12 mL/(kg·d)),香菇多糖組(香菇多糖200 mg/(kg·d)),植物乳桿菌C88組(C88菌液1.0×1010mL-1,12 mL/(kg·d)),合生元組(香菇多糖200 mg/kg+C88菌株1.0×1010mL-1,12 mL/(kg·d)),連續灌胃28 d。
1.2.3 小鼠糞便中水分、氨和pH值含量測定
小鼠糞便中水分質量分數測定。于實驗結束灌胃前5 d(第24 d~第28 d),各組每天隨機撿取10粒的小鼠新鮮糞便,105℃干燥至恒重。干燥前后小鼠糞便質量差值占干燥前糞便質量的百分比即為小鼠糞便水分質量分數。
小鼠糞便中氨質量分數的測定。采用納氏試劑分光光度法檢測糞便氨質量分數。按照GB/ T18204.25-2000《公共場所空氣中氨測定方法》中給出氨的化學檢測方法制作氨質量分數的標準曲線。測定方法:在實驗第28d取小鼠腸道成型內容物0.1 g置于試管中,加入吸收液[C(H2SO4=0.005 moL/L)]5 mL,充分混勻,定容至10 mL,離心(6 000 r/min,10 min,4℃),取上清液1.0 mL,加入9.0 mL吸收液,混勻。依次加入0.1 mL酒石酸鉀鈉溶液和0.5 mL納氏試劑,混勻,室溫下放置10 min。在波長425 nm下檢測其吸光度,每組3個重復。根據標準曲線計算糞便中氨質量分數。
小鼠糞便中的pH值的測定。在實驗第28 d取小鼠新鮮糞便0.1 g,加入1.0 mL蒸餾水充分混勻,離心(8 000 r/min,10 min,4℃)檢測pH值,每組3個重復。
1.2.4 血清指標分析
末次灌胃后,小鼠禁食不禁水14 h,摘取小鼠眼球取血,血液在37℃靜置60 min,4℃放置60 min,3 000 r/min離心10 min制備血清,-80℃冰箱保存。按照ELISA試劑盒說明書測定小鼠血清中DAO、D-LA、ET、TNF-α的含量。
1.2.5 腸道菌群計數
分別于小鼠灌胃第0,7,14,21,28 d每組取小鼠3只;拉椎處死,無菌條件下取小鼠腸道成形內容物于試管內,滅菌生理鹽水梯度稀釋,分別吸取50 μL涂布于LBS,MRS+NNLP,VRBDA,BEA瓊脂平板上;按照各自的培養條件進行培養,通過菌落形態觀察、革蘭氏染色鏡檢等方法鑒定菌群種類并計數[10]。
腸道內主要菌群鑒定方法:
①乳桿菌(LBS瓊脂)在37℃培養48 h,白色或乳白色G+無芽孢桿菌。
②雙歧桿菌(MRS+NNLP瓊脂)在37℃厭氧培養48 h,微白色、表面光滑、凸起、G+的叉狀或棒狀菌落。
③腸桿菌(VRBDA瓊脂)在37℃培養24 h,發酵乳糖、G-的菌落。
④腸球菌(BEA瓊脂)在37℃培養4 h,明顯褐色圈、G+的菌落。
1.2.6 短鏈脂肪酸含量分析
處死小鼠后,取結腸內容物0.1 g,加蒸餾水5 mL溶解并震蕩2 h,離心(10 000 r/min,10 min,4℃),0.45 μm濾膜過濾。取上清液2 mL依次加入加入50% H2SO4和2.0 mL乙醚,充分混勻,離心(10 000 r/min,10 min,4℃),吸取上層乙醚溶液用于氣相色譜分析[11]。氣相色譜分析采用外標法,用乙酸、丙酸和丁酸作標準曲線。氣相色譜測定條件:DB-FFAP色譜柱(30 m× 0.25 mm,0.25 μm)。升溫程序:初溫120℃,維持5 min,以15℃/min速度升到250℃,保持1 min。FID檢測器溫度為280℃;載氣為氮氣,分流比為10∶1,流速為2.0 mL/min;待測樣品進樣體積為2 μL[12]。
1.3 統計學分析
實驗數據處理采用SPSS 17.0軟件進行分析,結果以“均數±標準差(x±s)”表示,不同劑量組間與對照組的比較采用方差分析比較,以P<0.05判斷為具有顯著性差異,P<0.01為具有極顯著性差異。
2 結果與分析
2.1 對小鼠糞便理化指標的影響
表1為植物乳桿菌C88、香菇多糖及其合生元組合物對小鼠糞便氨質量分數、水分質量分數和pH值的影響。
腸道中不被消化分解的食物蛋白質、胰腺及上皮組織等分泌脫落的蛋白質作為腸道細菌生長的主要氮源[13]。大腸中的細菌將血液中的尿素分解成微生物蛋白,經糞便排出體外[14-16]。由表1可以看出,小鼠連續灌胃28 d后,與空白對照組相比,各組小鼠糞便中氨質量分數有所下降。香菇多糖和植物乳桿菌C88單獨使用均能降低小鼠糞便中氨質量分數。而香菇多糖-植物乳桿菌C88合生元組合物降低小鼠糞便中氨質量分數,明顯低于香菇多糖組,實驗結束時小鼠糞便中氨質量分數降到52.45 μg/g,與空白對照組比差異顯著(P<0.01)。分析原因可能是香菇多糖作為一種非消化性多糖,有助于降低機體對蛋白質的攝入量,減少糞便中氨的質量分數,同時植物乳桿菌C88能促進尿素的轉運及利用,減少了腎臟中氨的排泄量[17]。
在給小鼠灌胃28 d后,與空白對照組相比,各組小鼠糞便中水分質量分數有所下降。C88組和香菇多糖-植物乳桿菌C88合生元組小鼠糞便中水分質量分數的明顯降低,小鼠腸道成型糞便呈長條形,且植物乳桿菌C88降低糞便中水分的作用強于香菇多糖。說明植物乳桿菌C88及香菇多糖-植物乳桿菌C88合生元可能通過降低小鼠糞便中水分質量分數。
益生菌在腸道內發酵可產生乙酸、丙酸、丁酸、乳酸等有機酸,為腸黏膜細胞提供能量,同時促進細胞生長代謝,降低并調節腸道內pH值,抑制致病菌的生長和繁殖,調節腸道微生態平衡[18-19]。在給小鼠灌胃28 d后,與空白對照組相比,各組小鼠糞便的pH值有所下降。表明香菇多糖和植物乳桿菌C88可能通過促進益生菌的增殖和增加短鏈脂肪酸的產量,降低腸道內環境的pH值,調節腸道微生態平衡。
2.2 對小鼠血清指標的影響
表2為植物乳桿菌C88、香菇多糖及其合生元組合物對小鼠血清中DAO,D-LA,ET,TNF-α質量濃度的影響。
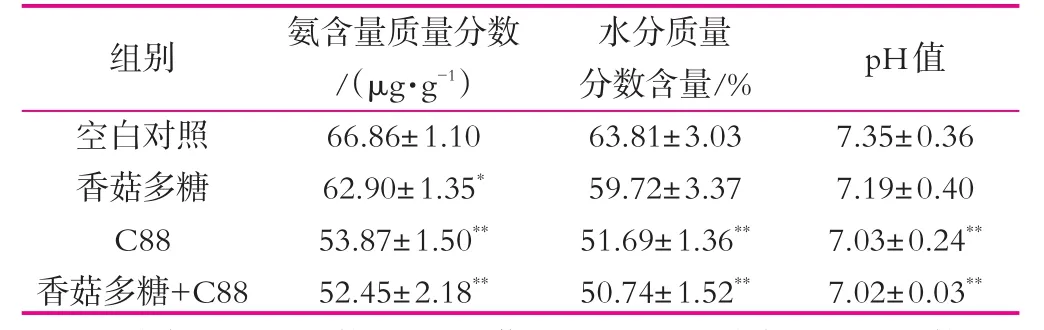
表1 植物乳桿菌C88、香菇多糖及其合生元組合物的影響
當腸道黏膜受損時,釋放DAO進入血液、淋巴及腸腔,從而降低腸黏膜中DAO的活性。因此,在機體無創情況下血清中DAO活性能更直接地反映腸上皮細胞及腸黏膜屏障結構的損傷程度,是監測腸道屏障功能的標志物[20-21]。如表2可知,灌胃28 d后,各組小鼠血清中DAO的含量有不同程度降低,與空白對照組相比,C88組和香菇多糖+C88組小鼠血清中DAO的含量有顯著性降低(P<0.05);香菇多糖-植物乳桿菌C88合生元組小鼠血清中DAO含量降低到1.06 U/L,與模型組相比有極顯著差異(P<0.01)。表明香菇多糖、植物乳桿菌C88及香菇多糖-植物乳桿菌C88合生元均能降低小鼠血清中DAO活性,有預防腸道屏障功能受損的作用,合生元作用效果優于單獨使用香菇多糖或植物乳桿菌C88。
生理狀態下,血清中D-乳酸是多種腸道細菌發酵的主要代謝產物[22]。當腸道發生急性損傷時,腸道中大部分D-乳酸可通過受損的腸黏膜進入血液循環系統,提高血清D-乳酸含量。因此,血清中D-乳酸水平可以及時地反映出腸黏膜損害程度和通透性的變化[23]。如表2所示,香菇多糖、植物乳桿菌C88以及香菇多糖-植物乳桿菌C88合生元均能降低血清中D-乳酸含量,與空白對照組相比有極顯著性差異(P<0.01)。且合生元對血清中乳酸的降低效果優于二者單獨使用。
內毒素在機體內直接作用于生物膜并產生毒性,同時間接損傷靶器官,刺激細胞吞噬系統分泌TNF-α、IL-1等多種炎癥遞質,促進炎癥反應的發生,進而影響機體細胞代謝功能以及腸道屏障功能的完整性[24-25]。如表2可知,小鼠灌胃28 d后各實驗組小鼠血清中的ET和TNF-α含量均有不同程度的降低。香菇多糖-植物乳桿菌C88合生元對血清中內毒素和TNF-α的降低效果最好。單獨使用植物乳桿菌C88或香菇多糖均能降低小鼠腸道中降低血清中DAO、D-LA、ET和TNF-α的水平,兩者聯合使用作用效果優于單獨使用,兩者可能存在協同作用或疊加作用。試驗結果表明,香菇多糖和植物乳桿菌C88聯合作用可能通過促進小鼠腸道中有益菌的數量,降低內毒素水平,進而降低炎癥因子TNF-α的水平,維持小鼠細胞代謝功能以及屏障功能的完整性。
2.3 對小鼠腸道短鏈脂肪酸的影響
表3為植物乳桿菌C88、香菇多糖及其合生元組合物對小鼠腸道中短鏈脂肪酸質量濃度的影響。
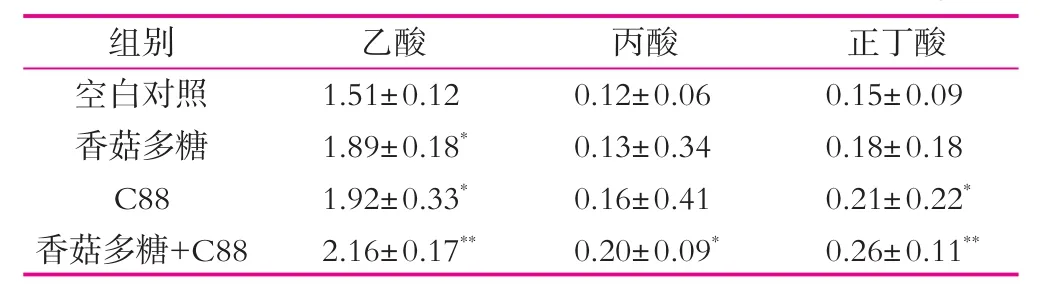
表3 植物乳桿菌C88、香菇多糖及其合生元組合物對小鼠的影響mg/mL
由表3可以看出,28 d實驗結束時小鼠腸道中乙酸、丙酸、正丁酸的質量濃度均有不同程度的增加。飲食中寡糖、不消化的淀粉、纖維多糖等物質在結腸腔內經細菌酵解生成短鏈脂肪酸,其中乙酸、丙酸和丁酸所占比例高達85%。大部分的短鏈脂肪酸被黏膜上皮細胞吸收,轉運至血液為機體肝臟、肌肉、心臟等的代謝提供能源。由于碳水化合物底物不同,發酵產生的短鏈脂肪酸的比例和生理作用也有所不同[26-27]。我們的研究結果表明,灌胃植物乳桿菌C88、香菇多糖及其合生元組合物均能不同程度提高小鼠腸道短鏈脂肪酸的質量濃度。香菇多糖-植物乳桿菌C88合生元組合物能顯著提高小鼠腸道中乙酸、丙酸和丁酸的質量濃度。表明香菇多糖通過促進植物乳桿菌C88的增殖,增加小鼠結腸內短鏈脂肪酸的產量,香菇多糖-植物乳桿菌C88合生元組合物的作用優于二者單獨使用。
2.4 對小鼠腸道菌群的影響
不同實驗組小鼠腸道中乳酸菌與雙歧桿菌數量的變化情況如圖1所示。
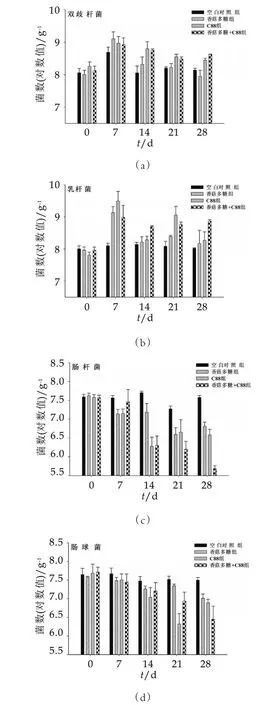
圖1 植物乳桿菌C88、香菇多糖及其合生元組合物對小鼠腸道菌群的影響
由圖1可以看出,灌胃7 d乳桿菌和雙歧桿菌數量均有不同程度的增加,香菇多糖組小鼠腸道中雙歧桿菌數量達到9.10 g-1(對數值),C88組小鼠腸道中乳桿菌數量達到9.49 g-1(對數值)。灌胃14 d時,小鼠腸道中乳桿菌和雙歧桿菌數量有所下降。灌胃21 d和28 d乳桿菌和雙歧桿菌數量基本保持平穩,與灌胃前相比,乳桿菌和雙歧桿菌數量略有增加。灌胃結束時,香菇多糖-植物乳桿菌C88合生元對乳桿菌和雙歧桿菌數量增加最明顯,效果優于單獨使用香菇多糖和植物乳桿菌C88。除空白對照組外,小鼠腸道中腸桿菌和腸球菌隨著灌胃時間的增加,數量逐漸下降。到第14天時,C88組和香菇多糖+C88組小鼠腸道中的腸桿菌數量有明顯下降趨勢,C88組腸球菌數量明顯降低。灌胃結束時,香菇多糖-植物乳桿菌C88合生元對小鼠腸道中腸桿菌和腸球菌數量降低最明顯,效果優于單獨使用香菇多糖或植物乳桿菌C88。香菇多糖和植物乳桿菌C88對小鼠腸道菌群有調節作用,促進腸道有益菌乳桿菌、雙歧桿菌數量,抑制并降低腸道有害菌腸桿菌、腸球菌數量,植物乳桿菌C88-香菇多糖合生元合效果優于單獨使用香菇多糖或植物乳桿菌C88。
3 結論
植物乳桿菌C88和香菇多糖聯合使用對小鼠腸道微生態的調節作用,一方面是由于C88與香菇多糖利于腸道有益菌的繁殖,促進短鏈脂肪酸的產生,抑制致病菌的生長,另一方面兩者降低血清中DAO、D-LA、ET和TNF-α的質量濃度,改善腸道屏障功能,調節小鼠腸道微生態平衡。植物乳桿菌C88與香菇多糖聯合使用效果優于二者單獨使用,二者形成的合生元組合物有望開發成具有保健功能的微生態制劑,具有廣泛的應用前景。
[1]KUMAR M,RAKESH S,NAGPAL R,et al.Probiotic Lactobacillus rhamnosus GG and Aloe vera gel improve lipid profiles in hypercholesterolemic rats[J].Nutrition,2013,29(3):574-579.
[2]GIBSONG R.In vitro and in vivo effects of oligofructose and inulin on the colonic microbiota[C].ORAFTI 1st ORAFTI Research conference proceedings,Brussels,1995.
[3]趙杰.益生菌、益生元、合生元與炎癥性腸病[J].腸外與腸內營養,2014,21(4):251-256.
[4]魏艷,曾小群,潘道東,等.水蘇糖-植物乳桿菌合生元對小鼠免疫功能的影響[J].中國食品學報,2014,14(1):15-19.
[5]LIONG MT,SHAH NP.Effects of a Lactobacillus casei synbiotic on serum lipoprote in intestinal microflora and or ganicacids in rats[J].Journal of Dairy Sciencei,2006,89(5):1390-1399.
[6]LIONG MT,DUNSHEA FR,SHAH NP.Effects of a synbiotic containing Lactobacillus acidophilus ATCC 4962 on plasma lipid profiles and morphology of erythrocytes in hypercholesterolaemic pigs on high and low-fat diets[J].British Journal of Nutrition,2007,98(4): 736-744.
[7]余建新.含合生元的早期腸內營養對嚴重燒傷病人血漿內毒素的影響[D].杭州:浙江大學,2003:41-45.
[8]欒暢.植物乳桿菌Sc52聯合牛蒡低聚果糖對2型糖尿病的治療作用[D].長春:吉林農業大學,2015:12-13.
[9]胡美娟.香菇多糖聯合益生菌改善小鼠腸道微生態的探究及產品研發[D].吉林:北華大學,2015:12-16.
[10]馬治宇,趙獻軍,張曉慶,等.乳酸菌及其培養液對肉雞盲腸菌群的影響[J].西北農業學報,2008,17(3):33-36.
[11]SCHNEIDER S M,FERNAAND G P,RODOLPHE A,et al.Effects of total enteral nutrition supplemented with a multifibre mix on faecal short chain fatty acids and microbiota[J].Clinical Nutrition,2006,25(1):82-90.
[12]連曉蔚,彭喜春.腸道茵群利用去淀粉麥麩體外發酵產短鏈脂肪酸[J].暨南大學學報,2011,32(3):291-293.
[13]BLACHIER F,MARIOTTI F,HUNEAU J F,et al.Effects of amino acid-derived luminal metabolites on the colonic epithelium and physiopathological consequences[J].Amino Acids,2007,33(4):547-562.
[14]ANDRIAMIHAJA M,DAVILA AM,EKLOU-LAWSON M,et al. Colon luminal content and epithelial cell morphology are markedly modified in rats fed with a high protein diet[J].American Journal of Physiology,2010,299(5):1030-1037.
[15]ANDRIAMIHAJA M,CHAUMONTET C,TOME D,et al.Butyrate metabolism in human coloncarcinoma cells:implications concerning its growth-inhibitory effect[J].Journal Cell Physiology,2009,218(1): 58-65.
[16]DE PRETER V,HAMER HM,WINDEY K,et al.The impact of pre-and/or probiotics on humancolonic metabolism:Does it affect human health[J].Molecular Nutrition&Food Research,2011,55(1): 46-57.
[17]YOUNES H,GARLEB K,BEHR S,et al.Fermentable fibers or oligosaccharides reduce urinary nitrogen excretion by increasing urea disposalintheratcecum[J].JournalofNutrition,1995,125(4): 1010-1016.
[18]GIBSON G R,WANG X.Bifidogenic properties of different types of fhictooligosaccharides[J].Food Microbiol,1994,11(5):491-498.
[19]BAE CH,PARK MS,JI GE,et al.Effects of phosphorylated cross-linked resistant corn starch on the intestinal microflora and short chain fatty acid formation during in vitro human fecal batch culture[J].Food Science and Biotechnology,2013,22(6):1649-1654.
[20]LUK GD,BAYLESS TM,BAYLIN SB.Diamine oxidase(Histaminase)[J].Journal of Clinical Investigation,1980,66(1):66-70.
[21]LUK GD,BAYLESS TM,BAYLIN SB.Plasma postheparin diamine oxidasesensitive provocative test for uantitating length of acute intestinal mucosal injury in the rat[J].Journal of Clinical Investigation,1983,71(5):1305-1308.
[22]CLAUSEN MR,BONNEN H,TVEDE M,et al.Colonic fermentation to short-chain fatty acids is decreased in antibiotic-associated diarrhea[J].Gastroenterology,1991,101(6):1497-1504.
[23]RUH J,VOGEI F,SCHDT E,et al.Effects of hydrogen peroxide scavenger catalase onvillous microcirculation in the rat small intestine in a model of inflammatory bowel disease[J].Microvascular research,2000,59(3):329-337.
[24]BUCHER M,HOBBHAHN J,TAEGER K,et al.Cytokine-mediateddownregulation of asopressin V(1A)receptors during acute endotoxemiain rats[J].American Journal of Physiology-regulatory Integrative and Comparative Physiology,2002,282(4):979-984.
[25]OKAJIMA K.Regulation of inflammatory responses by endothelial cells-understanding the molecular mechanism(s)and its therapeutic applicationto sepsis[J]Masui,2008,57(3):311-320.
[26]ZHAO G,NYMAN M,JONSSON JA.Rapid determination of short-chain fatty acids in colonic contents and feces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J].Biomedical Chromatography,2006,20(8):674-682.
[27]ZHAO G,LIU J,NYMAN M,et al.Determination of short-chain fatty acids in serum by hollow fiber supported liquid membrane extraction coupled with gas chromatography[J].Journal of Chromatography B-Analytical Technologies in Biomedical and Life Sciences,2007,846(1-2):202-208.
Regulation function of lentinan combined with Lactobacillus plantarum C88 on the gut microflora in mice
LUO Hong1,DUAN Cui-cui2,ZHAO Yu-juan2,GAO Lei2,LI Sheng-yu2
(1.College of special education,Changchun University,Changchun 130022,China;2.Institute of Agro-food Technology,Jilin Academy of Agricultural Sciences,Changchun 130124,China)
The article studied the regulation function of lentinan combined with Lactobacillus plantarum C88 on the gut microflora in mice. The results showed that L.plantarum C88 combined lentinan could reduce the moisture,ammonia and pH of feces,decrease diamine oxidase,D-lactic acid,endotoxin and TNF-α levels,promote the growth of intestinal lactobacilli,bifidobacteria,etc.,decline the number of enterobacteria,enterococci and other harmful bacteria and raise the production of short chain fatty acids.Moreover,L.plantarum C88 combined with lentinan indicated better effects than that of single use of L.plantarum C88 or lentinan.the synbiotics made by L.plantarum C88 and lentinan play a role in regulating intestinal microecology balance and improving intestinal function.
Lactobacillus plantarum;lentinan;short-chain fatty acid;synbiotics
Q93-33
A
1001-2230(2016)08-0004-05
2016-03-31
國家現代農業產業技術體系專項(CARS-37);吉林省科技廳成果轉化項目(20115026);吉林省世行貸款農產品質量安全項目(2011-Y35)。
羅宏(1962-),女,副教授,主要從事中醫臨床教學與研究。
李盛鈺

