新型吲哚類衍生物對人胃癌MGC-803細胞增殖的影響
滕玉鷗,趙紅葉,周 瑤,韓開林,陸 斌,孫 華(天津科技大學生物工程學院,天津 300457)
新型吲哚類衍生物對人胃癌MGC-803細胞增殖的影響
滕玉鷗,趙紅葉,周 瑤,韓開林,陸 斌,孫 華
(天津科技大學生物工程學院,天津 300457)
為了深入研究吲哚類衍生物對胃癌細胞增殖的作用及其機制,本文研究了19種吲哚類衍生物對人胃癌MGC-803細胞增殖的抑制作用并進行了構效關系分析,最終篩選出結構全新且具有明顯抗腫瘤活性的候選化合物16. 進一步的研究發現:化合物16能誘導MGC-803細胞發生G2/M期阻滯;同時,Annexin V/PI雙染的結果表明化合物16能誘導MGC-803細胞的凋亡.
吲哚類衍生物;細胞增殖;細胞凋亡
吲哚類衍生物具有廣泛的生物活性,如抗癌、抗抑郁、抗驚厥、抗真菌、抗HIV及消炎等[1].在過去的幾十年中,越來越多的工業界和學術界研究人員已著手開發新的吲哚類抗癌藥物[2].2006年FDA批準的用于治療胃腸道間質腫瘤和晚期腎細胞癌的化療藥舒尼替尼(Sutent)即為吲哚類衍生物.本課題組在前期工作中合成了一系列新型吲哚類衍生物,并對其抑制人白血病細胞K562的增殖作用進行了初步研究[3-4].
胃癌近年來呈現高發病率和高致死率的趨勢,在世界范圍內發病率僅次于肺癌,位居第二位.每年胃癌發病率約為萬分之六,死亡率約為萬分之三,居惡性腫瘤死亡第一位[5].本文以人胃癌MGC-803細胞為實驗對象,研究了吲哚類衍生物對胃癌細胞增殖的影響及其初步的作用機制.首先通過MTT法[6]對19種化合物的抗腫瘤活性進行測試,通過構效關系分析篩選出具有明顯抗腫瘤活性的候選化合物.然后觀察候選化合物對胃癌MGC-803細胞形態學的影響,并應用流式細胞技術檢測候選化合物對MGC-803細胞周期及凋亡的影響,從而闡明候選化合物抑制MGC-803細胞增殖的初步作用機制.深入研究吲哚類衍生物對胃癌細胞增殖的作用及其機制,對擴展該類化合物的抗腫瘤譜及日后開發新型吲哚類抗癌藥物具有重要意義.
1 材料與方法
1.1 細胞株與細胞培養
人胃癌細胞MGC-803(天津科技大學生物工程學院藥物設計與合成研究室保存)用體積分數為10%,胎牛血清的DMEM培養基,置于37,℃、5%,CO2恒溫培養箱中培養.取對數生長期細胞用于實驗.吲哚類衍生物加入培養基前均用二甲基亞砜(DMSO)溶解.
1.2 試劑與儀器
PRMI-1640細胞培養液、巴西胎牛血清、0.25%,胰蛋白酶(1×)溶液、青霉素-鏈霉素溶液,賽默飛世爾科技公司;MTT、RNase A,北京索萊寶科技有限公司;乙醇(分析純),國藥集團化學試劑有限公司;喜樹堿(分析純),北京偶合科技有限公司;二甲基亞砜,美國Amresco公司;Annexin V-FITC 凋亡試劑盒,美國BD公司;碘化丙啶(PI),西格瑪奧德里奇中國有限公司;本實驗使用的吲哚類衍生物由天津科技大學生物工程學院藥物設計與合成研究室成員韓開林等人合成.
TX323L型電子分析天平,島津國際貿易有限公司;Model 3100 series型CO2培養箱、MULTISKAN MK3型基礎酶標儀,賽默飛世爾科技公司;CKX41型奧林巴斯倒置顯微鏡,奧林巴斯(中國)有限公司;TGL-20M型高速臺式冷凍離心機,湘儀離心機儀器有限公司;VORTEX-6型漩渦混合器、LX-300型迷你離心機,海門市其林貝爾儀器制造有限公司;YXQ-LS-50SI型立式壓力蒸汽滅菌鍋,上海博迅實業有限公司.
1.3 吲哚類衍生物抑制MGC-803細胞增殖的IC50值的測定
取對數生長期的MGC-803細胞,用0.25%,胰蛋白酶消化,以5×104,mL-1濃度接種于96孔培養板內,每孔100,μL,置37,℃、5%,CO2培養箱孵育24,h.吲哚衍生物組(2—20)加藥終濃度分別為:10,μmol/L、1,μmol/L、0.1,μmol/L、10,nmol/L、1,nmol/L.同時設置等體積DMSO 溶劑對照組和陽性對照組(喜樹堿),每組設3個平行孔.24,h后,每孔加入藥物0.5,μL,溶劑對照組加入等體積DMSO.37,℃、5%,CO2培養箱孵育48,h后,每孔加入MTT 20,μL,37,℃、5%,CO2培養箱繼續孵育4,h后終止培養,小心吸棄孔內培養基上清液,每孔加入DMSO 100,μL,置于培養箱10,min,使甲臜結晶充分溶解,酶標儀492、630,nm波長下測定吸光度,用Graph Pad Prism 5.0軟件計算藥物對細胞生長的半數抑制濃度IC50值[7].
1.4 化合物16對MGC-803細胞形態學的影響
取對數生長期的MGC-803細胞,用0.25%,胰蛋白酶消化,以5×104,mL-1濃度接種于6孔培養板內,37,℃、5%,CO2培養箱培養24,h.每孔加入10,μL終濃度為 300,nmol/L化合物16,繼續作用24,h.將各組細胞置于奧林巴斯倒置顯微鏡下觀察細胞生長情況及形態變化.
1.5 化合物16對MGC-803細胞周期的影響
取對數生長期的MGC-803細胞,用0.25%,胰蛋白酶消化,以5×104,mL-1濃度接種于6孔培養板內,在37,℃、5%,CO2培養箱培養,24,h后每孔加入10,μL終濃度為 300,nmol/L化合物16,同時溶劑對照組加入等體積DMSO,繼續培養6,h.以2,500,r/min離心5,min后收集細胞,并用預冷的PBS緩沖液500,μL清洗2次,2,500,r/min再次離心5,min收集細胞,緩緩加入預冷75%,乙醇,4,℃下固定過夜.1,000,r/min離心5,min后收集細胞,并用1,mL PBS清洗2次,最后用含有100,μg/mL RNase A、50,μg/mL PI、0.2%, Triton X-100 的PBS緩沖液500,μL重懸細胞,4,℃避光孵育30,min,立即用流式細胞儀測定細胞周期,得到其細胞周期的分布時相.
1.6 化合物16對MGC-803細胞凋亡的影響
收集對數期細胞鋪板,細胞濃度為5×104,mL-1,化合物16加藥終濃度為300,nmol/L,溶劑對照組加入等體積DMSO,加藥刺激24,h后,以2,500,r/min離心5,min后收集細胞.然后用預冷的500,μL PBS清洗2次,以2,500,r/min離心5,min后收集細胞.用100,μL 1×Binding buffer 重懸細胞,使細胞濃度為1×106,mL-1,置于新的EP管,加5,μL FITC Annexin V 和 5,μL PI,25,℃避光放置15,min,每管加400,μL 1×Binding buffer用流式細胞儀進行細胞凋亡測定[8].
2 結果與分析
2.1 吲哚類衍生物抑制MGC-803細胞增殖的IC50值的測定結果
通過MTT法檢測5-取代吲哚類衍生物2—9對人胃癌細胞MGC-803體外抗腫瘤活性,其中化合物1(喜樹堿)為陽性對照,化合物2(靛紅)為母核化合物,結果見表1.
從表1中的數據可以看出,在C-5位引入甲基丙烯酸酯的化合物9表現出的抗腫瘤活性比母核化合物2至少提高130~230倍.因此,將化合物9作為先導化合物,進一步研究了N-衍生物的構效關系,結果見表2.

表1 吲哚類衍生物2—9抑制MGC-803細胞增殖的IC50值Tab. 1 IC50of indole derivatives 2-9 for MGC-803 cell

表2 吲哚類衍生物10—20抑制MGC-803細胞增殖的IC50值Tab. 2 IC50of indole derivatives 10-20 for MGC-803 cell
由表2可知,在N-1的位置引入芐基并在苯環的對位引入溴時,化合物16抑制MGC-803細胞生長的IC50值為最低,達到了0.08,μmol/L.與溴芐基的對位取代化合物16相比,間位和鄰位溴芐基取代的化合物17和化合物18的生物活性有所降低,其IC50值分別為0.35,μmol/L和0.51,μmol/L.這一結果說明:R2處溴芐基取代的空間位置對化合物的活性有較大影響,對位的溴芐基取代能提高至少4~6倍的抗腫瘤活性.
表1和表2的構效關系分析結果表明:在19個新型吲哚類衍生物中,化合物16較其他衍生物具有更高效的抗腫瘤活性.因此,將選擇化合物16為候選化合物,進一步研究該化合物對MGC-803細胞形態學產生的影響和對細胞周期及細胞凋亡的誘導作用.
2.2 化合物16對MGC-803細胞形態學的影響
在普通光學顯微鏡下觀察MGC-803細胞生長狀況時發現(圖1):溶劑對照組細胞生長旺盛,細胞形態完整;而化合物16(300,nmol/L)刺激24,h后,細胞形態出現變化,細胞從不規則形態變成圓形并呈漂浮狀態,且多數呈漂浮狀態.

圖1 化合物16對MGC-803細胞形態學的影響Fig. 1 Effect of compound 16 on MGC-803 cell morphology
2.3 化合物16對MGC-803細胞周期的影響
化合物16對MGC-803細胞周期的影響如圖2所示.從圖2中可以看出:濃度為300,nmol/L的化合物16處理細胞6,h后,與溶劑對照組相比,化合物16組的G1期以及S期細胞明顯下降,G2/M期細胞明顯上升(從12.7%,增加至32.8%).說明化合物16能夠顯著引起MGC-803細胞周期發生G2/M期阻滯.

圖2 化合物16對MGC-803細胞周期的影響Fig. 2 Effect of compound 16 on MGC-803 cell cycle
2.4 化合物16對MGC-803細胞凋亡的影響
化合物16對MGC-803細胞凋亡的影響如圖3所示.
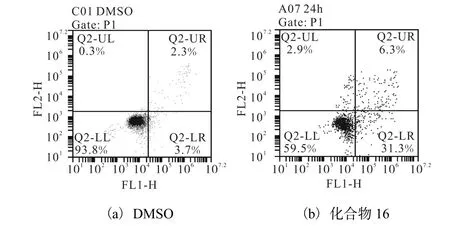
圖3 化合物16對MGC-803細胞凋亡的影響Fig. 3 Effect of compound 16 on MGC-803 cell apoptosis
從圖3中可以看出:化合物16 以300,nmol/L處理MGC-803細胞24,h后,右下象限早期凋亡細胞顯著增加(31.3%),比溶劑對照組的早期凋亡率(3.7%)增加了27.6%,說明候選化合物16能夠誘導MGC-803細胞的凋亡.這可能是該化合物抑制MGC-803細胞增殖的另一個作用機制.
3 討 論
吲哚類生物堿具有重要的生物活性,在已發現的天然吲哚類化合物中,有40多種可作為治療型藥[9],如可治療心血管病、糖尿病及肺癌等多種疾病.吲哚類化合物在醫藥領域的應用非常廣泛,如主要由5-甲氧基吲哚制取的松果腺素(又名腦白金)直接作用于下丘腦,具有促進睡眠、調節內分泌及增強免疫力等多種生理功能[10].
本文從吲哚衍生物的構效關系分析入手,由于一些N-芐基靛紅衍生物表現出廣泛的生物活性,我們以化合物9作為一個潛在的先導化合物,進一步集中N-衍生化類似物的構效關系.首先通過在C-5位改變取代基,通過分析化合物2—9對MGC-803胃癌細胞增殖抑制作用,發現C-5丙烯酸酯基團取代的靛紅衍生物有潛在抗腫瘤活性,而后對C-5丙烯酸酯基團取代的靛紅衍生物進行了一系列N取代,取代合成了10—20的化合物.以同樣的方法對10—20這一系列化合物進行MTT法分析,從數據和不同取代基團分析選用活性較好的化合物16進行進一步的作用機制研究.
化合物16對MGC-803細胞的形態學影響和對細胞周期及凋亡的影響實驗結果顯示:MGC-803細胞經化合物16刺激后變成圓形,呈漂浮狀態;化合物16能夠顯著引起MGC-803細胞周期發生G2/M期阻滯.腫瘤細胞過度增殖的本質是細胞周期調控異常,主要是兩方面原因:其一為細胞周期的驅動機制失控(如Cyclins過表達,Cdk表達異常,CKI表達不足和突變Cyclins、Cdk和CKI表達異常);其二為監控機制受損,其主要原因為G1/S、G2/M檢查點異常[11].化合物16對這些細胞周期調控蛋白的影響正在進一步的研究中.同時,在研究化合物16對MGC-803細胞凋亡的影響時發現,化合物16能夠誘導MGC-803細胞凋亡.細胞凋亡是機體生長、分化、發育和病理過程中由基因編碼調控的細胞主動自殺過程,機體通過凋亡使衰老、畸變和能導致疾病的細胞清除[12].化合物16具體是通過哪個通路誘導MGC-803細胞凋亡的,有待進一步的研究.
綜上,化合物16對胃癌細胞MGC-803增殖有較好的抑制作用,該化合物能誘導G2/M期的阻滯和細胞凋亡.這一結果對深入研究具有自主知識產權的新型吲哚類抗腫瘤藥物具有重要意義.目前,關于化合物16更加深入的作用機制研究正在進行中.
[1] 張屹,孟霞,秦大偉,等. 吲哚類抗腫瘤藥物的研究進展[J]. 化工中間體,2011,1(1):15-18.
[2] 孫祥軍,徐繼光,段啟虎,等. 吲哚類化合物的抗腫瘤作用[J]. 聊城大學學報:自然科學版,2010,23(2):28-32.
[3] Zhou Yao,Zhao Hongye,Han Kailin,et al. 5-(2-carboxyethenyl)isatin derivative induces G2/M cell cycle arrest and apoptosis in human leukemia K562 cells [J]. Biochemical & Biophysical Research Communications,2014,450(4):1650-1655.
[4] Han Kailin,Zhou Yao,Liu Fengxi,et al. Design,synthesis and in vitro cytotoxicity evaluation of 5-(2-carboxyethenyl)isatin derivatives as anticancer agents[J]. Bioorganic & Medicinal Chemistry Letters,2014,24(2):591-594.
[5] 陳凜,李濤. 胃癌綜合治療現狀與進展[J]. 世界華人消化雜志,2008,16(6):571-574.
[6] 于玲媛,李潔. MTT法在抗腫瘤藥物對細胞殺傷力測定中的應用[J]. 哈爾濱師范大學自然科學學報,2006,22(5):93-95.
[7] Wang Haomeng,Zhang Li,Liu Jiang,et al. Synthesis and anti-cancer activity evaluation of novel prenylated and geranylated chalcone natural products and their analogs[J]. European Journal of Medicinal Chemistry,2015,92:439-448.
[8] 王珊,李寧,于力方,等. 流式細胞術檢測細胞凋亡比較研究[J]. 標記免疫分析與臨床,2005,12(3):168-170.
[9] 李記太,代紅光,藺志平. 3-取代吲哚衍生物的合成[J].化學進展,2007,19(5):751-761.
[10]段傳鳳,楊依軍. 褪黑激素(N-乙酰基-5-甲氧基色胺)的合成[J]. 藥學學報,1996,31(3):182-185.
[11]Houtgraaf J H,Versmissen J,Van d G W J. A concise review of DNA damage checkpoints and repair in mammalian cells [J]. Cardiovascular Revascularization Medicine,2006,7(3):165-172.
[12]Kaczanowski S,Sajid M,Reece S E. Evolution of apoptosis-like programmed cell death in unicellular protozoan parasites [J]. Parasites & Vectors,2011,4(4):250-254.
責任編輯:郎婧
Effects of Novel Indole Derivatives on Human Gastric Cancer MGC-803 Cell Proliferation
TENG Yuou,ZHAO Hongye,ZHOU Yao,HAN Kailin,LU Bin,SUN Hua
(College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
In order to study the effect of indole derivatives on human gastric cancer cell proliferation and its mechanism,the structure-activity relationships of 19 indole derivatives were analyzed,and compound 16 with a novel structure was finally screed,which had significant anti-tumor activities.In further research,it was found that compound 16 can induced G2/M phase arrest in MGC-803 cells.After treatment,compound 16 also caused apoptosis in MGC-803 cells.
indole derivatives;cell proliferation;apoptosis
R962
A
1672-6510(2016)03-0016-04
10.13364/j.issn.1672-6510.20150114
2015-09-05;
2015-09-29
國家自然科學基金資助項目(31301142);大學生創新創業訓練計劃資助項目(201410057069)
滕玉鷗(1976—),女,吉林人,副教授;通信作者:孫 華,副教授,sunhua@tust.edu.cn.
數字出版日期:2015-12-10;數字出版網址:http://www.cnki.net/kcms/detail/12.1355.N.20151210.1045.006.html.

