遲發性運動障礙的研究進展
孫振曉孫宇新于相芬
(1山東省臨沂市精神衛生中心精神科,山東臨沂276005;2山東大學醫學院2013級,濟南250012)
遲發性運動障礙的研究進展
孫振曉1孫宇新2于相芬1
(1山東省臨沂市精神衛生中心精神科,山東臨沂276005;2山東大學醫學院2013級,濟南250012)
遲發性運動障礙(Tardive dyskinesia,TD)是一組由多巴胺(DA)受體阻滯劑引起的遲發的醫源性運動障礙,部分病例在運動障礙的基礎上伴發感覺癥狀,如感覺異常、疼痛等。本文對TD的概念由來、病因學、發生率、危險因素、病理生理機制、臨床表現、診斷、鑒別診斷、治療及預防等作一綜述。
多巴胺受體阻滯劑;遲發性運動障礙;不良反應
遲發性運動障礙(Tardive dyskinesia,TD)是一組由多巴胺(DA)受體阻滯劑引起的遲發的醫源性運動障礙,部分病例在運動障礙的基礎上伴發感覺癥狀,如感覺異常、疼痛等。近年來,許多學者對TD從多方面進行了探討,本文對其研究進展作一綜述。
1概念由來
1957年 Schonecker M 首次報道了應用氯丙嗪治療的患者出現口面部刻板的不自主運動,被稱為“陣發性運動障礙”(paroxysmal dyskinesia)[1]。TD的概念首先由Faurbye A等[2]于1964年提出,其突出特征為開始應用致病藥物與發生異常不自主運動之間有一定的時間延遲,因此命名為“遲發的”。目前這一概念被廣泛用于定義任何形式的遲發性運動障礙,如刻板動作、靜坐不能、肌張力障礙、震顫、抽動、舞蹈樣運動及肌陣攣,也有些學者將這一概念專門用于口面部刻板性運動,因而容易造成概念混亂。由于許多患者可伴發不同的臨床現象,表現為各種各樣的運動異常以及感覺癥狀的組合,Waln O等[3]認為應用“遲發性綜合征”這一概念更為恰當,并建議應用“典型 TD”這一概念指以口面部刻板運動作為唯一或主要表現的遲發性綜合征。
2病因學
TD可由長期暴露于DA受體阻滯劑引起,如某些抗精神病藥物(包括典型及非典型抗精神病藥物)、三環類抗抑郁劑(如阿莫沙平)、止吐藥及其他用于胃腸道疾病的藥物(如胃復安)。典型抗精神病藥物 DA D2受體阻滯作用較強,其導致TD的危險性高于非典型抗精神病藥物(如氯氮平、喹硫平等),但目前認為非典型抗精神病藥物也可引起TD。也有報道抗抑郁劑如選擇性5-羥色胺(5-HT)再攝取抑制劑(SSRIs)或選擇性5-HT去甲腎上腺素(NE)再攝取抑制劑(SNRIs)也可引起 TD,其機制未明,有學者認為增加5-HT水平可抑制紋狀體神經元,產生類似于DA受體阻滯劑的抗DA效應。鋰鹽及鈣通道阻滯劑(如桂利嗪、氟桂利嗪)也可引起TD[3]。
3發生率
抗精神病藥物導致TD的發生率因調查方法及人群不同結果各異。抗精神病藥物所致TD患病率估計為20%~ 50%,隨著年齡增長,患病率增加[3]。Kane JM等[4]對56個研究共34 555例服用抗精神病藥物患者的綜合分析,發現TD平均患病率為20%。甲氧氯普胺所致TD的患病率為低于1%~10%。抗精神病藥物所致TD的患病率在年輕患者較低(每年3%~ 5%),在中年及老年患者較高,尤其是女性,累積暴露于抗精神病藥物1年后發生率高達30%。應用非典型抗精神病藥物(利培酮、奧氮平、喹硫平、氨磺必利、齊拉西酮)TD發生率較低,50歲以下患者年發病率為0.8%,50歲以上患者為5.3%[3]。Jeste DV等[5]對應用抗精神病藥物治療的患者每1~ 3個月隨訪一次,在 1,2,3年時 TD的累積發病率分別為 26%,52%和60%。有文獻報道,典型及非典型抗精神病藥物所致TD的發生率分別為32.4%,13.1%[6]。
4危險因素
TD的發生與多種危險因素有關:年齡大、女性,尤其是絕經后女性TD發生的危險性高,可能與雌激素具有調節DA介導的行為,具有抗氧化效應,從而減少TD的發生。非洲裔美國人種、診斷情感障礙、存在精神分裂癥陰性癥狀、人類免疫缺陷病毒(HIV)陽性、伴有酒精及藥物濫用、糖尿病、既往存在運動障礙、腦損傷、認知功能受損、服用典型抗精神病藥物、抗精神病藥物劑量大,應用時間長,合用鋰鹽及抗帕金森藥物、用藥早期發生急性肌張力障礙等[3,6-7]。
5病理生理機制
TD的病理生理機制尚未完全闡明,可能涉及以下方面。
5.1 DA受體超敏
多數抗精神病藥物阻斷DA受體,引起D2受體功能上調,導致DA受體功能超敏[3]。由于D2受體是抑制性受體,表達于中型多棘神經元,投射到間接途徑,其超敏可引起內側蒼白球及丘腦底核的脫抑制,產生各種運動障礙[6]。對嚙齒動物模型研究顯示暴露于DA受體阻滯劑后可產生廣泛的、可逆性 D2受體上調[8]。臨床觀察發現,增加DA受體阻滯劑的劑量可使TD癥狀暫時緩解,突然停用DA受體阻滯劑可引起或惡化TD。但DA受體超敏及受體功能上調理論不能解釋TD患者在停用致病藥物后常持續數年或數十年,因為從理論上講,DA受體缺乏繼續阻滯將會由于下調出現數量減少[6]。
5.2 γ-氨基丁酸(GABA)能神經元功能異常
紋狀體的GABA能快閃中間神經元在通常情況下,負責維持直接與間接紋狀體蒼白球通路的平衡,暴露于抗精神病藥物后導致平衡破壞,引起運動障礙。動物模型研究發現,蒼白球GABA水平升高與帕金森病動物模型相關,蒼白球及黑質GABA水平降低與運動過度性運動障礙相關[6]。臨床研究發現,TD患者腦脊液中GABA水平減少,且減少程度與無意義咀嚼動作(VCMs)相關[8]。但也有不同的報道,且應用GABA激動劑治療的療效不肯定[8]。
5.3膽堿能功能缺陷
膽堿能功能缺陷與TD的發生有關。暴露于氟哌啶醇的大鼠模型VCMs增多。Grimm JW等[9]比較了暴露于氟哌啶醇(21 mg/kg)及芝麻油的大鼠紋狀體及伏隔核局部乙酰膽堿細胞數量,發現暴露于氟哌啶醇的大鼠VCMs增加1 400%,其紋狀體腹外側及伏隔核乙酰膽堿轉移酶陽性細胞減少。暴露于氟哌啶醇后VCMs少的大鼠乙酰膽堿轉移酶減少26%,而在VCMs多的大鼠,乙酰膽堿轉移酶減少29%~ 39%。暴露于氟哌啶醇后VCMs少的大鼠乙酰膽堿轉移酶陽性細胞密度減少26%,而在VCMs多的大鼠,乙酰膽堿轉移酶陽性細胞密度減少37%。這兩個研究均發現紋狀體腹外側及伏隔核中的膽堿減少,而這兩個區域均與口面部運動有關[6]。
5.4神經變性
抗精神病藥物可增加脂質過氧化反應及自由基生成,引起神經元受損及不同神經遞質系統的變性。動物實驗及對TD患者的尸檢神經病理學研究發現,長期應用抗精神病藥物后導致腦結構改變,出現神經元脫失及基底節膠質細胞增生。神經變性假說最終融入氧化應激假說,DA受體阻斷引起DA翻轉增加,通過單胺氧化酶及DA分子自動氧化造成自由基生成增加,加上抗氧化系統受損引起氧化應激增加。錳超氧化物歧化酶(MnSOD)是參與抗氧化防御機制的主要酶之一。臨床研究發現,TD患者血清MnSOD活性低于應用抗精神病藥物的非TD患者或正常對照組。MnSOD的水平與TD的嚴重程度相關。MnSOD基因多態性也與TD發生有關[3]。抗精神病藥物(典型 >非典型)通過抑制電子傳遞鏈復合體1生成自由基,動物實驗發現,暴露于氟哌啶醇的大鼠活性氧增加[8]。長期暴露于抗精神病藥物導致VCMs多的高齡大鼠黑質神經元數量減少,TD大鼠模型應用抗氧化劑如α-苯基-N-叔丁基硝酮治療有效[6]。
5.5突觸可塑性適應不良
根據突觸可塑性適應不良理論,D2受體超敏,氧化應激增加,引起神經元退行性改變,紋狀體中間神經元谷氨酸能突觸可塑性產生繼發效應,直接及間接引起基底神經節通路的平衡失調,導致感覺運動皮層的輸出異常。皮層突觸可塑性適應不良,加上基底神經節的輸出異常,導致運動程序的編碼異常,出現異常運動[3]。有證據提示N-甲基-D-天冬氨酸受體(NMDA-Rs)及細胞內鈣參與神經元可塑性,與TD發生有關。動物實驗發現,暴露于氟哌啶醇的動物,再暴露于NMDA-R拮抗劑美金剛后,VCMs減少[6]。
5.6自適應神經信號缺陷
動物實驗顯示,一種在中樞DA通路表達的核受體家族轉錄因子Nur77基因缺失,和(或)維甲類X受體(RXR)拮抗劑引起的神經生化改變導致TD的易患性增加。Nur77及RXR在紋狀體的正常表達與運動功能有關。與野生型小鼠比較,在Nur77基因敲除小鼠暴露于氟哌啶醇引起的VCMs惡化。長期暴露于氟哌啶醇未發生TD的猴子與發生TD的猴子比較,Nur77表達升高。可增加Nur77或其異質二聚體RXR表達的制劑對TD有效。多不飽和脂肪酸二十二碳六烯酸,具有RXR激動作用,可使暴露于氟哌啶醇的小鼠VCMs減少,而RXR拮抗劑可增加錐體外系癥狀[6]。
5.7遺傳易患性
臨床發現許多服用抗精神病藥物多年的患者不發生TD,而服用同種藥物劑量發生TD的患者其嚴重程度及臨床表現也各不相同,提示具有個體差異和遺傳易患性。一些候選基因可提示TD的易患傾向,如DA D3、D2、5-HT2A受體、MnSOD、兒茶酚胺氧位甲基轉移酶(COMT)及其他基因多態性與TD相關聯。另外,細胞色素P450(CYP2D6),可影響藥物代謝,也影響TD發生的危險性[3]。
6臨床表現
TD癥狀常常發生于持續應用抗精神病藥物后的1~ 2年,發生于3個月內罕見。起病隱襲,通常在數日到數周癥狀發展完全,然后癥狀趨于穩定,呈慢性狀態但微起伏的病程。其嚴重程度可從常被患者忽視的輕微不自主運動到致殘[3]。臨床表現以不自主的、有節律的刻板運動為主要特征。多數表現為“口-舌-頰三聯征”,即口、唇、舌面部不自主運動,如舌頭不自主在口中轉,不自主咀嚼動作等。可表現肢體不自主擺動、無目的抽動、舞蹈樣指劃動作、手足徐動、四肢軀干的扭轉性運動等。文獻報道,TD可表現為吞咽困難[10]、胃腸癥狀[11]、腹部有節奏的不自主搖擺運動[12]、耳朵運動[13]、呼吸性運動障礙[14]、言語異常[15]、口及生殖器疼痛[16]、幻肢出現 TD[17]等。
7診斷
TD的診斷主要根據有應用抗精神病藥物歷史,臨床表現、排除臨床現象學相似的其他疾病[3]。1982年Schooler NR等[18]提出的診斷標準為:至少3個月間斷或不間斷服藥史;身體至少一個部位中度及以上的異常運動,或至少2個部位輕度及以上的異常運動;排除其他潛在病因;病程超過3個月。
8鑒別診斷
8.1神經系統疾病
許多神經系統疾病,如 Huntington病、Wilson病等,可伴有運動障礙。但常有快速惡化的病程,相應的癥狀及神經系統陽性體征,必要時可進行神經影像學檢查、血銅檢測等以明確診斷[3,7]。
8.2缺齒性運動障礙(edentulous orodyskinesia)
老年無牙患者可出現口面部運動障礙,但無神經系統疾病,應注意鑒別[3]。
8.3急性撤藥綜合征
急性撤藥綜合征由 Polizos P等[19]于1973年首次描述,為長期應用抗精神病藥物的兒童突然撤藥后出現的舞蹈樣運動,癥狀通常在停藥后的數日或數周出現。DSM-V認為,急性撤藥綜合征的運動障礙在時間上是有限的,即持續時間少于4~ 8周,運動障礙持續存在超過此時間段則應考慮為TD[20]。
9治療
TD的治療包括停用合用的抗膽堿能藥物,如有可能停用抗精神病藥物,但應緩慢減量,因突然停藥可能會促發TD或急性撤藥綜合征。有大量證據表明,停用致病藥物越早,TD逐漸緩解的可能性越大。如果患者確需繼續應用抗精神病藥物治療,可選用非典型抗精神病藥物如喹硫平、氯氮平。重新應用或增加抗精神病藥物的劑量可減輕TD,但應盡量避免使用,只有當極嚴重病例需要馬上控制不自主運動時,才作為緊急解決方案。大劑量氯氮平及喹硫平可減輕TD癥狀,但這些藥物不能用于TD的長期治療[3]。
Revuelta GJ等[21]提出了TD的治療規范。見圖1。
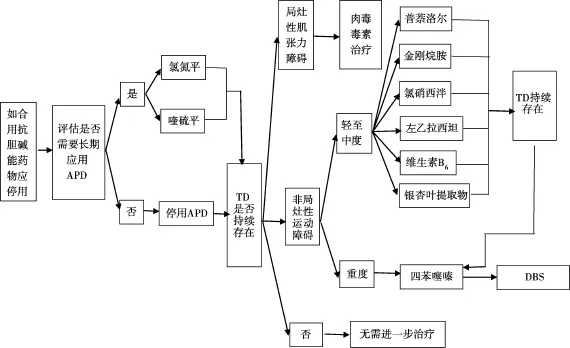
圖1 TD的治療規范
9.1四苯噻嗪
四苯噻嗪是一種多巴胺耗竭劑,抑制神經末梢突觸前膜的囊泡單胺轉運蛋白(VMAT),使單胺暴露于單胺氧化酶,導致突觸間隙單胺耗竭。目前認為是治療中重度TD的選擇,是頑固性TD最有效的一線藥物[3,8]。Kenney C等[22]研究顯示可使95%的TD患者異常不自主運動的強度和幅度顯著或中度改善。該藥耐受性良好,但控制TD癥狀常常需要大劑量,可引起抑郁、嗜睡、靜坐不能及帕金森病癥狀。嚴重的不良反應如體溫過高、惡性綜合征、急性肌張力障礙及自殺罕見。Guay DR等[23]綜合評價了從 1950-2010年2月,10個四苯噻嗪治療TD的回顧性研究,共1 142例患者,71%的患者TD癥狀獲得顯著、極顯著改善或完全緩解。16個開放性研究,包括88例TD患者,77例有效。
9.2金剛烷胺
金剛烷胺治療TD的機制可能與其NMDA受體阻斷作用有關[8]。兩個小樣本、盲法研究證實金剛烷胺可減輕TD患者異常不自主運動量表(AIMS)評分,改善TD的臨床癥狀[8]。Pappa S等[24]對22例門診伴有TD的精神分裂癥患者進行隨機雙盲、安慰劑交叉對照研究,應用金剛烷胺(400 mg/d)或安慰劑治療2周,而后給予 4周清洗期,再進行2周交叉實驗,在每一治療期結束時,金剛烷胺組AIMS評分顯著降低,總的變化率為22%,10例患者改善 >20%,而安慰劑組無作用或作用甚微。
9.3左乙拉西坦與吡拉西坦
左乙拉西坦是一種抗癲癇藥,可改善TD癥狀。其治療TD機制可能與N型鈣通道阻滯作用或與突觸泡蛋白2A受體結合,從而穩定突觸囊泡內容物神經遞質如DA的作用有關。Woods SW等[25]在對 50例 TD患者隨機雙盲安慰劑對照研究中,應用安慰劑或左乙拉西坦(劑量達3 000 mg/d),治療3月以上,結果發現左乙拉西坦組AIMS評分減少43.5%,而安慰劑組為18.7%。而且,在雙盲期過后,安慰劑組加用左乙拉西坦治療,其AIMS評分減少39%。其常見不良反應為嗜睡、易激惹及攻擊行為,應嚴密觀察,尤其是對于精神病患者,自殺危險性增加是一個罕見但危險的發現[6]。
吡拉西坦化學結構類似于左乙拉西坦,主要用于肌陣攣的治療,在30年前發現其可改善TD癥狀。Libov I等[26]進行的隨機雙盲、安慰劑交叉對照研究證實其療效。40例伴TD的精神分裂癥或分裂情感性障礙患者在維持抗精神病藥物治療的同時,隨機分至安慰劑或吡拉西坦組(4 800 mg/d)治療4周,在進入4周交叉期前有1周清洗期,應用錐體外系癥狀評定量表(ESRS)進行評定,吡拉西坦組TD分量表平均減分3分,而安慰劑組TD分量表評分增加0.2分(P=0.003)。
9.4氯硝西泮
氯硝西泮是一種GABA間接興奮劑,20世紀70年代開始探索用于治療 TD[8]。Thaker GK等[27]在一個隨機雙盲、安慰劑對照研究中,對19例中重度TD患者應用氯硝西泮治療12周,結果發現氯硝西泮治療使運動障礙分值減少37.1%,減分有統計學差異(P< 0.000 3)。劑量在2~ 3.5 mg/d時顯示抗運動障礙效應。對5例患者進行長期隨訪,5~8月后療效消失。在停用氯硝西泮1~2周后,重新應用,再次顯示氯硝西泮對TD有效。
9.5普萘洛爾
在多年前發現普萘洛爾可治療TD,對涉及31例患者的開放治療或單盲交叉研究文獻復習,發現低劑量普萘洛爾治療TD常有快速戲劇性療效[8]。SchrodtGR等[28]進行的雙盲安慰劑交叉對照研究,應用開放試驗劑量的10倍(800 mg/d),應用AIMS每周評定一次,評定 20周,發現在盲法期間其療效不穩定,但在開放隨訪期間有明顯的長期改善。
9.6維生素B6
維生素B6是一種抗氧化劑,早期病例報道及小樣本盲法試驗研究發現治療TD有效[8]。Lerner V等[29]對 50例患者進行26周隨機、雙盲、安慰劑交叉對照研究,將50例患者隨機分為維生素B6組(1 200 mg/d)及安慰劑組,治療12周后,給予 2周清洗期,然后進行12周交叉試驗,維生素B6組ESRS臨床大體印象評分降低2.4分,而安慰劑組為0.2分(P<0.000 1)。帕金森分量表減分分別為18.5分及1.4分(P<0.000 1),運動障礙分量表減分分別為5.2分及 -0.8分(P<0.000 1)。
9.7銀杏葉提取物(EGb-761)
銀杏葉提取物是一種抗氧化劑,可直接清除自由基或通過酶的調節作用間接抑制自由基,用于TD的治療[6]。Zhang WF等[30]對157例患者進行隨機雙盲、安慰劑平行對照研究,EGb-761劑量240 mg/d。所有患者進行1周單盲安慰劑試驗,安慰劑效應 >25%者被排除在外。剩余患者進行12周安慰劑或EGb-761治療,應用AIMS評定療效,減分>30%定義為有效。152例患者完成研究。接受EGb-761治療者AIMS分明顯減少:(2.13± 1.75)vs.(-0.10± 1.69)(P<0.000 1),治療組51%有效,安慰劑組僅5%有效(P<0.001)。沒有明顯的不良反應,所有患者均無精神癥狀及認知功能惡化。
9.8唑尼沙胺
唑尼沙胺是一種硫胺類抗癲癇藥,可減少8-羥基脫氧鳥苷的生成,8-羥基脫氧鳥苷是DNA氧化受損的標志物,也可通過GABA的變構作用增加GABA釋放[6]。Iwata Y等[31]驗證了唑尼沙胺對TD的治療作用。對11例患者進行4周開放性研究,AIMS評分從24.1降至19.5,36.4%的患者AIMS評分減少20%以上。
9.9褪黑激素
褪黑激素對DA神經元具有抗氧化作用,可阻止哺乳動物中樞神經系統及紋狀體DA釋放,從而改善TD[6]。Shamir E等[32]進行的雙盲安慰劑交叉對照研究,對22例患者給予10 mg/d,治療6周,結果發現,褪黑激素組AIMS減分2.45分,而安慰劑組為0.77分,7例患者在褪黑激素治療期間臨床癥狀顯著改善,9例患者改善超過30%。
9.10必需脂肪酸(omega-3)
必需脂肪酸在神經遞質受體及營養神經因子改善神經傳遞中起重要作用,具有神經保護及抗抑郁特性。與不伴TD的精神病患者對照組比較,患有TD的個體必需脂肪酸水平低,而且omega-3脂肪酸可促進神經元生長,對TD有治療作用[6]。在動物模型研究中,對Nur77基因缺陷大鼠暴露于氟哌啶醇引起VCMs,同時暴露于二十二碳六烯酸,100 mg/(kg·d),8天,具有Nur77(+/+)野生型大鼠氟哌啶醇引起的VCMs減輕(P<0.05)。二十二碳六烯酸對Nur77缺陷的大鼠VCMs無減輕。必需脂肪酸有明顯的治療TD的潛能[33]。
9.11支鏈氨基酸
在苯丙酮尿癥患者中發現運動障礙,提示氨基酸可能與TD發病機制有關。蛋白質進餐試驗證實高濃度支鏈氨基酸(亮氨酸、異亮氨酸、纈氨酸)導致芳香族氨基酸比率增加,抑制神經遞質包括DA、5-HT及NE的合成[6]。Richardson MA等[34]對36例男性TD患者,給予安慰劑或高劑量支鏈氨基酸(222 mg/kg),每日3次,治療3周,每周應用Simpson簡短運動障礙量表(SADS)評定一次。接受支鏈氨基酸治療者SADS評分減少36.5%,而安慰劑組為3.4%,治療組有某些改善。而且TD癥狀的減輕與芳香族氨基酸的減少明顯相關(r= 0.39)。Richardson MA等[35]應用支鏈氨基酸治療6例兒童青少年TD患者,治療2周后,發現3例患者TD癥狀減輕50%以上,2例減輕40%。而且發現繼續應用支鏈氨基酸治療,TD癥狀繼續改善。
9.12氟伏沙明
氟伏沙明是一種內質網蛋白 sigma1受體激動劑,可調節邊緣系統DA神經傳遞[36]。Albayrak Y等[37]報道應用氟伏沙明100 mg/d治療TD 3例取得較好療效。
9.13肉毒毒素
應用肉毒毒素治療TD的研究較少,病例報道對具有不自主伸舌動作的患者在頦舌肌部位注射肉毒毒素有效[6]。一個單盲研究對8例口面部運動障礙患者應用肉毒毒素治療33周,劑量逐漸增大,發現當患者抗精神病藥物治療允許隨精神病性癥狀變化而變化時,應用AIMS評定的口面部運動癥狀無顯著減輕,而當抗精神病藥物劑量保持恒定時,AIMS評分顯著減少[38]。
9.14腦深部電刺激(DBS)
多個病例報道顯示蒼白球內側DBS治療TD,尤其是遲發性肌張力障礙有效,極少病例報道丘腦及丘腦底部刺激有效。許多患者TD癥狀改善50%。療效可立即出現或延遲至6個月出現,持續數月或數年[8]。10例難治性TD在3個月內側蒼白球(GPI)DBS后,AIMS及ESRS評分分別減少56%及61%,在6個月隨訪期間療效維持[39]。在一個DBS的綜合評價中,17個研究共44例抗精神病藥物所致TD患者 AIMS評分平均改善71.5%[40]。
9.15重復經顱磁刺激(rTMS)
張華[41]對36例慢性精神分裂癥TD患者應用rTMS治療 12周,應用 AIMS評定療效,結果發現,治療后AIMS評分顯著下降(P<0.01),顯效率為56.5%。
9.16電休克治療(ECT)
文獻報道,ECT治療TD有效[42-43]。Yasui-Furukori N等[44]報道應用ECT治療 18例 TD或遲發性肌張力障礙,采用雙側電極,前5周每周3次,6~ 15周每周2次,平均(10.5± 2.4)周,采用AIMS評定療效,以減分50%作為有效。治療后AIMS評分從(19.1± 4.7)降至(9.6± 4.2),其中7例患者有效,有效率39%。ECT治療TD的機制未明,可能涉及以下方面:ECT阻止突觸后DA受體超敏;增強DA傳遞,這種增強可發生于受體及受體后水平;動物實驗顯示ECT可使GABA能系統功能上調;ECT破壞血腦屏障,增加抗精神病藥物進入大腦,從而緩解運動癥狀[44]。
10預防
TD是一種醫源性疾病,是難以完全避免的,最好的方法是預防。當患者確實需要抗精神病藥物治療時,應告知患者及家屬TD發生的危險性,使用最安全的藥物及最低有效劑量,用藥期間應嚴密觀察,出現TD的早期征象時應減少抗精神病藥物劑量或換用TD危險性低的藥物[7]。
[1]Schonecker M.Paroxysmal dyskinesia as the effect of megaphen [J].Nervenarzt,1957,28(2):550-553.
[2]Faurbye A,Rasch PJ,Petersen PB,et al.Neurological symptoms in pharmacotherapy of psychosis[J].Acta Psychiatr Scand,1964,40(1):10-27.
[3] Waln O,Jankovic J.An Update on Tardive Dyskinesia:From Phenomenology to Treatment[J].Tremor Other Hyperkinet Mov (N Y),2013:tre-03-161-4138-1.
[4] Kane JM,Smith JM.Tardive dyskinesia:prevalence and risk factors,1959 to 1979[J].Arch Gen Psychiatry,1982,39(4):473-481.
[5] Jeste DV,Caligiuri MP,Paulsen JS,et al.Risk of tardive dyskinesia in older patients.A prospective longitudinal study of 266 outpatients[J].Arch Gen Psychiatry,1995,52(9):756-765.
[6] Rana AQ,Chaudry ZM,Blanchet PJ.New and emerging treatments for symptomatic tardive dyskinesia[J].Drug Des Devel Ther,2013(7):1329-1340.doi:10.2147/DDDT.S32328.eCollection 2013.
[7] Jankelowitz SK.Treatment of neurolept-induced tardive dyskinesia[J].Neuropsychiatr Dis Treat,2013(9):1371-1380.doi:10. 2147/NDT.S30767.
[8] Cloud LJ,Zutshi D,Factor SA.Tardive Dyskinesia:Therapeutic Options for an Increasingly Common Disorder[J].Neurotherapeutics,2014,11(1):166-176.
[9] Grimm JW,Chapman MA,Zahm DS,et al.Decreased choline acetyl-transferase immunoreactivity in discrete striatal subregions following chronic haloperidol in rats[J].Synapse,2001,39(1):51-57.
[10] Gregory RP,Smith PT,Rudge P.Tardive dyskinesia presenting as severe dysphagia[J].J Neurol Neurosurg Psychiatry,1992,55(12):1203-1204.
[11] 馮春霞.TD表現為胃腸癥狀[J].國外醫學精神病學分冊,1991,18(1):46-47.
[12] Lemere F.Tardive dyskinesia of the abdomen[J].JAMA,1977,238(4):306.
[13] Carluer L,Schupp C,Defer GL.Ear dyskinesia[J].J Neurol Neurosurg Psychiatry,2006,77(7):802-803.
[14] Godlee FN,Brooks DJ,Impallomeni M.Dyskinesia in the elderly presenting as rispiratory disorder[J].Postgraduate Med J,1989,65(769):830-831.
[15] Gerratt BR,Goetz CG,Fisher HB.Speech abnormalities in tardive dyskinesia[J].Arch Neurol,1984,41(3):273-276.
[16] Ford B,Greene P,Fahn S.Oral and genital tardive pain syndromes[J].Neurology,1994,44(11):2115-2119.
[17] McCalley-Whitlers M,Nasrallak HA.Tardive dyskinesia in a phantom limb[J].Br J Psychiatry,1983,142:206-207.
[18] Schooler NR,Kane JM.Research diagnoses for tardive dyskinesia[J].Arch Gen Psychiatry,1982,39(4):486-487.
[19]Polizos P,Engelhardt DM,Hoffman SP,et al.Neurological consequences of psychotropic drug withdrawal in schizophrenic children[J].J Autism Child Schizophr,1973,3(3):247-253.
[20] American Psychiatric Association.Diagnostic and statistical manual of mental disorders[M].15th ed.Washington(DC):American Psychiatric Association,2013:712.
[21] Revuelta GJ,Cloud L,Aia PG,et al.Tardive dyskinesias//Albanese AJ,editor.Hyperkinetic movement disorders:differential diagnosis and treatment[M].Chichester:Wiley-Blackwell,2012:331-352.
[22]Kenney C,Jankovic J.Tetrabenazine in the treatment of hyperkinetic movement disorders[J].Expert Rev Neurother,2006,6(1):7-17.
[23] Guay DR.Tetrabenazine,a monoamine-depleting drug used in the treatment of hyperkinetic movement disorders[J].Am J Geriatr Pharmacother,2010,8(4):331-373.
[24] Pappa S,Tsouli S,Apostolou G,et al.Effects of amantadine on tardive dyskinesia:a randomized,double-blind,placebo-controlled study[J].Clin Neuropharmacol,2010,33(6):271-275.
[25]Woods SW,Saksa JR,Baker CB,et al.Effects of levetiracetam on tardive dyskinesia:a randomized,double-blind,placebo-controlled study[J].J Clin Psychiatry,2008,69(4):546-554.
[26] Libov I,Miodownik C,Bersudsky Y,et al.Efficacy of piracetam in the treatment of tardive dyskinesia in schizophrenic patients:arandomized,double-blind,placebo-controlled crossover study[J].J Clin Psychiatry,2007,68(7):1031-1037.
[27] Thaker GK,Nguyen JA,Strauss ME,et al.Clonazepam treatment of tardive dyskinesia:A practical gabamimetic strategy [J].Am J Psychiatry,1990,147(7):445-451.
[28] Schrodt GR,Wright JH,Simpson R,et al.Treatment of tardive-dyskinesia with propranolol[J].J Clin Psychiatry,1982,43 (8):328-331.
[29] Lerner V,Miodownik C,Kaptsan A,et al.Vitamin B6treatment for tardive dyskinesia:a randomized,double-blind,placebo-controlled,crossover study[J].J Clin Psychiatry,2007,68 (11):1648-1654.
[30]Zhang WF,Tan YL,Zhang XY,et al.Extract of Ginkgo biloba treatment for tardive dyskinesia in schizophrenia:a randomized,double-blind,placebo-controlled trial[J].J Clin Psychiatry,2011,72(5):615-621.
[31] Iwata Y,Irie S,Uchida H,et al.Effects of zonisamide on tardive dyskinesia:a preliminary open-label trial[J].J Neurol Sci,2012,315(1-2):137-140.
[32] Shamir E,Barak Y,Plopsky I,et al.Is melatonin treatment effective for tardive dyskinesia?[J].J Clin Psychiatry,2000,61 (6):556-558.
[33] Ethier I,Kagechika H,Shudo K,et al.Docosahexaenoic acid reduces haloperidol-induced dyskinesias in mice:involvement of Nur77 and retinoid receptors[J].Biol Psychiatry,2004,56 (7):522-526.
[34] Richardson MA,Bevans ML,Read LL,et al.Efficacy of the branched-chain amino acids in the treatment of tardive dyskinesia in men[J].Am J Psychiatry,2003,160(6):1117-1124.
[35] Richardson MA,Small AM,Read LL,et al.Branched chain amino acid treatment of tardive dyskinesia in children and adolescents[J].J Clin Psychiatry,2004,65(1):92-96.
[36] Hayashi T,Su TP.An update on the development of drugs for neuropsychiatric disorder:focusing on the sigma 1 receptor ligand[J].Expert Opin Ther Targets,2008,12(1):45-58.
[37]Albayrak Y,Hashimoto K.Beneficial effects of the sigma-1 agonistfluvoxaminefortardivedyskinesiainpatientswith postpsychotic depressive disorder of schizophrenia:report of 5 cases[J].Psychiatry Investig,2013,10(4):417-420.
[38] Slotema CW,van Harten PN,Bruggeman R,et al.Botulinum toxin in the treatment of orofacial tardive dyskinesia:a single blind study[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(2):507-509.
[39] Welter ML,Grabli D,Vidailhet M.Deep brain stimulation for hyperkinetics disorders:dystonia,tardive dyskinesia,and tics[J]. Curr Opin Neurol,2010;23(4):420-425.
[40] Mentzel CL,Tenback DE,Tijssen MA,et al.Efficacy and safety of deep brain stimulation in patients with medication-induced tardive dyskinesia and/or dystonia:a systematic review [J].J Clin Psychiatry,2012,73(11):1434-1438.
[41]張華.重復經顱磁刺激治療遲發性運動障礙患者的療效觀察[J].臨床精神醫學雜志,2011,21(5):315-316.
[42] Chacko RC,Root L.ECT and tardive dyskinesia:two cases and a review[J].J Clin Psychiatry,1983,44(7):265-266.
[43] Malek-Ahmadi P,Weddige RL.Tardive Dyskinesia and Electroconvulsive Therapy[J].Convuls Ther,1988,4(4):328-331.
[44] Yasui-Furukori N,Kikuchi A,Katagai H,et al.The effects of electroconvulsive therapy on tardive dystonia ordyskinesia induced by psychotropic medication:a retrospective study[J]. Neuropsychiatr Dis Treat,2014(10):1209-1212.doi:10.2147/ NDT.S62490.eCollection 2014.
Progress in Study on Tardive Dyskinesia
Sun Zhenxiao1,Sun Yuxin2,Yu Xiangfen1
(1 Psychiatry Department of Linyi Municipal Mental Health Center of Shandong Province,Shandong Linyi 276005,China;2 2013 Grade of Medical College of Shandong University,Shandong Jinan 250012,China)
Tardive dyskinesia(TD)is a group of delayed-onset iatrogenic movement disorders of various phenomenology caused by dopamine receptor-blocking agents.In some cases,the movement disorder may be accompanied by sensory phenomenon such as paresthesias and pain.This paper reviews the origin of concept,etiology,incidence,risk factors,pathological and physiological mechanisms,clinical manifestations,diagnosis,differential diagnosis,prevention and treatment of TD.
Dopamine Receptor-blocking Agents;Tardive Dyskinesia;Adverse Reaction
10.3969/j.issn.1672-5433.2016.03.009
孫振曉,男,主任醫師。研究方向:臨床精神醫學。通訊作者E-mail:szx.ywk@163.com
2015-11-20)

