2016年高考框圖題的命題角度預測
卞小峰

框圖推斷題是高考經典題型,通過框圖推斷題往往將基本理論聯系起來考查,在復習中,精編框圖題,適度開發、拓展,充分發揮其價值。本文通過自編框圖題將高考主干基本理論聯系起來,提升綜合思維能力。
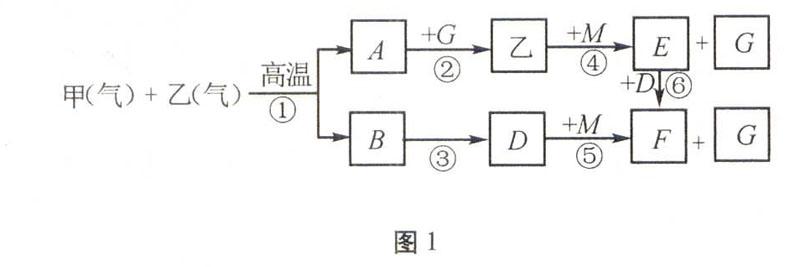
原創題圖1為短周期元素組成的物質之間轉化關系圖,甲分子立體結構為正四面體形、乙分子為10電子分子,B與空氣主要成分之一互為等電子體。回答相關問題:
圖1 (1)在t℃(高于500℃)和相同壓強下對反應B+乙A+D進行Ⅰ、Ⅱ、Ⅲ、Ⅳ四組實驗,實驗起始時放入容器內各組分的物質的量見表1。
①上述四種情況達到平衡后,n(D)的大小順序是()。
A.Ⅱ=Ⅳ>Ⅲ=Ⅰ B.Ⅱ>Ⅳ>Ⅰ>Ⅲ
C.Ⅳ>Ⅱ>Ⅲ=Ⅰ D.Ⅳ>Ⅲ>Ⅱ>Ⅰ表1
B乙ADⅠa mola mol0 mol0 molⅡ2a mola mol0 mol0 molⅢ0 mol0 mola mola molⅣa mol0 mola mola mol②若實驗Ⅰ在該條件下達到平衡時,平衡常數K=916,則B的轉化率為 (可用分數表示)。圖2
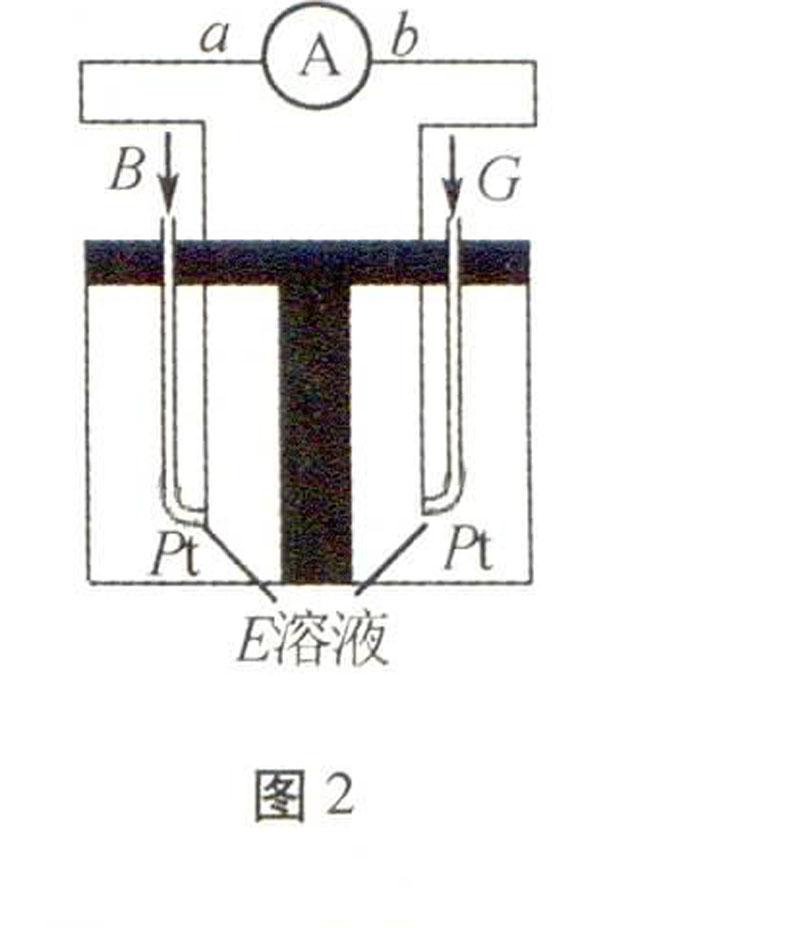
(2)在E溶液中將B、G構成電池如圖2所示:
電子由 極經外電路流向 極(填:a或b);負極反應式為 。
(3)取等物質的量的E、F、M分別溶于水,都配制等體積溶液,這三種溶液中陰離子濃度由小到大的順序是 。(用E、F、M表示)
(4)已知25℃、101 kPa條件下,A、B、甲的燃燒熱分別為286 kJ/mol、283 kJ/mol、890 kJ/mol,若將a mol A、B、甲的混合氣體完全燃燒,生成氣態D和液態乙,且n(D)=n(乙),則放出的熱量
(Q)取值范圍為 。
(5)等質量的M分別發生反應④和⑤,轉移電子數之比為 ;設計一個簡單易行的小實驗,證明反應⑤是放熱反應。實驗方法是 。
(6)如果A、B混合氣體7.8 g(平均摩爾質量為10 g/mol),在與過量的G充分反應后,通過足量M粉末,可使M固體粉末增重 。
解析本題以框圖為載體,將化學平衡、電化學、熱化學、電解質溶液、氧化還原反應和化學計算等基本理論聯系起來考查,思維跨度大,綜合性強。空氣主要成分是氮氣和氧氣,CO是氮氣分子的等電子體。甲、乙在高溫下反應,且甲為正四面體、乙為10電子分子,推知甲為CH4,乙為H2O,A為H2,B為CO,再由乙+ME+G,D+MF+G,聯想水蒸汽、二氧化碳與過氧化鈉反應,推知:M為Na2O2,E為NaOH,G為O2,F為Na2CO3。(1) 依題意,四組實驗中,溫度、壓強相等,容器的容積不一定相等。采用“一邊倒”法,將產物轉化成起始反應物,列于表2。
(2)CO與O2在氫氧化鈉溶液中構成原電池,CO在負極發生氧化反應,所以CO氣體的一極為負極。(3)取1 mol Na2O2、1 mol NaOH、1 mol Na2CO3分別溶于水配制成等體積的溶液,碳酸鈉只很小部分水解:CO2-3+H2OHCO-3+OH-,陰離子濃度:過氧化鈉溶液的最大,氫氧化鈉溶液的最小。
由產物水和二氧化碳的物質的量相等得出:n(H2)+2n(CH4)=n(CO)+n(CH4),n(H2)+n(CH4)=n(CO), n(CO)=0.5 a mol,n(H2)+n(CH4)=0.5a mol,用極端假設法計算:若混合氣體由H2和CO組成,則Q=283 kJ/mol×0.5a mol+286 kJ/mol×0.5a mol=284.5a kJ;若混合氣體由CH4和CO組成,則Q=283 kJ/mol×0.5a mol+890 kJ/mol×0.5a mol=586.5a kJ。根據平均值原理: 284.5a kJ (5) 2Na2O2+2CO22Na2CO3+O2↑,2Na2O2+2H2O4NaOH+O2↑等量的過氧化鈉完全反應,兩個反應轉移電子數相等;利用棉花燃燒現象證明該反應是放熱反應。 (6)從凈反應看,過氧化鈉凈增質量相當于CO和H2總質量。 答案:(1)①A②3/7(2)a b CO-2e-+4OH-CO2-3+2H2O(3)E 知識儲備(1)中學常考典型分子的立體結構 結構直線形V形三角錐形正四面體形(2)中學常見的等電子粒子 等電子10e-14e-18e-典型 粒子HF,H2O,NH3,CH4,F-,NH+4,H3O+,OH-,Al3+,Na+,Mg2+Si,CO,N2,C2-2,C2H2,CN-,HCNHCl,H2S,PH3,SiH4,HS-,S2-,O2-2,F2 H2O2,CH3CH3,CH3OH,CH3F,CH3NH2(3)等電子體原理:含原子數相等、電子數相等的粒子構型和化學鍵相似。如SO2與O3,N2O與CO2,CO與N2、C2-2、CN-互為等電子體,等電子體粒子具有相似的電子式。

