IL-10基因修飾的未成熟樹突狀細胞在大鼠角膜移植排斥反應中的作用
李 佳,李 雪,孫建華,李 兵
?
IL-10基因修飾的未成熟樹突狀細胞在大鼠角膜移植排斥反應中的作用
李佳1*,李雪1,2*,孫建華3,李兵1
注:*李佳和李雪對本文貢獻一致。
1Department of Ophthalmology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000,Liaoning Province,China;2Shenyang Aier Eye Hospital, Shenyang 110000, Liaoning Province, China;3Department of Otorhinolaryngology Head and Neck Surgery, Jinzhou Central Hospital, Jinzhou 121000, Liaoning Province, China
*Co-first authors:Jia Li and Xue Li.
Correspondence to:Bing Li. Department of Ophthalmology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, Liaoning Province, China. jzslibingv@163.com
Received:2016-03-02Accepted:2016-07-14
?AIM:Through the establishment of penetrating keratoplasty model of rats, to detect the role and its mechanism of immature dendritic cells with IL-10 gene modified.
?METHODS:Allogeneic penetrating corneal transplantation in rat model was performed. SD rats were randomly divided into positive control group, GFP-DC group, 8-DC and IL-10-GFP-DC group. At 3d before keratoplasty, the rats were given tail intravenous injection with the same amount of PBS, bone marrow 8-DC (DC had cultured for 8d) from donor Wistar rats, GFP-DC after 48h transfection and IL-10-GFP-DC. Rats were observed under slit-lamp for corneal graft cases every day, and recorded rejection index and corneal graft survival time. At 14d after keratoplasty, pathologic and immunohistochemical examinations were performed.
?RESULTS:Compared with GFP-DC group and 8-DC group, corneal graft survival time of IL-10-GFP-DC group was significantly longer (P<0.01); at 14d after keratoplasty, corneal opacity, edema, neovascularization and rejection index of IL-10-GFP-DC group were significantly lower (P<0.01). Pathological examination showed that in the three experimental groups corneal inflammation was lighter than the positive control group without significant central graft neovascularization. Immunohistochemistry showed: compared to the positive control group, GFP-DC group and 8-DC group, CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cells in IL-10-GFP-DC group were lower(P<0.01).
?CONCLUSION: After donor-derived immature dendritic cells pretreated, corneal graft survival was significantly prolonged, successfully induced corneal transplantation tolerance. CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cells are involved in corneal allograft rejection regulation, IL-10-GFP-DC may reduce CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cell infiltration, inhibit corneal transplant rejection.
Citation:Li J, Li X, Sun JH,etal. Role and its mechanism of immature dendritic cells with IL-10 gene modified in rats after keratoplasty.GuojiYankeZazhi(IntEyeSci) 2016;16(8):1439-1443
摘要
目的:通過建立大鼠角膜穿透性移植模型,探討IL-10基因修飾的未成熟樹突狀細胞在大鼠角膜移植排斥反應中的作用及其作用機制。
方法:建立大鼠同種異體穿透性角膜移植模型,將受體SD大鼠隨機分為:陽性對照組、GFP-DC組、8-DC組及IL-10-GFP-DC組,分別于角膜移植術前3d尾靜脈注射等量的PBS、供體Wistar大鼠骨髓源8-DC(培養8d的DC)、轉染48h的GFP-DC及IL-10-GFP-DC。術后每天在裂隙燈下觀察角膜植片情況,記錄排斥反應指數及角膜植片存活時間,在移植術后第14d行各組角膜組織的病理學檢查及免疫組織化學檢查。
結果:IL-10-GFP-DC組角膜植片存活時間較GFP-DC組、8-DC組比較顯著延長(P<0.01)。術后第14d時IL-10-GFP-DC組角膜植片的混濁、水腫、新生血管及排斥指數均顯著降低(P<0.01)。病理組織學檢查結果顯示各實驗組角膜植片的炎癥反應較陽性對照組輕,植片中央未見明顯新生血管。免疫組織化學結果顯示:IL-10-GFP-DC組的CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞數量較陽性對照組、GFP-DC組、8-DC組減少,差異均具有顯著統計學意義(P<0.01)。
結論:經過供體來源未成熟樹突狀細胞預處理的受體,角膜植片的存活時間顯著延長,成功誘導角膜移植免疫耐受。CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞參與了同種異體角膜移植排斥反應的調控,IL-10-GFP-DC可降低CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的浸潤,抑制角膜移植排斥反應的發生。
關鍵詞:IL-10;樹突狀細胞;穿透性角膜移植;移植排斥
引用:李佳,李雪,孫建華,等.IL-10基因修飾的未成熟樹突狀細胞在大鼠角膜移植排斥反應中的作用.國際眼科雜志2016;16(8):1439-1443
0引言
在我國,每年因角膜病致盲的患者約有400萬,角膜病是我國目前主要致盲病因之一,已成為第二致盲眼病,角膜移植術是治療頑固性角膜病的最終手段,但角膜移植術后的排斥反應仍然是角膜移植失敗的主要因素,如何抑制排斥反應的發生已經成為角膜移植研究中亟待解決的關鍵問題[1]。目前研究表明誘導受體對供體器官產生免疫耐受是抑制移植排斥反應的最佳方法[2]。樹突狀細胞(dendritic cell,DC)是現在所知唯一的機體內專職的、功能強大的、誘導初始T細胞活化的抗原遞呈細胞(antigen processing cell,APC),是適應性T細胞免疫應答的始動者[3]。未成熟的樹突狀細胞(immature dendritic cell,imDC)能夠調節T細胞的反應能力,誘導其發生免疫耐受[4]。IL-10(Interleukin 10,IL-10)又叫細胞因子合成抑制因子,是由Th2淋巴細胞和單核細胞合成分泌的,在抗炎和抑制多種細胞因子合成方面發揮著重要的作用。據研究表明,IL-10能夠抑制DC成熟,并且imDC又能夠進一步分泌IL-10,從而放大imDC在誘導免疫耐受中的作用,形成反饋效應,從而延長移植物的存活時間[5-6]。本實驗通過建立同種異體大鼠穿透性角膜移植模型,經過供體大鼠骨髓源樹突狀細胞對受體大鼠預處理的方法,觀察移植術后各組角膜植片的存活情況及病理組織學變化,觀察CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+的表達,從而探討IL-10基因修飾的未成熟樹突狀細胞在大鼠角膜移植排斥反應中的作用。
1材料和方法
1.1材料健康SD大鼠52只,購自遼寧醫學院實驗動物中心;健康Wistar大鼠26只,購自中國醫科大學實驗動物中心,這兩種大鼠重量均為200~250g,鼠齡6~8wk,雌雄不限。IL-10-GFP-Adenovirus(上海吉凱基因化學技術有限公司),CD4免疫組化試劑盒、CD8免疫組化試劑盒、CD25免疫組化試劑盒、IL-2免疫組化試劑盒、NK免疫組化試劑盒、NF-κB免疫組化試劑盒(北京博奧森生物技術有限公司),本實驗的DC細胞的來源和培養主要通過利用大鼠淋巴細胞分離液及細胞因子誘生方法,提取大鼠骨髓源樹突狀細胞的前體細胞并進行培養[7]。
表1移植術后角膜植片各參數評分標準

角膜植片的臨床觀察情況評分角膜植片混濁0~4 植片完全透明0 植片透明度輕度丟失1 植片透明度中度丟失,虹膜血管可見2 虹膜血管窺視不清,但瞳孔可見3 瞳孔輪廓窺不清4角膜植片水腫0~2 無水腫0 中度水腫1 伴有植片增厚的顯著水腫2角膜植片新生血管0~4 無新生血管0 新生血管在任何象限伸入達到植片半徑的25%1 新生血管達到植片半徑的50%2 新生血管達到植片半徑的75%3 新生血管達到植片的中央4總積分10
1.2方法
1.2.1實驗分組將培養第6d的DC分為3組:第1組繼續原條件培養48h后(共培養8d),即為8-DC,收集細胞,PBS洗滌2次,調整細胞懸液濃度為2×106個/mL;另兩組分別經GFP-Adenovirus、IL-10-GFP-Adenovirus轉染48h后,收集細胞,PBS洗滌2次,調整細胞懸液濃度為2×106個/mL。以SD大鼠為受體,Wistar大鼠為供體,將受體SD大鼠隨機分為4組,每組13例13眼。陽性對照組:術前3d受體鼠尾靜脈注射PBS 1mL;GFP-DC組:術前3d受體鼠尾靜脈注射GFP-DC細胞懸液1mL;8-DC組:術前3d受體鼠尾靜脈注射8-DC細胞懸液1mL;IL-10-GFP-DC組:術前3d受體鼠尾靜脈注射IL-10-GFP-DC細胞懸液1mL。
1.2.2建立角膜移植動物模型[8]術前15min術眼滴復方托吡卡胺滴眼液充分散瞳,腹腔注射10%水合氯醛進行全身麻醉,常規消毒。在手術顯微鏡下,用植片直徑3.5mm的環鉆在供體大鼠(術眼為雙眼)角膜中央輕壓形成壓痕,用尖刀在壓痕處刺入前房,使用顯微角膜剪沿壓痕環形剪下角膜,作為備用植片,放入0.9%氯化鈉注射液中保存(保存時間不超過20min);使用植床直徑3.0mm的環鉆,按上述相同方法剪除受體大鼠(術眼為右眼)中央角膜,制作植床。將植片置于植床上,用10-0愛惜良尼龍線間斷縫合8針,建立前房。術畢紅霉素眼膏涂結膜囊內,縫合眼瞼。術后第1d拆除眼瞼縫線,術后每天用復方托吡卡胺滴眼液和氯霉素滴眼液滴眼3次至術后第10d。
1.2.3裂隙燈顯微鏡觀察自術后第1d起每日在裂隙燈顯微鏡下對受體鼠術眼進行觀察,以水腫、混濁和新生血管3項指標進行評分,參照Larkin等[9]評分標準(表1),3項評分之和為當日排斥反應指數(rejection index,RI),當RI≥5時,或者植片混濁一項達到3時視為排斥反應發生,記錄角膜植片存活時間。
1.2.4組織病理學檢查角膜移植術后第14d,各組隨機抽取6只大鼠,術眼(右眼)全眼球摘除,正常SD大鼠3只,6眼為陰性對照,4%多聚甲醛固定,常規石蠟包埋,5μm切片,HE染色,鏡檢。
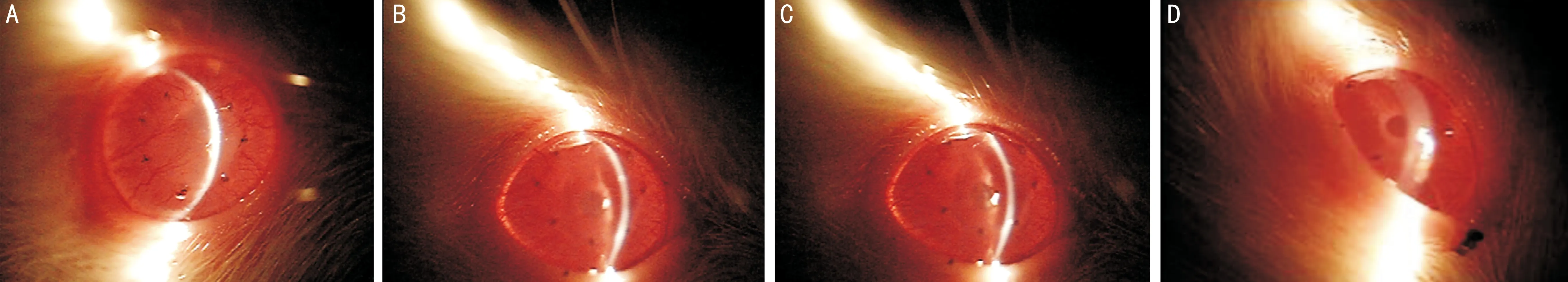
圖1顯微鏡下觀察移植術后第14d各組角膜植片的情況A:陽性對照組:角膜植片混濁、水腫,瞳孔窺不見,新生血管角膜長入植片中央,角膜植片發生排斥;B:GFP-DC組:角膜植片輕度混濁、水腫,新生血管長入植片邊緣;C:8-DC組:角膜植片輕度混濁、水腫,新生血管長入植片邊緣;D:IL-10-GFP-DC組:角膜植片透明,未見混濁、水腫,新生血管長入植片邊緣。
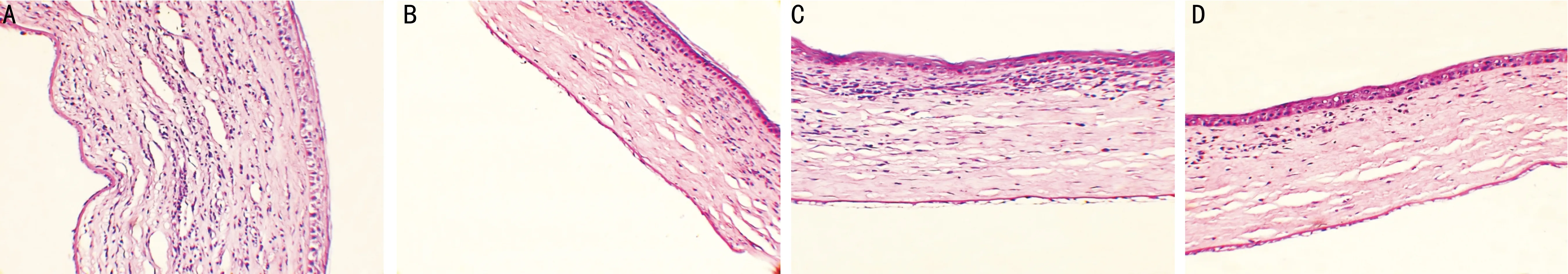
圖2術后第14d各組角膜病理組織學HE染色(×200)A:陽性對照組:角膜植片明顯水腫、增厚,植片可見大量炎細胞浸潤并可見新生血管,基質層排列紊亂;B:GFP-DC組;C:8-DC組;D:IL-10-GFP-DC組。
1.2.5免疫組織化學檢測石蠟切片常規脫蠟,微波修復抗原,滅活內源性過氧化物酶。滴加5% BSA封閉液,室溫10~30min。滴加1∶200濃度稀釋的一抗,4℃孵育過夜,PBS洗滌3次。滴加1∶200濃度稀釋的二抗,37℃孵育30min。滴加試劑SP,DAB顯色。蘇木素復染、脫水、封片,光學顯微鏡下觀察。設立陰性對照:以PBS代替一抗。進行圖像分析:以×400圖像輸入。每張切片隨機取5個視野,每個視野面積為0.2mm×0.2mm。陽性結果為細胞胞膜、胞漿或胞核呈棕黃色,計數單位視野內陽性細胞數。
2結果
2.1角膜植片存活時間各組角膜植片的存活時間GFP-DC組、8-DC組、IL-10-GFP-DC組與陽性對照組比較,植片存活時間明顯延長,差異具有顯著統計學意義(P<0.01);IL-10-GFP-DC組角膜植片存活時間顯著長于GFP-DC組、8-DC組,有顯著統計學意義(P<0.01);GFP-DC組與8-DC組比較,差異無統計學意義(P>0.05,表2,圖1)。
2.2各組角膜植片參數結果術后第14d,GFP-DC組、8-DC組、IL-10-GFP-DC組與陽性對照組比較,角膜植片的混濁、水腫、新生血管及排斥指數均降低,差異具有顯著統計學意義(P<0.01);IL-10-GFP-DC組與GFP-DC組、8-DC組比較角膜植片的混濁、水腫、新生血管及排斥指數均降低,差異具有顯著統計學意義(P<0.01);GFP-DC組與8-DC組比較,差異無統計學意義(P>0.05,表3)。
2.3組織病理學檢查結果術后第14d,陽性對照組角膜植片明顯水腫、增厚,植片可見大量炎細胞浸潤,并可見新生血管,基質層排列紊亂;GFP-DC組、8-DC組及IL-10-GFP-DC組角膜植片無明顯水腫及增厚,且炎性細胞浸潤較少,角膜結構基本正常,其中IL-10-GFP-DC組角膜植片改善最明顯,炎性細胞最少(圖2)。
表2 各組角膜植片存活時間 ±s,d)
注:aP<0.01vs陽性對照組;bP<0.01vsGFP-DC組;cP<0.01vs8-DC組。
2.4免疫組織化學檢測結果應用細胞圖像分析系統進行圖像分析,以×400圖像輸入。每只眼隨機取出1張切片,每張切片隨機取5個視野,每個視野面積為0.2mm×0.2mm。陽性結果為細胞胞膜、胞漿或胞核呈棕黃色,計數單位視野內陽性細胞數。陽性對照組中、GFP-DC組、8-DC組及IL-10-GFP-DC組角膜植片中均存在CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的表達,但其余三組陽性細胞數量明顯較陽性對照組減少。IL-10-GFP-DC組CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的數量最少,陽性對照組CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的數量最多;GFP-DC組與8-DC組比較,結果無統計學意義(P>0.05);IL-10-GFP-DC組與GFP-DC組、8-DC組及陽性對照組比較,差異具有統計學意義(P<0.01,表4)。
3討論
目前,角膜病已成為第2位致盲眼病,角膜移植仍然是目前治療各種嚴重角膜疾病的最終途徑,而免疫排斥反應是造成植片衰竭導致移植失敗的主要原因[10]。如何避免排斥反應的發生是角膜移植研究中需要解決的關鍵問題,近來眾多學者認為誘導受體對供體器官產生免疫耐受才是解決異體移植排斥反應的關鍵所在[11-13]。
DC是目前所知的機體內唯一的、專職的、功能強大的、誘導初始T細胞活化的APC,是適應性T細胞免疫應答的始動者[14-15]。IL-10主要是由Th2淋巴細胞和單核細胞合成分泌的,在抗炎和抑制多種細胞因子合成等方面發揮著重要的作用。大量的實驗證明,IL-10修飾的DC可以明顯降低心臟、肝、腎等移植術后的排斥反應,延長移植物的存活時間,誘導免疫耐受的發生[16-18]。
有研究表明,同種異體的角膜移植排斥反應是由T淋巴細胞為主所介導的遲發型超敏反應(delayed type hypersensitivity,DTH)[19],根據其表型的不同可分為:CD4+T細胞和CD8+T細胞。有研究學者在對大鼠角膜移植術后的排斥反應的病理組織學中發現,在移植排斥反應中,植片內有很多CD4+T細胞和CD8+T細胞的浸潤[20-21]。CD4+Th主要負責介導細胞免疫應答,在器官移植排斥反應、抗感染及自身免疫性等疾病的誘導中起著重要的作用。CD25是效應性T細胞的重要標志[22],作為非特異性免疫系統重要組成部分之一的NK細胞與T淋巴細胞同屬共同的祖細胞,與T細胞不同的是,NK細胞表面沒有特異性抗原識別受體的表達。有實驗表明,術前受體內NK細胞的清除可以明顯延長動物異體心臟移植的存活時間[23]。1986年,Sen和Blaldwin最初在B細胞核的抽取物中發現了一種核蛋白因子,取名為NF-κB[24],在許多參與免疫和炎癥反應物質的基因中,NF-κB均對其有誘導調控的作用[25],調控T淋巴細胞、B淋巴細胞和樹突狀細胞的生長、增殖及分化,在體液和細胞免疫中扮演著重要的角色[26],在器官移植排斥反應中也可能發揮著中心調控者的作用。

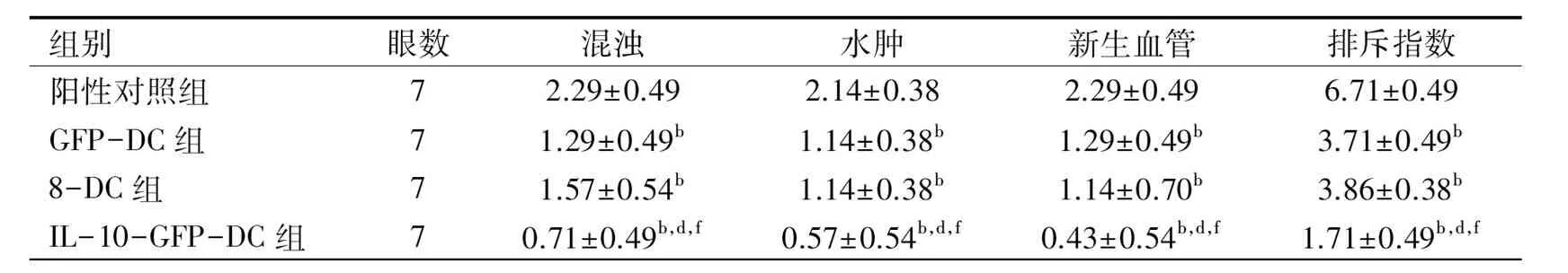
組別眼數混濁水腫新生血管排斥指數陽性對照組72.29±0.492.14±0.382.29±0.496.71±0.49GFP-DC組71.29±0.49b1.14±0.38b1.29±0.49b3.71±0.49b8-DC組71.57±0.54b1.14±0.38b1.14±0.70b3.86±0.38bIL-10-GFP-DC組70.71±0.49b,d,f0.57±0.54b,d,f0.43±0.54b,d,f1.71±0.49b,d,f
注:bP<0.01vs對照組;dP<0.01vsGFP-DC組;fP<0.01vs8-DC組。
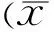

組別眼數CD4+CD8+CD25+IL-2+NK+NF-κB+陽性對照組641.20±5.0738.00±2.9235.40±2.7038.60±2.3034.60±4.4569.80±5.22GFP-DC組629.40±2.07b23.60±2.19b20.80±3.35b23.60±2.41b23.20±3.90b43.00±5.48b8-DC組632.00±2.65b24.00±2.35b22.00±2.74b25.20±0.84b24.60±2.60b44.60±1.95bIL-10-GFP-DC組619.60±2.07b,d,f17.60±3.05b,d,f15.00±1.58b,d,f17.40±2.07b,d,f11.60±3.56b,d,f24.80±3.63b,d,f
注:bP<0.01vs對照組;dP<0.01vsGFP-DC組;fP<0.01vs8-DC組。
本實驗室前期的研究通過細胞因子誘生法成功培養出大鼠骨髓源樹突狀細胞,已證實IL-10-GFP-Adenovirus轉染可以抑制樹突狀細胞的成熟,GFP-Adenovirus對DC無影響。在本實驗研究中,術后第14d我們對角膜植片行病理組織學檢查及免疫組織化學檢測,研究角膜移植術后角膜植片的病理學變化及植片中CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞數量的表達變化。病理組織學檢查結果顯示:GFP-DC組、8-DC組、IL-10-GFP-DC組與陽性對照組比較,植片存活時間明顯延長(P<0.01),IL-10-GFP-DC組角膜植片存活時間顯著長于GFP-DC組、8-DC組(P<0.01)。陽性對照組角膜植片明顯水腫、增厚,植片可見大量的炎細胞浸潤及新生血管,基質層排列紊亂,GFP-DC組、8-DC組、IL-10-GFP-DC組角膜植片無明顯水腫及增厚,且炎性細胞浸潤較少,角膜結構基本正常,其中IL-10-GFP-DC組角膜植片改善最明顯,炎性細胞最少。免疫組織化學檢測結果為:陽性對照組角膜植片中CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的數量最多,說明誘導了排斥反應的發生,IL-10-GFP-DC組的陽性細胞數量較陽性對照組、GFP-DC組、8-DC組減少,差異均具有統計學意義(P<0.01)。在各實驗組中可能由于imDC低表達MHCⅠ/Ⅱ類分子,并且缺乏免疫應答中所必需的CD40、B7(CD80、CD86)等共刺激分子和黏附分子,缺少激活T細胞免疫應答所必需的第二信號,不能有效激活T細胞,抑制了上述細胞的浸潤,從而抑制排斥反應,可見imDC在誘導移植免疫耐受過程中具有重要作用。IL-10-GFP-DC組中,CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+的細胞數量最少、炎癥反應最輕,并且角膜植片存活時間最長。由此可見,IL-10-GFP-DC在誘導角膜移植免疫耐受中更加具有優勢。
本實驗通過受體大鼠術前尾靜脈注射經供體來源的imDC、GFP-Adenovirus、IL-10-GFP-Adenovirus轉染的供體來源imDC能夠延長角膜植片存活時間,能誘導角膜移植免疫耐受,結果顯示IL-10-GFP-DC組誘導耐受效果最佳。CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+細胞參與了角膜移植排斥反應的調控,IL-10-GFP-DC可降低CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+陽性細胞的浸潤,抑制角膜移植排斥反應的發生。本文探討了IL-10基因修飾的樹突狀細胞在大鼠角膜移植中的作用,為誘導角膜移植免疫耐受提供實驗依據。
參考文獻
1蘇海英,刁玉梅,李兵.L-10修飾的樹突狀細胞在大鼠角膜移植中的作用.國際眼科雜志 2011;11(4):588-590
2 Yashiro T, Kubo M, Ogawa H,etal. PU.1 suppresses Th2 cytokine expression via silencing of GATA3 transcription in dendritic cells.PloSOne2015;10(9):e0137699
3 Nakano T, Lai CY, Goto S,etal. Immunological and Regenerative Aspects of Hepatic Mast Cells in Liver Allograft Rejection and Tolerance.PLoSOne2012;7(5): e37202
4 Shen H, Heuzey E, Mori D,etal. Haptoglobin Enhances Cardiac Transplant Rejection.CircRes2015;116(10):1670-1679
5 Cherukuri A, Rothstein DM, Clark B,etal. Immunologic human renal allograft injury associates with an altered IL-10/TNF-α expression ratio in regulatory B cells.JAmSocNephrol2014;25(7):1575-1585
6姚向超,王延東,梁光江.環抱霉素A在眼科應用中的研究分析.當代醫學 2011;27(17):151-152
7李雪,李兵. IL-10基因修飾的樹突狀細胞在大鼠角膜移植中的作用.遼寧醫學院碩士學位論文2012
8 Kitamura N, Yokoyama H, Yashiro T,etal. Role of PU.1 in MHC class Ⅱ expression through transcriptional regulation of class Ⅱ transactivator pI in dendritic cells.JAllergyClinImmunol2012;129(3):814-824
9 Larkin DF,Calder VL,Lightman SL.Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection.ClinExpImmunol1997;107(2):381-391
10 Kusumesh R,Vanathi M.Graft rejection in pediatric penetrating keratoplasty: Clinical features and outcomes.OmanJOphthalmol2015;8(1):33-37
11 Yu T, Rajendran V, Griffith M,etal. High-risk corneal allografts: A therapeutic challenge.WorldJTransplant2016;6(1):10-27
12 Shaharuddin B, Ahmad S, Meeson A,etal. Concise Review: Immunological Properties of Ocular Surface and Importance of Limbal Stem Cells for Transplantation.StemCellsTranslMed2013;2(8):614-624
13 Stepp MA, Zieske JD, Trinkaus-Randall V,etal.Wounding the Cornea to Learn How it Heals.ExpEyeRes2014;121:178-193
14 Pindjakova J,Vitova A,Krulova M.Corneal rat-to-mouse xenotransplantation and the effects of anti-CD4 or anti-CD8 treatment on cytokine and nitric oxide production.TransplInt2005;18(7):854-862
15 Eom TY, Stanco A, Guo J,etal.Differential regulation of microtubule severing by APC underlies distinct patterns of projection neuron and interneuron migration.DevCell2014;31(6):677-689
16 Keubler LM, Buettner M, H?ger C,etal. A Multihit Model: Colitis Lessons from the Interleukin-10-deficient Mouse.InflammBowelDis2015;21(8):1967-1975
17 Trifunovic J, Miller L, Debeljak Z,etal. Pathologic patterns of interleukin 10 expression -A review.BiochemMed(Zagreb) 2015;25(1):36-48
18 Holan V, Zajicova A, Javorkova E,etal.Distinct cytokines balance the development of regulatory T cells and interleukin-10-producing regulatory B cells.Immunology2014;141(4):577-586
19 Koorella C,Nair JR, Murray ME,etal.Novel Regulation of CD80/CD86-indu -ced Phosphatidylinositol 3-Kinase Signaling by NOTCH1 Protein in Interleukin-6 and Indoleamine 2,3-Dioxygenase Production by Dendritic Cells.JBiolChem2014;289(11):7747-7762
20 Xu XW, Ding BW, Zhu CR,etal. PU.1-silenced dendritic cells prolong allograft survival in rats receiving intestinal transplantation.WorldJGastroenterol2013;19:7766-7771
21 Bretscher PA. On the Mechanism Determining the Th1/Th2 Phenotype of an Immune Response, and its Pertinence to Strategies for the Prevention, and Treatment, of Certain Infectious Diseases.ScandJImmunol2014;79(6):361-376
22 Duggal NA, Upton J, Phillips AC,etal. An age-related numerical and functional deficit in CD19+CD24hiCD38hiB cells is associated with an increase in systemic autoimmunity.AgingCell2013;12(5):873-881
23 Weber M, Stein P, Prüfer S,etal. Donor and host B cell-derived IL-10 contributes to suppression of graft-versus-host disease.EurJImmunol2014;44(6):1857-1865
24 Alhabbab R, Blair P, Elgueta R,etal. Diversity of gut microflora is required for the generation of B cell with regulatory properties in a skin graft model.SciRep2015;5:115-119
25 Haas M, Sis B, Racusen LC,etal. Banff 2013 Meeting Report: Inclusion of C4d-Negative Antibody-Mediated Rejection and Antibody-Associated Arterial Lesions.AmJTransplant2014;14(2):272-283
26 Lee KM, Kim JI, Stott R,etal. Anti-CD45RB/Anti-TIM-1-Induced Tolerance Requires Regulatory B Cells.AmJTransplant2012;12(8):2072-2078
基金項目:遼寧省自然科學基金計劃項目(No.2013022001)
作者單位:1(121000)中國遼寧省錦州市,錦州醫科大學附屬第一醫院眼科;2(110000)中國遼寧省沈陽市,沈陽愛爾眼科醫院眼科;3(121000)中國遼寧省錦州市中心醫院耳鼻咽喉頭頸外科
作者簡介:李佳,博士,主治醫師,研究方向:角膜及眼表疾病;李雪,碩士,醫師,研究方向:角膜病。
通訊作者:李兵,博士,主任醫師,教授,碩士研究生導師,研究方向:角膜移植、角膜及眼表疾病.jzslibingv@163.com
收稿日期:2016-03-02 修回日期: 2016-07-14
Foundation item:Project of Natural Science Foundation of Liaoning Province(No:2013022001)
DOI:10.3980/j.issn.1672-5123.2016.8.09
?KEYWORDS:Interleukin-10; dendritic cells; penetrating keratoplasty; transplant rejection
Role and its mechanism of immature dendritic cells with IL-10 gene modified in rats after keratoplasty
Jia Li1*, Xue Li1,2*, Jian-Hua Sun3, Bing Li1
Abstract

