TGF-β1 PDGF-BB及CTGF在慢性乙型肝炎患者肝組織中的表達及意義
郭 塹, 農村立
(廣西醫科大學第四附屬醫院 感染科, 廣西 柳州, 545005)
?
TGF-β1PDGF-BB及CTGF在慢性乙型肝炎患者肝組織中的表達及意義
郭塹, 農村立
(廣西醫科大學第四附屬醫院 感染科, 廣西 柳州, 545005)
摘要:目的探討慢性乙型肝炎(CHB)患者肝纖維化不同階段轉化生長因子-β1(TGF-β1)、血小板源性生長因子-BB(PDGF-BB)、結締組織生長因子(CTGF)在肝組織中的表達及意義。方法根據慢性肝炎分期標準,將80例CHB患者分為S0組、S1組、S2組、S3組和S4組,觀察各組肝組織TGF-β1、PDGF-BB、CTGF免疫組織化學染色;比較各組肝組織TGF-β1、PDGF-BB、CTGF含量,以及血清Ⅲ型前膠原(PCⅢ)、Ⅳ型膠原(CⅣ)、透明質酸(HA)、層粘連蛋白(LN)水平,并分析TGF-β1、PDGF-BB、CTGF水平與血清肝纖維化相關指標的相關性。結果TGF-β1、PDGF-BB、CTGF免疫組化染色結果及水平比較表明,肝組織中TGF-β1、PDGF-BB、CTGF水平均與肝纖維化程度密切相關,且隨肝纖維化程度的加重而增加。從S0組到S4組,血清PCⅢ、CⅣ、HA、LN水平依次遞增,各組間比較差異均有統計學意義(P<0.01)。相關性分析結果表明,肝組織中TGF-β1、PDGF-BB、CTGF水平均與血清PCⅢ、CⅣ、HA、LN水平呈正相關(P<0.05)。結論在肝纖維化的不同階段,肝組織中TGF-β1、PDGF-BB、CTGF表達水平隨肝纖維化程度的加重而增加,在早期肝纖維化診斷方面具有重要價值。
關鍵詞:轉化生長因子-β1; 血小板源性生長因子; 結締組織生長因子; 慢性乙型肝炎
肝纖維化是慢性乙型肝炎(CHB)發展為肝硬化的重要病理變化,主要表現為肝臟纖維結締組織增生、細胞外基質(ECM)過度沉積等。目前普遍認為,肝纖維化的發生與肝星狀細胞(HSC)激活過程密切相關[1-2]。HSC激活后,大量ECM被合成,基質金屬蛋白酶(MMP)活性下降,MMP組織抑制因子合成增加,纖維基質降解減少,沉積增加。在肝纖維化啟動、發展、肝硬化形成過程中,轉化生長因子-β1(TGF-β1)發揮核心作用,且與HSC、實質細胞、纖維化相關生長因子及各種酶類具有相互作用[3]。血小板源性生長因子-BB(PDGF-BB)是作用于HSC的最重要促有絲分裂原。多種因素引起的肝損害均可導致肝臟多種細胞合成并釋放PDGF-BB, 以促進HSC轉化為肌樣成纖維細胞,從而加速肝纖維化的發生與發展[4]。結締組織生長因子(CTGF)主要來源于HSC,能夠誘導成纖維細胞增殖,并促進其分泌ECM。研究[5]發現,機體CTGF表達上調可作為HSC活化的標志。本研究通過觀察CHB肝纖維化不同階段TGF-β1、PDGF-BB及CTGF在肝組織的表達水平,并探討其與肝纖維化發生發展的關系,以期為臨床評估肝纖維化提供更多的理論依據。
1資料與方法
1.1一般資料
選取2012年4月—2015年4月廣西醫科大學第四附屬醫院收治的CHB患者80例,均行肝臟活體組織穿刺病理檢查,排除標準: ① 酒精性肝病、脂肪肝;② 甲、丙、戊型肝炎或重疊感染; ③ 藥物性肝病; ④ 自身免疫性肝病、腫瘤,以及其他器官組織纖維化。其中男42例,女38例;年齡19~50歲,平均(39.5±2.0)歲;病程30 d~15年。參考《病毒性肝炎防治方案》[6]中對慢性肝炎的分期標準,分為5組,即S0組15例、S1組16例、S2組17例、S3組17例、S4組15例。各組一般資料比較差異無統計學意義(P>0.05), 見表1。

表1 各組一般資料
1.2方法
1.2.1肝臟活體組織穿刺: 行肝臟活體組織穿刺前對血小板計數、凝血酶原時間、凝血酶原活動度等指標進行檢測,以確定患者是否符合肝穿活檢適應證。本研究入組80例患者均符合該適應證,在SoNoLiNEVerSA plus型彩色多普勒超聲(德國西門子)引導下,用穿刺槍行肝臟組織穿刺術,取肝組織10×1 mm, 經10%福爾馬林固定,送病理檢查,進行炎癥分級和纖維化分期。肝組織常規脫水,石蠟包埋,切片,行常規HE染色、Masson染色、網狀纖維染色,水洗、封片后,經病理圖像分析系統讀片。
1.2.2肝功能與血清肝纖維化指標檢測: 實驗開始前,清晨空腹采集靜脈血3 mL, 離心后取血清,行常規肝功能和乙型病毒性肝炎(HBV)-DNA檢測。采用放射免疫分析法檢測血清肝纖維化指標,包括血清Ⅲ型前膠原(PCⅢ)、Ⅳ型膠原(CⅣ)、透明質酸(HA)、層粘連蛋白(LN)。檢測試劑盒均購自北京中山生物技術有限公司。
1.2.3TGF-β1、PDGF-BB、CTGF免疫組織化學染色: 石蠟切片后,經脫蠟、過氧化氫孵育、蒸餾水漂洗、抗原修復、滴加一抗和二抗、磷酸鹽緩沖液(PBS)漂洗、DAB顯色等步驟,鏡下觀察染色結果。每張切片隨機選取10個視野,采用美國IPP彩色圖像分析軟件測定每一視野中TGF-β1、PDGF-BB、CTGF的含量,取10個視野的平均值為本張切片的陽性染色含量。彩色圖像分析軟件測定單位為面密度。
1.3觀察指標
比較各組肝組織TGF-β1、PDGF-BB、CTGF含量,以及血清PCⅢ、CⅣ、HA、LN水平;分析TGF-β1、PDGF-BB、CTGF與血清肝纖維化相關指標的相關性。
1.4統計學處理
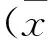
2結果
2.1各組肝組織TGF-β1、PDGF-BB、CTGF免疫組化染色結果
肝組織TGF-β1免疫組化染色陽性顯色為棕黃色, S0組未見陽性反應物質(圖1A); S1、S2組陽性染色主要位于肝竇壁細胞、肝竇周細胞,著色較淺(圖1B、1C); S3、S4組可見大量陽性染色物質,主要位于纖維間隔、肝細胞,著色較深(圖1D、1E)。
肝組織PDGF-BB免疫組化陽性染色呈棕黃色, S0組未見陽性染色物質(圖2A);S1、S2組陽性染色物質主要分布于肝竇壁細胞、肝竇周細胞、肝間質細胞和肝細胞,染色較明顯(圖2B、2C); S3、S4組陽性染色主要分布于纖維間隔區域,染色最深(圖2D、2E)。
肝組織CTGF免疫組化染色結果顯示,陽性染色物質為棕黃色,S0組未見明顯CTGF陽性染色物質(圖3A),S1、S2組可見CTGF陽性染色程度較淺,主要分布于纖維化區(圖3B、3C); S3、S4組可見CTGF陽性染色程度較深,主要分布于纖維化區、HSC、成纖維細胞中(圖3D、3E)。
2.2各組肝組織TGF-β1、PDGF-BB、CTGF含量比較
從S0組到S4組,TGF-β1、PDGF-BB、CTGF的面密度逐漸增加,各組間比較,差異均有統計學意義(P<0.01), 見表2。可見,肝臟TGF-β1、PDGF-BB、CTGF水平與其纖維化程度密切相關,隨著肝纖維化程度的加重而表達增多。

注:1A:S0組;1B:S1組;1C:S2組;1D:S3組;1E:S4組圖1 各組肝組織TGF-β1免疫組化染色

注:2A:S0組;2B:S1組;2C:S2組;2D:S3組;2E:S4組圖2 各組肝組織PDGF-BB免疫組化染色

注:3A:S0組;3B:S1組;3C:S2組;3D:S3組;3E:S4組圖3 各組肝組織CTGF免疫組化染色
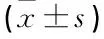
表2 各組肝組織TGF-β1、PDGF-BB、CTGF含量比較 ×10-2, g/m2
與S0組比較,**P<0.01; 與S1組比較, ##P<0.01; 與S2組比較, △△P<0.01; 與S3組比較, ▲▲P<0.01。
2.3各組血清PCⅢ、CⅣ、HA、LN水平比較
從S0組到S4組,血清PCⅢ、CⅣ、HA、LN水平依次遞增,各組間比較,差異均有統計學意義(P<0.01), 見表3。可見, CHB患者血清PCⅢ、CⅣ、HA、LN水平與肝纖維化程度密切相關,隨著肝纖維化程度的加重而增加。

表3 各組血清PCⅢ、CⅣ、HA、LN水平比較 μg/L
與S0組比較,**P<0.01; 與S1組比較, ##P<0.01; 與S2組比較, △△P<0.01; 與S3組比較, ▲▲P<0.01。
2.4TGF-β1、PDGF-BB、CTGF與血清肝纖維化指標的相關性
肝組織TGF-β1與血清PCⅢ、CⅣ、HA、LN水平呈正相關(P<0.05),r分別為0.684、0.756、0.740、0.732。肝組織PDGF-BB與血清PCⅢ、CⅣ、HA、LN水平呈正相關(P<0.05),r分別為0.681、0.692、0.785、0.720。肝組織CTGF與血清PCⅢ、CⅣ、HA、LN水平呈正相關(P<0.05),r分別為0.655、0.740、0.732、0.725。
3討論
在關于肝纖維化發生機制及治療靶點的研究中,細胞因子網絡是學者研究的重點。研究[7]表明,TGF-β1、PDGF-BB、CTGF在肝纖維化過程中發揮重要作用。TGF-β1在肝臟中含量較高,與肝纖維化關系較密切[8]。肝損傷期間,ECM沉積和降解的動態平衡被打破, TGF-β1能夠抑制ECM降解,并促進其合成,對肝細胞再生具有抑制作用[9]。TGF-β1通過與肝纖維化相關細胞因子及各種酶類相互作用而引發肝纖維化,在肝纖維化的啟動、進展過程中發揮核心作用[10]。肝細胞外基質的主要產生細胞是HSC, TGF-β1能夠激活靜態的HSC, 轉換其表型,使HSC膜上巨球蛋白受體表達增加,從而進一步增加TGF-β1的表達水平[11]; 同時,其還能增加ECM受體在HSC膜上的表達。研究[12]發現,肝病患者肝組織中TGF-β1表達水平顯著高于健康人群,且TGF-β1升高程度與肝纖維化程度呈正相關。本研究結果也證實, CHB患者肝組織中TGF-β1水平與肝纖維化程度呈顯著正相關, S0期未見明顯TGF-β1陽性染色物質,S1、S2期僅在肝血竇周細胞、炎癥壞死灶周圍出現,表明在肝纖維化早期, TGF-β1主要來源于肝間質細胞; S4、S3期TGF-β1陽性表達主要分布于纖維間隔,表明肝纖維化發展至后期, TGF-β1主要來源于肝細胞。可見,在CHB纖維化發生過程中,各個分期均有TGF-β1表達,且其表達部位與纖維化發生部位一致,進一步說明TGF-β1促進了肝纖維化的形成。
PDGF-BB具有刺激特定細胞群分裂、增殖的能力[13]。體內主要由單核巨噬細胞分泌,當肝臟受傷時,巨噬細胞、血小板、炎癥細胞、激活的HSC等均可分泌PDGF-BB。研究[14]證實,在纖維化過程中, PDGF-BB能夠使處于靜止期的G0細胞進入G1、S1期,從而進行DNA復制。本研究發現,PDGF-BB陽性染色主要位于細胞漿, S0期未見明顯陽性染色, S1、S2期主要分布于肝竇壁細胞、肝細胞、間質細胞, S3、S4期主要表達于纖維間隔區,且著色較深。研究[15]發現,肝炎肝硬化患者PDGF-BB表達水平明顯高于CHB患者,且隨肝纖維化程度的加重而增加。本研究中,PDGF-BB表達水平從S0期到S4期逐漸升高,證實了PDGF-BB在促肝纖維化形成中發揮了重要作用。
CTGF通過誘導成纖維細胞的增殖和分泌ECM, 來參與細胞增生以及傷口愈合的過程[16]。其主要來源細胞是HSC, 同時HSC活化也需要CTGF表達上調等因素。有研究[17]表明,肝炎肝硬化患者CTGF表達水平明顯高于CHB患者,肝纖維化程度越高,CTGF表達水平越高。可見CTGF在肝組織中的表達與肝纖維化嚴重程度密切相關。本研究發現,CTGF染色強度隨肝纖維化程度的加重而增強。作為促纖維化因子, CTGF通過促進HSC增殖、活化來參與肝纖維化的發生與發展。相關性分析結果顯示,肝組織中TGF-β1、PDGF-BB、CTGF水平與血清肝纖維化指標水平成正相關,說明TGF-β1、PDGF-BB、CTGF與肝纖維化指標的聯合檢測有助于診斷CHB的肝纖維化。
參考文獻
[1]劉婷, 徐銘益.肝纖維化的血清學診斷研究進展[J].實用肝臟病雜志, 2016, 19(1): 125-128.
[2]Sheen V, Nguyen H, Jimenez M, et al.Routine laboratory blood tests may diagnose significant fibrosis in liver transplant recipients with chronic hepatitis C: A 10 year experience[J].J Clin Transl Hepatol, 2016, 4(1): 20-25.
[3]任鳳芹, 吳紅赤.P311與腎間質纖維化的相關性研究進展[J].浙江臨床醫學, 2015, 17(8): 1432-1434.
[4]van Dijk F, Olinga P, Poelstra K, et al.Targeted therapies in liver fibrosis: Combining the best parts of platelet-derived growth factor BB and interferon gamma[J].Front Med (Lausanne), 2015, 5: 72.
[5]劉瑤, 吳同玉, 李東良, 等.早期乙型肝炎肝硬化中醫證素特征及其與血漿CTGF、PDGF的相關性研究[J].廣州中醫藥大學學報, 2015, 32(1): 4-9.
[6]中華醫學會傳染病與寄生蟲病學分會、肝病學分會.病毒性肝炎防治方案[J].中華傳染病雜志, 2001, 19(1): 56-62.
[7]Maiwall R, Kumar M.Prevention and treatment of recurrent hepatitis B after liver transplantation[J].J Clin Transl Hepatol, 2016, 4(1): 54-65.
[8]Golbar H M, Izawa T, Wijesundera K K, et al.Depletion of hepatic macrophages aggravates liver lesions induced in rats by thioacetamide (TAA)[J].Toxicol Pathol, 2016, 44(2): 246-258.
[9]孫濤, 逯素梅, 王晶晶.奧曲肽對肝星狀細胞活性的影響及在肝纖維化形成中的意義[J].中華實驗外科雜志, 2015, 32(3): 508-510.
[10]Li F B, Zhao H, Peng K R, et al.Expression of transforming growth factor-β1and connective tissue growth factor in congenital biliary atresia and neonatal hepatitis liver tissue[J].Genet Mol Res, 2016, 15(1): gmr.15017217.
[11]徐葉進, 陳凌, 郭玉香, 等.胰島素樣生長因子-1受體在TGF-β1疫苗干預后肝纖維化大鼠肝組織中的表達[J].中華臨床感染病雜志, 2015, 8(2): 158-161.
[12]Waluga M, Kukla M, orniak M, et al.Visfatin and TGF-β1in primary biliary cirrhosis and two other common liver diseases[J].Folia Med Cracov, 2015, 55(4): 59-70.
[13]朱立新.慢性乙型肝炎的血清血小板衍生生長因子BB檢測相關性分析[J].檢驗醫學與臨床, 2012, 9(6): 665-666.
[14]Robert S, Gicquel T, Bodin A, et al.Characterization of the MMP/TIMP imbalance and collagen production induced by IL-β1or TNF-α release from human hepatic stellate cells[J].PLoS ONE, 2016, 11(4): e0153118.
[15]Knop J, App C, Huff T, et al.Identification of PDGF-BB binding to thymosin β4by chemical cross-linking[J].Expert Opin Biol Ther, 2015, 15(Suppl 1): S147-S154.
[16]貝婭, 張曉懿, 朱靜.慢性乙型肝炎患者肝組織膠原與血清多肽生長因子測定的臨床評價[J].放射免疫學雜志, 2013, 26(1): 15-18.
[17]Zhou J, Liang Y, Pan J X, et al.Protein extracts of Crassostrea gigas alleviate CCl-induced hepatic fibrosis in rats by reducing the expression of CTGF, TGF-β1and NF-κB in liver tissues[J].Mol Med Rep, 2015, 11(4): 2913-2920.
收稿日期:2016-04-03
基金項目:中國高校醫學期刊臨床專項資金(11527743)
中圖分類號:R 512.6
文獻標志碼:A
文章編號:1672-2353(2016)13-059-05
DOI:10.7619/jcmp.201613017
Expression and significance of TGF-β1,PDGF-BB and CTGF in the liver tissue of patients with chronic hepatitis B
GUO Qian, NONG Cunli
(1.DepartmentofInfectiousDiseases,FourthAffiliatedHospitalofGuangxiMedicalUniversity,Liuzhou,Guangxi, 545005)
ABSTRACT:ObjectiveTo explore the expression and significance of transforming growth factor-β1(TGF-β1), platelet-derived growth factor-BB (PDGF-BB) and connective tissue growth factor (CTGF) in the liver tissue of patients with chronic hepatitis B (CHB) at different stages of liver fibrosis.MethodsEighty patients with CHB were divided into groups S0, S1, S2, S3 and S4 according to chronic hepatitis staging standards.The immunohistochemical staining of TGF-β1, PDGF-BB and CTGF in the liver tissue was observed in each group.The contents of TGF-β1, PDGF-BB and CTGF in the liver tissue as well as levels of serum procollagen Ⅲ (PCⅢ), collagen Ⅳ (CⅣ), hyaluronic acid (HA) and laminin (LN) were all compared in each group, and the relationships between TGF-β1, PDGF-BB and CTGF levels and serum liver fibrosis-related indexes were also analyzed.ResultsThe immunohistochemical staining results of TGF-β1, PDGF-BB and CTGF and comparison of their levels revealed that the levels of TGF-β1, PDGF-BB and CTGF in the liver tissue were all associated with the degree of liver fibrosis, and increased with the degree of liver fibrosis exacerbation.The levels of serum PCⅢ, CⅣ, HA and LN gradually elevated from groups S0 to S4, and the differences were statistically significant among groups (P<0.01).Correlation analysis showed that the levels of TGF-β1, PDGF-BB and CTGF in the liver tissue were all positively correlated with levels of serum PCⅢ, CⅣ, HA and LN (P<0.05).ConclusionAt different stages of liver fibrosis, the levels of TGF-β1, PDGF-BB and CTGF in the liver tissue increase with the degree of liver fibrosis
exacerbation, which is of great importance in the early diagnosis of liver fibrosis.
KEYWORDS:transforming growth factor-β1; platelet-derived growth factor-BB; connective tissue growth factor; chronic hepatitis B

