3種丁香葉片的PSⅡ光化學活性及光能利用特點
張鈺瑩,張會慧,張萌萌,李 陽,張瀠心,孫廣玉*
(1.東北林業大學 生命科學學院,哈爾濱 150040;2.東北農業大學 資源與環境學院,哈爾濱 150030)
?
3種丁香葉片的PSⅡ光化學活性及光能利用特點
張鈺瑩1,張會慧2,張萌萌1,李陽1,張瀠心1,孫廣玉1*
(1.東北林業大學 生命科學學院,哈爾濱 150040;2.東北農業大學 資源與環境學院,哈爾濱 150030)
摘要:以我國北方地區常見的3種丁香屬植物紫丁香(Syringa oblata)、白丁香(S.oblata var.alba)和暴馬丁香(Syringa reticulata(Blume)H.Hara)為試驗材料,利用快相葉綠素熒光動力學技術研究3種丁香葉片的PSⅡ光化學活性之間的差異。結果表明:3種丁香葉片Fv/Fm之間差異不大,但暴馬丁香葉片的Fv/Fo和PIABS卻小于紫丁香和白丁香,達到極顯著差異水平,說明暴馬丁香葉片的PSⅡ光化學活性相對較低。暴馬丁香葉片PSⅡ電子受體側電子由QA向QB傳遞的速率明顯低于紫丁香和白丁香,而且向QB傳遞速率也明顯低于紫丁香和白丁香,但3種丁香葉片Sm無顯著差異,即在PQ庫容量差異較小情況下,暴馬丁香葉片QA向QB傳遞速率較低的原因與QB接受電子能力較低有關,受QB下游PQ庫的影響較小。暴馬丁香葉片放氧復合體OEC的功能和類囊體膜結構的穩定性也明顯低于紫丁香和白丁香。雖然暴馬丁香單位反應中心吸收的光能ABS/RC明顯高于紫丁香和白丁香,但是3種丁香葉片的ETo/RC之間卻無顯著差異,但DIo/RC極顯著高于紫丁香和白丁香。因此,暴馬丁香葉片PSⅡ反應中心能量分配的不均衡性也是其PSⅡ反應中心光化學活性較低的原因之一。
關鍵詞:丁香;光系統Ⅱ;OJIP曲線
0引言
丁香為木樨科丁香屬優良觀賞植物[1],丁香具有極強的抗旱、耐寒、耐鹽優勢以及耐貧瘠等特點[2-3],廣泛栽植于庭園或散植于園路兩旁、草坪之中,具有色、香、姿的觀賞性狀。丁香在中國已有一千年多年的栽培歷史,是我國裁種的著名花木。丁香主要分布于我國長江以北,在華北地區紫丁香(Syringaoblata)、白丁香(S.oblatavar.alba)和暴馬丁香(Syringareticulata(Blume)H.Hara)是最為主要的品種[4]。但是,不同品種丁香的抗逆能力明顯不同,例如紫丁香的耐淹能力明顯低于暴馬丁香[5]。植物的不同品種在長期自然進化中,導致其光合能力存在明顯差異[6-7]。植物的光合能力是植物生長發育的基礎,特別是PSⅡ反應中心的功能在維持葉片同化物的積累促進其生長方面發揮重要的作用[8-9]。通過分析分布在同一區域內的不同丁香品種葉片的光合能力,可以篩選出適合當地生長、適應性較強的優良品種。目前,在丁香屬品種光合作用研究較多[10],但是對于不同丁香品種光合特性,特別是葉片PSⅡ功能差異方面的研究較少,沒有通過葉綠素熒光角度分析不同品種丁香具有不同光合能力的內在機理。為此,本試驗以我國北方常見的3種丁香為試驗材料,利用快相葉綠素熒光動力學技術研究了自然環境下3種丁香葉片PSⅡ反應中心光化學活性及光能利用方面的差異,為深入研究丁香屬植物的光合機理,為丁香在我國北方地區的引種栽培提供一些基礎數據。
1材料與方法
1.1試驗材料
試驗于2014年8月在東北林業大學進行,試驗材料紫丁香(Syringaoblata)、白丁香(S.oblatavar.alba)和暴馬丁香(Syringareticulata(Blume)H.Hara)均為多年生,紫丁香和白丁香株高大約1.5 m,暴馬丁香大約3.5 m,3種丁香生境周圍均無高大樹木遮蔭。
1.2測定項目和方法
快速葉綠素熒光動力學曲線(OJIP)的測定:選擇不同丁香品種的當年生枝條頂部第2片完全展開葉,進行30 min暗適應后利用Mini調制式掌上葉綠素熒光儀(FluorPen FP 100 max,捷克)測定各暗適應后葉片的OJIP曲線。OJIP曲線由3 000 μmol/m2·s的脈沖紅光誘導,相對熒光強度的記錄從10 μs開始至1 s結束,利用5次重復的平均值繪制OJIP曲線。其中OJIP曲線上O、J、I和P點分別為0、2、30、1 000 ms對應的時刻,L和K點分別表示0.15、0.3 ms對應的時刻,O、J、I和P點的相對熒光強度分別以Fo、FJ、FI和Fm表示。為特異分析J點和I點相對可變熒光VJ和VI的變化,將O-P曲線標準化,即將O點的相對熒光強度定義為0,而P點相對熒光強度定義為1,按公式(Ft-Fo)/(Fm-Fo)求得各時間點的相對可變熒光,其中Ft表示各時間點的相對熒光強度。為分析不同品種丁香葉片放氧復合體OEC活性和類囊體解離狀態的影響,即K點和L點的相對可變熒光VL和VK的變化,分別將O-J和O-K曲線進行標準化,其計算公式分別為:(Ft-Fo)/(FJ-Fo)和(Ft-Fo)/(FK-Fo)。對OJIP曲線按照Strasser等人的方法JIP-test分析[11],得到PSⅡ最大光化學效率(Fv/Fm)、PSⅡ潛在光化學活性(Fv/Fo)、以光吸收為基礎的光合性能指數(PIABS)、熒光上升的初始斜率(Mo)、QA完全被還原所需要的能量(Sm)、QA被氧化還原次數(N)、單位反應中心吸收的光能(ABS/RC)、單位反應中心捕獲的用于還原QA的能量(TRo/RC)、單位反應中心捕獲的用于電子傳遞的能量(ETo/RC)和單位反應中心耗散掉的能量(DIo/RC)等。
1.3數據處理和統計方法
運用Excel和DPS軟件對試驗數據進行統計分析,數據結果為5次重復的平均值±標準差(SE),采用單因素方差分析(One-way ANOVA)和最小顯著差異法(LSD)比較不同數據組間的差異。
2結果與分析
2.13種丁香葉片的OJIP曲線
由圖1可以看出,紫丁香和白丁香葉片的OJIP曲線形態基本相似,二者無明顯差異,但是暴馬丁香葉片的OJIP曲線各點相對熒光強度明顯高于紫丁香和白丁香,并且隨著測定時間的延長,差異程度逐漸變大。定量分析結果表明:紫丁香和白丁香O、J、I和P點的相對熒光強度均無顯著差異,而暴馬丁香則與紫丁香和白丁香均達極顯著差異水平。
2.23種丁香葉片的PSⅡ光化學活性
圖2結果可以看出,3種丁香葉片的Fv/Fm無顯著差異,但是暴馬丁香葉片的Fv/Fo分別低于紫丁香和白丁香22.63%(P<0.01)和18.05%(P<0.01),PIABS也分別較紫丁香和白丁香降低57.71%(P<0.01)和52.99%(P<0.01),均達極顯著差異水平。紫丁香和白丁香葉片的Fv/Fo和PIABS無顯著差異。
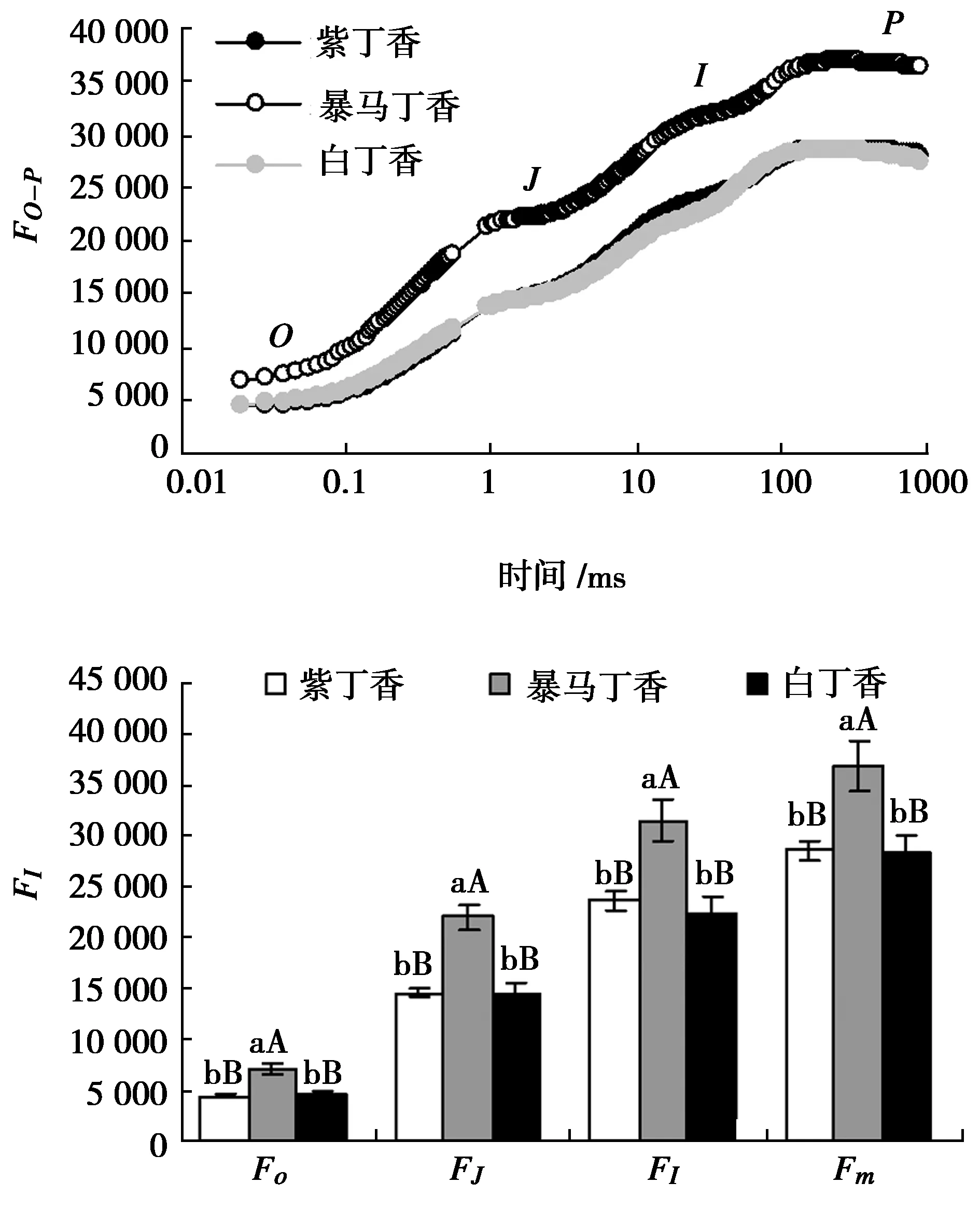
圖1 3種丁香葉片OJIP曲線及特征點相對熒光強度Fig.1 OJIP tramsient and feature points relative fluorescence intensity in leaves of three clove varieties

圖2 3種丁香葉片Fv/Fm、Fv/Fo和PIABSFig.2 Fv/Fm ,Fv/Fo and PIABS in leaves of three clove varieties
2.33種丁香葉片的標準化O-P曲線
將OJIP曲線標準化后可以看出,3種丁香標準化OJIP曲線以2 ms時(J點)的相對可變熒光差異最為明顯,I點相對可變熒光也表現出明顯的差異,并且均以暴馬丁香J點和I點的相對可變熒光最大。定量分析結果表明,暴馬丁香葉片的VJ和VI分別高于紫丁香20.96%(P<0.01)和3.12%(P<0.01),分別高于白丁香23.08%(P<0.05)和9.34%(P<0.01)。另外,由于暴馬丁香葉片J點相對可變熒光的增加,還導致暴馬丁香葉片熒光曲線的初始上升斜率Mo分別較紫丁香和白丁香增加了55.07%(P<0.05)和47.14%(P<0.05)。

圖3 3種丁香葉片VO-P、VJ、VI和MoFig.3 VO-P,VJ,VI and Mo in leaves of three clove varieties
2.43種丁香葉片的Sm和N
由圖4可以看出,紫丁香和暴馬丁香葉片的Sm分別高于白丁香葉片23.73%(P>0.05)和26.44%(P>0.05),但是3者均未達顯著差異水平,3種丁香葉片的N表現為暴馬丁香>紫丁香>白丁香,其中暴馬丁香葉片的N分別高于紫丁香和白丁香31.12%(P<0.05)和51.23%(P>0.05),但僅暴馬丁香和白丁香之間差異顯著。
2.53種丁香葉片標準化O-J和O-K曲線
為特異分析OJIP曲線上K點和L點的相對可變熒光變化,分別將O-J和O-K曲線標準化(圖5(a)和圖5(b)),圖中結果可以看出,3種丁香葉片標準化O-J曲線上出現明顯的差異點K(0.3 ms),標準化O-K曲線上出現明顯差異點L(0.15 ms)。圖5(c)定量分析結果表明,紫丁香和白丁香葉片的K點和L點的相對可變熒光VK和VL均無顯著差異,而暴馬丁香葉片的VK分別高于紫丁香和白丁香28.28%(P<0.01)和18.05%(P<0.01),VL分別高于紫丁香和白丁香12.40%(P<0.01)和7.81%(P<0.01)。
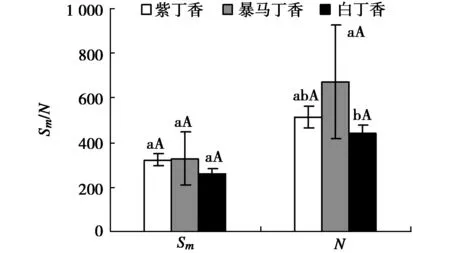
圖4 3種丁香葉片的Sm和NFig.4 Sm and N in leaves of three clove varieties
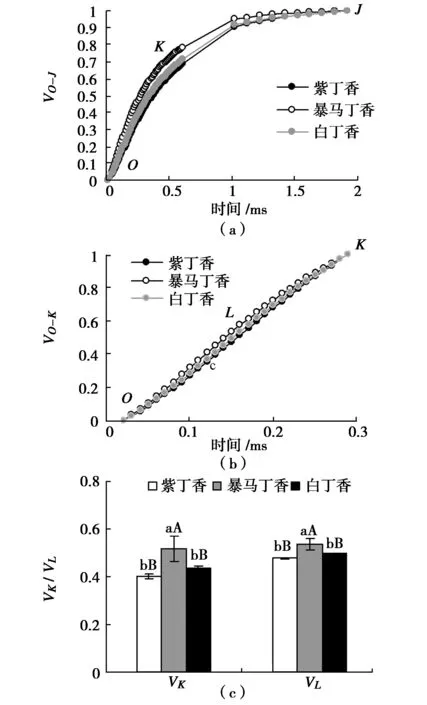
圖5 3種丁香葉片VO-J、VO-K、VK和VLFig.5 VO-J,VO-K,VK and VL in leaves of three clove varieties
2.63種丁香葉片能量分配參數
3種丁香葉片單位反應中心的光能吸收和利用情況明顯不同,其中,暴馬丁香和白丁香葉片的ABS/RC分別高于紫丁香34.45%(P<0.01)和24.23%(P<0.05),與ABS/RC相似,TRo/RC也分別高于紫丁香28.10%(P<0.01)和19.48%(P<0.01)。但是3種丁香葉片的ETo/RC之間卻無顯著差異,雖然暴馬丁香葉片的DIo/RC極顯著高于紫丁香和白丁香,但紫丁香和白丁香之間卻無顯著差異。
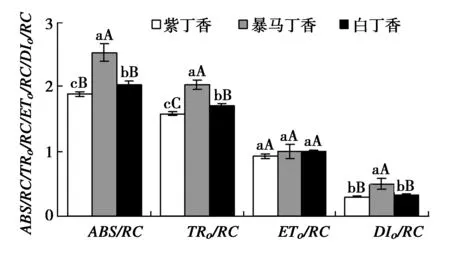
圖6 3種丁香葉片能量分配參數Fig.6 ABS/RC,TRo/RC,ETo/RC and DIo/RC in leaves of three clove varieties
3討論
同屬不同品種植物葉片之間的光合能力明顯不同[12],嚴俊鑫等人研究了我國北方地區主要栽培丁香品種的光合能力,結果發現,在生長季中暴馬丁香葉片的平均凈光合速率明顯低于紫丁香和白丁香,而紫丁香稍高于白丁香[13]。本試驗得到了相似的結果,正常生長條件下,暴馬丁香葉片的PSⅡ光化學活性明顯低于紫丁香和白丁香,表現出極低的Fv/Fo和PIABS,但是3種丁香葉片的Fv/Fm無顯著差異,均維持在0.8以上,不存在種間差異,說明在正常生長條件下,雖暴馬丁香葉片的PSⅡ光化學活性較低,但并沒有發生明顯的光抑制現象。

將將OJIP曲線按O-J和O-K標準化后可以看出,標準化O-J和O-K曲線上分別在0.3 ms和0.15 ms時3種丁香表出明顯的差異點,暴馬丁香葉片的VK和VL均明顯高于紫丁香和白丁香,而紫丁香和白丁香之間無顯著差異。VK和VL的上升分別是放氧復合體OEC受到傷害和類囊體解離的特異性標志[17-18]。因此,本試驗結果可以說明,暴馬丁香葉片光合能力較低的原因還與放氧復合體OEC的水裂解能力相對較低有關,導致光合電子傳遞鏈上的電子供應不足,從而限制了同化力的產生。另外,光合電子傳遞體均隨著在類囊體膜上發揮電子傳遞的功能[19-20],當類囊體解離或其結構不足以附著電子傳遞體時,就會使電子傳遞體QA或QB等喪失電子傳遞功能,因此暴馬丁香葉片葉綠體內類囊體膜結構的穩定性低于紫丁香和白丁香也可能是導致其PSⅡ受體側電子傳遞能力較低的重要原因之一。通過單位反應中心能量分配參數的結果可以看出,雖然暴馬丁香單位反應中心吸收的光能ABS/RC明顯高于紫丁香和白丁香,但是3種丁香葉片的ETo/RC之間卻無顯著差異,即暴馬丁香葉片吸收的光能用于電子傳遞的能量比例相對較低,而是將能量更多地以無效熱能的形式耗散(DIo/RC極顯著高于紫丁香和白丁香),因此,暴馬丁香葉片PSⅡ反應中心能量分配的不均衡性也是其PSⅡ反應中心光化學活性較低的原因之一。
4結論
紫丁香和白丁香葉片的光合性能明顯優于暴馬丁香,其原因不但與暴馬丁香葉片PSⅡ受體側電子傳遞能力較低有關,而且放氧復合體OEC的水裂解能力較低以及類囊體膜結構的穩定性也是導致其PSⅡ反應中心活性較低的重要原因。雖然3種丁香葉片的ETo/RC無明顯差異,但暴馬丁香ETo/RC占總能量的比例明顯低于紫丁香和白丁香,即暴馬丁香用于電子傳遞的能量比例相對較低,而無效熱能耗散的比例DIo/RC明顯高于紫丁香和白丁香。
【參考文獻】
[1]張會慧,張秀麗,李鑫,等.花色素苷在丁香新生葉光合機構中的作用[J].中南林業科技大學學報,2012,32(7):93-99.
[2]安玉艷,梁宗鎖,韓蕊蓮.黃土高原3種鄉土灌木的水分利用與抗旱適應性[J].林業科學,2011,47(10):8-15.
[3]郭二果,王成,彭鎮華,等.半干旱地區城市單位附屬綠地綠化樹種的選擇-以神東礦區為例[J].林業科學,2007,43(7):35-43.
[4]張會慧,張秀麗,王娟,等.利用快相葉綠素熒光參數綜合評價3種丁香的耐鹽性[J].南京林業大學學報:自然科學版,2013,37(5):13-19.
[5]李娟娟,許小妍,朱文旭,等.淹水對3種丁香生理特性的影響[J].林業科技,2011,22(1):21-23.
[6]盛寶龍,常有宏,姜衛兵,等.不同類型梨品種光合特性的比較[J].果樹學報,2007,24(6):742-746.
[7]閆小紅,尹建華,段世華,等.四種水稻品種的光合光響應曲線及其模型擬合[J]生態學雜志,2013,32(3):604-610.
[8]Jiang C D,Jiang G M,Wang X Z,et al.Increased photosynthetic activities and thermostability of photosystem II with leaf development of elm seedlings(Ulmuspumila)probed by the fast fluorescence rise OJIP[J].Environmental and Experimental Botany,2006,58:261-268.
[9]Chen H X,Li W J,An S Z,et al.Characterization of PSII photochemistry and thermostability in salttreated Rumex leaves[J].Journal of Plant Physiology,2004,161:257-264.
[10]李海梅,何興元,陳瑋.沈陽城市森林主要綠化樹種-丁香的光合特性研究[J].應用生態學報,2004,15(12):2245-2249.
[11]Strasser R J,Srivastava A,Govindjee G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology,1995,61(1):32-42.
[12]邱念偉,周峰,顧祝軍,等.5種松屬樹種光合功能及葉綠素快相熒光動力學特征比較[J].應用生態學報,2012,23(5):1181-1187.
[13]嚴俊鑫,劉曉東,張曉嬌,等.6種丁香的光合特性[J].東北林業大學學報,2008,36(7):23-24,41.
[14]齊飛,張會慧,田野,等.繡線菊葉片中花色素苷對光合PSⅡ功能的影響[J].經濟林研究,2012,30(4):19-26.
[15]Strasser R J,Srivastava A,Govindjee G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochem Photobiology,1995,61(1):32-42.
[16]李鵬民,高輝遠,Strasser R J.快速葉綠素熒光誘導動力學分析在光合作用研究中的應用[J].植物生理與分子生物學學報,2005,31(6): 559-566.
[17]葉露幻,沈唯軍,鄭寶剛,等.兩優培九劍葉衰老過程中光合膜功能及蛋白復合物的變化[J].作物學報,2013,39(11):2030-2038.
[18]Strasser R J.Donor side capacity of photosystem Ⅱ probed by chlorophyll a fluorescence transients[J].Photosynthesis Research,1997,52(2):147-155.
[19]索郎拉措,楊小林,尼珍,等.川滇高山櫟的光合作用特征[J].林業科技,2014,39(3):28-30.
[20]李慶亮,譚偉,薛明.B型煙粉虱危害對煙草葉片光系統II的影響[J].中國農業科學,2012,45(19): 3988-3995.
收稿日期:2016-01-28
基金項目:國家自然科學基金(31500508);“十二五”國家科技支撐計劃項目(2011BAD08B02-03);黑龍江省科技攻關項目(GZ13B004)
第一作者簡介:張鈺瑩,碩士研究生。研究方向:植物營養生理學方面研究。 *通信作者:孫廣玉,博士,教授。研究方向:植物生理生態學研究。E-mail:sungy@vip.sina.com
中圖分類號:S 685.26
文獻標識碼:A
文章編號:1001-005X(2016)04-0013-05
PSⅡ Photochemical Activity and Light Energy Utilizationin Leaves of Three Clove Varieties
Zhang Yuying1,Zhang Huihui2,Zhang Mengmeng1,Li Yang1,Zhang Yingxin1,Sun Guangyu1*
(1.College of Life Science,Northeast Forestry University,Harbin 150040;2.College of Resources and Environment,Northeast Agricultural University,Harbin 150030)
Abstract:In this paper,the difference of PS Ⅱ photochemical activity in the three kinds of leaves of Syringa oblata,S.oblata var.alba and Syringa reticulata(Blume)H.Hara from Northeast China was investigated by using chlorophyll fast fluorescence technique.The results showed that there was no significant difference among the Fv/Fm in three kinds of leaves.However,the Fv/Fo and PIABSin Syringa reticulata(Blume)H.Hara were significantly lower than that in Syringa oblate and S.oblata var.alba.PSⅡ photochemical activity in Syringa reticulata(Blume)H.Hara was relatively low.The transfer rate from QA to QB in PS II electron acceptor side in Syringa reticulata(Blume)H.Hara was obviously lower than that in Syringa oblate and S.oblata var.alba,and the transfer rate from to QB was the same as QA to QB,but Sm was not significantly different among the three kinds of varieties.It was suggested that the low transfer rate from QA to QB in Syringa reticulata(Blume)H.Hara was related to the low capability of QB accepting electron under less difference of the PQ library capability,and that was less affected by PQ library at QB downstream.The function of oxygen evolving complex(OEC)and the stability of thylakoid aggregation structure in the Syringa reticulata(Blume)H.Hara was significantly lower than that in Syringa oblate and S.oblata var.alba,and light absorption by unit reaction centre ABS/RC was apparently higher than that in Syringa oblate and S.oblata var.alba.However,there was no significant difference between the ETo/RC in the three kinds of leaves,but DIo/RC in Syringa reticulata(Blume)H.Hara was greater significantly than that in Syringa oblate and S.oblata var.alba oppositely.Therefore,the imbalance of energy distribution of PSⅡ reaction centre was one of the reasons that led to the decrease of the photochemical activity of PSⅡ reaction centre.
Keywords:Syringa L;photosystemⅡ;OJIP curve
引文格式:張鈺瑩,張會慧,張萌萌,等.3種丁香葉片的PSⅡ光化學活性及光能利用特點[J].森林工程,2016,32(4):13-17.

