瑞舒伐他汀對心肌肥厚大鼠TLR4信號通路的影響
范芳芳,張 磊,梁江久
(1.天津醫科大學第二醫院心臟科,天津心臟病學研究所,天津 300211;2.山東省千佛山醫院保健科,山東 濟南 250014)
?
瑞舒伐他汀對心肌肥厚大鼠TLR4信號通路的影響
范芳芳1,張磊2,梁江久2
(1.天津醫科大學第二醫院心臟科,天津心臟病學研究所,天津300211;2.山東省千佛山醫院保健科,山東 濟南250014)
目的研究瑞舒伐他汀(rosuvastatin,RSV)對壓力負荷誘導心肌肥厚大鼠心肌中toll樣受體4(TLR4)及其下游核轉錄因子NF-κB p65、IκBα、炎癥因子TNF-α表達的影響。方法采用腹主動脈縮窄大鼠模型,♂Wistar大鼠隨機分為假手術組(S)、模型組(M)、RSV給藥組(R,10 mg·kg-1·d-1)每組10只。行心臟超聲學檢查,采用RT-PCR、Western blot、免疫組化、ELISA等方法檢測心肌組織中心肌肥大基因ANP及TLR4、NF-κB p65、IκBα、TNF-α的表達。將TLR4蛋白水平分別與ANP、NF-κB p65、TNF-α水平進行相關性分析。結果M組與S組相比,心臟體積和心肌細胞橫截面直徑、ANP mRNA水平均明顯增加(P<0.01),伴TLR4mRNA和蛋白、NF-κB p65及TNF-α的水平明顯增加及IκBα蛋白水平減少(P<0.05)。RSV抑制心肌肥厚,下調心肌組織中TLR4mRNA和蛋白、NF-κB p65及TNF-α的表達及上調IκBα蛋白水平(P<0.05)。在M組和R組,TLR4蛋白水平分別與ANP、NF-κB p65、TNF-α水平呈正相關。結論RSV抑制心臟壓力負荷誘導的心肌肥厚的作用可能與其抑制TLR4信號系統有關。
瑞舒伐他汀;toll樣受體4;腹主動脈縮窄;壓力負荷;心肌肥厚;炎癥因子
心肌肥厚是心肌細胞受各種刺激后的代償性反應,可短期內增加心肌收縮力,但長期的心肌肥厚最終發展成心力衰竭,是心源性死亡的重要原因[1]。近年來,炎癥信號通路及炎癥因子在心肌肥厚的發生發展過程中的作用越來越受到重視。研究發現[2-3],toll樣受體(toll like receptor 4,TLR4)信號系統參與心肌肥厚發生發展過程,并發揮重要作用。多種神經內分泌因子、血流動力學變化可促進TLR4表達和活化,活化的TLR4可以使IκBα磷酸化并降解,從而激活NF-κB并轉移至細胞核內,促進腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)等炎癥因子及心肌肥大基因A型鈉尿肽(atrial natriuretic peptide, ANP)的表達,促進心肌肥厚的發生發展[4]。他汀類藥物是臨床應用廣泛的降脂藥物,已有研究發現,他汀類藥物不僅有降脂作用,而且還具有抗炎、抗氧化、改善內皮功能等非調脂心血管保護作用[5]。已有研究證實,瑞舒伐他汀可抑制壓力負荷誘導的心肌肥厚作用[6]。然而這種保護性作用是否通過阻斷TLR4/NF-κB/炎癥因子(TNF-α等)通路這一途徑,目前尚無報道。本研究建立大鼠腹主動脈縮窄模型,檢測TLR4、NF-κB、IκBα、TNF-α的表達,探討TLR4/NF-κB/炎癥因子(TNF-α)通路在瑞舒伐他汀抑制心肌肥厚的作用機制。
1 材料與方法
1.1材料
1.1.1實驗動物健康♂ Wistar大鼠30只,體質量(250±20) g,由山東大學提供。
1.1.2主要試劑瑞舒伐他汀鈣片(阿斯利康公司),1 g·L-1水合氯醛(麻醉用0.3 mL·(100 g)-1腹腔注射,購于山東大學齊魯醫院),TRIzol(美國Invitrogen公司),逆轉錄試劑盒(日本Toyobo公司),SYBR Green Master (瑞士Roche公司),TLR4單克隆抗體(1 ∶1 000稀釋,英國Abcam公司),NF-κB p65、IκBα單克隆抗體(1 ∶1 000稀釋,美國CST公司),辣根過氧化酶標記的二抗(1 ∶3 000稀釋,北京康為世紀公司),BCA法蛋白定量試劑盒(中國碧云天公司),ECL試劑盒(美國Milipore公司),TNF-α ELISA試劑盒(北京科盈美公司)。
1.1.3主要儀器惠普HPSonos5500彩色超聲診斷儀(美國惠普公司),S12探頭,頻率10 Hz;Olympus FSX-100顯微鏡(日本奧林巴斯公司);ABI PRISM 7300實時定量PCR儀(美國應用生物系統公司);Tanon顯像儀(上海天能科技有限公司)。
1.2方法
1.2.1壓力負荷心肌肥厚大鼠模型的制備及分組將大鼠隨機分為假手術組(S)、模型組(M)、瑞舒伐他汀給藥組(R),每組10只。采用腹主動脈縮窄模型[7]。麻醉大鼠,皮膚消毒后于劍突下沿腹中線打開腹腔,分離腹主動脈,用4號線于腎動脈上0.5~1.0 cm處將腹主動脈與7號針(去尖)結扎,拔出墊針,將腹主動脈縮窄到0.7 mm左右,建立腹主動脈縮窄模型,假手術組不結扎動脈,其余操作同上。R組術前1周起給予瑞舒伐他汀片10 mg·kg-1·d-1灌胃,持續至術后4周實驗結束,其余組給予等劑量的生理鹽水。
1.2.2超聲心動學檢測大鼠在麻醉狀態下行超聲檢查,取左室長軸切面二尖瓣尖水平,在二維影像指導下,M型超聲測量舒張期左室后壁厚度(posterior wall thickness at diastole,LVPWd)、室間隔(interventricularseptal thickness at diastole,IVSd)厚度,分別取連續5次心動周期求平均值, M型超聲影像麻醉清醒時記錄[8]。
1.2.3組織病理心臟經0.4 g·L-1的多聚甲醛固定、石蠟包埋,經HE染色后觀察細胞形態,測量細胞大小。每張切片隨機選取10個視野,每個視野選10個細胞,應用圖像分析軟件Image Pro Plus(IPP)6.0測量有核心肌細胞橫截面最短直徑。
1.2.4實時定量PCR① 提取總RNA:TRIzol法提取心肌總RNA。② 逆轉錄:用10 μL反應體系,將復合物震蕩混勻,37 ℃15 min,98 ℃ 5 min逆轉錄得單鏈cDNA;③ 熒光定量PCR:ANP引物:上游5′-AGG AGA AGA TGC CGG TAG AAG-3,下游5′- AGA GCC CTC AGT TTG CTT TTC-3′。TLR4引物:上游5′-GAA TCT CAG CAA AAT CCC TCA-3′,下游5′-TCC TGG GGA AAA ACT CTT GAT-3′。內參GAPDH引物:上游5′-ACA GCA ACA GGG TGG TGG AC-3′,下游5′-TTT GAG GGT GCA GCG AAC TT-3′。以cDNA為模板,進行實時聚合酶鏈反應。所得數據用2-ΔΔCt法計算。
1.2.5Western blot分別提取左心室心肌組織總蛋白及核蛋白,采用BCA法蛋白定量。蛋白電泳、轉膜,于質量分數為0.5 g·L-1的脫脂奶粉中室溫封閉1 h,封閉后分別與TLR4、NF-κB p65、IκBα一抗孵育,4 ℃過夜。TBST漂洗后與辣根過氧化酶標記的二抗共孵育,37℃ 1 h,TBST漂洗。顯色,拍照。所得蛋白條帶應用Image J蛋白印跡分析軟件分析。
1.2.6酶聯免疫吸附試驗(enzyme linked immunosorbent assay, ELISA)根據試劑盒說明書,采用雙抗體夾心ELISA法檢測左心室脫蠟心肌組織勻漿上清液中TNF-α含量。所有操作嚴格無菌操作。
2 結果
2.1瑞舒伐他汀降低壓力負荷大鼠心肌肥厚程度Tab 1結果顯示,與S組相比較,M組大鼠LVPWd、IVSd、心肌細胞直徑明顯增大(P<0.01),表明大鼠心肌肥厚模型成功。與M組相比,R組LVPWd、IVSd和心肌細胞直徑明顯降低(P<0.01)。
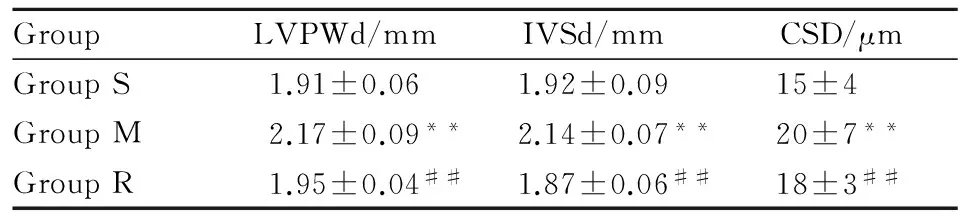
Tab 1 Effect of rosuvastatin on cardiac hypertrophy
S:Sham group;M:Model group;R:Rosuvastatin+Model group. LVPWd:Posterior wall thickness at diastole; IVSd:Interventricularseptal thickness at diastole; CSD:The cross sectional diameter of myocardial cells.**P<0.01vssham group;##P<0.01vsmodel group.
2.2瑞舒伐他汀抑制壓力負荷大鼠心肌ANP、TLR4基因表達ANP是心肌肥大的標志性基因之一。與S相比,M組ANP (P<0.01)和TLR4(P<0.05)基因mRNA表達水平增加;而瑞舒伐他汀明顯抑制以上基因mRNA水平的上調,見Fig 1。
2.3瑞舒伐他汀抑制壓力負荷大鼠TLR4、NF-κB p65、TNF-α的表達及IκBα的降解M組較S組TLR4蛋白水平上調(P<0.01),免疫組織化學結果顯示TLR4表達下調且更向細胞膜聚集,TNF-α、NF-κB p65表達升高(P<0.01;P<0.05)、IκBα表達水平減少(P<0.01)。瑞舒伐他汀明顯抑制壓力負荷引起的TLR4、NF-κB p65、TNF-α的表達增加和IκBα的降解。見Fig 2,3。
2.4TLR4蛋白水平與ANP、NF-κB p65、TNF-α的相關性分析TLR4蛋白水平與ANP mRNA水平增加呈正相關(r=0.878,P<0.01),而瑞舒伐他汀降低TLR4蛋白水平和ANP mRNA水平,TLR4蛋白水平與ANP mRNA水平降低呈正相關(r=0.798,P<0.01);在M組和R組,大鼠心肌組織內TLR4蛋白水平與NF-κB p65、TNF-α水平均呈正相關(TLR4蛋白水平與NF-κB p65水平,M組:r=0.768,與R組:r=0.697,P<0.05;TLR4蛋白水平與TNF-α水平,M組:r=0.705,與R組:r=0.687,P<0.05)。
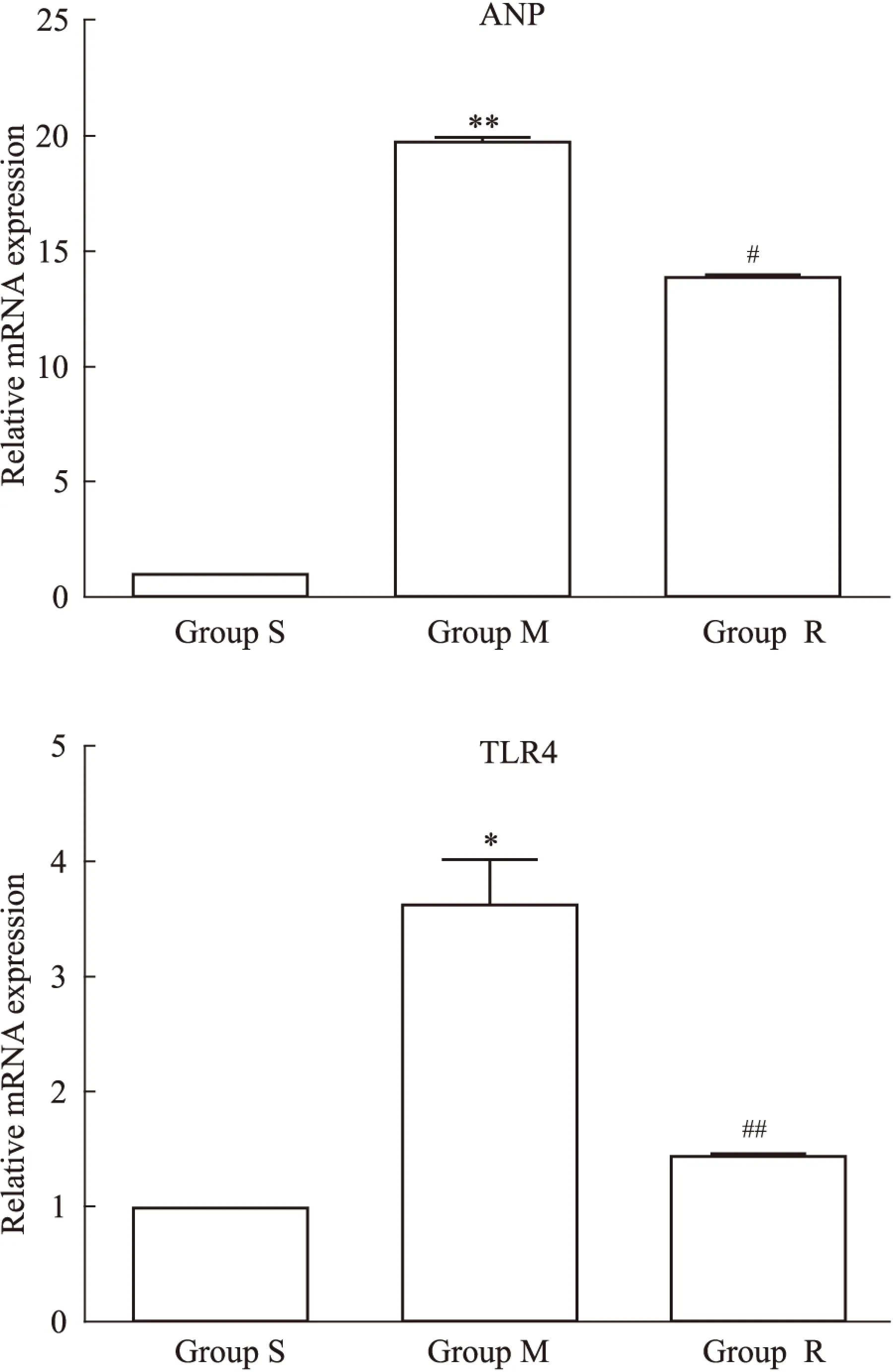
Fig 1 The mRNA expression of ANP and TLR4
S:Sham group;M:Model group;R:Rosuvastatin+model group.*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
3 討論
壓力負荷、容量負荷、神經內分泌因子等多種因素作用于心臟,可激活心肌細胞內MAPK、Ca2+及其依賴的信號通路、JNK/STAT等多種信號系統,各系統相互作用并通過級聯放大反應,引起蛋白合成、細胞外間質沉積,ANP、β型肌球蛋白重鏈等胚胎性基因表達,導致心肌肥厚[9]。雖然這種代償性反應可一定程度上增強心肌泵血功能,但長期的刺激作用促進心肌失代償的發生,出現心力衰竭和惡性心律失常。
近年來研究表明,TLR4作為一種固有免疫系統的跨膜蛋白受體,除了能識別內毒素等物質,激活免疫反應,還可與細胞損傷釋放的物質反應,激活下游信號系統,在心肌肥厚發生發展過程中發揮重要作用[2,10]。拮抗TLR4及其下游NF-κB p65、TNF-α等的治療可減輕大鼠的心肌肥厚,而這種作用不依賴于其對血壓的影響[11]。本研究也證實,縮窄腹主動脈造成心臟壓力負荷(后負荷)過重,導致心肌肥厚,同時伴有心肌細胞TLR4表達增加,并向細胞膜聚集,促進IκBα磷酸化降解,增加NF-κB質核轉移,介導TNF-α等炎癥因子的表達。再次表明心肌TLR4信號系統激活參與壓力負荷導致的心肌肥厚的病理生理過程。
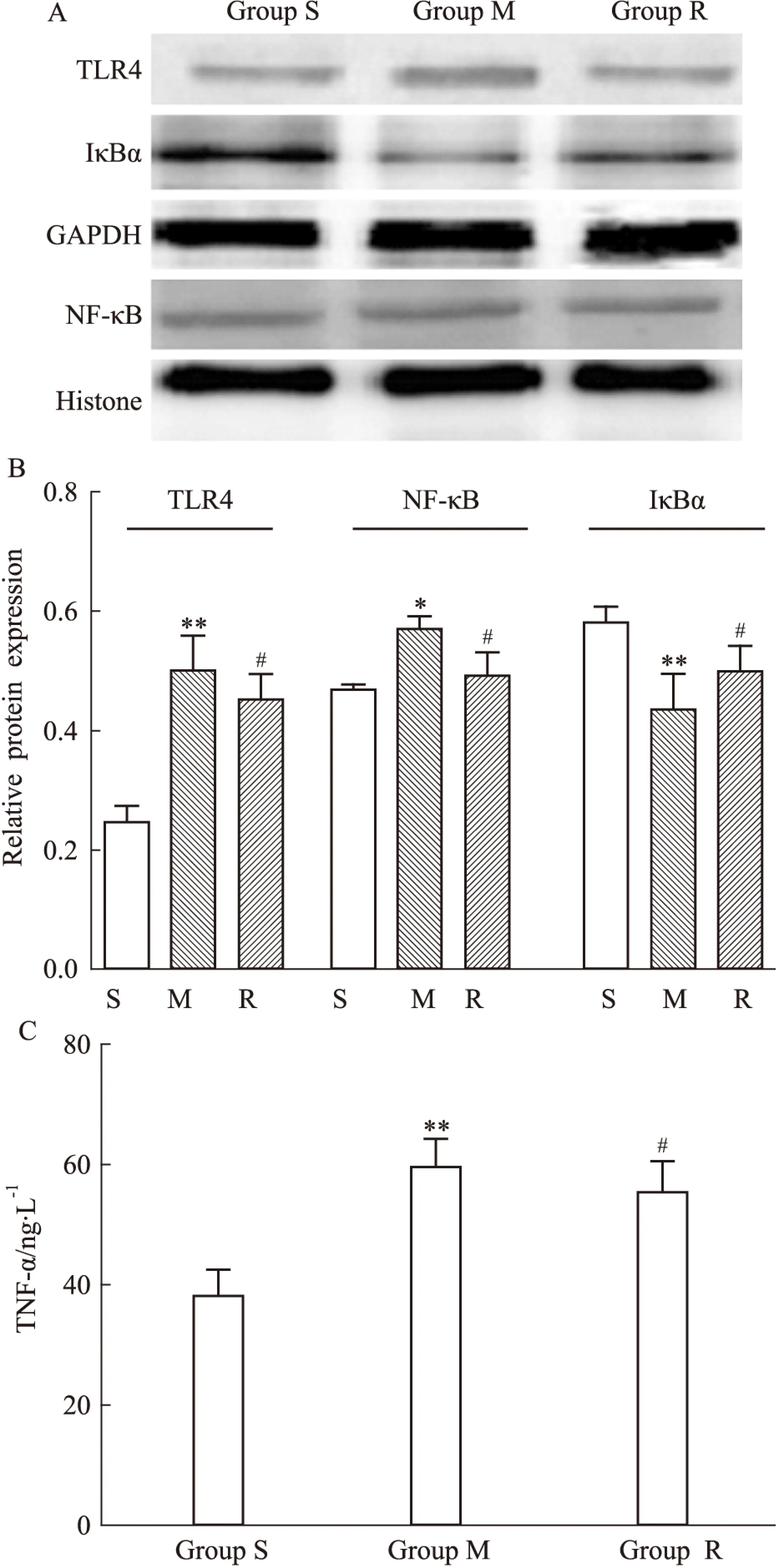
Fig 2 The protein expression of TLR4,TNF-α,NF-κB,IκBα
A:The band of Western blot;B:The results of Western blot;C: The results of ELISA;S:Sham group;M:Model group;R:Rosuvastatin+model group.*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
他汀類藥物除了具有調脂作用,還具有抑制心肌肥厚的作用[12]。已有文獻報道,他汀類藥物可影響JAK/STAT、Rho/Ras-ERK等多種信號系統及Ca通道,對多種動物模型的心肌肥厚起抑制作用[8-14]。盡管有諸多研究致力于他汀類藥物抑制心肌肥厚的作用機制,該抑制作用是否通過阻斷TLR4/NF-κB/炎癥因子通路這一途徑尚不明確。
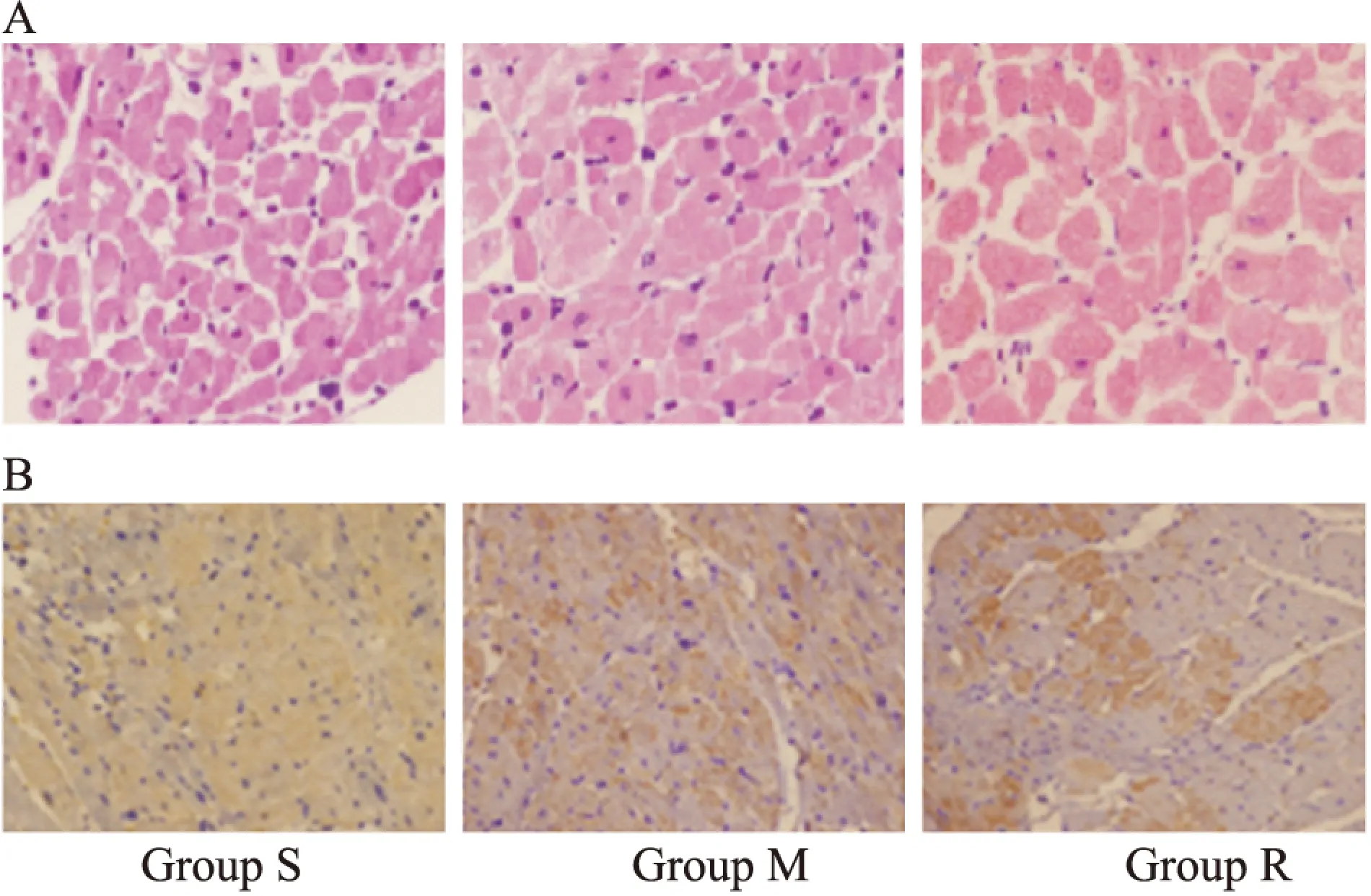
Fig 3 HE staining and immunohistochemistry of the cardiomyocytes
A:HE staining images(magnification 400×) Scale bar, 16 μm;B:Immunohistochemistry images. The expression of TLR4(brown)(magnification 200×). S:sham group;M:model group;R:rosuvastatin+model group.
本實驗結果表明,瑞舒伐他汀可抑制壓力負荷誘導的心肌肥厚,表現為:室壁厚度(LVPWd、IVSd)和心肌細胞直徑明顯的降低,心肌肥大基因ANP表達的減少。對心肌肥厚的抑制作用同時伴有TLR4、NF-κB、TNF-α的表達降低,IκBα降解減少。相關性分析表明:瑞舒伐他汀抑制ANP表達增加與其抑制心肌中TLR4蛋白表達呈正相關,TLR4蛋白水平又與心肌組織中NF-κB和炎癥因子TNF-α水平呈正相關。結合上述TLR4/NF-κB/炎癥因子信號通路在心肌肥厚中的重要作用,我們推測瑞舒伐他汀抑制心肌肥厚的作用可能與其下調心肌組織TLR4表達,抑制核轉錄因子NF-κB的質核轉移與TNF-α等炎癥因子的表達相關。
壓力負荷可導致心肌肥厚、心力衰竭,伴有TLR4信號系統激活。瑞舒伐他汀可能通過下調該系統,發揮抑制心肌肥厚的作用。盡管瑞舒伐他汀如何下調TLR4信號系統仍需進一步研究,以上機制仍是瑞舒伐他汀發揮抑制心肌肥厚作用的重要途徑之一。本課題組將對瑞舒伐他汀影響TLR4信號系統的具體機制做深入研究,為他汀類藥物在心肌肥厚治療上的應用提供新的理論基礎。
(致謝:本實驗在山東省千佛山醫院中心實驗室完成,感謝實驗室所有老師的指導和幫助!)
[1]Rohini A,Agrawal N,Koyani C N,Singh R. Molecular targets and regulators of cardiac hypertrophy[J].PharmacolRes,2010,61(4):269-80.
[2]Eissler R, Schmaderer C, Rusai K, et al. Hypertension augments cardiac Toll-like receptor 4 expression and activity[J].HypertensRes, 2011,34(5):551-8.
[3]Riad A, Meyer zu Schwabedissen H, Weitmann K,et al.Variants of Toll-like receptor 4 predict cardiac recovery in patients with dilated cardiomyopathy[J].JBiolChem,2012,287(32):27236-43.
[4]張靜,王洪新,楊娟,等.黃芪多糖通過Toll樣受體4/核轉錄因子NF- κB信號通路抑制異丙腎上腺素誘導的心肌細胞肥大[J].中華高血壓雜志,2014,22(2):157-62.
[4]Zhang J, Wang H X, Yang J,et al. Astragalus polysacharides inhibites cardiomyocyte hypertrophy induced by isoproterenol via Tol-like receptor 4/nuclear factor-κB signal pathway[J].ChinJHypertens, 2014,22(2):157-62.
[5]Mason R P,Corbalan J J,Jacob R F,et al. Atorvastatin enhanced nitric oxide release and reduced blood pressure, nitroxidative stress and rantes levels in hypertensive rats with diabetes[J].JPhysiolPharmacol,2015,66(1):65-72.
[6]廖穎,曲秀芬,劉麗,等.瑞舒伐他汀對壓力超負荷肥厚大鼠心臟結構和交感神經重構的影響[J].中華醫學雜志,2009,89(34):2412-5.
[6]Liao Y, Qu X F, Liu L,et al. Sympathetic nerve in rat with pressure overload left ventricular hypertrophy[J].NatlMedJChina,2009,89(34):2412-5.
[7]Cittadini A, Monti M G,Iaccarino G,et al. SOCS1 gene transfer accelerates the transition to heart failure through the inhibition of the gp130/JAK/STAT pathway[J].CardiovascRes, 2012, 96(3):381-90.
[8]Dai D F,Hsieh E J,Liu Y,et al. Mitochondrial proteome remodelling in pressure overload-induced heart failure: the role of mitochondrial oxidative stress[J].CardiovascRes,2012,93(1):79-88.
[9]Rohini A, Agrawal N, Koyani C N, Singh R. Molecular targets and regulators of cardiac hypertrophy[J].PharmacolRes,2010,61(4):269-80.
[10]Mehta J L,Ding Z, Liu S,et al. Hypertension, TLR4 activation in brainand cardiac hypertrophy[J].CardiovascRes,2014,103(1):3-4.
[11]Echem C, Bomfim G F,Ceravolo G S,et al. Anti-toll like receptor 4(TLR4) therapy diminishes cardiac remodeling regardless of changes in blood pressure in spontaneously hypertensive rats(SHR)[J].IntJCardiol,2015,187:243-5.
[12]Liu J, Shen Q, Wu Y. Simvastatin prevents cardiac hypertrophyinvitroandinvivovia JAK/STAT pathway[J].LifeSci,2008,82(19-20):991-6.
[13]Takayama N, Kai H, Kudo H, et al. Simvastatin prevents large blood pressure variability induced aggravation of cardiac hypertrophy in hypertensive rats by inhibiting RhoA/Ras-ERK pathways[J].HypertensRes,2011,34(3):341-7.
[14]范芳芳,田秀青,徐雪,等.他克莫司對大鼠心肌肥厚及TOLL受體4的影響[J].中國藥理學通報,2013,29(7);445 -8.
[14]Fan F F, Tian X Q, Xu X, et al. Effect of tacrolimus on cardiac hypertrophy and toll like receoptor 4 signaling pathway in myocardium[J].ChinPharmacolBull,2013,29(7);445 -8.
Effect of rosuvastatin on TLR4 signal pathway in rats with cardiac hypertrophy induced by pressure overload
FAN Fang-fang1, ZHANG Lei2,LIANG Jiang-jiu2
(1.DeptofCardiology,InstituteofCardiology,theSecondHospitalofTianjinMedicalUniversity,Tianjin300211,China;2.DeptofHealthCare,QianfoshanHospitalAffiliatedtoShandongUniversity,Jinan250014,China)
AimTo study the influence of rosuvastatin on toll-like receptor 4(TLR4), and its downstream nuclear transcription factor NF-kappa B p65, IκBα, inflammation factors TNF alpha in rats with myocardial hypertrophy induced by pressure overload.MethodsMyocardial hypertrophy was induced by abdominal aortic constriction(AAC).Male Wistar rats were divided into 3 groups(n=10):① sham-operated rats(S);② AAC rats(M);③ AAC+rosuvastatin(10 mg·kg-1·d-1) rats. From 1 week pre-opertion to 4 weeks post-operation, three groups were performed by gavage administration with equal volume of rosuvastatin and vehicle. The rats underwent cardiac color Doppler examination. The level of ANP,TLR4, NF-κB p65,IκBα,TNF-α mRNA and protein expression in myocardium were detected by real-time PCR, Western blot, immunohistochemical and ELISA respectively.ResultsThe sizes of heart and cardiomyocytes and the expression of ANP mRNA and TLR4 signaling molecules were significantly increased in group M, which could be blocked by rosuvastatin. TLR4 protein was positively related to ANP, NF-κB p65 and TNF-α respectively.ConclusionRosuvastatin prevents cardiac hypertrophy induced by pressure overload, which is associated with its inhibition of TLR4, NF-κB and TNF-α in myocardium expression.
rosuvastatin; toll like receptor 4; abdominal aortic constriction; pressure overload; cardiac hypertrophy; inflammation factors
2016-02-20,
2016-04-14
山東省自然科學基金資助項目(ZR2010HM116)。
范芳芳(1988- ),女,碩士,住院醫師,研究方向:心力衰竭疾病,Tel:022-88328617,E-mail:FT_0823@163.com;梁江久(1962-),男,主任醫師,研究方向:心力衰竭疾病,通訊作者,E-mail:liangjiangjiu001@163.com
10.3969/j.issn.1001-1978.2016.07.017
A
1001-1978(2016)07-0970-05
R-332;R322.11;R392.11;R542.2;R972.6
網絡出版時間:2016-6-20 11:49網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.034.html