對九年級化學幾個實驗疑點的再探究
陸春華
摘要:對九年級化學教學中的4個實驗疑點作了實驗探究:(1)稀釋濃硫酸是否一定要將濃硫酸注入水中?(2)鐵絲燃燒實驗中為何需事先把鐵絲繞成螺旋狀?(3)用海水制堿為何要先通入氨氣?(4)為何用扇子一扇就能熄滅蠟燭的火焰?結合實驗對上述問題進行了論證和解釋,旨在與同行交流以及促進九年級化學實驗教學的發(fā)展。
關鍵詞:濃硫酸稀釋;鐵絲燃燒;海水制堿;蠟燭熄滅;實驗疑點
文章編號:1005–6629(2016)6–0076–03 中圖分類號:G633.8 文獻標識碼:B
1 稀釋濃硫酸一定要將濃硫酸注入水中嗎
人教版九年級化學教材下冊第52頁介紹了幾種常見的酸,以及濃硫酸的稀釋方法。由于這個知識點是學習的重點,所以,教學時筆者設計了以下幾個問題:
(1)實驗室中,我們一般用稀硫酸來做實驗,但是,我們從藥品店里買到的都是濃硫酸,如何把濃硫酸稀釋成稀硫酸呢?學生非常爽快地回答:加水(學生根據平時的生活經驗很容易想到這點)。
(2)在稀釋濃硫酸的時候,能否把水注入濃硫酸中呢?學生思考片刻,有些學生說行,有些學生說不行,再看了教材后統(tǒng)一回答不行。
學生在查閱教材獲知:稀釋濃硫酸的時候,一定要把濃硫酸沿器壁緩緩注入水里,并不斷攪拌,切不可把水倒入濃硫酸中。
筆者翻閱了大量資料,資料中顯示:濃硫酸的密度為1.98 g/cm3,而水的密度為1 g/cm3,如果把水倒入濃硫酸中,由于水的密度較小,所以水就浮在濃硫酸的表面,濃硫酸溶于水放出的大量的熱量會造成硫酸液滴飛濺,事實果真如此嗎?
學生進行分組討論,從安全的角度去選擇儀器,設計了如圖1所示的Ⅰ、Ⅱ兩套裝置。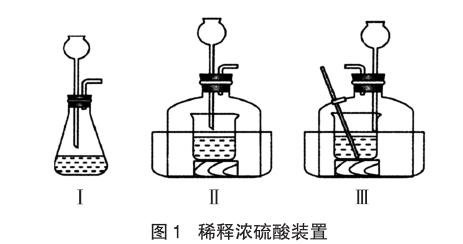
實驗器材:錐形瓶、雙孔橡皮塞、長頸漏斗、燒杯、水槽、鐘罩、玻璃棒、濃硫酸、蒸餾水等
實驗操作過程及現象:把蒸餾水從長頸漏斗中慢慢注入濃硫酸中,濃硫酸和水出現分層現象,水浮在濃硫酸上面,不一會兒,錐形瓶內壁和鐘罩內壁出現大量水霧,偶有大的液滴飛濺。
分析:也許是沒有用玻璃棒攪拌。師生討論后把裝置Ⅱ改為裝置Ⅲ。
實驗操作過程及現象:把蒸餾水從長頸漏斗中慢慢注入濃硫酸中,并用玻璃棒不斷攪拌,鐘罩內壁出現水霧,但燒杯中沒有出現液滴飛濺。
結論:稀釋濃硫酸時,通常情況下,教材上的操作要求是規(guī)范合理的。但如果滴加水的速度很緩慢,用玻璃棒不斷進行攪拌,并且做好一定的防護措施,實驗還是可行的。當然,稀釋大量濃硫酸時還是采用規(guī)范操作為好。
2 鐵絲燃燒為何事先要把鐵絲繞成螺旋狀
在人教版九年級化學教材第二單元課題2“氧氣”一節(jié)中,做鐵絲在氧氣中燃燒實驗時,要求把鐵絲繞成螺旋狀,這是為什么呢?筆者查閱了相關資料,資料顯示:增大和氧氣的接觸面積或對未燃燒部分進行預熱,究竟哪種回答更為準確呢?根據日常生活中火柴棒的擺放方式不同導致燃燒的現象也不同,筆者設計了如下實驗:
探究一:是為了增加鐵絲與氧氣的接觸面積
實驗器材:粗細、長度一樣的細鐵絲(10cm)、250mL的集氣瓶3只(瓶中盛有一定量等體積的水并且收集滿氧氣)
實驗操作過程及現象:①把細鐵絲全部伸入到集氣瓶中,保證細鐵絲和氧氣的接觸面積相同;②把一根細鐵絲拉直,另兩根繞成粗細不同的螺旋狀(如圖2所示);③在細鐵絲的末端系一根火柴梗,等火柴只剩1/4時,伸入盛有氧氣的集氣瓶中。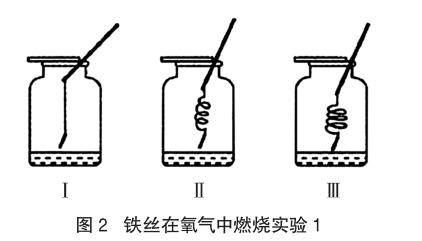
猜想:把三根細鐵絲全部伸入到集氣瓶中,這是因為表面積固定,所以和氧氣的接觸面積一定,如果三根細鐵絲都能燃燒,則說明和氧氣的接觸面積無關。
實驗現象:三根鐵絲都能和氧氣發(fā)生劇烈的反應,火星四射,放出大量的熱,同時生成黑色固體。實驗Ⅱ、Ⅲ與實驗Ⅰ相比,劇烈程度更強一些。
分析:影響反應現象的原因有物質的性質、反應物的濃度與接觸面積。上述三個實驗中,物質的性質、氧氣的濃度以及反應物的接觸面積都相同,所以,實驗中把鐵絲繞成螺旋狀與增大反應物的接觸面積無關。
探究二:對未燃燒部分進行預熱
實驗器材:粗細、長度一樣的細鐵絲(10cm)、250mL的集氣瓶2只(瓶中盛有一定量等體積的水并且收集滿氧氣)。
實驗操作過程及現象:①把細鐵絲全部伸入到集氣瓶中,保證細鐵絲和氧氣的接觸面積相同;②把其中的一根細鐵絲拉直,另一根繞成螺旋狀(如圖3所示);③在細鐵絲的末端系一根火柴梗,等火柴只剩1/4時,伸入盛有氧氣的集氣瓶中。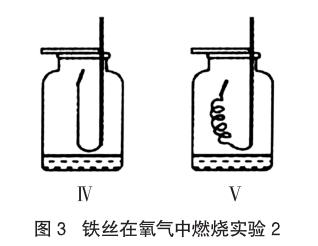
實驗現象:兩根鐵絲都沒有燃燒。(重復4次,現象相同)
分析:可燃物燃燒的條件是與氧氣接觸,且溫度達到著火點。實驗Ⅰ與Ⅳ、Ⅱ與Ⅴ中,氧氣的濃度和鐵絲都相同,但現象明顯不一樣,仔細觀察可以看到金屬彎曲的方式不一樣。在Ⅳ與Ⅴ中由于火柴燃燒火焰以及空氣對流的原因,熱量向上流失,沒有對下面的金屬進行預熱,因此,溫度沒有達到鐵絲的著火點,所以,鐵絲不能正常燃燒。
結論:細鐵絲繞成螺旋狀是為了對未燃燒部分的鐵絲進行預熱,在燃燒過程中,燃燒部分的熱量可以傳遞給即將燃燒的那部分鐵絲,這樣就達到了提高局部溫度的效果,起到預熱未燃燒部分的作用,使燃燒更容易進行。
3 海水制純堿為什么要先通氨氣呢
在魯教版九年級化學教材第二單元第3節(jié)“海水制堿”一課中,先把氨氣通入飽和食鹽水制成飽和氨鹽水,然后在加壓的條件下通入二氧化碳。為什么要先通入氨氣,再通二氧化碳呢?相關資料顯示:氨氣極易溶于水,一體積的水大約能溶解700體積的氨氣;二氧化碳也能溶于水,一體積的水約能溶解一體積的二氧化碳。相同條件下,氣體體積比等于分子個數比。
猜想:通氣體的先后順序是由二氧化碳和氨氣的溶解性決定的。
實驗器材(如圖4所示):帶刻度的儲氣罐兩個(一個存放氨氣、一個存放二氧化碳)、導氣管、橡膠導管、125mL的集氣瓶兩只(瓶中分別盛放40毫升的飽和食鹽水)、量筒、托盤天平等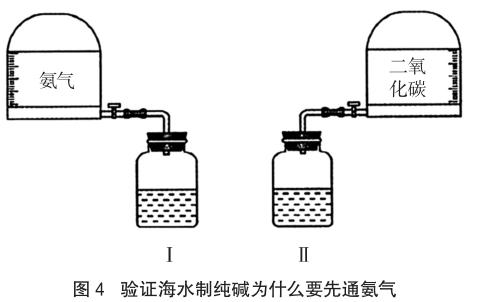
實驗操作過程及現象:①用量筒量取40毫升飽和食鹽水,分別倒入集氣瓶中;②把瓶Ⅰ和瓶Ⅱ分別連接在氨氣和二氧化碳的儲氣罐上,不斷振蕩,直至儲氣罐的刻度不再改變?yōu)橹梗涗涀x數;③把瓶Ⅰ和瓶Ⅱ迅速交換連接,并振蕩,直至刻度不再改變?yōu)橹梗涗涀x數;④觀察瓶底部有多少晶體,過濾、稱量。
分析:瓶Ⅰ中吸收二氧化碳和氨氣的總量遠遠大于瓶Ⅱ中所吸收的氨氣與二氧化碳的總量,而且瓶Ⅰ中出現的晶體質量要遠遠大于瓶Ⅱ中的晶體。這個過程中發(fā)生了如下反應:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl。根據化學方程式可以判斷,參加反應的二氧化碳和氨氣的分子個數比為1:1,由于氨氣的溶解能力極強,所以瓶Ⅰ中的氨氣量多,當連接到盛放二氧化碳的儲氣罐的時候,參與反應的二氧化碳就多,這就很好地解釋了瓶Ⅰ消耗氣體的體積遠遠大于瓶Ⅱ的原因。瓶Ⅰ中有更多的產物生成以及消耗了大量的水,因此,飽和食鹽水中析出的實驗晶體要比瓶Ⅱ多。
結論:前面的猜想正確。
4 扇子扇蠟燭火焰,為什么一扇就滅
在人教版九年級化學教材上冊第135頁“練習與應用”中有這么一道題目“扇子扇蠟燭火焰,為什么一扇就滅?”。這是生活中我們經常遇到的一個現象,這個問題主要考查了滅火的原理和促進燃燒的方法,根據燃燒的條件,滅火主要有三種方法:①隔絕氧氣或空氣;②清除可燃物;③降溫至著火點以下。促進燃燒的主要方法有兩種:①增大氧氣的濃度;②增大可燃物與氧氣的接觸面積。筆者查閱了相關資料,大致的解釋內容相同:扇子一扇,帶走了蠟燭燃燒產生的熱量,從而使石蠟達不到著火點,所以蠟燭就熄滅了。然而有些資料顯示:石蠟的著火點大約190℃,蠟燭燃燒其實就是石蠟蒸氣在燃燒,扇子扇是單純的降溫,還是把石蠟蒸氣吹走了,清除了可燃物,從而使蠟燭火焰熄滅呢?為此,筆者設計了如下實驗。
做出猜想:“扇子一扇,蠟燭熄滅”是清除了可燃物,不僅僅是降溫。
實驗思路:用一股比石蠟著火點高的熱空氣吹蠟燭火焰,如果蠟燭熄滅了,則說明假設成立;否則假設不成立。
實驗器材:鐵質的易拉罐兩個(一個剪去頂部和底部,另一個剪去底部,把兩個易拉罐串聯(lián)起來)、自制金屬帶柄活塞、酒精燈兩盞(目的是增大加熱面積)、溫度計(量程500℃)、火柴、蠟燭、鐵架臺兩個。裝置如圖5所示。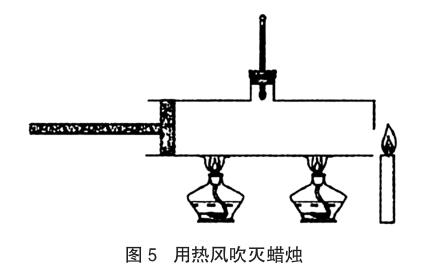
實驗操作過程及現象:把溫度高于300℃的空氣迅速推出,蠟燭火焰立刻熄滅。
結論:扇子一扇,蠟燭火焰熄滅是因為清除了氣態(tài)可燃物,不僅僅是降溫。
上述所舉四個實驗案例僅是九年級化學實驗中類似例子的冰山一角,筆者只是對幾個實驗疑點進行了探討,撰寫此文的目的是希望能引起同行對相關問題的關注,使我們的實驗教學更加科學、合理。
參考文獻:
[1]莊曉松.對初中《化學》教材實驗內容的幾點思考[J].化學教學,2014,(11):24~26.
[2]劉懷樂.純堿生產實驗的秘訣[J].化學教學,2011,(1):48.
[3]劉懷樂著.中學化學實驗與教學研究[M].重慶:西南大學出版社,1996:48.
[4]王程杰.燃燒條件3+1 [J].化學教學,2016,(1):49~54.

