談高考試題對化學教學的啟示
摘要:通過例舉分析高考試題,闡述了目前高考試題對科學性教學、教學的嚴謹性、理解性教學和滲透化學價值觀的教學啟示;指出在教學中教師不僅要關注高考試題的解題方法、知識和能力的考查要求,還應從中汲取對改善教學的啟示。
關鍵詞:高考試題;試題分析;教學啟示;化學教學
文章編號:1005–6629(2016)6–0085–06 中圖分類號:G633.8 文獻標識碼:B
高考試題凝結了命題專家的心血和智慧,是精心的設計和苦心的創作。每當我們在研讀高考試題時,都會被試題的原創性、試題背景的新穎性及相關問題設置的科學嚴謹性所深深折服。然而,如果我們能夠對高考試題進行進一步的分析和思考,還能對我們平時的教學有很多的啟示。
1 對教學科學性的啟示
教學的科學性問題現在越來越受到教師的重視,向學生傳遞正確的化學知識,盡量避免出現科學性錯誤是對我們開展教學活動的最基本的要求,但是由于長期的流傳和錯誤試題的引導使我們在教學中會出現將知識絕對化的行為,這是出現科學性問題的主要原因之一。例如在電解教學過程中,教師在歸納總結離子放電規律時,常會說當惰性電極電解時,在陰極放電的是陽離子,而陰離子在陽極放電。


同樣,陽離子也會在陽極放電。在2014年全國新課標Ⅱ卷理綜第27題涉及以石墨為電極,通過電解Pb(NO3)2和Cu(NO3)2的混合溶液來制取PbO2,此時陽極的電極反應式為Pb2++2H2O-2e-=PbO2+4H+。2013年的天津理綜第9題的第(7)小題和2013年的福建理綜第23題均涉及在惰性電極時,電解FeCl2溶液的問題。陽極反應式為Fe2++2e-=Fe,總反應式為2Fe2++2H+=2Fe3++ H2↑。而在2014年的北京理綜28題更是將電解FeCl3酸性溶液脫除H2S后的廢液以再生作為背景素材,設計為探究性的實驗題。通過在不同電壓下電解pH=1的FeCl2溶液,獲知陽極產生Fe3+的原因即可能是Cl-在陽極放電,生成的Cl2將Fe2+氧化,也可能是Fe2+直接在陽極放電,而且通過控制電壓的實驗結果,驗證了Fe2+要先于Cl-放電。
例2 (2014年北京理綜,26題節選)(4)工業上電解NO制備NH4NO3,其工作原理如圖1所示。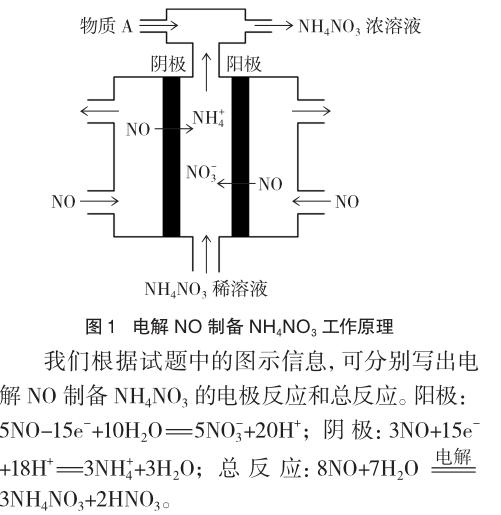
通過上述兩例可知,電解池中在陰、陽極放電的既可以是離子也可以是氣體分子,陽離子既可能在陰極放電也可能在陽極放電,同樣,陰離子既可能在陽極放電也可能在陰極放電。這些試題啟示我們,在平時的教學中切勿隨意對高中的知識進行歸納,而是要將本質的規律講透徹。電解的基本原理之一就是陽極發生氧化反應,陰極發生還原反應,這是任何形式的電解裝置共同的核心本質。
2 對教學嚴謹性的啟示
在教學過程中教師對有些教學內容的處理過于簡單化,考慮問題過于單一化,沒有綜合地、全面地考慮問題,使我們的教學變得不夠嚴謹。如在金屬的電化學腐蝕的教學中,教師經常簡單地說,“鋼鐵在酸性環境下發生析氫腐蝕,在堿性或中性環境下發生吸氧腐蝕”。按照書本[3]編排的析氫腐蝕實驗,具體操作:向還原鐵粉中加入少量的碳粉,混合均勻后,撒入內壁用稀醋酸潤濕過的具支試管中,按圖2組裝好儀器。馬上打開止水夾,會觀察到導管中的液面低于試管中的液面,但是很快又會出現導管中的液面高于試管中液面的情況。面對這種情況,教師總是關注導管中液面低于試管中的液面的現象,而忽略后一現象,或者對該實驗進行改進,如提高醋酸的濃度甚至用強酸代替醋酸,以期達到較長時間出現導管中的液面高于試管中液面的現象。其實,鋼鐵的電化學腐蝕是較復雜的過程,無論在酸性、中性還是堿性條件下吸氧腐蝕都是存在的。而析氫腐蝕則主要發生在H+濃度較大的環境中。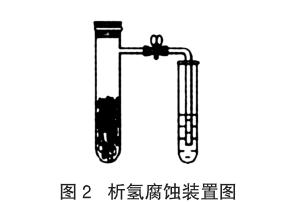
例3 (2014安徽理綜,28題節選)某研究小組為探究弱酸性條件下鐵發生電化學腐蝕類型的影響因素,將混合均勻的新制鐵粉和碳粉置于錐形瓶底部,塞上瓶塞(如圖3)。從膠頭滴管中滴入幾滴醋酸溶液,同時測量容器中的壓強變化。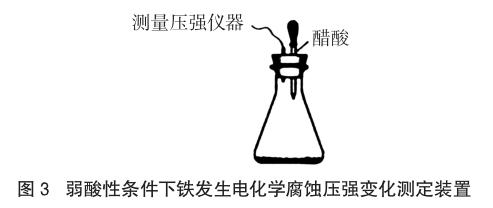
(1)請完成以下實驗設計表(表中不要留空格):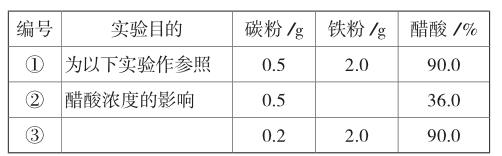
(2)編號①實驗測得容器中壓強隨時間變化如圖4。……
(3)該小組對圖4中0~t1時壓強變大的原因提出了如下假設,
請你完成假設二:
假設一:發生析氫腐蝕產生了氣體;
假設二: ;……
該試題說明了在弱酸性條件下吸氧和析氫腐蝕是同時發生的,在教學中我們要正視這個問題,而且也是有必要向學生講明的。在新課教學中可以通過演示例3中的數字化實驗,得出圖4的壓強隨時間變化圖像,并將此實驗結果作為新課教學中的一個教學資源由師生共同分析,以利于學生掌握金屬腐蝕的基本原理。在教學中教師要綜合考慮問題,盡量避免非此即彼的觀念泛化的現象。
由于中學化學教學的階段性,很多知識都是進行了簡化處理。教師需要對教材中經過簡化處理的概念和理論的背景知識有所了解。在蘇教版《化學反應原理》教材中對化學反應速率的定義為“通常用單位時間內反應物濃度(常用物質的量濃度)的減少或者生成物濃度的增加來表示化學反應速率”[4]。并且說明“反應物或生成物的物質的量濃度可以用mol·L-1表示”[5]。在教學中很多教師沒有關注到“通常”這兩個字的含義,只是一味地介紹用物質的量濃度變化表示的化學反應速率,造成了教學的“死教”和學生的“死學”。
(2015廣東理綜,31題節選)用O2將HCl轉化為Cl2,可提高效益,減少污染。(3)一定條件下測得反應過程中n(Cl2)的數據如下: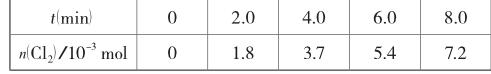
計算2.0~6.0min內以HCl的物質的量變化表示的反應速率(以mol·min-1為單位,寫出計算過程)。
化學反應的平均速率是單位時間內反應物的減少量或者生成物的增加量,其減少量或增加量可以是質量、氣體體積或者是物質的量,當反應是在體積一定的密閉容器內進行的化學反應,則可以用單位時間內反應物濃度的減少或者生成物的濃度的增加來表示。上述兩例就是很好的說明。
例5 (2014年福建理綜,12題)在一定條件下,N2O分解的部分實驗數據如下:
下圖能正確表示該反應有關物理量變化規律的是 。正確答案如圖5所示。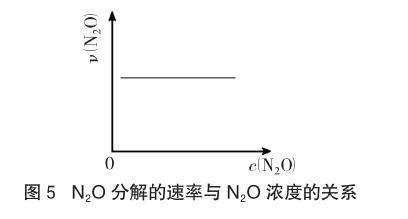


3 對理解教學的啟示
當下的化學教學降低了對化學事實性知識的學習要求,而是以提高學生科學素養為主旨,突出對知識學習的過程與方法的體驗和學科基本觀念的形成。在教學過程中教師不能只是通過背誦、記憶具體事實及概念原理讓學生對知識的理解停留在淺層次上,而是要讓學生對可遷移的核心概念和對更為根本的學科知識結構進行深層次的理解。事實性知識只是促進學生深入理解化學核心概念和基本原理的載體與工具,在教學中要讓具體知識的學習為學生學科觀念和學科思想發展提供支撐,這樣學生才能對知識有深層次和本質的理解。
例6 (2015廣東理綜,11題節選)一定溫度下,水溶液中H+和OH-的濃度變化曲線如圖6所示。
(2013年全國大綱卷,理綜12題節選)下圖(圖7)表示水中c(H+)和c(OH-)的關系。
(2013山東理綜,13題節選)某溫度下,向一定體積0.1mol/L醋酸溶液中逐滴加入等濃度的NaOH溶液,溶液中pOH{pOH=-lg[OH-]}與pH的變化關系如圖8所示,則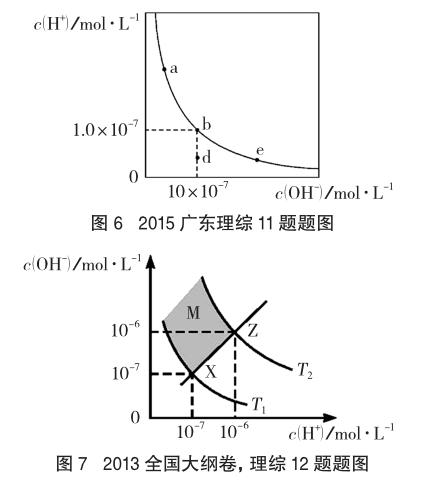
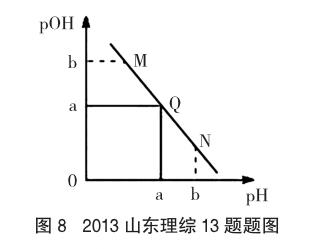
在溶液的酸堿性的教學過程中,為了要讓學生理解掌握溶液酸堿性的本質,可以采用數學圖像的手段。圖6所表示的是同一溫度下水溶液中c(H+)和c(OH-)之間的關系圖,屬于數學中的反比例函數圖像,c(H+)和c(OH-)數值的相對大小決定了溶液的酸堿性。圖7所表示的是不同溫度下水溶液中c(H+)和c(OH-)之間的關系圖,其中T1為常溫下的關系圖,T2為溫度高于常溫下(T1)的關系圖,若溫度低于常溫則其c(H+)和c(OH-)關系圖要低于常溫下(T1)的關系圖。象限的角平分線為中性線,在該線段上的點(X、Z)均為中性點,而在中性線的上方區域(M區)則為堿性區域,中性線的下方區域為酸性區域。為了加深學生對pH的理解,可以遷移類比到pOH。在圖8中pH與pOH為一次函數曲線,同樣,該曲線象限的角平分線為中性線,在該線段上的點均為中性點(Q點),而在中性線的上方區域(M點)則為酸性區域,中性線的下方區域(N點)為堿性區域。當圖8中a=7時,是常溫下的關系曲線,若高于常溫,則曲線位于常溫曲線的下方,若低于室溫,則曲線位于常溫曲線的上方。通過這一系列圖像的分析,學生對溶液酸堿性的實質有了更深入的理解。
我們還可以借用哲學中的矛盾觀來理解溶液的酸堿性,水溶液中的H+和OH-可以看作是一對矛盾,它們相互之間可以相互反應體現了矛盾的對立性和斗爭性,同時它們又同時存在于水溶液中,不會出現某一方的單方面的消亡,這體現了矛盾的統一性,它們相互依存,存在著此消彼長的辯證關系。
H+代表著酸性,OH-代表著堿性,這是矛盾的兩個方面,當c(H+)>c(OH-)時,酸性是矛盾的主要方面,而堿性是次要方面,即酸性是矛盾起主導作用的方面,所以顯酸性,反之當c(OH-)>c(H+)時,堿性是矛盾的主要方面,而酸性是次要方面,即堿性是矛盾起主導作用的方面,所以顯堿性,當c(H+)與c(OH-)相等時,則勢均力敵,達到一種平衡,所以溶液顯中性[7]。
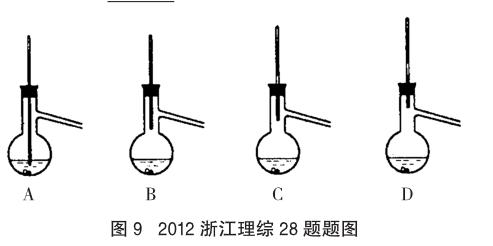
例7 (2012年浙江理綜,28題節選)(6)粗產品蒸餾提純時,下面裝置中溫度計位置正確的是 C ,可能會導致收集到的產品中混有低沸點雜質的裝置是 A、B 。
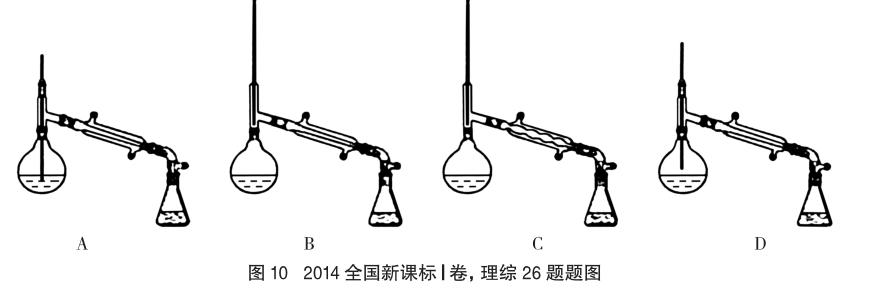
(2014年全國新課標Ⅰ卷,理綜26題節選)(6)在蒸餾操作中,儀器選擇及安裝都正確的是B (填標號)。
(2013年全國新課標Ⅰ卷,26題節選)(6)在環己烯粗產物蒸餾過程中,不可能用到的儀器有C、D (填正確答案標號)。
A.圓底燒瓶 B.溫度計
C.吸濾瓶 D.球型冷凝管 E.接收器
上述3道高考試題均考察了學生對蒸餾實驗的理解程度,這些問題啟示我們,如果在實驗教學中只是告訴學生事實性知識,學生是很難真正理解這些事實存在的緣由的,就不會對實驗有透徹的掌握。我們在實驗教學中應該引導學生多去思考一些為什么,如實驗中為什么要選用這樣的儀器?該儀器為什么這樣進行設計?為什么要這樣進行操作?若不這樣操作會產生怎樣的結果?在分析討論中學生對實驗才能做到真正的掌握。如在蒸餾實驗教學中,可由學生討論如下問題:(1)蒸餾時溫度計水銀球的位置應在哪里?為什么?(2)若溫度計的水銀球過高或過低會對實驗結果產生怎樣的影響?為什么?(3)在蒸餾裝置中冷凝的儀器選用直型冷凝管還是球型冷凝管?若采用球型冷凝管會產生怎樣的結果?(4)蒸餾時若無蒸餾燒瓶能否進行蒸餾操作?可選用怎樣的儀器?經過深度思考后,學生就不會把儀器的使用當作一種簡單的、孤立的操作。學生就會思考自己所進行的每個操作怎樣一步步達成實驗目的,從而使自己的操作符合系統性和規范性要求。
4 對教學中體現學科價值的啟示
化學是一門中心的、實用的、創造性的基礎學科,化學學科的發展對人類文明的進步作出了巨大的貢獻,在我們的教學中要責無旁貸地向學生滲透化學學科的價值,讓學生認同和熱愛化學這門學科。化學教學不僅要傳授給學生基本的化學知識、技能和方法,更重要的是要讓他們能從化學的視角去認識和關注科學、技術、社會和生活方面的問題。在高考中有很多將化學知識與生產、生活、社會、環境、能源、科技等方面相聯系的試題,這類試題考查了學生在真實情境中應用化學知識和技能解決問題的能力。因有貼近社會生活的素材為背景、有體現可持續發展的思想為問點,對培養學生的化學價值觀具有獨特的功能和價值。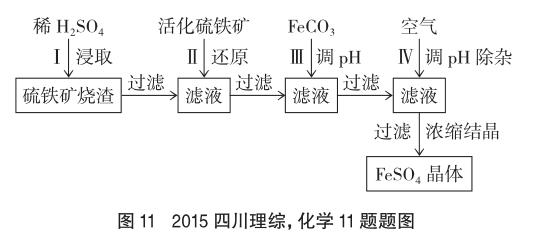
例8 (2015年四川理綜,化學部分,第11題節選)為了保護環境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦燒渣(鐵主要以Fe2O3存在)轉變成重要的化工原料FeSO4(反應條件略)。
(2015年浙江理綜,28題節選)某研究機構用CO2代替水蒸氣開發了綠色化學合成工藝——乙苯-二氧化碳耦合催化脫氫制苯乙烯。保持常壓和原料氣比例不變,與摻水蒸汽工藝相比,在相同的生產效率下,可降低操作溫度;該工藝中還能夠發生反應:CO2+H2=CO+H2O,CO2+C=2CO。新工藝的特點有 (填編號)。
(2015年重慶理綜,化學部分,第11題節選)我國古代青銅器工藝精湛,有很高的藝術價值和歷史價值,但出土的青銅器大多受到環境腐蝕,故對其進行修復和防護具有重要意義。
(3)研究發現,腐蝕嚴重的青銅器表面大都存在CuCl。關于CuCl在青銅器腐蝕過程中的催化作用,下列敘述正確的是 。
(4)采用“局部封閉法”可以防止青銅器進一步被腐蝕。如將糊狀Ag2O涂在被腐蝕部位,Ag2O與有害組分CuCl發生復分解反應,該化學方程式為 。
上述幾道試題中的情境素材體現了在循環使用資源、優化保護環境、改良創新技術、充分利用能源甚至考古等方面所涉及的化學知識,并且能夠將考察的知識寓于實際問題中。在分析試題的過程中,通過對素材的關注可讓學生領略和感受到學習化學的價值,在利用化學概念和原理與解決這些生產生活中的化學問題的過程中,不僅提高了學生解決實際問題的能力,通過引導還可使學生樹立正確的化學價值觀。在高考試題中的很多素材背景又可以拓展教師的視野,在平時教學中可以作為教學情境加以利用,不斷地去充實教學資源。
當我們仔細去研讀這些新課程高考下的試題時,總會讓我們有著不一樣的發現,總會給我們的教學帶來思考。如果我們只是去關注這些題目的解法、考察的知識和能力,將會使我們錯過它們所帶給我們的精彩和對改善化學教學的啟示。
參考文獻:
[1]劉卉,陶國宏,邵元華,寇元.功能化的離子液體在電化學中的應用[J].化學通報,2004,(11):795.
[2]王喜然,劉海洋. NaCl對離子液體中電解精煉鋁的影響[J].化學通報,2011,74(8):738~739.
[3][4][5]王祖浩主編.普通高中課程標準實驗教科書·化學反應原理(選修)[M].南京:江蘇教育出版社,2006:23,31.
[6]傅獻彩,沈文霞,姚天揚,侯文華.物理化學[M].北京:高等教育出版社,2006:173.
[7]李曉明.“溶液的酸堿性”創新教學設計[J].中學化學教學參考,2015,(8):27

