冷水浸泡對離心運動后大鼠骨骼肌衛星細胞的影響
張俊峰,毛旭娟,吳麗君,陳 昊
冷水浸泡對離心運動后大鼠骨骼肌衛星細胞的影響
張俊峰1,毛旭娟2,吳麗君3,陳 昊4
目的:探究運動訓練后冷水浸泡在促進機體功能恢復過程中是否會對肌衛星細胞產生影響。方法:68只雄性SD大鼠隨機分為對照組(C)、運動組(E)、運動冷水浸泡組(CWI),并根據取材時間點再分為0h、24h、48h、72h、120h等時相亞組。E和CWI組進行跑臺離心運動,其中CWI組運動后進行10℃冷水浸泡10min;蛋白免疫印記法檢測腓腸肌MyoD、Myogenin蛋白表達。結果:MyoD蛋白在C、E、CWI組之間均有顯著性差異(p<0.05),E組峰值出現在72h,CWI組峰值出現在48h;Myogenin蛋白在C和E、C和CWI組之間均有顯著性差異(p<0.05),但E和CWI之間未有顯著性差異(p>0.05),E組峰值出現在120h,CWI組峰值出現在72h。結論:離心運動后,大鼠骨骼肌MyoD和Myogenin的表達上調,運動后進行冷水浸泡能夠加快肌衛星細胞的增殖分化,這可能是冷水浸泡促進機能恢復的部分原因。
冷水浸泡;離心運動;肌衛星細胞;增殖分化
運動訓練中,大強度運動尤其是離心運動形式會導致運動性骨骼肌微細損傷(Exercise-Induced Muscle Damage,EIMD)[1],例如,Z盤變寬、出現模糊丟失甚至斷裂、肌節撕裂等情況,同時伴隨著氧化應激反應、炎癥反應、能源物質過量消耗以及神經疲勞等。如果采取合理的恢復措施,可以促進運動能力的恢復,使運動員以較快的時間進入更佳的競技狀態。在傳統的恢復措施中,有按摩、拉伸、針刺等方法。最近幾年出現一種備受關注的新興冷凍療法(簡稱冷療),有冷水浸泡、全身冷凍、冰敷、冰按摩等常見形式,經常作為運動員高強度訓練或是大運動量后的一種恢復措施,在促進運動員機能恢復中發揮了重要作用[2]。而在骨骼肌進行結構重塑與機能恢復過程中,骨骼肌衛星細胞發揮了重要作用。骨骼肌衛星細胞作為一種單核細胞,存在于肌膜與基底膜之間[3],在正常情況下處于無活性、未分化的靜止狀態,運動損傷、大負荷離心運動、注射毒素、冷刺激、熱刺激等均可促使激活、增殖、分化成為肌細胞最終融合成肌纖維,具有干細胞性質[4]。研究表明,MyoD可作為肌衛星細胞激活增值的標志,Myogenin可作為肌衛星細胞分化的標志[5]。目前,關于冷療作用效果的機理研究并不多,為了探究運動訓練后冷水浸泡在促進機體功能恢復過程中是否會對肌衛星細胞產生影響,本實驗以大鼠離心運動訓練建立模型,并進行冷水浸泡,觀察骨骼肌MyoD和Myogenin的變化,以探究冷水浸泡是否會對骨骼肌衛星細胞的增值分化產生影響,并對冷凍療法的機理進行初步探討。
1 材料與方法
1.1動物分組和干預方法
8周齡 SD大鼠 68只(健康雄性 SPF級別),體重220±7.1g,購買于北京華阜康生物科技股份有限公司,許可證編號:SCXK(京)2009-0007。大鼠進行隨機分組,分為對照組(Control,C組)6只、運動組(Exercise,E組)30只、運動冷水浸泡組(exercise plus cold water immersion,CWI組)30只,E組和CWI組再依據干預后的取材時間分為 0h、24h、48h、72h、120h等時相組。于北京體育大學動物飼養房中分籠飼養,每籠 4只,自由飲水進食,飼料嚴格用國家標準嚙齒類動物飼料,室內溫度為22±2℃,相對濕度30%-60%,光照12h+黑暗12h模擬晝夜交替,大鼠適應性飼養 3天以后,進行相應后續實驗。本實驗運動方案參照Armstrong的離心運動模型[7],在大鼠進行適應環境3d后,其中C組不運動,E組和CWI組大鼠進行適應性跑臺訓練:第1天跑臺坡度0°,跑速16m/min,時間5min;第2天跑臺坡度0°,跑速16m/min,時間10min;第3天進行休息,第4天開始正式實驗,坡度-16°,跑速16m/min,每次訓練時間90min。CWI組用Camargo等人[7]的冷水浸泡方法,在運動后即刻把大鼠放進冷水當中自由游泳10min,溫度控制在10℃,溫度計監控水溫,并隨時進行溫度調控,之后擦干皮毛放回籠中。
1.2標本采集
正式實驗結束后,按相應的時相進行分批取材,大鼠稱重后用戊巴比妥鈉進行腹腔麻醉處理,腹主動脈取血,分離出大鼠腓腸肌,錫紙包裹好并標記,投入液氮后轉存到-80℃冰箱保存。
1.3Western Blot 方法測定MyoD和Myogenin蛋白含量
取腓腸肌進行液氮研磨,按1:9比例(g/ml)加入RIPA裂解液(北京普利萊基因技術公司),4℃、12000rpm離心20min,取上清液,蛋白濃度測定采用BCA(Pierce公司)法進行測定,樣品與試劑盒BCA工作液進行混勻,之后37℃孵育30min,酶標儀進行數據讀取。按照濃度曲線計算各樣品的濃度,根據測定的蛋白濃度進行樣品調整,使其濃度統一,樣品95℃煮10min進行蛋白變性,-80℃存儲備用。制膠濃度為濃縮膠4%,分離膠10%,電泳分離出內參蛋白β-actin(Santa Cruz公司)和目的蛋白 MyoD(abCam)、Myogenin(Millipore),蛋白轉到PVDF膜上,麗春紅預染,TBST搖床清洗,4℃封閉過夜(5%BSA),一抗和二抗均用5%BSA稀釋,內參蛋白室溫孵育2h,濃度1:3000,MyoD蛋白4℃過夜,濃度1:2000,Myogenin蛋白4℃過夜,濃度1:3000。TBST洗膜5min*6次。二抗選用辣根過氧化物酶標記羊抗兔IgG(北京中杉金橋生物技術有限公司)濃度1∶ 8000,室溫搖床1.5h,TBST 5min*6次洗脫,取相同體積量的超敏發光液A液和B液進行混合,并滴加到膜上,使充分與發光液接觸,去除氣泡,吸去多余的發光工作液,將膜置于凝膠成像系統內,室溫反應適當時間進行顯像。Gel-pro軟件進行相應的條帶灰度值分析。
1.4數據統計
測試結果以均數±標準差來表示,采用多因素方差分析(Two-Way Classification ANOVA),對處理因素(安靜,運動,運動冷水浸泡)和時相因素(0h、24h、48h、72h、120h)進行主效應檢驗以及交互作用分析,顯著性水平取p<0.05。
2 實驗結果
2.1骨骼肌中MyoD的變化
如表1、圖1所示,從均值的變化可發現,E組和CWI組的變化形式基本一致,均是連續上升后下降趨勢,并且兩組在48h之前都是上升。其中E組峰值出現在72h,CWI組趨勢與E組基本相同,峰值出現在48h,提示,運動后進行冷水浸泡能夠促使MyoD的峰值提前。通過對處理因素和時相因素進行雙因素方差分析,結果發現,主效應分析均有顯著性差異(p<0.05)。對處理因素進行事后多重檢驗發現,C、E、CWI組之間兩兩比較均有顯著性差異(p<0.05)。提示,運動后相對于安靜組MyoD有明顯變化,并且運動后進行冷水浸泡也能夠起到顯著作用。
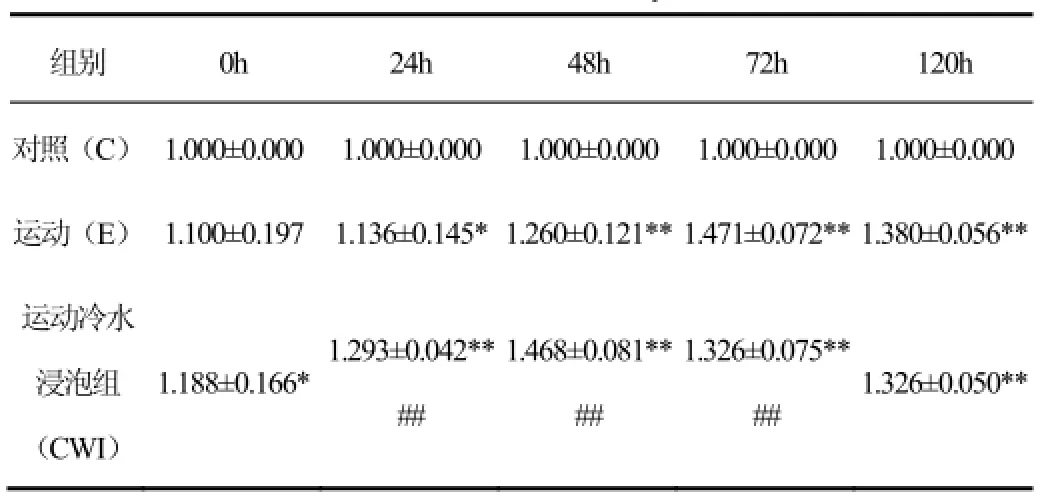
表1 離心運動后及冷水浸泡之后MyoD的蛋白表達情況
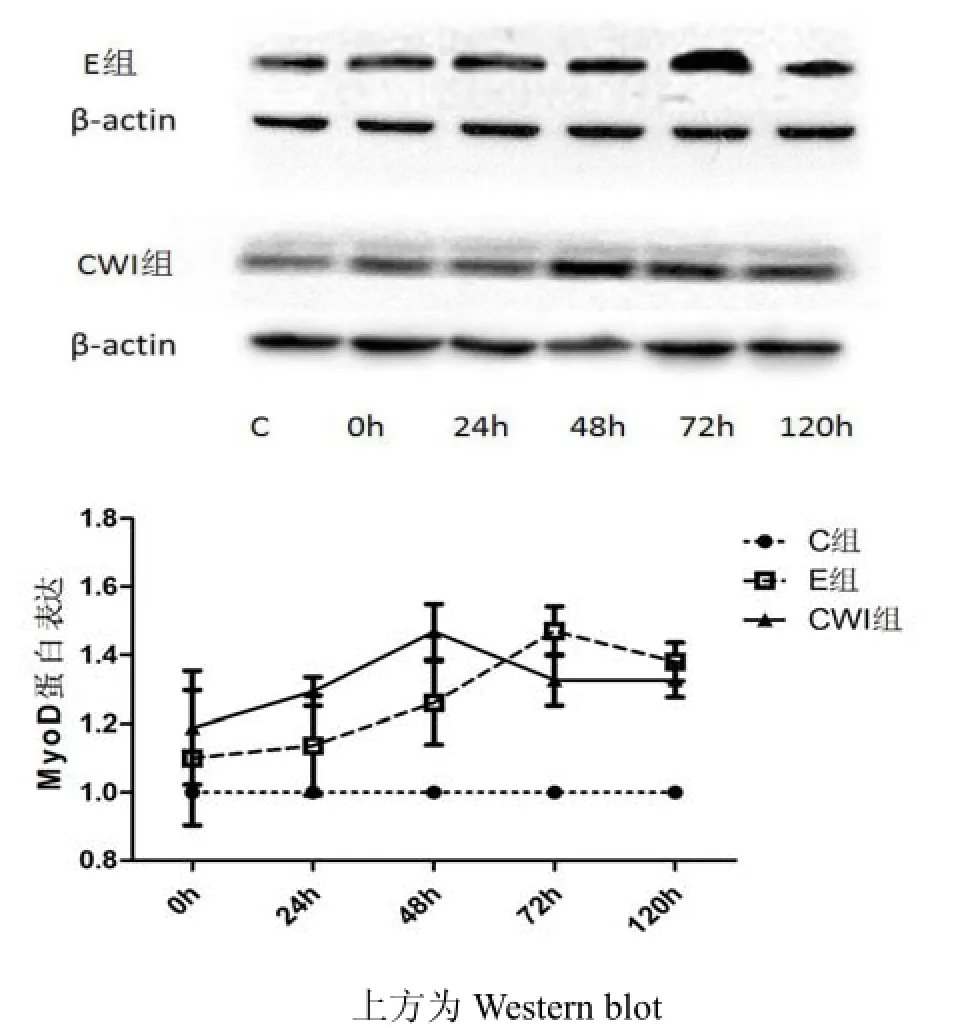
圖1 各組MyoD蛋白表達變化
2.2骨骼肌中Myogenin的變化
從均值的變化趨勢可發現,E組和CWI組的變化基本一致,出現連續升高趨勢。在24h和72h均出現較為明顯的升高,其中E組峰值出現在120h,CWI組峰值出現在72h。提示,運動后進行冷水浸泡能夠促使Myogenin的峰值提前。通過對處理因素和時相因素進行多因素方差分析,結果發現,主效應分析均有顯著性差異(p<0.05)。對處理因素進行事后多重檢驗發現C和E、C和CWI組之間兩兩比較均有顯著性差異(p<0.05),但E和CWI之間未有顯著性差異(p>0.05)。提示,運動后 Myogenin相對于安靜組有明顯變化。
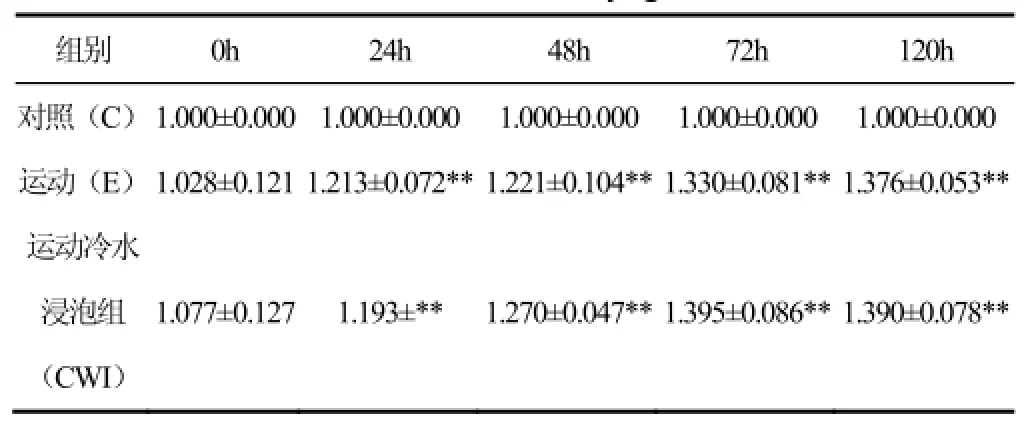
表2 離心運動后及冷水浸泡之后Myogenin的蛋白表達情況
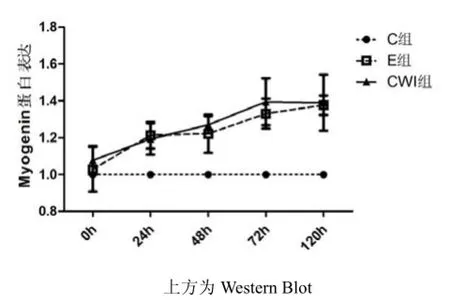
圖2 各組Myogenin蛋白表達變化
3 討論部分
肌衛星細胞包繞骨骼肌細胞,位于肌膜與基底膜之間,是骨骼肌損傷后進行修復再生肌纖維的主要來源。研究表明,骨骼肌衛星細胞在正常情況下是處于未激活狀態,生肌調節因子(MRFs)的表達較少,當機體大負荷運動尤其是不適應的運動方式時,會造成骨骼肌微細結構的損傷,并出現微循環障礙和代謝紊亂等情況,并導致部分肌纖維壞死和凋亡,巨噬細胞開始進行吞噬。之后 MRFs開始表達,并引起微細損傷部位肌衛星細胞激活、增殖,在肌衛星細胞進行幾個循環的增殖階段后多數進入分化期,最后融合成為新的肌纖維或是進入損傷部位直接進行修復。而其余未分化的肌衛星細胞則會退出細胞的周期進行自我更新,以此來填充肌衛星細胞池,用于維持數量的穩定[8]。生肌調節因子 MRFs家族能夠精細調節骨骼肌衛星細胞的增殖分化等,是其發揮功能的重要調節因子。MyoD和myogenin均屬于MRFs家族中的一員,MyoD在快肌纖維中表達較多,能夠激活肌衛星細胞,在定向分化為成肌細胞的過程中發揮重要作用,可作為肌衛星細胞激活增值的標志。myogenin在慢肌中表達較多,表達峰值要晚于MyoD,是肌細胞終末分化的調節因素,在肌管融合以及肌纖維成熟的過程中起重要作用,可作為肌衛星細胞分化的標志[5、9、10]。腓腸肌作為紅白混合型肌纖維,因此在本研究中選用腓腸肌作為實驗取材部位。
3.1離心運動后進行冷水浸泡對骨骼肌MyoD影響
陳彩珍等人[11]對小鼠進行耐力訓練和抗阻訓練,之后進行MyoD和Myogenin的mRNA的檢測。研究發現,兩種訓練方式均能提高MyoD和Myogenin的表達,尤其是抗阻訓練組升高的幅度更大。Costs等人[12]研究發現,進行反復性的離心運動后第3天,MyoD的表達并未上升反而出現下降趨勢,而Myogenin出現顯著增加。在曾纓的研究中發現,注射大鼠骨骼肌后造成肌肉損傷,在修復過程中MyoD在損傷后的18h開始表達,推測在Costs的實驗中出現此種結果的原因可能是MyoD表達峰值已過,而Myogenin正處于峰值階段。Kvorning等人[13]對22名男性進行8周的力量訓練后,發現Myogenin的表達增加。
在以往的研究中均發現進行運動訓練后MyoD出現不同程度的變化,并且研究結果并不統一,主要是與運動模型的設計以及干預方法不同有關,在骨骼肌衛星細胞的激活增殖過程中,往往是和外界刺激導致骨骼肌的損傷程度有關,在一定程度上運動模型導致骨骼肌微細結構損傷的程度決定了研究對象中MyoD的變化幅度以及峰值時相的變化。需要說明的是在本研究中發現,在運動后和運動冷水浴組即刻均發現有少量的MyoD進行表達,說明在長時間的訓練過程中已經有部分肌衛星細胞表達MyoD。在運動組腓腸肌中的 MyoD表達始終高于安靜組,峰值出現在72h,表明在大負荷離心運動后大鼠骨骼肌衛星細胞開始出現增殖,這與以往的研究相似。運動后進行冷水浸泡,發現MyoD的變化趨勢與E組基本相同,峰值出現在48h,表明運動后進行冷水浸泡能夠促使肌衛星細胞的增殖提前。冷水浸泡能夠對肌衛星細胞產生作用可能是由于冷水刺激導致IL-6和TNF-α等炎癥因子產生變化,而這些炎癥因子均會對MyoD產生作用[14]。不足的是本研究并未對炎癥因子進行深層次的相關探究。
3.2離心運動后進行冷水浸泡對骨骼肌Myogenin影響
Kadi等人[15]研究Myogenin在耐力訓練中的變化,進行功率自行車練習,免疫組化結果表明,Myogenin在練習腿中累積較多,而在非練習腿中幾乎未見表達。Eksteen等人[16]對優秀長跑運動員進行了 4周上坡跑和下坡跑訓練,結果發現,運動員骨骼肌中MyoD和Myogenin均有明顯的增加,其中下坡跑略高于上坡跑。Siu等人[17]對大鼠進行耐力運動訓練8周后研究發現,比目魚肌中的Myogenin mRNA和蛋白的表達均升高。
在本研究中發現,運動組腓腸肌中Myogenin表達始終高于安靜組,峰值出現在 120h,表明在大負荷離心運動后大鼠骨骼肌衛星細胞開始出現分化情況,這與以往的研究相似。在運動組和冷水浸泡組均能發現Myogenin在0h-24h有明顯的增加,而在較短的時間內肌衛星細胞進行增殖然后再進行分化的可能性不大,可能是由于部分肌衛星細胞直接進入分化階段有關,而并未再進入增殖階段,這和Adams等人的觀點相似[18]。運動后進行冷水浸泡,發現Myogenin峰值出現在72h,表明運動后進行冷水浸泡能夠促使肌衛星細胞的分化提前。但在多因素方差分析中并未發現E組和CWI組有顯著性差異,可能是由于時相點太少,肌衛星細胞的分化才剛開始增強,還并未達到最明顯的程度,若是增加后續的時相點可能會出現明顯的差異。本實驗中冷水浸泡能夠促使肌衛星細胞分化提前,可能是由于冷水刺激使增殖提前出現,導致后續的分化也受到影響,也可能是炎癥因子或是其他因子的直接作用,這些都需要進一步的研究驗證。
進行不習慣的運動,尤其是離心運動會導致骨骼肌的微細損傷,像T管、肌原纖維、骨骼肌骨架系統等超微結構改變,并伴隨著骨骼肌功能下降,影響運動能力。因此,大負荷訓練后如何加速恢復骨骼肌功能,成為提高運動成績的重要保障。較多研究表明,運動后進行冷水浸泡能夠促進骨骼肌的機能恢復,而在這一過程中肌衛星細胞具有重要作用。肌衛星細胞經過一系列的精密有序的調控,被激活后進行增殖、分化最終融合為肌纖維。在本實驗中,能夠發現運動后進行冷水浸泡會導致骨骼肌衛星細胞提前出現增殖,并且加速了衛星細胞分化的進程,在時程上來看,進行冷水浸泡能夠促使骨骼肌提前進入微細結構的恢復,這在一定程度上能夠加快運動員機能的恢復。
4 結 論
離心運動后,大鼠骨骼肌MyoD和Myogenin的表達上調,運動后進行冷水浸泡能夠加快肌衛星細胞的增殖分化,這可能是冷水浸泡促進機能恢復的部分原因。
[1] Howatson G,van Someren KA. The Prevention and Treatment of Exercise -Induced Muscle Damage. Sports Med,2008,38(6):483~503.
[2] 檀志宗,劉新宇,李 男,等. 冷凍療法在運動領域中的研究進展[J]. 體育科研,2014(04).
[3] Montarras, D. et al. Direct isolation of satellite cells for skeletal muscle regeneration.Science ,2005,309, 2064~2067.
[4] Gwéna?lleBegue, AymericDouillard, Olivier Galbes, Bernadette Rossano, Barbara Vernus, Robin Candau, Guillaume Py. Early activation of rat skeletal muscle IL-6/STAT1/STAT3 dependent gene expression in resistance exercise linked to hypertrophy[J]. Plos One, 2013, 8(2): 65~65.
[5] Asakura A,Hirai H,Kablar B,et al. Increased survival of muscle stem cells lacking the Myo D gene aftertransplantation into regenerating skeletal muscle.ProcNatlAcadSci USA,2007,104(42):16552~16557.
[6] Armstrong RB, Ogilvie RW, Schwane JA. Eccentric exercise-induced injury to rat skeletal muscle[J].J ApplPhysiolRespir Environ Exerc Physiol, 1983, 54(1): 80~93.
[7] Camargo M Z, Preti M C P, Nakamura F Y, et al. Effects of light emitting diode (LED) therapy and cold water immersion therapy on exercise-induced muscle damage in rats.[J]. Lasers in Medical Science, 2012, 27(5): 1051~1058.
[8] Rhoads R P, Fernyhough M E, Liu X, et al. Extrinsic regulation of domestic animal-derived myogenic satellite cells II[J]. Domestic Animal Endocrinology, 2009, 36(3): 111~26.
[9] Hughes S M, Taylor J M, Tapscott S J, et al. Selective accumulation of MyoD and myogenin mRNAs in fast and slow adult skeletal muscle is controlled by innervation and hormones.[J]. Development, 1993,118(4): 1 137~1 147.
[10] Haruka Kodama M D, Yoshihiko Kumai MD PhD,KoheiNishimoto MD PhD, et al. Modulation of satellite cells activity and MyoD in rat thyroarytenoid muscle after reinnervation[J]. Laryngoscope, 2015, 125(7): E245~E251.
[11] 陳彩珍,盧 健. 抗阻訓練與耐力訓練對小鼠腓腸肌衛星細胞激活作用的影響[J]. 成都體育學院學報,2014,40(4):55~59.
[12] Costa A, Dalloul H, Hegyesi H, et al. Impact of repeated bouts of eccentric exercise on myogenic gene expression[J]. European Journal of Applied Physiology, 2007, 101(4): 427~436.
[13] Hospital H, Citationformats.Suppression of testosterone does not blunt mRNA expression of myoD, myogenin, IGF, myostatin or androgen receptor post strength training in humans.[J]. Journal of Physiology, 2007, 578(2): 579~593.
[14] Warren GL; Hulderman T; Jensen N; McKinstry M; Mishra M; Luster MI; Simeonova PP. Physiological role of tumor necrosis factor alpha in traumatic muscle injury.[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2002, 16(10): 1 630~1 632.
[15] Kadi F, Johansson F, Johansson R, et al. Effects of one bout of endurance exercise on the expression of myogenin in human quadriceps muscle.[J]. Histochemistry& Cell Biology, 2004, 121(4):329~334.
[16] Eksteen GJ. Satellite cell proliferation in response to achronic laboratory controlled uphill vs. downhill intervaltraining intervention. University of Stellenbosch Degree of Master, 2006.
[17] Siu P M, Donley D A, Bryner R W, et al. Myogenin and oxidative enzyme gene expression levels are elevated in rat soleus muscles after endurance training.[J]. Journal of Applied Physiology, 2004, 97(1):277~85.
[18] Adams G R, Haddad F, Baldwin K M. Time course of changes in markers of myogenesis in overloaded rat skeletal muscles[C]// J Appl Physiol. 1999: 1705~12.
Effects of Cold Water Immersion on Skeletal Muscle Satellite Cellsin Rats After Eccentric Exercise
ZHANG Junfeng1, MAO Xujuan2, WU Lijun3, et al
Objective: The aim of this study is to observe the effects of eccentric exercise and cold water immersion on the skeletal muscle satellite cells. Methods 68 male SD rats were randomly divided into control group (C), exercise group (E) and exercise plus cold water immersion group (CWI). Rats in groups E and CWI were submitted to downhill running on a treadmill. Rats in groups CWI received cold water immersion (10℃, 10min) therapy immediately after running. Protein expressions of Myo D, my ogenin were detected by western blot. Results: The MyoD protein was significantly different from group C, E ,CWI(P< 0.05),and peaked at 72h in group E and 48h in group CWI; The Myogeninprotein was significantly different from group C and E ,C and CWI(P<0.05), notsignificantly different from group E and CWI(p>0.05), and peaked at 120h in group E and 72h in group CWI. Conclusion eccentric exercise may up-regulate MyoD and myogeninprotein expression,to speed up the muscle satellite cells proliferation and differentiation after cold water immersion,this is part of the reason that promoted the functional recovery .
Cold water immersion; Eccentric exercise; Skeletal muscle satellite cells; Proliferation and differentiation
G804.7
A
2016-01-04
1.山西體育職業學院社會體育系,山西 太原,030006;2.山西職工醫學院基礎部病理生理教研室,山西 太原,030012;3.山西大學體育學院,山西 太原,030006;4.北京體育大學運動人體科學學院,北京,100084。1.Dept of Social Sports, Shanxi Physical Vocational College,Taiyuan Shanxi, 030006, China;2. Shanxi Medical College for Continuing Education, Taiyuan Shanxi, 030012, China;3. Shanxi University, Taiyuan Shanxi, 030006, China;4. Beijing Sport University, Beijing, 100084, China.

