可用于功能性成分研究的Caco-2細胞中空纖維反應器的構建
徐冬冬, 楚強, 楊蕓蕓, 呂相敏, 章燕珍, 鄭曉冬*
(1.浙江大學生物系統工程與食品科學學院,杭州 310058;2.浙江大學醫學院附屬第二醫院,杭州 310009)
?

可用于功能性成分研究的Caco-2細胞中空纖維反應器的構建
徐冬冬1, 楚強1, 楊蕓蕓1, 呂相敏1, 章燕珍2, 鄭曉冬1*
(1.浙江大學生物系統工程與食品科學學院,杭州 310058;2.浙江大學醫學院附屬第二醫院,杭州 310009)
為了構建一種新型的Caco-2細胞中空纖維膜反應器,探究該模型應用于研究功能性成分吸收轉運的可行性,利用體外細胞培養技術,將Caco-2細胞接種于聚醚砜(polyethersulfone, PES)和聚偏氟乙烯(polyvinylidenefluoride, PVDF)中空纖維膜上,與經典的Transwell單層培養模型進行比較,探討不同材料對細胞模型的影響;同時,利用光學顯微鏡和掃描電鏡觀察細胞形態學特點,通過細胞功能表征方法,包括用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽比色法繪制細胞生長曲線,熒光免疫染色觀察驗證細胞單層的完整性和通透性,測定細胞的堿性磷酸酶和谷氨酰轉肽酶活性來驗證細胞的刷狀緣酶系活性,從而對Caco-2細胞在3維中空纖維反應器與2維模型中的增殖分化狀況進行對比和評價。細胞形態學觀察結果表明:Caco-2細胞于接種10 d后鋪展良好,輪廓清晰,逐漸融合形成細胞單層和完整的緊密連接;刷狀緣酶系活性檢測表明:Caco-2細胞于接種后8~14 d內完成功能分化并且活性水平高于在Transwell模型上培養的細胞。因此,聚醚砜和聚偏氟乙烯中空纖維膜能有效促進細胞增殖,縮短細胞分化周期,從而形成高效穩定的3維細胞模型;同時,中空纖維膜Caco-2細胞3維反應器已經具備甚至高于傳統的Transwell單層模型所具有的功能。
Caco-2細胞; 中空纖維; Transwell模型; 聚醚砜; 聚偏氟乙烯
Summary Human colon carcinoma cell line Caco-2 has been extensively used over the last thirty years as a model of the intestinal barrier. The parental cell line undergoes a process of spontaneous differentiation that leads to the formation of a monolayer of cells, expressing several morphological and functional characteristics of the mature enterocyte. Hollow fiber membrane bioreactors can offer aninvivo-like microenvironment for adherent cell types, such as Caco-2 cells, and enable a high quantity of the desired cellular product with less population variation and favorable operation costs.
The objective of this study is to construct a novel Caco-2 cell hollow fiber membrane bioreactor, to explore the feasibility for further application by morphological observation and functional test of Caco-2 cells.
In this experiment, the Caco-2 cells were cultured in polyethersulfone (PES) and polyvinylidenefluoride (PVDF) hollow fiber membranes as well as the classic Transwell culture plate. The morphological features of the cells were observed by optical microscope and scanning electron microscope (SEM), and the cell growth characters were examined by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT). Meanwhile, the integrity of the cell monolayer was verified by fluorescence microscopy. The polarization and compactification of the monolayer was determined by brush border enzymatic activity, including the activities of alkaline phosphatase andγ-glutamyltransferase. In this way, the proliferation and differentiation of Caco-2 cells were compared and evaluated in three-dimensional hollow fiber bioreactor and two-dimensional models.
Subsequently, time-dependent morphological observation of cell layers indicated that the Caco-2 cells cultured on hollow fiber, spread well and showed clear outline, and gradually formed confluent monolayer within 10 days. The brush border enzymes were well differentiated with higher expressed function within 8-14 days compared to the traditional model, and all of them tended to be consistent in the late cultivation.
In conclusion, both the PES and PVDF hollow fiber membranes can effectively accelerate the proliferation and differentiation of Caco-2 cells during the 21-day culture period, resulting in the construction of a highly stable three-dimensional cell model. Eventually, the three-dimensional Caco-2 cell hollow fiber membrane bioreactors of PES and PVDF are successfully constructed, and the model has advantages over the traditional Transwell monolayer model.
Caco-2細胞是人源結腸腺癌細胞,同源性好,生命力強,經過3周左右的培養后,可形成連續的細胞單層,并在形態和功能上分化出接近成熟小腸上皮細胞的狀態[1],也相應表達出類似小腸上皮細胞的水解酶(如麥芽糖酶、乳糖酶、氨基肽酶等)的作用。
作為附著依賴性細胞,單層貼壁培養模型是Caco-2細胞最常見的培養模型。為了改善極性細胞培養情況,HUBATSCH等[2]將Caco-2細胞培養在覆有透過性微孔濾膜的插入式嵌套培養板上,如圖1所示。被培養在半透過性濾膜上的Caco-2細胞單層將整個培養體系分成了頂膜側(apical side)和基底膜側(basolateral side),化學物質由頂膜側進入體系,通過檢測基底膜側被測物質的濃度即可進行物質吸收、轉運及代謝研究[3]。較為經典的產品有Transwell?、Millicell?等。
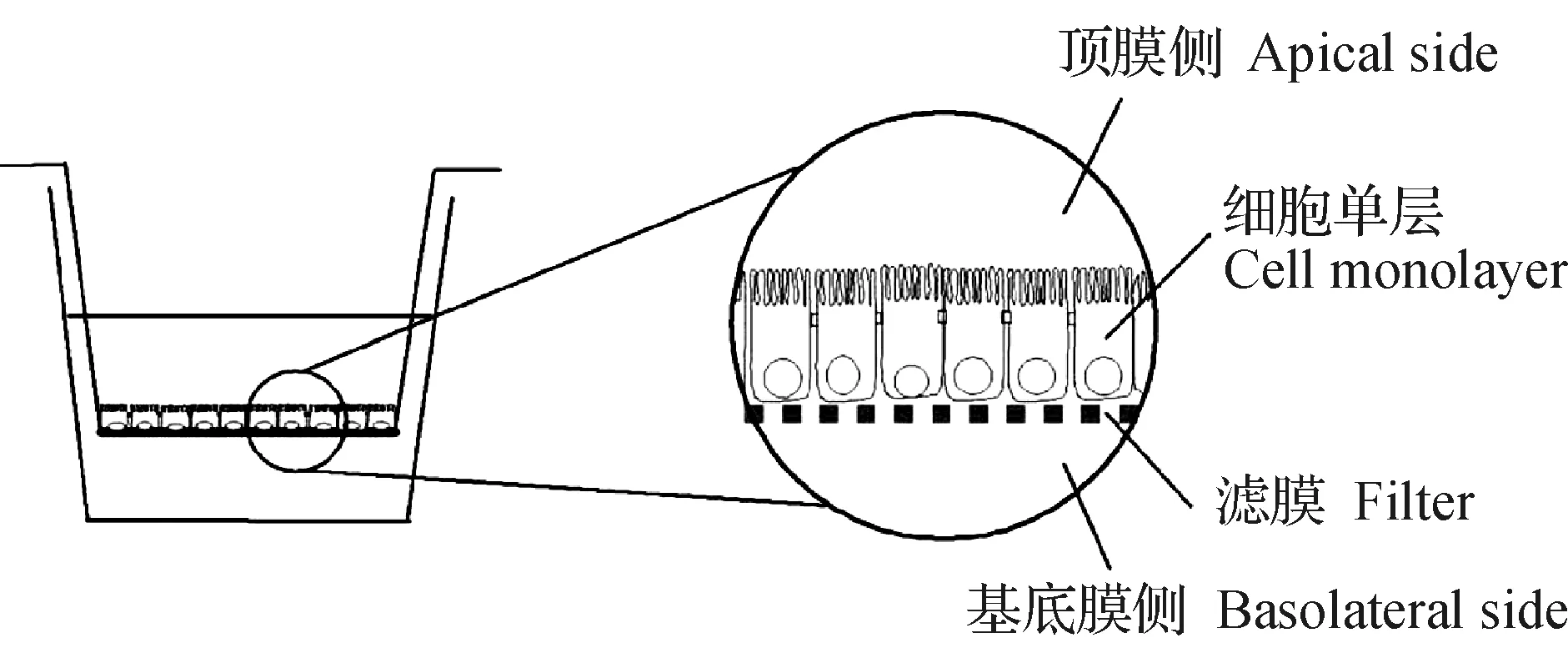
圖1 Caco-2細胞單層培養模型[2]Fig.1 Caco-2 cell monolayer model[2]
中空纖維是一種由微濾膜材料制成的細微管狀結構,如圖2所示,管壁是極薄的半透膜;每根纖維具有很高的比表面積,其構造類似于動物的毛細血管,可以為貼壁細胞提供類似體內的微環境[4]。膜上的微孔結構使離子和營養物質可以穿過膜到達細胞單層的兩側,避免了培養液流動而產生的不良應力

A: 橫截面;B:聚醚砜中空纖維膜內表面;C:聚偏氟乙烯中空纖維膜內表面.A: Cross-section of hollow fiber; B and C: Inner surface of polyethersulfone (PES) and polyvinylidenefluoride (PVDF) hollow fibers, respectively.圖2 中空纖維膜結構Fig.2 Structure of hollow fiber
影響,從而使細胞以更為自然的方式進行代謝。同時,通過中空纖維膜構建的細胞培養環境溫和,培養細胞密度較高,可達1×107~1×108mL-1[5]。
Caco-2細胞模型常被應用于口服藥物的攝取、吸收轉運以及毒性研究[6-7],近年來也被大量應用于氨基酸、核苷酸、微量元素等營養素的小腸吸收機制[8]以及丙烯酰胺等毒性成分的研究[9]。傳統的單層細胞模型與正常腸道存在較大差異,而采用中空纖維構建的生物反應器在形態上更接近小腸的管腔結構,可以為Caco-2細胞提供大量中空纖維間的孔隙作為生長空間,增加了Caco-2細胞與培養基的接觸面積,有利于物質交換[10],進而可以縮短細胞的培養分化周期,從而更好地應用于口服藥物以及功能性成分的小腸吸收機制研究。
本文構建了3維Caco-2中空纖維反應器模型,通過對比聚醚砜(polyethersulfone, PES)和聚偏氟乙烯(polyvinylidenefluoride, PVDF)中空纖維培養環境與傳統Transwell模型的差別,研究不同材料和構型對Caco-2細胞增殖分化的影響,為建立可靠、穩定的Caco-2細胞模型并用于食品功能性成分的吸收、轉運研究提供依據。
1 材料與方法
1.1材料與試劑
Caco-2細胞(由中國科學院上海細胞生物學研究所提供,30~60代);聚醚砜親水性中空纖維微濾膜(孔徑0.1 μm,在0.1 MPa下純水通量為1 000 L/(m2·h),內/外徑0.8 mm/1.4 mm)、聚偏氟乙烯親水性中空纖維微濾膜(孔徑0.2 μm,在0.1 MPa下純水通量為800 L/(m2·h),內/外徑0.7 mm/1.3 mm)(天津森諾過濾技術有限公司);Transwell聚碳酸酯膜細胞培養小室(Cat.No.3415,美國Corning公司)。
DMEM高糖培養基、胰蛋白酶(美國Gibco公司);胎牛血清(美國Hyclone公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT](美國Sigma-Aldrich公司);Ⅰ型鼠尾膠原(美國Corning公司);赫斯特熒光燃料33342(上海晶純生化科技股份有限公司);ZO-1免疫熒光染色試劑盒(武漢博士德生物工程有限公司);堿性磷酸酶試劑盒(上海碧云天生物技術研究所);γ-谷氨酰轉肽酶試劑盒(北京索萊寶科技有限公司)。
1.2儀器
超凈臺(SW-CJ-2D型,江蘇省蘇州市凈化設備公司),冷凍微量離心機(Legend Micro 17R,美國Thermo公司),5% CO2恒溫培養箱(BB15,美國Thermo公司),立式壓力蒸汽滅菌鍋(MLS-3750,日本Sanyo公司),倒置相差顯微鏡(IX2-SLP,日本Olympus公司),酶標儀(SpectraMAX PLUS 384,美國分子儀器公司),熒光顯微鏡(AX10,德國Zeiss公司),掃描電子顯微鏡(TM-1000,日本Hitachi公司),步進電機及其控制器和驅動系統(上海四宏電機有限公司)。
1.3細胞培養
將Caco-2細胞接種于細胞培養瓶中,加入含10%胎牛血清的DMEM高糖培養基,然后置于37 ℃、5% CO2培養箱中培養;隔天換液,當細胞達到約80%~90%融合時(約2~3 d),用胰酶消化并按一定比例進行傳代。
1.4Caco-2細胞單層培養模型的構建
在接種細胞前用0.75 mg/mL的Ⅰ型鼠尾膠原溶液鋪被Transwell小室的頂膜側濾膜,晾干后將處于對數生長期的Caco-2細胞以1.5×105cm-2的密度接種于濾膜上,基底膜側加入DMEM培養基;接種后隔天換液,1周后每天換液,培養21 d。
1.5Caco-2細胞3維培養模型的構建
將中空纖維切成3 cm小段,浸入磷酸鹽緩沖溶液(phosphate-buffered saline,PBS)中,通過蒸汽高壓滅菌后在超凈臺上鋪開風干。在接種細胞前,先用0.1%乙酸溶液配置0.75 mg/mL鼠尾膠原溶液,注入中空纖維內腔,靜置于6孔板中待膠原凝固。試驗時,將密度為5×106mL-1的Caco-2細胞懸液注入中空纖維內腔,置于37 ℃培養箱中,使用步進電機驅動系統連續運轉,使中空纖維沿軸向旋轉,便于細胞均勻貼附;旋轉4 h后,將培養有細胞的中空纖維置于6孔板中,每孔加入2~3 mL培養基,每天輕微晃動培養板,每1~2 d更換一次培養基,培養21 d。
1.6細胞形態學觀察
于倒置相差顯微鏡下觀察培養瓶中的細胞生長狀態,了解其生長習性并記錄拍照。
將生長于中空纖維上的細胞單層用戊二醛固定并用乙醇梯度脫水處理后,于掃描電子顯微鏡下觀察Caco-2細胞在中空纖維膜內表面的生長狀況和細胞單層形成情況。
用10 μg/mL Hoechst 33342熒光染料溫育中空纖維內腔的Caco-2細胞,棄去染料溶液,并用PBS漂洗后剖開中空纖維,迅速置于倒置熒光顯微鏡(紫外激發光)下通過細胞核觀察Caco-2細胞的生長和分布情況。
1.7MTT試驗
將接種有Caco-2細胞的中空纖維取出,放入新的6孔板中,用PBS漂洗;將配好的MTT溶液注入中空纖維,然后將該6孔板置于培養箱中反應3~4 h,使MTT還原為藍紫色甲臜結晶并沉積在細胞中,然后用PBS漂洗2次,將中空纖維剖開觀察結晶情況,再加入含有0.1% HCl的異丙醇溶液萃取10 min,得到藍紫色萃取液;設置波長為570 nm,測該萃取液的吸光度值。
1.8刷狀緣酶系檢驗
取出中空纖維置于新的6孔板中,用PBS漂洗,將中空纖維剖開剪碎,用0.5% Trition X-100溶液(經PBS稀釋)進行裂解,必要時可進行超聲或振蕩處理;30 min后收集裂解液,將樣品置于-80 ℃冰箱中凍存。根據試劑盒說明操作并測得標準品和樣品的吸光度值,根據酶活性的定義計算出樣品中堿性磷酸酶(alkaline phosphatase,ALP)和谷氨酰轉肽酶(γ-glutamyl transpeptidase,γ-GT)的活性。
1.9ZO-1蛋白熒光染色試驗
將培養有Caco-2細胞的中空纖維膜和Transwell嵌套小室從培養箱中取出,用PBS漂洗,隨后用預先配好的4%多聚甲醛溶液浸泡,于4 ℃冰箱中放置過夜以固定細胞,之后用PBS溶液緩慢清洗3次,再用混合有1%胎牛血清和0.2% Trition X-100的PBS溶液于室溫下浸潤90 min,以封閉樣品;用鵝抗兔IgG-CY3抗體對封閉后的樣品染色,于37 ℃環境下放置90 min;最后用PBS緩慢清洗后迅速置于熒光顯微鏡下觀察,紅色熒光的激發波段和發射波段分別為510~560 nm和>590 nm。
1.10數據統計分析
試驗數據使用Excel 2013和SPSS 19.0軟件處理,以均數±標準差表示。組間先進行方差分析,方差齊性用t檢驗,方差不齊用t′檢驗,P<0.05表示差異具有統計學意義。
2 結果與分析
2.1Caco-2細胞生長曲線(MTT法)
通過MTT試驗來表征不同材料的中空纖維反應器和Transwell單層培養模型中Caco-2細胞琥珀酸脫氫酶活性,即在570 nm處的吸光度值。如圖3所示,中空纖維反應器和Transwell單層模型呈現出相似的變化趨勢(P>0.05)。在前9~10 d細胞的總琥珀酸脫氫酶活性不斷增長,而在隨后1周內總體上基本維持穩定水平,在細胞增長分化末期呈現出一定的衰減。其原因可能是在細胞大量增長融合后,由于生存空間有限而使細胞間形成了接觸抑制,隨后,其細胞內的大量營養物質和能量被用于功能分化,因而代表線粒體功能的琥珀酸脫氫酶有所減弱。

圖3 Caco-2細胞在Transwell插入式濾膜、PES和PVDF中空纖維膜上培養的MTT結果Fig.3 MTT value of Caco-2 cells cultured on the surface of Transwell insert, PES and PVDF hollow fibers
2.2Caco-2細胞掃描電鏡觀察
在21 d培養周期內,Caco-2細胞在PES和PVDF中空纖維內表面的生長融合狀態見圖4和圖5。在培養前期,Caco-2細胞增殖明顯,逐漸形成細胞單層,覆蓋了中空纖維膜內表面;而在培養后期,細胞數目明顯增多,不僅覆蓋膜材料表面,還出現復層生長,并出現部分球形死亡細胞。對2種中空纖維材料比較發現,在PES中空纖維膜表面,Caco-2細胞形態更為清晰,而在PVDF膜內培養21 d左右形成的細胞密度更大,完全覆蓋了膜材料表面。
從接種培養9 d的掃描電鏡圖(圖6)中可以觀察到:Caco-2細胞在中空纖維膜表面黏附鋪展良好,細胞均伸出偽足,細胞輪廓清晰,呈現出良好的梭形或不規則多邊形的上皮細胞形態,逐漸匯合成片,形成細胞單層;在PVDF中空纖維膜上,部分細胞向材料空隙內遷移。
2.3Caco-2細胞熒光顯微鏡觀察
使用Hoechst 33342染料對活細胞核進行原位
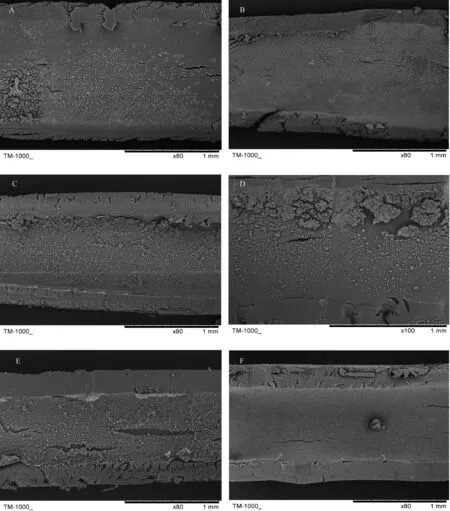
A~F分別表示接種Caco-2細胞后第2、5、7、9、11、19天的生長情況。標尺=1 mm。A-F show the morphology of Caco-2 cell layers cultured on the inner surface of PES hollow fiber membrane at the days 2, 5, 7, 9, 11, 19, respectively. Bar=1 mm. 圖4 培養在PES中空纖維膜內表面的Caco-2細胞掃描電鏡圖Fig.4 Scanning electron microscope (SEM) images of the morphology of Caco-2 cell layers cultured on the inner surface of PES hollow fiber membrane
熒光染色。從圖7和圖8中可以看出,在中空纖維膜內表面上可見大量染色的細胞核分布,有的細胞核呈橢圓形,有的呈梭形,貼附于中空纖維膜內側。從細胞分布情況(圖7)看,在PES中空纖維內表面的Caco-2細胞分布相對不均勻,而在PVDF中空纖維內表面的細胞密度均勻。對比圖8和圖7可見,接種Caco-2細胞第8天后的中空纖維內表面的細胞數較接種后第4天的增量明顯,罕見濃縮、碎裂的細胞核。該結果與在掃描電鏡下觀察到的一致。

A~F分別表示接種Caco-2細胞后第2、5、7、9、11、19天的生長情況。標尺=1 mm。A-F show the morphology of Caco-2 cell layers cultured on the inner surface of PVDF hollow fiber membrane at the days 2, 5, 7, 9, 11, 19, respectively. Bar=1 mm.圖5 培養在PVDF中空纖維膜內表面的Caco-2細胞掃描電鏡圖Fig.5 SEM images of the morphology of Caco-2 cell layers cultured on the inner surface of PVDF hollow fiber membrane

(A~B):PES中空纖維,放大倍數分別為500×,2 000×;(C~D):PVDF中空纖維,放大倍數分別為500×,2 000×。(A-B): PES hollow fiber, with magnification times of 500× and 2 000× respectively; (C-D): PVDF hollow fiber, with magnification times of 500× and 2 000× respectively.圖6 Caco-2細胞在中空纖維上生長9 d后的掃描電鏡圖Fig.6 SEM images of the morphology of Caco-2 cells cultured on the inner surface of hollow fiber membranes at the ninth day

A:PES;B:PVDF。放大倍數200×。A: PES; B: PVDF. The magnification is 200 times.圖7 接種Caco-2細胞第4天的中空纖維膜的熒光染色圖 Fig.7 Image of fluorescent staining of Caco-2 cells cultured on the inner surface of hollow fiber at the fourth day
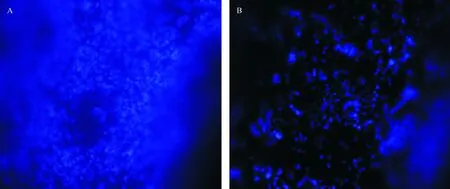
A:PES;B:PVDF。放大倍數200×。A: PES; B: PVDF. The magnification is 200 times.圖8 接種Caco-2細胞第8天的中空纖維膜的熒光染色圖Fig.8 Image of fluorescent staining of Caco-2 cells cultured on the inner surface of hollow fiber at the eighth day
2.4Caco-2細胞極性觀察
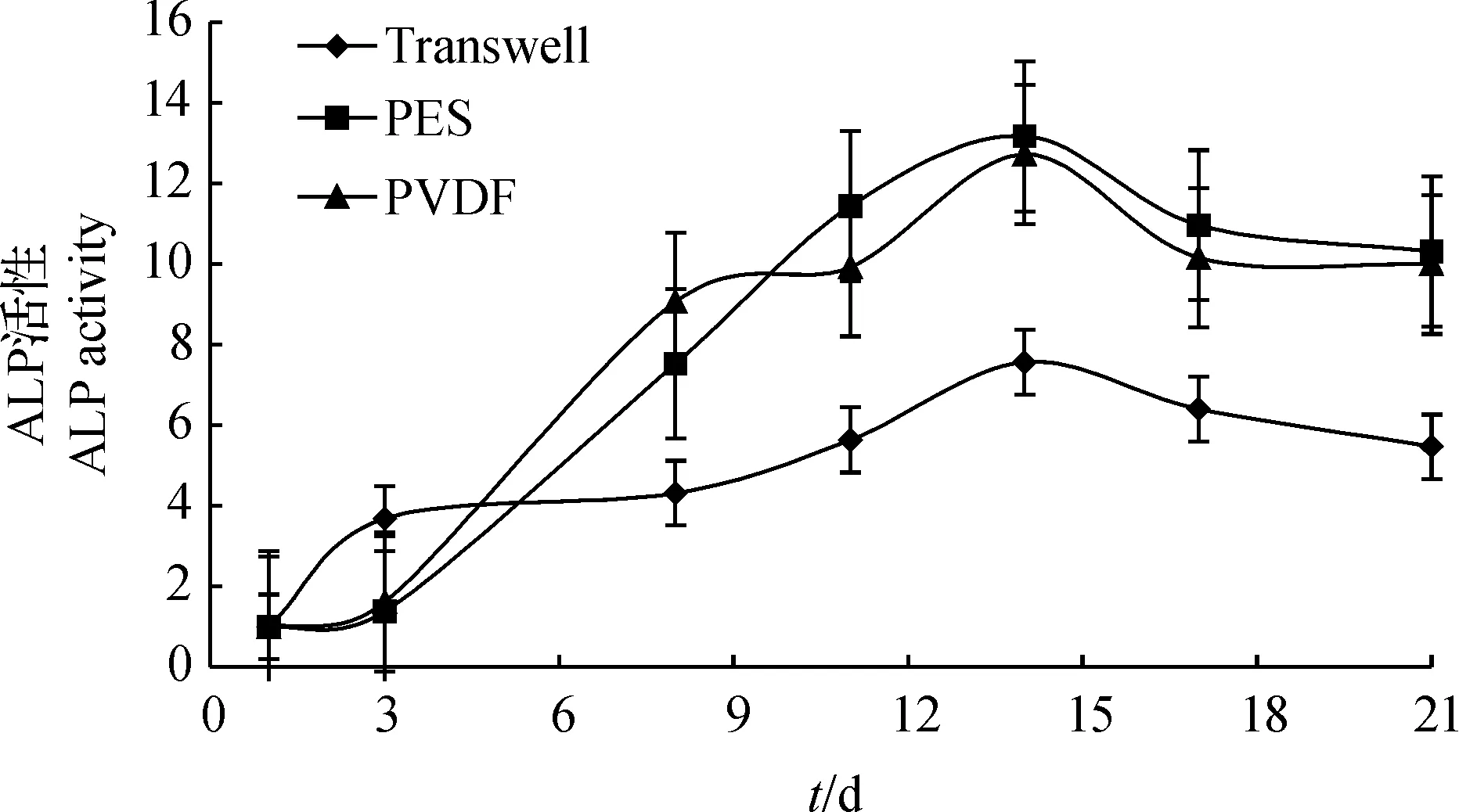
ALP活性值為相對于第1天活性值的倍數。The value of ALP activity is times of its activity cultured at day 1.圖9 培養在Transwell、PES和PVDF板上的Caco-2細胞的ALP活性檢測Fig.9 Alkaline phosphatase (ALP) activity of Caco-2 cells cultured on the apical surface of Transwell insert and the inner surface of PES and PVDF hollow fiber membranes
Caco-2細胞接種培養后,前期穩定增長融合形成細胞層,后期開始分化,出現肌動蛋白和刷狀緣。刷狀緣酶系中最具代表性的是堿性磷酸酶(ALP)和γ-谷氨酰轉肽酶(γ-GT)。堿性磷酸酶活性在Caco-2細胞培養周期中不斷增長,可以驗證單細胞層的分化情況[11]。本文在21 d的培養時間內通過測定特異性底物的水解反應速率來確定酶活性,對比PES、PVDF中空纖維膜和Transwell插入式濾膜之間的差別。如圖9所示:在PES和PVDF中空纖維膜上培養的Caco-2細胞的ALP活性在培養周期內持續快速增長,并在2周左右達到峰值,增長了約12倍,兩者都與在Transwell上培養的結果存在顯著差異;在培養8 d后,Caco-2細胞的ALP活性在PES和PVDF中空纖維反應器中的變化較為穩定,而在Transwell嵌套小室上培養的Caco-2細胞的酶活性增長緩慢,在培養10 d后較快增長,與酶活性已有下降的中空纖維膜上培養的細胞間差異有統計學意義(P<0.05)。

圖10 培養在Transwell、PES和PVDF板上的Caco-2細胞的γ-GT活性檢測Fig.10 γ-Glutamyltransferase (γ-GT) activity of Caco-2 cells cultured on the apical surface of Transwell insert and the inner surface of PES and PVDF hollow fiber membranes
從圖10可以看出:在21 d的培養周期內,在中空纖維膜內表面培養的細胞的γ-GT相對活性高于在Transwell嵌套小室上培養的細胞;在前期培養中,PES和PVDF中空纖維培養模型顯著優于Transwell模型(P<0.05),而三者在培養后期的酶活性水平趨于一致。
2.5Caco-2細胞層的緊密連接完整性觀察
完整的緊密連接網絡是Caco-2細胞實現充分分化的標志之一。一般而言,用羅丹明-鬼筆環肽染色足以證明肌動蛋白細胞單層的存在,而ZO-1蛋白的免疫熒光染色結果可以驗證Caco-2細胞緊密連接的完整性[2]。由于本試驗采用的PVDF中空纖維膜的內表面孔徑大于細胞直徑,導致單個細胞生長于各膜孔內壁,熒光染色結果難以說明是否形成了細胞層表面緊密連接。而PES中空纖維膜表面相對光滑,從圖11中可以觀察到具有完整緊密連接的Caco-2細胞層的形成。說明用本試驗構建的PES中空纖維膜內表面培養Caco-2細胞可以保證細胞層的完整性和致密性。
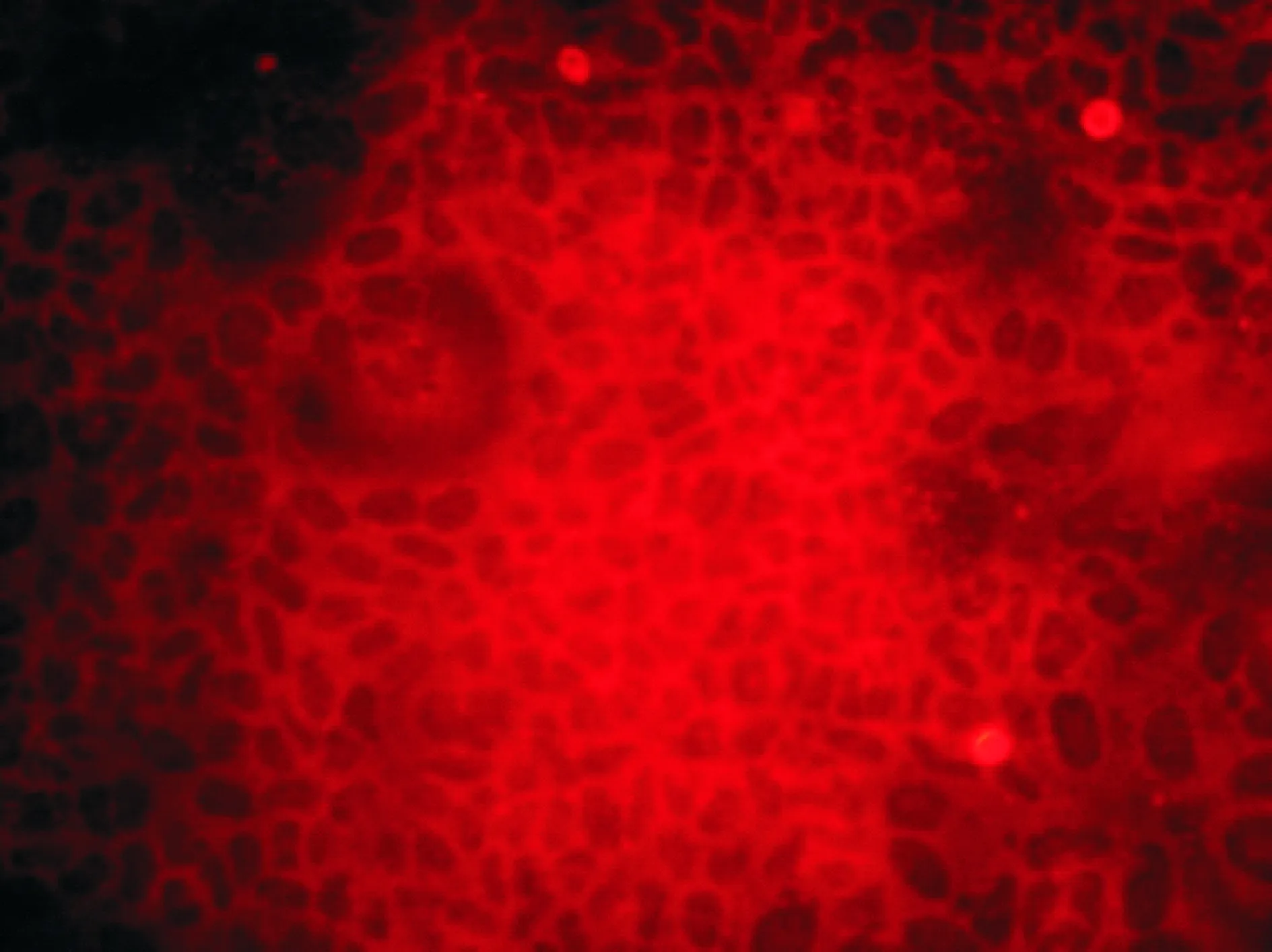
放大倍數200×.The magnification is 200 times.圖11 接種Caco-2細胞第10天的PES中空纖維膜內表面的ZO-1熒光染色圖Fig.11 Image of ZO-1 fluorescent staining of Caco-2 cells cultured on the inner surface of PES hollow fiber membrane at the 10th day
3 討論
通常情況下,人們通過評價Caco-2細胞模型單細胞層的緊密性和完整性來判斷模型構建是否成功,主要觀測指標有細胞形態、刷狀緣酶系活性、跨膜電阻值、漏出標志物被動擴散的跨膜通量等。只有至少滿足2個以上條件才能說明Caco-2細胞單層的緊密性與完整性良好[12]。本試驗采用多種顯微鏡觀察細胞形態和測定刷狀緣酶系活性,以及通過熒光染色觀察來考察Caco-2細胞單層的完整性和細胞分化情況。
本文通過MTT法測定表明,細胞在前10 d快速增長,隨后生長變緩趨于穩定,之后略有下降。這與文獻[13]所報道的Caco-2細胞生長變化趨勢一致。此外,Caco-2細胞在中空纖維膜內的生長情況與傳統的Transwell單層細胞模型對比無顯著差異。這與DENG等[14]的試驗結果一致,證明該3維Caco-2模型不遜于傳統的2維細胞模型。
從掃描電鏡照片可以看出,在細胞培養后期,細胞逐漸融合形成單層結構,在PVDF中空纖維膜內甚至覆蓋了膜內表面。在熒光顯微鏡下可以觀察到被熒光染料染色的細胞核,從側面反映了Caco-2細胞在中空纖維膜內表面生長情況良好,在培養周期的前期大量增殖并逐漸形成細胞單層。同時,ZO-1蛋白所指示的細胞間緊密連接的形成也證明了PES中空纖維膜構建的Caco-2細胞模型用于后期功能性成分滲透研究的可行性。
從Caco-2細胞的刷狀緣酶系活性結果可知,在中空纖維膜反應器中的Caco-2細胞實現了充分的分化,其堿性磷酸酶和谷氨酰轉肽酶活性均在8~14 d培養范圍內達到較高水平,已經具備甚至高于在傳統的Transwell插入式濾膜上培養21 d的細胞所具有的功能。
在體內,組織或器官需要星羅棋布的血管輸送氧氣和營養。而細胞體外培養時,由于缺乏網絡狀的血管系統,細胞聚集體超過一定厚度(一般為幾百μm)就會導致位于中心的細胞缺乏營養和氧氣而壞死,這是組織工程目前無法解決的難題[15-16]。盡管存在諸如培養環境不夠均一、培養工藝不易放大的缺點,但具有微濾膜性質的中空纖維膜,不但直徑大小可選,還能實現可控的選擇透過性,是理想的組織和細胞體外培養的替代材料。中空纖維以它特有的優點,在加速細胞功能表達方面表現出極大的價值。
借助于現有的在藥物滲透、轉運、吸收方面的研究基礎,近年來,Caco-2細胞模型也已經越來越多地被應用于食品科學領域中活性物質的吸收代謝研究[17],如對類胡蘿卜素[18]、酯類[19]、黃酮類物質[20]等的研究。未來除了在食品科學領域對活性物質的研究之外,構建Caco-2細胞中空纖維模型的成功經驗,也可以運用到其他組織細胞模型的構建中,從而拓寬中空纖維細胞模型的應用范圍。
[1]PINTO M, ROBING-LEON S, APPAY M D,etal. Enterocyte-like differentiation and polarization of the human colon carcinoma cell line Caco-2 in culture.BiologyoftheCell, 1983,47(3):323-330.
[2]HUBATSCH I, RAGNARSSON E G E, ARTURSSON P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers.NatureProtocols, 2007,2(9):2111-2119.
[3]LI A P. Screening for human ADME/Tox drug properties in drug discovery.DrugDiscoveryToday, 2001,6(7):357-366.
[4]WUNG N, ACOTT S M, TOSH D,etal. Hollow fibre membrane bioreactors for tissue engineering applications.BiotechnologyLetters, 2014,36(12):2357-2366.
[5]CABRERA M I, LUNA J A, GRAU R J. Solving design equations for a hollow fiber bioreactor with arbitrary kinetics.ChemicalEngineeringJournal, 2001,84(3):445-461.
[6]ARTURSSON P. Epithelial transport of drugs in cell culture. Ⅰ: A model for studying the passive diffusion of drugs over intestinal absorbtive (Caco-2) cells.JournalofPharmaceuticalSciences, 1990,79(6):476-482.
[7]HIDALGO I J, LI J. Carrier-mediated transport and efflux mechanisms in Caco-2 cells.AdvancedDrugDeliveryReviews, 1996,22(96):53-66.
[8]查龍應,許梓榮,王敏奇.Caco-2細胞模型及其在營養素小腸吸收機理研究中的應用.動物營養學報,2006,18(3):215-222.
ZHA L Y, XU Z R, WANG M Q. The Caco-2 cell model and its application in elucidating the absorption mechanisms of nutrients in intestine.ChineseJournalofAnimalNutrition, 2006,18(3):215-222. (in Chinese with English abstract)
[10]陳杰,彭承宏,沈柏用,等.肝細胞體外培養技術的研究與進展.中國組織工程研究與臨床康復,2008,12(53):10539-10542.
CHEN J, PENG C H, SHEN B Y,etal. Research and progress ofinvitroculture method of hepatocytes.JournalofClinicalRehabilitativeTissueEngineeringResearch, 2008,12(53):10539-10542. (in Chinese with English abstract)
[11]VOLPE D A. Variability in Caco-2 and MDCK cell-based intestinal permeability assays.JournalofPharmaceuticalSciences, 2008,97(2):712-725.
[12]曾寶,王春玲,吳安國,等.Caco-2細胞模型的建立及其在中藥吸收研究中的應用探討.中藥新藥與臨床藥理,2010,21(6):570-573.
ZENG B, WANG C L, WU A G,etal. Establishment of Caco-2 cell model and exploration of its application to absorption of Chinese medicine.TraditionalChineseDrugResearchandClinicalPharmacology, 2010,21(6):570-573. (in Chinese with English abstract)
[13]WANG L, MURTHY S K, BARABINO G A,etal. Synergic effects of crypt-like topography and ECM proteins on intestinal cell behavior in collagen based membranes.Biomaterials, 2010,31(29):7586-7598.
[14]DENG X D, ZHANG G, SHEN C,etal. Hollow fiber culture accelerates differentiation of Caco-2 cells.AppliedMicrobiologyandBiotechnology, 2013,97:6943-6955.
[15]GRIFFITH L G, NAUGHTON G. Tissue engineering—current challenges and expanding opportunities.Science, 2002,295(5557):1009-1014.
[16]GRIFFITH L G, SWARTZ M A. Capturing complex 3D tissue physiologyinvitro.NatureReviews:MolecularCellBiology, 2006,7(3):211-224.
[17]黃海智,陳健樂,程煥,等.Caco-2細胞模型預測活性物質吸收代謝的研究進展.中國食品學報,2015(1):164-172.
HUANG H Z, CHEN J L, CHENG H,etal. Research progress of Caco-2 models in absorption and metabolism of active substance.JournalofChineseInstituteofFoodScienceandTechnology, 2015(1):164-172. (in Chinese with English abstract)
[18]NETZEL M, NETZEL G, ZABARAS D,etal. Release and absorption of carotenes from processed carrots (Daucuscarota) usinginvitrodigestion coupled with a Caco-2 cell trans-well culture model.FoodResearchInternational, 2011,44(4):868-874.
[19]FENG Q, HOU X L, TAKAHASHI K,etal. Andrographolide inhibits the expression and metabolic activity of cytochrome P450 3A4 in the modified Caco-2 cells.JournalofEthnopharmacology, 2012,141(2):709-713.
[20]YASUDA M T, FUJITA K, HOSOYA T,etal. Absorption and metabolism of luteolin and its glycosides from the extract ofChrysanthemummorifoliumflowers in rats and Caco-2 cells.JournalofAgricultural&FoodChemistry, 2015,63(35):7693-7699.
Construction of Caco-2 cell hollow fiber bioreactor for the study on functional substances.JournalofZhejiangUniversity(Agric. &LifeSci.), 2016,42(4):401-410
XU Dongdong1, CHU Qiang1, YANG Yunyun1, Lü Xiangmin1, ZHANG Yanzhen2, ZHENG Xiaodong1*
(1.CollegeofBiosystemsEngineeringandFoodScience,ZhejiangUniversity,Hangzhou310058,China; 2.TheSecondAffiliatedHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310009,China)
Caco-2 cell; hollow fiber; Transwell model; polyethersulfone; polyvinylidenefluoride
浙江省自然科學基金(Z14C200006);浙江大學馥莉食品研究院基金(KY201301);浙江省公益性技術應用研究計劃(2013C33139).
Corresponding author):鄭曉冬(http://orcid.org/0000-0002-0307-7754),E-mail:xdzheng@zju.edu.cn
聯系方式:徐冬冬(http://orcid.org/0000-0001-5451-9885),E-mail:xudong006@163.com
2015-09-18;接受日期(Accepted):2015-11-06;網絡出版日期(Published online):2016-07-19
TS 201.1
A
URL:http://www.cnki.net/kcms/detail/33.1247.S.20160719.1907.008.html

