小球藻抽脂殘留物培養產氣腸桿菌的制氫研究
MUHAMMAD Jawed,王 俊,徐 莉,閆云君
華中科技大學生命科學與技術學院,湖北 武漢 430074
小球藻抽脂殘留物培養產氣腸桿菌的制氫研究
MUHAMMAD Jawed?,王俊?,徐莉*,閆云君*
華中科技大學生命科學與技術學院,湖北 武漢 430074
為使高效產氫產氣腸桿菌能夠運用到實際生產中,探索并且優化以小球藻抽脂殘留物的水解產物為底物的厭氧批次產氫發酵實驗參數.采用中心組合設計,通過三次平行實驗取得的數值,擬合得到反映溫度、接種量和pH值與產氫量之間關系的多元二次回歸模型,以產氫率為響應值,進行響應面分析.方差分析結果顯示,該模型的顯著性和可靠性較高,擬合效果良好.該模型預測出最佳產氫結果為54.22 mL/g小球藻抽脂殘留物,產氫條件為溫度37.55℃,接種量12.25%,pH值5.95.進行了厭氧批次發酵產氫驗證實驗,實際結果為小球藻抽脂殘留物的產氫量為54.61 mL/g,與預測值十分接近,說明該模型能較好反應三因素對產氫量的影響.優化了高效產氫菌利用廉價底物發酵產氫的運行條件,為實現生產氫氣的過程與有機廢棄物無害化處理相耦合提供了新思路.
產氣腸桿菌;生物制氫;小球藻提脂殘留物;響應面法
1 引言
隨著能源危機的加劇,人們環保意識越發增強,氫氣作為可再生的清潔能源載體受到越來越多的重視[1-3].其中,厭氧發酵產氫技術反應條件溫和、能耗低、效率高,能同時解決化石燃料能源消耗所帶來的資源匱乏、環境污染等問題,因此成為目前制氫方法的研究熱點[4-8].
但是,微生物厭氧發酵制氫成本高制約著微生物發酵制氫的大規模產業化.利用富含碳水化合物的廢棄物代替葡萄糖、蔗糖這類昂貴的原料作為底物,實現生產氫氣的過程與有機廢棄物無害化處理相耦合是生物制氫最有應用前景的方向之一,吸引了政府和科研人員的大力關注[9-11].作為制備新能源的重要原料微藻具有光合效率高和資源豐富等特點,其油脂抽提后剩余的廢棄物藻渣(lipid extracted microalgal biomass residues,LMBRs)是一種營養豐富的有機質,若處理不當排放到環境當中將造成環境的污染和資源浪費[12].厭氧發酵產氫菌對底物適應性較廣,如果利用來源豐富的藻渣作為產氫微生物的發酵底物來制備氫氣,變廢為寶,在降解有機廢棄物解決環境問題的同時,可以降低氫氣生產成本.該方法將為最終實現原位處理類似有機廢棄物低成本獲得氫氣提供新的思路.
發酵培養條件及其工藝優化可以得到最佳的產氫效率.產氫發酵的培養條件主要包括培養基成分、培養溫度、反應器轉速、pH值的大小和初始接種量等因素.在這些因素中,有一些因素微小的變化會導致目的產物產量發生大幅度改變,一般認為這樣的因素對于目的變量具有顯著性影響.通過單因素實驗結合最陡爬坡試驗(plackett-burman,PB試驗)可以確定一個因素是否具有顯著性和該因素最優值的范圍.為了確定培養參數之間的關系和最優值,各種統計學方法和工具被開發和應用[13].其中“響應面優化法”(response surface methodology,RSM)因其方便準確擬合度好而運用廣泛[14-15].
在此背景下,本研究針對厭氧發酵制氫成本較高的問題,擬開展利用油脂抽提后剩余的小球藻藻渣LMBRs水解產物作為發酵底物,利用響應面優化法研究利用該底物發酵產氫量與培養溫度、培養基pH值大小以及接種量之間的關系,預測這三個因素在進行產氫發酵時的最優數值,并進行驗證實驗.以此模擬工業化生產生物柴油的微藻藻渣原位水解產氫的過程,探索類似有機廢棄物工業應用的潛在價值.
2 實驗部分
2.1材料
2.1.1菌株產氫發酵菌株使用產氣腸桿菌工程菌 Enterobacter aerogenes AB91102-OP/N(Δppc,Δldh,nadE),該菌為本實驗利用基因敲除的方法構建獲得的產氣腸桿菌工程菌,該菌具有能夠利用五碳糖和六碳糖生長并產氫的特點,能夠較好地利用成分復雜的小球藻提脂殘留物水解產物[16]. 2.1.2培養基發酵培養基小球藻提脂殘留物LMBRs的水解產物水解液調節pH至中性后干燥.成分為31.8%(質量分數)的還原糖和6.1%(質量分數)的總氮.每升培養基中加入30.0 g小球藻提脂殘留物LMBRs的水解產物.
2.1.3儀器和試劑常規生化試劑均購自國藥公司.pH-stat計(德國 Schott),電轉化儀(美國Bio-RAD),電熱恒溫培養箱(上海蘇進),紫外檢測儀(上海金達生化儀器),恒流泵(上海金達生化儀器),臺式離心機(德國Eppendorf),恒溫搖床(上海智城),紫外可見分光光度計(上海美譜達),3 L自控發酵罐(上海保興).
2.2方法
2.2.1小球藻提脂殘留物的水解策略取10 L發酵罐發酵的畢赤酵母細胞培養液,4 000 r/min離心20 min取沉淀,無菌水重懸細胞,離心取沉淀重懸制備成質量濃度為10%的懸濁液,調節pH值至5.2;再向該溶液中加入NaCl和無水乙醇使其終質量濃度均為5%,混勻.50℃,150 r/min震蕩孵育24 h.4 000 r/min離心20 min取上清獲得酵母自溶物.取該新鮮酵母自溶物100 mL與5 g干燥后的小球藻抽脂殘余物LMBRs分別在37、43℃和50℃下,150 r/min震蕩孵育.再分別在80、100℃和121℃,用NaOH溶液堿解孵育上述預處理的小球藻提脂殘留物8 h.處理后將降解液冷卻,12 000 r/min離心5 min,分離上清液和固體物質,上清液檢測其還原糖和氨基酸含量,固體不溶物質檢測總氮含量.
2.2.2厭氧批次發酵實驗將裝有培養基的生物反應器在滅菌鍋中滅菌后,立即放在磁力攪拌座上,迅速接入通過濾膜Midisart 2000過濾后的99.9%(體積分數)的高壓氮氣30 min使培養環境處于無氧狀態,將排氣管連接到氣體收集瓶中.將pH電極與控制器連接,通過無菌操作將裝有質量分數為28%氨水和1 mol/L稀鹽酸的補料瓶連接到發酵罐,開啟攪拌至450 r/min,在控制器上設定pH值為預定值,打開自動調節.
種子培養基使用LB培養基,按照實驗設計的不同接種量確定體積,每次發酵接種兩瓶,一瓶作為檢測OD值變化樣品,一瓶作為接種液.37°C下搖床震蕩培養,待檢測瓶的OD值達到0.6時,迅速將另一瓶菌液接種到反應器中.發酵培養12 h,測定收集氣體中氫氣的含量. 2.2.3優化實驗設計采用三因素三水平中心組合設計(central composite design,CCD),利用統計分析軟件“Design Expert”將獲得的厭氧批次發酵優化實驗數據進行分析,研究產氫量與有效獨立變量:初始接種量、pH和溫度之間的關系.將每克小球藻抽脂殘余物LMBRs能夠產生的氫氣的量作為響應參數,各優化參數采用的考察水平如表1所示:
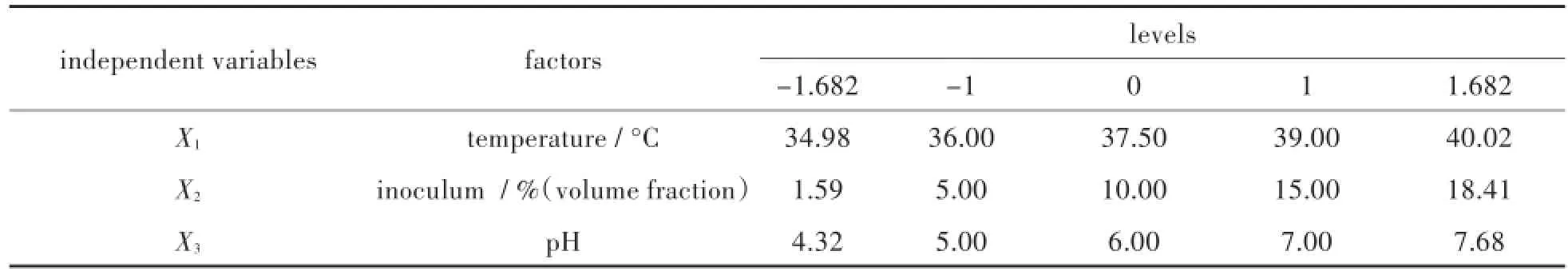
表1 優化小球藻提脂殘留物產氫的因素及其水平Tab.1 Levels and factors used for optimization of hydrogen production from LMBRs
由于需要優化的因素數量為3個,根據析因部分實驗的次數F=2k(k為因素的數量)得出,析因實驗的次數為 F=2k=23=8次.極值α=F1/4=81/4≈1.682,星點數為2k=2×3=6,為保證實驗的精密性,中心點實驗重復6次.所以需要進行的優化實驗次數總共為20次.
實驗得到的數據參數變量和相應值之間的關系可以用如公式(1)所示的二次模型表示:

其中,Y表示相應結果的預測值,xi表示輸入變量的值,i=1-k,j=1-k,A0表示線性系數,Aii表示二次項系數,Aij表示相互作用系數.
通過方差分析對該二次模型進行統計學分析.通過該模型構建的等高線圖和三維曲面圖可以進一步預測最大產氫量及產生該產氫量時初始接種量、pH和溫度的大小.
2.2.4氫氣濃度的測定氫氣的濃度使用氣象色譜儀進行測定,采用的是FULI GC-9750型氣相色譜,裝配有一個填充柱(2.0 mmL.D.200 mmL,carboxen-1004,80~100 mesh),和一個TCD熱導檢測器.檢測器和柱子的工作溫度分別為60℃和110℃.
3 結果與討論
3.1模型的建立及擬合檢驗
如表2所示,按照中心組合設計CCD設計的各參數變量的值進行一組20次的優化實驗,每組進行三次平行實驗,得到在所設計的初始接種量、pH和溫度下的產氫效率.該產氫效率設定為每克小球藻抽脂殘余物LMBRs為底物被菌株AB91102-OP/N利用產生的氫氣的量.
通過表2中的實驗數據,建立統計學模型,獲得多元回歸方程如公式(2)所示.
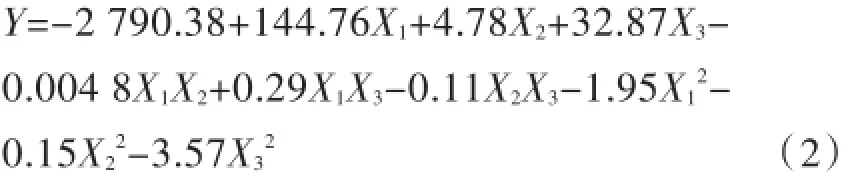
其中,Y表示產氫量,X1、X2和X3分別表示如表1中所示變量.對該回歸方程進行方差分析結果依次如表3中所示.
3.2產氫條件的優化
通過對二次模型的擬合檢驗,證明該模型具有較高的顯著性和可靠性,能夠較好的擬合產氫效率與初始接種量、培養溫度和pH值之間的關系,通過統計學軟件“Design Expert”將該模型生成能夠反應接種量、溫度和pH與產氫量之間關系的3D響應面圖,以及這三個參數兩兩之間相互作用的等高線圖,如圖1所示.
3.3最優發酵條件的預測
對二次回歸模型進行響應面分析,結合響應面3D立體圖中的極值點,預測得出產氫氣效率最大值為54.22 mL/g小球藻抽脂殘余物LMBRs,在條件為溫度37.55℃,接種量12.25%,pH值為5.95時產生.
3.4驗證實驗
為檢驗模型的實際預測效果,在上述預測的最優發酵條件下進行厭氧批次發酵驗證實驗,結果顯示該理想條件下利用小球藻抽脂殘余物LMBRs產氫效率為 54.61 mL/g,與預測結果54.22 mL/g小球藻抽脂殘余物LMBRs十分相近,證明該模型能夠很好地體現三個因素與產氫量之間的關系,具有良好的預測能力.
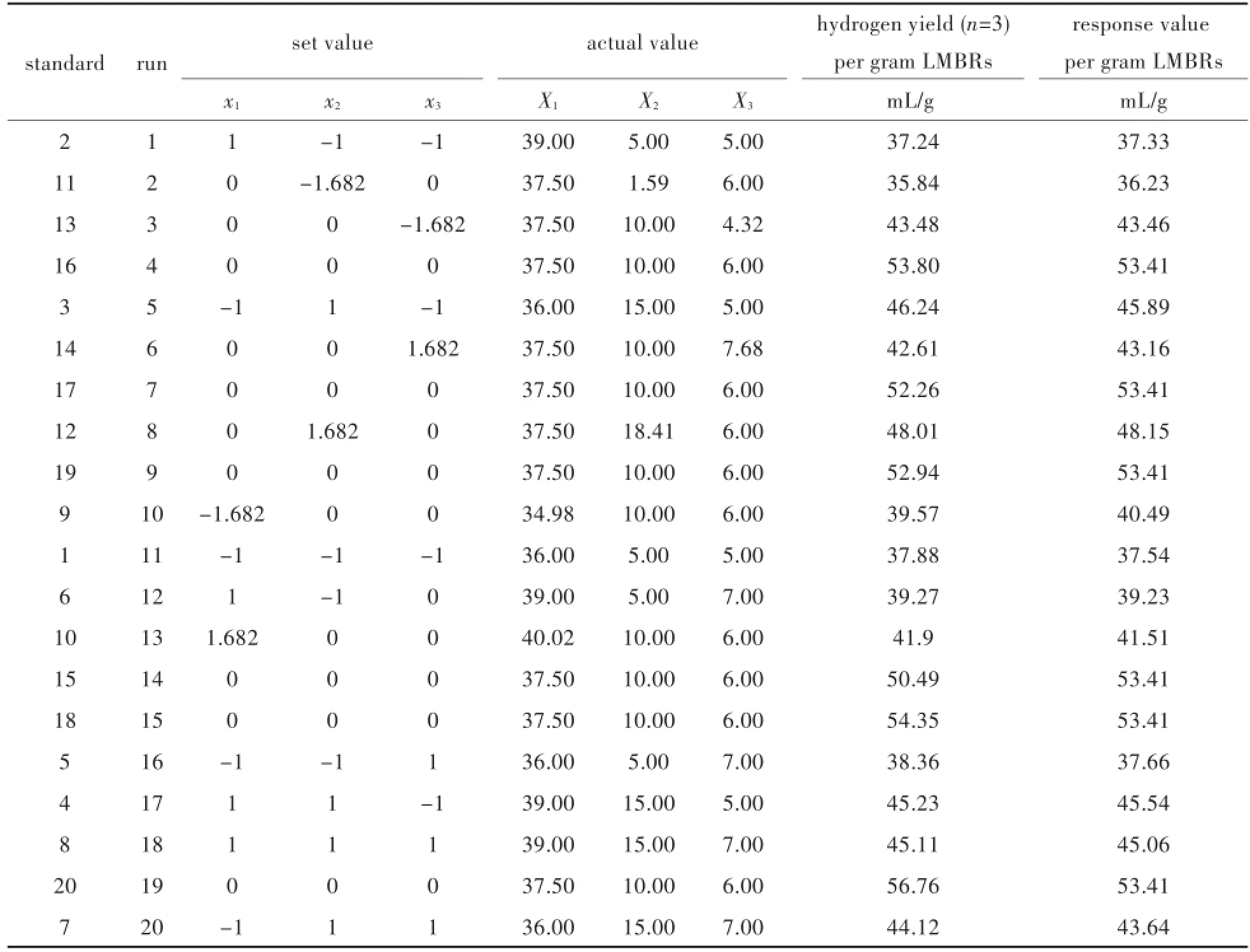
表2 利用小球藻提脂殘留物在不同溫度、接種量、pH值下氫氣的產量Tab.2 Hydrogen production from LMBRs at different temperatures,ratios of inoculum and pH values
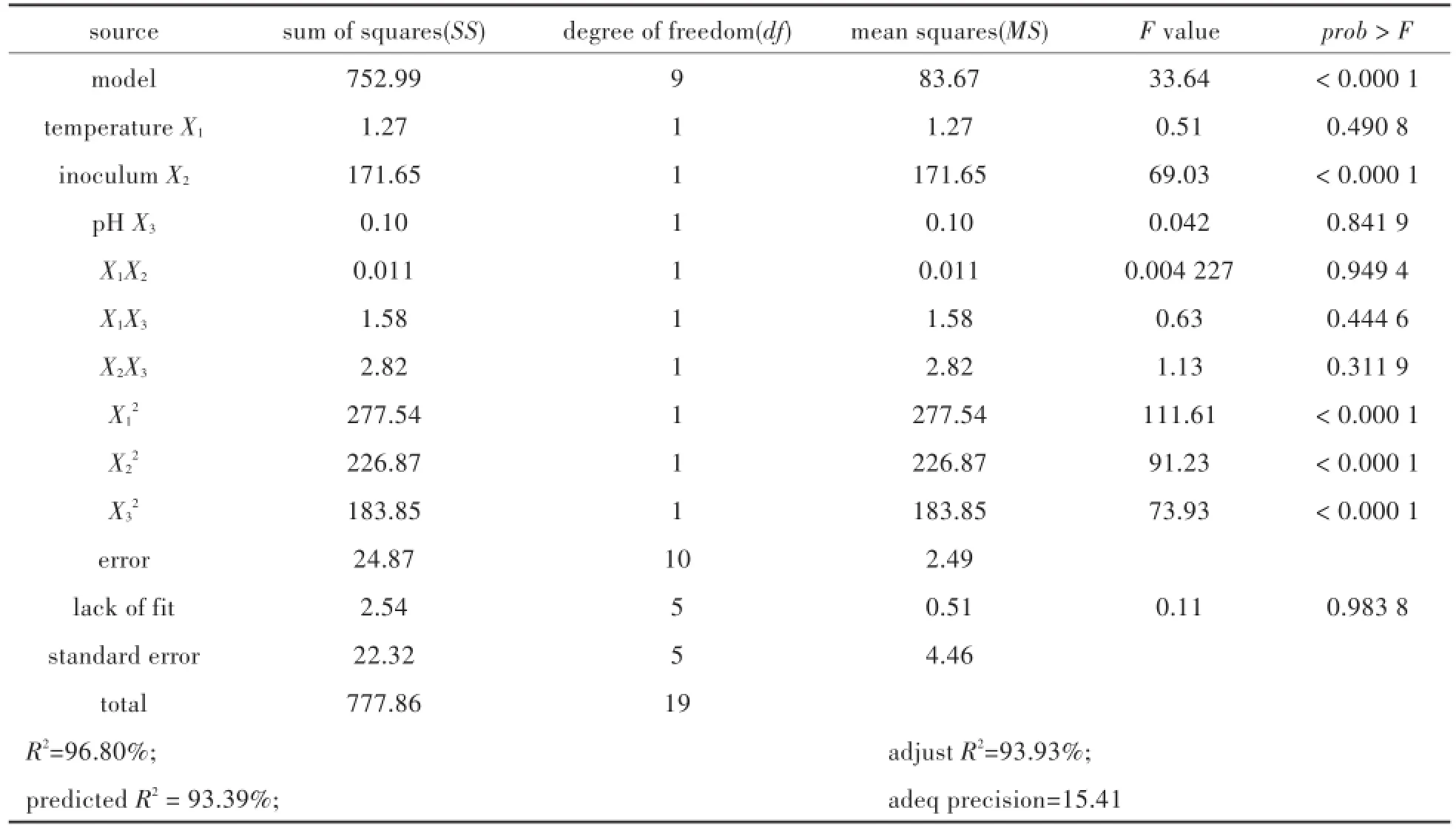
表3 響應面二次模型的方差分析Tab.3 ANOVA for response surface quadratic model

圖1 溫度、pH值和接種量影響產氫量的響應面和等高線圖(a)溫度和接種量對產氫量的影響;(b)溫度和pH值對產氫量的影響;(c)接種量和pH值對產氫量的影響Fig.1 Response surface plot and the corresponding contour lines showing the effects of temperature,pH and ratios of inoculum on hydrogen yield (a)Effects of temperature and ratios of inoculum on hydrogen yield;(b)Effects of temperature and pH on hydrogen yield;(c)Effects of ratios of inoculum and pH on hydrogen yield
3.5討論
響應面法是常用的優化產氫發酵重要參數的方法,在很多研究中被證明能夠有效地提高產氫量[14-19].Chong等運用響應面法優化酪酸梭菌利用棕櫚油流出物生產氫氣的條件,使產氫速率提高到了849.5 mL/h,培養條件的變化使收集氣體中氫氣的濃度從60%提高到了75%[14].Hay等運用響應面法優化厭氧活性污泥生物反應器的運行條件,建成了預測產氫準確的模型[18].
本研究為考察已構建的高效產氫腸桿菌工程菌AB91102-OP/N的實際應用能力,通過響應面法優化可再生廢棄物小球藻抽脂殘余物為底物的厭氧批次產氫發酵參數.該厭氧發酵產氫采用純培養,發酵底物采用同一批次獲得的小球藻抽脂殘余物水解產物;接種使用的培養物均控制相同的OD值;反應器中接入溶氧電極,確保每次實驗均在嚴格厭氧的條件下進行等系列措施,最大限度降低發酵過程的不確定因素,保證本擬合二次模型的各種擬合參數較高.研究結果表明,在通過響應面法優化的條件下,每克LMBRs產氫量將可達到54.61mL/g,相對未經優化的條件下45.33 mL/g的產氫量提升20.47%(P-value=0.016 2),效果顯著.該研究為進一步利用類似有機廢棄物作為發酵底物制備氫氣,實現氫氣的制備與有機廢棄物無害化處理相耦合,一并解決環境問題和能源危機問題,最終實現原位處理有機廢棄物,獲得低成本的綠色能源氫氣提供了新的思路.
4 結 語
系統優化了本實驗室構建的產氣腸桿菌工程菌以小球藻抽脂殘余物水解產物為培養基的厭氧發酵產氫條件.采用三因素三水平中心組合設計,通過統計學軟件“Design Expert”設計了一組數量為20次的優化實驗,并通過3次平行實驗取得的數值,擬合得到反應溫度、接種量和pH值與產氫量之間關系的多元二次回歸模型,以產氫率為響應值,進行響應面分析.方差分析結果顯示,該模型顯著性和可靠性較高,擬合效果良好.按照該模型預測出的最佳結果54.22 mL/g小球藻抽脂殘余物LMBRs產生的條件為溫度 37.55℃,接種量12.25%,pH值5.95.進行了厭氧批次發酵產氫驗證實驗,最終結果表明實際產氫量54.61 mL/g小球藻抽脂殘余物LMBRs與預測值十分相近,證明該模型能較好地反應三個因素對產氫量的影響.通過響應面法優化了高效產氫菌利用廉價底物發酵產氫的運行條件,對高效產氫菌的實際應用進行探索,為開發有效降低厭氧發酵產氫成本提供了新的策略.
[1] SODE K,WATANABE M,MAKIMOTO H,et al.Biohydrogen[M].United States:Springer,2014.
[2]ARGUN H,KARGI F.Bio-hydrogen production by different operational modes of dark and photo-fermentation:an overview[J].International journal of hydrogen energy,2011,36(13):7443-7459.
[3]LEE H,VERMAAS W F J,RITTMANN B E.Biological hydrogen production:prospects and challenges[J]. Trends in biotechnology,2010,28(5):262-271.
[4]TURNER J A.Sustainable hydrogen production[J].Science,2004,305(5686):972-974
[5] KOTHARI R,SINGH D P,TYAGI V V,et al.Fermentative hydrogen production-an alternative clean energy source[J].Renewable and sustainable energy reviews,2012,16(4):2337-2346.
[6]ZHANG C,LU F,XING X.Bioengineering of the enterobacter aerogenes strain for biohydrogen production[J]. Bioresource technology,2011,102(18):8344-8349
[7]王姝玉,王俊,徐莉,等.同源過表達fnr、pncB和fdhF對克雷伯菌產氫代謝的影響[J].生物工程學報,2013,29(9):1278-1289. WANG S Y,WANG J,XU L,et al.Enhanced biohydrogen productio by homologous over-expression of fnr,pncB,fdhF in Klebsiella sp.HQ-3[J].Chinese journal of biotechnology,2013,29(9):1278-1289.
[8]LEE D,CHIU L.Development of a biohydrogen economy in the United States,China,Japan,and India:with discussion of a chicken-and-egg debate[J].International journal of hydrogen energy,2012,37(20):15736-15745。
[9]SINHA P,PANDEY A.An evaluative report and challenges for fermentative biohydrogen production[J]. International journal of hydrogen energy,2011,36 (13):7460-7478.
[10]LIN C,LAY C,SEN B,et al.Fermentative hydrogen production from wastewaters:a review and prognosis [J].International journal of hydrogen energy,2012,37(20):15632-15642
[11]KAPDAN I K,KARGI F.Bio-hydrogen production from waste materials[J].Enzyme and microbial technology,2006,38(5):569-582.
[12]WAHLEN B D,WILLIS R M,SEEFELDT L C. Biodiesel production by simultaneous extraction and conversion of total lipids from microalgae,cyanobacteria,and wild mixed-cultures[J].Bioresource technology,2011,102(3):2724-2730
[13] JAMIL Z,MOHAMAD ANNUAR M S,IBRAHIM S,et al.Optimization of phototrophic hydrogen production by Rhodopseudomonas palustris PBUM001 via statistical experimental design[J].International journal of hydrogen energy,2009,34(17):7502-7512.
[14] CHONG M,ABDUL R N A,RAHIM R A,et al.Optimization of biohydrogen production by Clostridium butyricum EB6 from palm oil mill effluent using response surface methodology[J].International journal of hydrogen energy,2009,34(17):7475-7482.
[15]LIU Q,ZHANG X,ZHOU Y,et al.Optimization of fermentative biohydrogen production by response surface methodology using fresh leachate as nutrient supplement[J].Bioresourcetechnology,2011,102 (18):8661-8668.
[16]WANG J,YU W Y,XU L,et al.Effects of increasing the NAD(H)pool on hydrogen production and metabolic flux distribution in Enterobacter aerogenes mutants[J].International journal of hydrogen energy,2013,38(30):13204-13215.
[17]GUO W Q,REN N Q,WANG X J,et al.Optimization of culture conditions for hydrogen production by EthanoligenensharbinenseB49 usingresponsesurface methodology[J].Bioresource technology,2009,100 (3):1192-1196.
[18]HAY J X W,WU T Y,TEH C Y,et al.Optimized growthofRhodobactersphaeroidesO.U.001using response surface methodology(RSM)[J].Journal of scientific and industrial research,2012,71(2):149-154.
[19]NGUYEN T A D,KIM J P,MI S K,et al.Optimization ofhydrogen production by hyperthermophilic eubacteria,Thermotoga maritima and Thermotoga neapolitana in batch fermentation[J].International journal of hydrogen energy,2008,33(5):1483-1488.
本文編輯:張瑞
Cultivation of Enterobacter Aerogenes for Hydrogen Production with Lipid Extracted Microalgal Biomass Residues
MUHAMMAD Jawed?,WANG Jun?,XU Li*,YAN Yunjun*
School of Life Science and Technology,Huazhong University of Science and Technology,Wuhan 430074,China
To examine the feasibility of cultivating Enterobacter aerogenes for hydrogen production with lipid extracted microalgal biomass residues,the anaerobic batch fermentations from microalgal hydrolysate were conducted and their key parameters were optimized using response surface methodology.The central composite designs were performed,and a quadratic regression model based on temperature,pH,inoculum and hydrogen yield was obtained from the triplicate experimental data.The analysis of variances indicates that the model has good fitting degree.The predicted maximum hydrogen yield of 54.22 mL/g of lipid extracted microalgal biomass residues was obtained when the temperature,pH and inoculum were respectively at 37.55℃,5.95 and 12.25%.The confirmatory experiments showed that the mutant evolved hydrogen yield of 54.61 mL/g of lipid extracted microalgal biomass residues in the optimal conditions.The coincident result verified the practicability of the model.This study indicates that a strategy of cultivating Enterobacter aerogenes for hydrogen production with lipid extracted microalgal biomass residues has great potential for the large scale of production.
Enterobacter aerogenes;biohydrogen;lipid extracted microalgal biomass residues;response surface methodology
閆云君,博士,教授,博士研究性導師.E-mail:yanyunjun@hust.edu.cn
Q93-335
A
10.3969/j.issn.1674-2869.2016.04.001
1674-2869(2016)04-0313-06
2016-03-03
中央高校基本科研業務費專項資金(2010MS029)
王俊,博士研究生,為并列第一作者.E-mail:651113197@qq.com
徐莉,博士,副教授.E-mail:xuli@hust.edu.cn

