江西口岸及國檢監管區鼠類感染鉤端螺旋體的檢測及基因序列分析
趙明惠,徐鐵龍,張 強,胡 婷,王建軍,劉開明,廖 蕓
?
江西口岸及國檢監管區鼠類感染鉤端螺旋體的檢測及基因序列分析
趙明惠,徐鐵龍,張強,胡婷,王建軍,劉開明,廖蕓
目的為了解江西省口岸及國檢監管區鼠類攜帶的鉤端螺旋體情況,2015年7-12月,對江西省2個一類口岸和9個國檢監管區捕獲的鼠類攜帶的鉤端螺旋體進行了檢測。方法采用熒光定量PCR和特異性PCR擴增兩種方法對樣本進行檢測。結果研究發現捕獲的107只鼠類中存在12例致病性鉤端螺旋體陽性,陽性率為11.2%。包括褐家鼠6只,黃毛鼠3只,黃胸鼠1只,社鼠2只,分布在昌北機場、康替龍國檢監管區、南豐國檢監管區、鷹潭國檢監管區和瑞金國檢監管區。同源性對比和系統進化分析顯示,12例鉤端螺旋體中11例為問號鉤端螺旋體,另1例為博氏鉤端螺旋體。結論在江西口岸及國檢監管區鼠類中存在問號鉤端螺旋體和博氏鉤端螺旋體感染。兩種PCR檢測方法均可適用于口岸及國檢監管區對鉤端螺旋體的檢測,防止相應傳染病在口岸的爆發與傳播,保衛口岸安全。
口岸;國檢監管區;鼠類;鉤端螺旋體
鉤端螺旋體(Leptospira,簡稱鉤體)是一種絲狀、柱形、螺旋盤繞而致密的病原微生物。鉤體在世界范圍內廣泛分布,可引起人獸共患鉤端螺旋體病(leptospirosis,簡稱鉤體病)[1]。該病的早期癥狀包括高燒、流口水、眼睛紅腫及“茶色”尿液,如病菌入侵腎臟、肺和心臟可危及生命[2]。急性患者常因彌漫性肺出血(pulmonary diffuse hemorrhage,PHD)而死亡[3]。鼠和嚙齒動物是其主要傳染源,其他動物如豬、牛、羊、馬、狼、蛇、蛙等均可成為傳染源,但它們攜帶菌的情況和傳染作用等因地而異[4-6]。鉤體病是我國危害最大的鼠傳疾病之一,其發病高峰時期患病人數多達10萬,自1955年本病被列入法定報告傳染病以來,全國累計報告已經幾百萬病例[7]。由于我國經濟的快速發展,對外經濟貿易和人口的往來日益頻繁,這便加劇了鉤體病等鼠傳疾病在全球范圍的傳播。為了有效地控制鉤體病的流行,必須加強宿主動物間鉤體的流行病學監測。目前,實驗室檢測成為診斷鉤體病的重要手段。由于直接鏡檢陽性檢出率低,菌量過低時容易漏檢,而且分離培養時間較長,容易被污染,因此,在鉤體的早期診斷上具有一定的局限性。聚合酶鏈反應(PCR)技術具有特異性強和靈敏度高等特點,適用于大量標本的流行病學調查和鉤體病的早期監測[8-9]。本研究使用熒光定量PCR和特異性PCR擴增兩種方法,對江西口岸和國檢監管區捕獲的鼠類樣本進行鉤端螺旋體的檢測,通過基因序列分析初步了解鉤端螺旋體的種類,做好口岸風險評估,防止相應傳染病在口岸的爆發與傳播,保衛口岸安全。現將結果報告如下。
1 材料與方法
1.1實驗材料
1.1.1鼠種類2015年7月至12月,從江西省2個一類口岸和9個國檢監管區共捕獲活鼠107只,鼠種組成和分布見表1。
表12015年7-12月在江西省口岸及國檢監管區捕獲的鼠種類及分布
Tab.1Species and distributions of the rats captured from Jiangxi Ports and supervision areas during July to December 2015
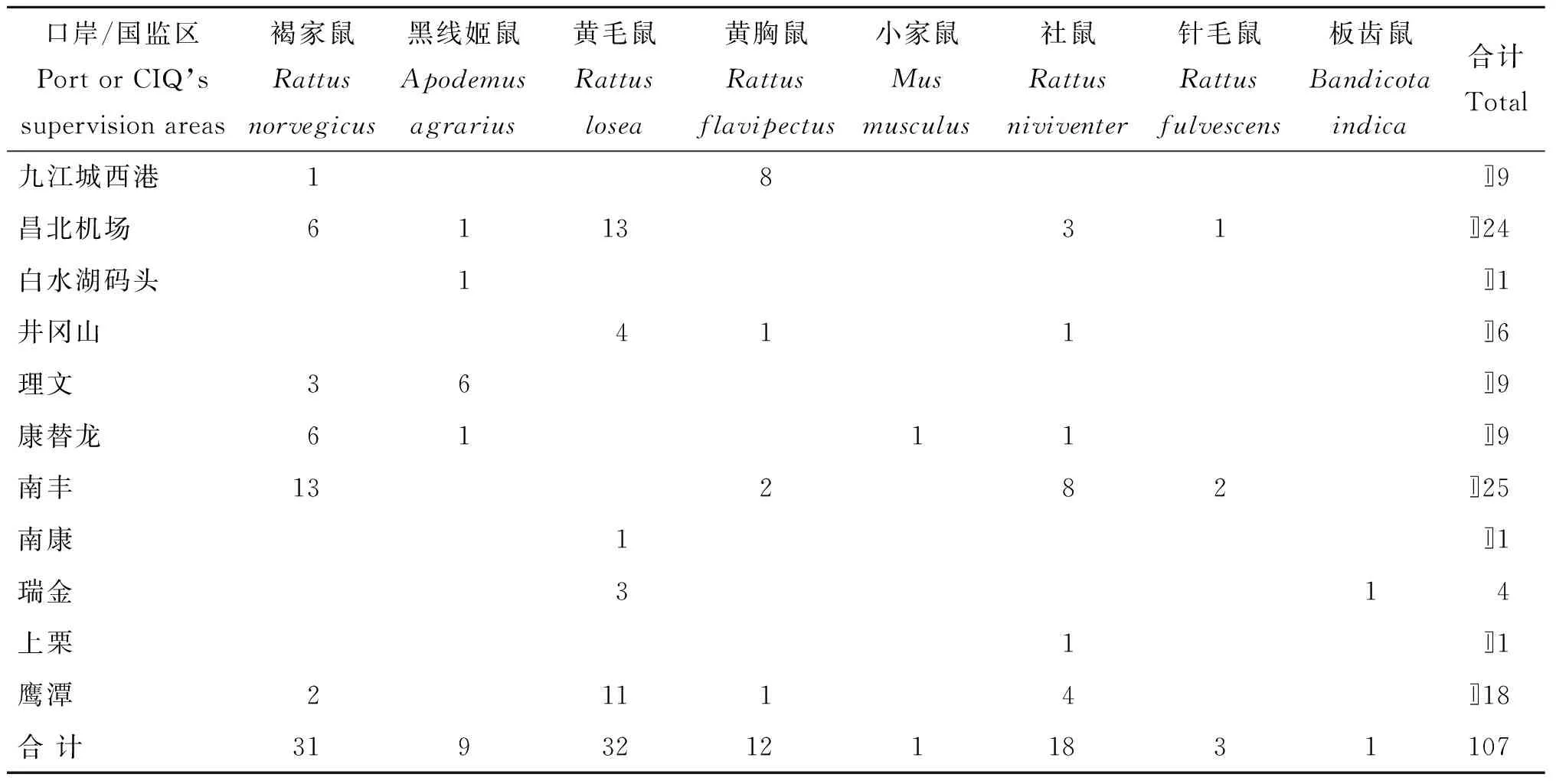
口岸/國監區PortorCIQ’ssupervisionareas褐家鼠Rattusnorvegicus黑線姬鼠Apodemusagrarius黃毛鼠Rattuslosea黃胸鼠Rattusflavipectus小家鼠Musmusculus社鼠Rattusniviventer針毛鼠Rattusfulvescens板齒鼠Bandicotaindica合計Total九江城西港18?9昌北機場611331?24白水湖碼頭1?1井岡山411?6理文36?9康替龍6111?9南豐13282?25南康1?1瑞金314上栗1?1鷹潭21114?18合計319321211831107
1.1.2試劑核酸提取試劑盒購自凱杰生物公司,熒光定量PCR檢測試劑盒購自上海之江生物公司,Taq DNA酶Mix和100 bp DNA Marker 購自康為世紀生物公司;瓊脂糖和染色劑購自上海生工生物公司。
1.1.3設備全自動核酸提取儀為凱杰QIAcube HT型號,生物樣本勻質儀為奧盛公司Bioprep-24型號,熒光定量PCR儀為伯樂CFX96Touch型號,普通PCR儀為伯樂T100型號,凝膠成像系統為伯樂GelDoc XR系統。
1.2實驗方法
1.2.1DNA的提取無菌條件下在生物安全柜內提取鼠腎組織50 mg左右,放入裝有研磨珠和450 μL ATL裂解液的研磨管中,使用生物樣品均質儀進行研磨勻漿,12 000 r/min離心2 min后,上機提取DNA。提取試劑采用凱杰公司的核酸提取試劑盒(貨號:54161),按照說明書操作,提取出來的DNA放在-20 ℃冰箱保存。
1.2.2熒光定量PCR檢測對提取出來的DNA首先用上海之江公司的鉤端螺旋體核酸檢測試劑盒進行病原體檢測,按照說明書操作。
1.2.3特異性PCR擴增根據相關文獻[10-11],合成鉤端螺旋體sec Y和23S rRNA基因引物,對樣本進行特異性擴增,引物見表2。反應體系為Taq酶 mix 12.5 μL,上游引物和下游引物各1 μL,DNA模板2 μL,最后加ddH2O補足到25 μL。反應條件是95 ℃,5 min,之后95 ℃ 30 s;55 ℃ 1 min;72 ℃ 1 min,反應35個循環,最后72 ℃ 10 min。PCR產物經1.5%瓊脂糖凝膠電泳,出現特異性條帶送生工公司測序。
表2鉤端螺旋體特異性PCR擴增引物
Tab.2Two pairs of specific primers used to amplify Leptospira
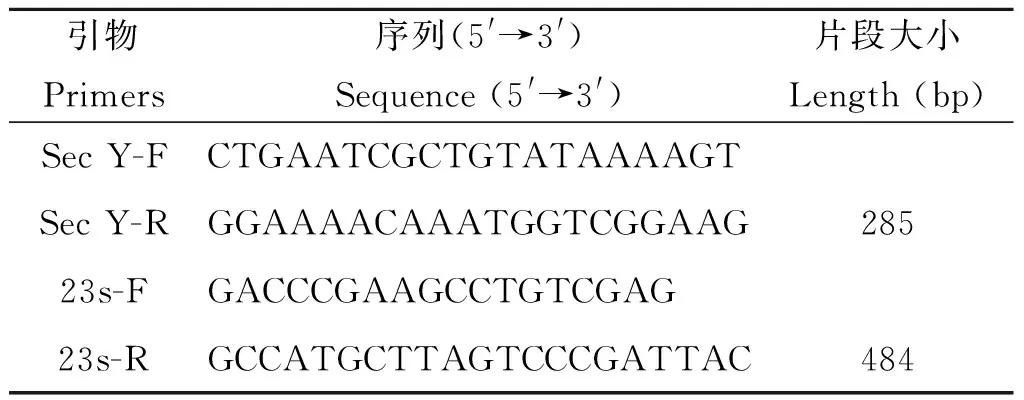
引物Primers序列(5'→3')Sequence(5'→3')片段大小Length(bp)SecY-FCTGAATCGCTGTATAAAAGTSecY-RGGAAAACAAATGGTCGGAAG28523s-FGACCCGAAGCCTGTCGAG23s-RGCCATGCTTAGTCCCGATTAC484
1.2.4基因序列分析將得到的片段序列在NCBI-BLAST平臺進行同源性比對,選擇同源性接近的鉤端螺旋體為代表株進行種系進化分析。利用Mega 6軟件構建系統進化樹。
2 結 果
2.1熒光定量PCR檢測結果對107只鼠進行鉤端螺旋體熒光檢測,共發現12例陽性,總的陽性率為11.2%。其中,褐家鼠6只,在總捕獲的褐家鼠中所占比重為19.4%;黃毛鼠3只,所占比重為9.4%;黃胸鼠1只,所占比重為8.3%;社鼠2只,所占比重為11.1%。陽性鉤端螺旋體樣本來源地分布見表3,熒光曲線見圖1。
表3陽性鉤端螺旋體樣本來源地分布
Tab.3Distribution of the positive Leptospira

來源地Origin褐家鼠Rattusnorvegicus黃毛鼠Rattuslosea黃胸鼠Rattusflavipectus社鼠Rattusniviventer合計Total康替龍33南豐1124鷹潭11昌北機場123瑞金11合計631212
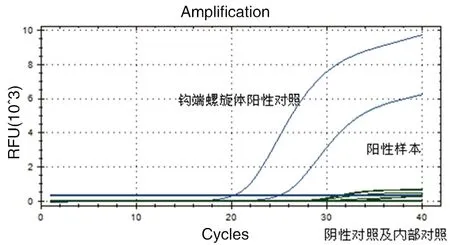
圖1 熒光定量PCR檢測結果圖Fig.1 Results of fluorogenic quantitative PCR
2.2特異性PCR擴增結果對107只鼠腎組織樣品進行sec Y基因和23S rRNA基因特異性擴增,結果與實時定量PCR結果一致,共發現12例陽性,擴增片段電泳檢測與預期大小一致,見圖2。

M: 100 bp Marker. 1: 23S rRNA negative control; 2: 23S rRNA positive specimen; 3: sec Y negative control; 4: sec Y positive specimen.圖2 特異性PCR擴增結果Fig.2 Results of specific PCR
2.3基因進化樹分析將測序所得的陽性樣本序列在NCBI-BLAST平臺進行同源性比對。建立基于sec Y基因和23S rRNA基因序列的系統進化樹(圖3,4)。結果顯示,12例陽性樣本中有11例為問號鉤端螺旋體,其23S rRNA 基因與8株問號鉤端螺旋體聚在一起,sec Y基因也與8株問號鉤端螺旋體聚在一起;1例為博氏鉤端螺旋體,其23S rRNA 基因與2株博氏鉤端螺旋體聚在一起,sec Y基因與4株博氏鉤端螺旋體聚在一起。兩個基因片段得到的同源性對比結果一致。

The dots were the 12 cases of positive Leptospira.圖3 鉤端螺旋體sec Y基因系統進化樹Fig.3 Phylogenic tree of Leptospira sec Y gene
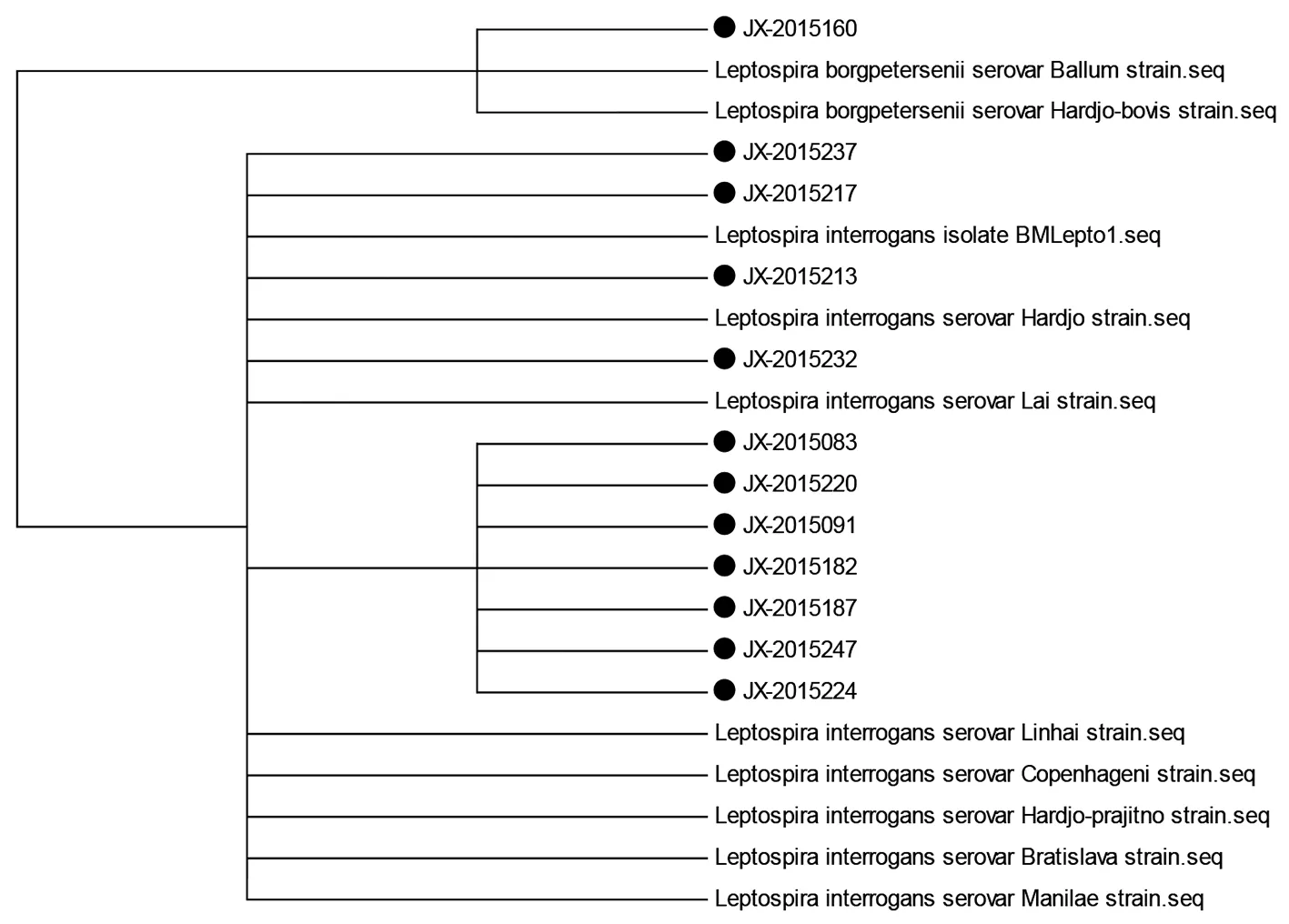
The dots were the 12 cases of positive Leptospira.圖4 鉤端螺旋體23S rRNA基因系統進化樹Fig.4 Phylogenic tree of Leptospira 23S rRNA gene
3 討 論
由致病性鉤端螺旋體引起的鉤端螺旋體病是一種人獸共患病,對動物和人類健康都產生重大的威脅。盡管目前還沒有全球患病人數的精確統計,近期,WHO給出了一個估計數據,即每年將近500 000患有嚴重的鉤端螺旋體病[12-13]。口岸及國檢監管區作為出入境的特殊區域,其出入境人員相對復雜,環境相對特殊,因此,在這些區域對捕獲的鼠類樣品進行鉤端螺旋體感染情況監測,不僅能夠了解口岸區域鉤體的傳播規律,也能有效的防止鉤端螺旋體病從口岸的傳入和傳出。目前,PCR檢測方法,因其檢測周期短,靈敏度高,已經普遍應用于實驗室鉤端螺旋體的檢測[10,14]。本研究采用實時定量PCR方法和特異性PCR擴增方法對江西省2個口岸和9個國檢監管區捕獲的107只鼠腎樣本進行了致病性鉤端螺旋體的檢測,共發現12例陽性,分別來自昌北機場、康替龍國檢監管區、南豐國檢監管區、鷹潭國檢監管區和瑞金國檢監管區,總的陽性率達11.2%。其中,褐家鼠陽性率最高,達所捕獲褐家鼠總數的19.4%。其次是社鼠,陽性率為11.1%,黃毛鼠和黃胸鼠的陽性率也將近10%。就口岸而言,昌北機場口岸陽性率為12.5%(3/24),其他四個國檢監管區的陽性率分別為康替龍國檢監管區33.3%(3/9),瑞金國檢監管區25%(1/4),南豐國檢監管區16%(4/25),鷹潭國檢監管區5.6%(1/18)。由此可以看出,在江西口岸及國檢監管區鼠類攜帶的鉤端螺旋體陽性率很高,因此有必要在這些陽性區域內實施必要的滅鼠防鼠措施,防治鉤端螺旋體病在鼠與人類之間的傳播,保障口岸安全。
兩種PCR檢測方法所得結果一致。熒光定量PCR檢測精度高,周期短,操作簡單,也有成品試劑盒可用于檢測,適用于口岸一線對鉤端螺旋體的快速檢測;特異性PCR擴增方法可以特異性擴增鉤端螺旋體的某個片段基因,陽性擴增產物經測序可以分析出鉤端螺旋體的種類,適用于對鉤端螺旋體血清型的進一步研究。本研究發現的12例鉤端螺旋體經同源性對比和聚類分析,結果為11例問號鉤端螺旋體和1例博氏鉤端螺旋體。2個基因同源性對比結果一致。其中,博氏鉤端螺旋體來自鷹潭國檢監管區,其他問號鉤端螺旋體則來自其他4個口岸及國檢監管區。說明江西口岸及國檢監管區鼠類感染的鉤端螺旋體為問號鉤端螺旋體和博氏鉤端螺旋體。
[1] Xu J, Guo XK, Jiang SC. Advances of the research on pathogenesis of Leptospira[J]. Inter J Epidemiol Infect Dis, 2006, 33(3): 167-170. (in Chinese)
徐靜,郭曉奎,姜敘誠. 鉤端螺旋體致病機制的研究進展[J].國際流行病學傳染病學雜志,2006,33(3):167-170.
[2] Feng YF, Xing J, Gong W, et al. Investigation ofLeptospirainfection in three new experimental animals by PCR methods[J]. Chin J Comp Med, 2014, 24(8): 31-35. (in Chinese)
馮育芳,邢進,鞏薇,等.應用PCR方法對3種新型實驗動物鉤端螺旋體感染情況的調查研究[J].中國比較醫學雜志,2014,24(8):31-35.
[3] Kobayashi Y. Human leptospirosis: management and prognosis[J]. J Postgrad Med, 2005, 51(3): 201-204.
[4] Li ZL, Sun JM, Jiang LP, et al. Application of InvA-PCR in leptospirosis detection in Pan′an[J]. Chin J Hlth Lab Technol, 2012, 22(10): 2360-2363. (in Chinese)
李鐘梁,孫繼明,姜理平,等. InvA-PCR應用于磐安縣鉤端螺旋體病檢測的研究[J].中國衛生檢驗雜志, 2012, 22(10):2360-2363.
[5] Smythe LD, Smith IL, Smith GA, et al. A quantitative PCR (TaqMan) assay for pathogenicLeptospiraspp[J]. BMC Infect Dis, 2002, 2: 13.
[6] Anne MS, Jens AH, Sabrina S, et al.Leptospiraspp. in rodents and shrews in Germany[J]. Int J Environ Res Public Hlth, 2014, 11: 7562-7574.
[7] Jiang LP, Meng Z, Cheng SY, et al. Development and application of a PCR method for detection ofLeptospirain Zhejiang Province[J]. Chin J Hlth Lab Technol, 2007, 17(8): 1392-1394. (in Chinese)
姜理平,孟真,程蘇云,等. 浙江省鉤端螺旋體PCR檢測方法建立與應用[J].中國衛生檢驗雜志, 2007, 17(8): 1392-1394.
[8] Yan SP, Liu FQ, Chen LZ. Research progress of PCR detection technology of leptospirosis[J]. Chin J Nat Med, 2009, 11(4): 313-316. (in Chinese)
顏仕鵬,劉富強,陳立章.鉤端螺旋體病PCR檢測技術的研究進展[J].中國自然醫學雜志, 2009, 11(4): 313-316.
[9] Lei JB, Wang LH, Zhang Y, et al. Analysis ofLeptospiradetection using two kinds of PCR[J]. Chin J Hlth Lab Technol, 2008, 18(6) :1209-1210. (in Chinese)
雷金寶,王黎洪,張英,等. 二種PCR檢測方法應用于鉤端螺旋體檢測結果分析[J].中國衛生檢驗雜志,2008,18(6):1209-1210.
[10] Hu Q, Ma SJ, Zou CY, et al. Detection and phylogenetic analysis ofLeptospiraspp. carried by rodents[J]. J Pathog Biol, 2015, 10(5): 427-429. (in Chinese)
胡群,馬思杰,鄒春穎,等.鼠類感染鉤端螺旋體的PCR檢測和基因序列分析[J].中國病原生物學雜志, 2015, 10(5):427-429.
[11] Jin WE, Jiang LP, Chen XF. Development and application of PCR detection forLeptospirain Quzhou[J]. Dis Surveill, 2007, 22(11): 726-729. (in Chinese)
金莞爾,姜理平,陳旭富.浙江省衢州市應用聚合酶鏈反應檢測鉤端螺旋體效果評價[J]. 疾病監測, 2007, 22(11):726-729.
[12] Abela RB, Sikkema R, Hartskeerl RA. Estimating the burden of human leptospirosis[J]. Int J Antimicrob Agents, 2010, 36 (Suppl 1): S5-S7.
[13] Jason SL, Michael AM, Joseph M V, et al. Leptospiral pathogenomics[J]. Pathogens, 2014, 3: 280-308.
[14] Tan ZM, Tang FY, Zhou L. Rapid detection of pathogenicLeptospiraspp. by quantitative real-time PCR[J]. Chin J Hlth Lab Technol, 2011, 21(7): 1701-1702. (in Chinese)
談忠鳴,湯奮揚,周璐. Real-time PCR快速檢測鉤端螺旋體方法的建立[J].中國衛生檢驗雜志,2011,21(7):1701-1702.
Detection and sequencing analysis ofLeptospiracarried by rats from Jiangxi Port and Entry-Exit Inspection and Quarantine Bureau’s supervision areas
ZHAO Ming-hui, XU Tie-long, ZHANG Qiang, HU Ting,WANG Jian-jun, LIU Kai-ming, LIAO Yun
(JiangxiInternationalTravelHealthcareCenter,Nanchang330002,China)
To detect theLeptospiracarried by rats in Jiangxi Ports and Entry-Exit Inspection and Quarantine Bureau’s (CIQ) supervision areas, rats captured from 2 ports and 9 supervision areas of Jiangxi were tested during July to December, 2015. Fluorescent quantitative PCR and specificity PCR amplification were used to test the samples. There were 12 positive cases ofLeptospiraamong the 107 rats (11.2%), including 6 cases ofRattusnorvegicus, 3 cases ofRattuslosea, 1 case ofRattusflavipectusand 2 cases ofRattusniviventer, which were captured from Changbei airport, Kangtilong, Nanfeng, Yingtan and Ruijin CIQ’s supervision areas. Homology comparison and phylogenetic analysis showed that there were 11 cases ofLeptospirainterrogansand 1 case ofLeptospiraborgpetersenii. Therefore, the study could confirm the existence ofLeptospirainterrogansandLeptospiraborgpeterseniiin Jiangxi Ports and CIQ’s supervision areas. And those two kinds of PCR detection methods could be applied to theLeptospiradetection in ports and supervision areas.
port; entry-exit inspection and quarantine bureau’s supervision areas; rats;Leptospira
Liao Yun, Email: zhihan1214@sina.com
廖蕓, Email:zhihan1214@sina.com
江西國際旅行衛生保健中心,南昌330002
R377.5
B
1002-2694(2016)07-0674-05
2016-01-07;
2016-04-11
DOI:10.3969/j.issn.1002-2694.2016.07.017

