89%級碳酸鋰轉電池級碳酸鋰氫化工藝研究
孫哲(新疆有色金屬研究所 烏魯木齊 830026)
89%級碳酸鋰轉電池級碳酸鋰氫化工藝研究
孫哲
(新疆有色金屬研究所烏魯木齊830026)
使用鹵水制備的純度為89%碳酸鋰產品為原料,采用氫化熱分解工藝對其提純制備電池級99.5%碳酸鋰。研究了氫化溫度、固液比、氫化時間和CO2氣體流速4個因素對最終產品主含量和產品鋰直收率的影響。實驗結果表明,在最優工藝條件下,可使Li2CO3產品的純度由89%提高到99.5%以上,各項雜質含量達到電池級級別,鋰直收率大于74%。
碳酸鋰電池級氫化熱分解提純
1 概述
電池級碳酸鋰是生產鋰離子電池正極材料和電解質的關鍵原料。隨著全球新能源開發的升溫,可再生能源儲能和汽車動力鋰離子電池發展迅速,由此也推動了電池級碳酸鋰市場消費的飛速增長。
隨著近年來國內外鹽湖鹵水生產工業級碳酸鋰產量的不斷擴大,其價格也逐漸降低,導致使用鹽湖工業級碳酸鋰作為原料制備電池級碳酸鋰生產成本將更為低廉。提純制備電池級碳酸鋰的方法很多,如苛化法、重結晶法、氫化熱分解法等。而氫化熱分解法制備電池級碳酸鋰具有工藝簡單、可操作性強、環境污染較小等優點,目前應用廣泛。該方法是將原料工業級碳酸鋰與高純水混合,在氫化塔中從底部通入高純CO2氣體,待反應一定時間后,過濾不可溶雜質。得到的濾液再通過熱分解、濃縮、過濾、烘干,得到電池級碳酸鋰。
本實驗采用鹵水制備而得的純度為89%碳酸鋰產品為原料。通過氫化熱分解工藝對其提純。研究了氫化溫度、固液比、氫化時間和CO2氣體流速4個因素對最終產品主含量和產品鋰直收率的影響。
2 實驗部分
取一定量的鹽湖89%級碳酸鋰于特制氫化塔中并與純水充分混合,控制氫化溫度,同時通入特定流速的CO2氣體。待氫化過程結束后使用布氏漏斗抽濾得到濾液,濾液在一定溫度的水浴鍋中加熱熱分解,加熱過程中持續攪拌,以防止Li2CO3結壁。沉淀產物用抽濾瓶和布氏漏斗過濾,烘干后得到電池級Li2CO3產物。
3 結果分析
3.1氫化溫度的影響
稱取200g的89%級工業碳酸鋰于6 L的特制氫化塔中,固液質量比為l∶25,氣體流速為4 L/min,分別選擇氫化溫度為10、15、20、25、30、40℃,氫化60min后用布氏漏斗抽濾得到氫化液,測定液相中鋰離子含量,考察氫化溫度對碳酸鋰溶解程度的影響。實驗結果見表1。

表1 氫化溫度影響數據
升高反應溫度會使化學反應速率加快。CO2氣體、Li2CO3和LiHCO3的溶解度又都隨溫度的升高而減小,使傳質推動力減小,從而導致反應速率減慢。由表1可以看出,隨著溫度的升高,溶解到氫化液中的鋰離子越少。由實驗數據可知,高溫不利于氫化反應的進行。結合具體操作環境總實際情況和中對節能的考慮,實驗選擇在室溫(20℃)條件下開展。
3.2固液比的影響
取200g的89%級工業碳酸鋰于6 L的特制氫化塔中,在室溫條件下進行反應,反應時間60min,氣體流速為4 L/min,固液比(質量比)選擇1∶20、1∶25、1∶30、1∶35、1∶40。完成氫化反應后用布氏漏斗抽濾得到氫化清液,再經過熱分解、離心固液分離、烘干,得到Li2CO3產品。考察氫化固液比對碳酸鋰直收率的影響。實驗結果見表2。
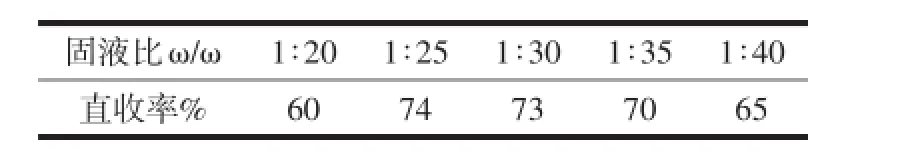
表2 固液比影響數據
從表2可以看出,在本次實驗范圍內,隨著固液比的降低,Li2CO3直收率明顯增加。當固液比從1∶20降低到1∶30時,產率從最初的60%增加到將近74%。主要原因是在Li2CO3質量固定條件下,隨著純水量的增多,通入的CO2氣體與Li2CO3漿料接觸時間更長,接觸面積更大,反應更完全,致使產物的直收率增加。但是當固液比進一步降低時,產品收率會逐漸下降,這是因為Li2CO3在純水中的溶解度是一定的,隨著純水量的增加,溶解在水中的Li2CO3的量也會增加,從而導致最終產品直收率的下降。因此,綜合考慮以上條件,確定固液比為1∶25。
3.3氫化時間的影響
取200g的89%級工業碳酸鋰于6 L的特制氫化塔中,在室溫條件下進行反應,固液質量比為l∶25,氣體流速為4 L/min,氫化時間30min、40min、50min、60min、70min、80min。主要考察不同氫化時間對Li2CO3產品產率的影響,實驗結果見表3。

表3 氫化時間影響數據
由表3可以看出,隨著氫化反應時間的延長,Li2CO3直收率和純度均有所增加,氫化時間進一步延長到60min之后,Li2CO3直收率和純度變化范圍較小。主要是因為隨著氫化時間延長,原料Li2CO3與CO2接觸更加充分,反應完全,溶液中LiHCO3濃度逐漸增加,導致產品直收率和純度都增加。但溶液中LiHCO3濃度達到飽和之后再繼續延長氫化反應時間則無明顯效果。反應60min后產品級別已達電池級99.5%標準。綜合考慮氫化時間對產品直收率和純度的影響,確定氫化時間為60min。
3.4CO2氣體流速的影響
取200g的89%級工業碳酸鋰于6 L的特制氫化塔中,在室溫條件下進行反應,固液質量比為l∶25,氫化時間60min,CO2氣體流速分別控制為2 L/min、4 L/min、8 L/min、10 L/min,主要考察不同氣體流速對Li2CO3產品直收率和純度的影響,實驗結果見表4。
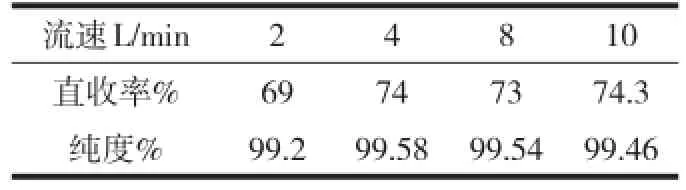
表4 CO2氣體流速的影響數據
由表4可以看出,隨著CO2流速的增加,Li2CO3的純度與收率均有所增加。當流速達到4 L/min時,純度與直收率均達到最大值,之后再增加CO2流速,純度與直收率都基本不變。隨著CO2流速的增加導致CO2氣體與Li2CO3漿料的接觸面積更大,反應也充分,氣體與液體充分混合,使Li2CO3固體能更迅速的反應成為LiHCO3。但在流速達到4 L/min后,繼續增大流速,對產品直收率和純度的影響并不顯著。因此,控制反應中CO2氣體流速在4 L/min較為合適。綜合考慮CO2氣體流速對產品直收率和純度的影響,氣體流速確定為4 L/min。
4 結論
通過氫化條件對89%級碳酸鋰提純影響的實驗研究,確定了氫化熱分解法提純制備電池級碳酸鋰的最佳工藝條件。實驗結果表明,Li2CO3氫化溫度控制在室溫(20℃)最為合理,固液比1∶25,氫化時間60min,CO2氣體流速4 L/min,產品純度和直收率較優,純度可達電池級標準99.5%以上,產率在74%左右。但整個氫化熱分解過程中,母液流通量較大,下一步還需采取母液循環的方式,進一步提高產品直收率。
[1]王運其.淺談高純碳酸鋰的制備方法[J].新疆有色金屬,2009,32(z1):92.
[2]伊文濤,閆春燕,馬培華,等.碳酸鋰碳化反應動力學研究[J].化工礦物與加工,2006,35(12):21-24.
收稿:2016-05-27
10.16206/j.cnki.65-1136/tg.2016.05.029

