農桿菌侵染條件對柱花草遺傳轉化效率的影響
陳彩虹,釧秀娟,王薈,賈艷星,陳志堅,劉國道,羅麗娟*
(1.海南大學園藝園林學院,海南 海口 570228;2.中國熱帶農業科學院熱帶作物品種資源研究所,海南 儋州 571737)
?
農桿菌侵染條件對柱花草遺傳轉化效率的影響
陳彩虹1,釧秀娟1,王薈1,賈艷星1,陳志堅2,劉國道2,羅麗娟1*
(1.海南大學園藝園林學院,海南 海口 570228;2.中國熱帶農業科學院熱帶作物品種資源研究所,海南 儋州 571737)
在前期建立的柱花草高效組織再生體系基礎上,進一步以柱花草熱研5號的下胚軸為受體材料,以GUS基因為報告基因,研究了農桿菌介導的柱花草遺傳轉化的幾個影響因素,包括根癌農桿菌菌液濃度、浸染時間和共培養時間等對農桿菌介導的柱花草遺傳轉化效率的影響。結果表明,以柱花草下胚軸為外植體,在農桿菌菌液濃度(OD600)為0.4~0.6,農桿菌浸染時間為15 min和共培養3 d的條件下,愈傷的轉化效率為72%。愈傷組織進一步經過分化、生根和煉苗等過程后,對轉化植株進行GUS染色和PCR檢測,結果表明外源基因已成功整合到柱花草基因組中。本研究結果對柱花草遺傳轉化和關鍵基因功能研究具有重要的參考價值。
根癌農桿菌;遺傳轉化;GUS染色;柱花草
柱花草(Stylosanthesspp.)是一種重要的豆科牧草,主要分布在熱帶、亞熱帶以及溫帶地區[1]。“熱研5號”柱花草是從哥倫比亞國際熱帶農業中心(CIAT)引進的CIAT184柱花草群體中,通過對早花、耐寒和抗病等性狀的單株選育而成,已被種植于我國南方地區,其具有高產、抗炭疽病和耐寒等特點[2]。隨著研究技術手段的發展,柱花草在生理生化特性[3]、遺傳多樣性[4]和植株再生以及遺傳轉化[5]等方面吸引了廣泛的關注和研究。然而,由于存在著可利用資源少、遺傳能力弱和易感染炭疽病等限制因素[6],嚴重制約了柱花草深入研究的開展。為了解決在柱花草中存在的上述問題,最有效和最常用的研究手段就是通過生物技術方法對柱花草進行遺傳改良。
根癌農桿菌介導的植物遺傳轉化是一種最常用的轉基因方法,在水稻(Oryzasativa)、玉米(Zeamays)、高粱(Sorghumbicolor)和大豆(Glycinemax)中都有成功的研究報道[7-10]。不同品種柱花草的組織再生以及遺傳轉化已有文獻報道,如S.hamata[11],S.humilis[12-13]和S.guianensis等[5,14]。Manners和Way[13]采用葉盤轉化法將載體pGV3850:103neo轉化S.humilis,并獲得轉基因植株。Wang等[15]采用葉盤轉化法將口蹄疫病毒外殼蛋白VP1基因轉化到柱花草栽培品種“熱研二號”中,獲得了轉基因植株。但是,迄今為止,國內外并未有從農桿菌浸染條件方面對柱花草遺傳轉化條件進行摸索和優化。并且,由于轉化效率低,在轉基因柱花草植株中進行基因功能分析只有少量文獻被報道[15-16],表明了柱花草是一種難以被根癌農桿菌介導轉化的豆科牧草。因此,對農桿菌介導的遺傳轉化條件進行摸索和優化,在穩定的組織再生體系基礎上,建立和優化柱花草遺傳轉化體系,對柱花草遺傳改良和基因功能研究有著重要的意義。
農桿菌介導的遺傳轉化效率受許多因素的影響,包括植物種類、外植體選擇、愈傷組織誘導和分化、農桿菌浸染條件等方面[7-10]。本研究在前期建立的柱花草“熱研5號”組織再生體系基礎上[17],從農桿菌浸染條件方面對柱花草遺傳轉化條件進行摸索和優化,利用GUS染色方法分析轉化效率,并通過PCR檢測來鑒定轉基因柱花草植株,為柱花草遺傳改良和重要基因功能研究提供重要的技術支持。
1 材料與方法
1.1材料
1.1.1植物與載體菌株柱花草為“熱研5號”品種(Stylosanthesguianensiscv. Reyan No. 5),由中國熱帶農業科學院品種資源研究所牧草中心提供,2014年10月13日種無菌苗;根癌農桿菌為EHA105(Agrobacteriumtumefaciens),載體質粒為pCAMBIA 1301(含GUS報告基因及潮霉素Hyg篩選標記)。
1.1.2試劑材料DNA聚合酶(Premix Taq Version 2.0)和DNA分子量標準(DNA Ladder Marker)均購自大連TaKaRa公司;新型廣譜植物基因組DNA快速提取試劑盒購自北京蓋寧金諾生物技術有限責任公司;卡那霉素、利福平、潮霉素、乙酰丁香酮均購自北京索萊寶有限公司;PCR引物合成由北京六合華大基因科技股份有限公司合成完成;常規化學藥品及組織培養所用試劑均為國產AR級分析純。
1.2方法
1.2.1無菌苗的培養無菌苗培養參照釧秀娟等[17]方法進行,待子葉完全展開后備用。
1.2.2農桿菌菌液的制備將含質粒pCAMBIA 1301的農桿菌EHA105菌液,劃線培養于含有50 mg/L卡那霉素和50 mg/L 利福平的YEB固體培養基上(表1),于28℃培養2 d。挑取單克隆接種于含有50 mg/L卡那霉素和50 mg/L利福平的YEB液體培養基中28℃培養過夜。將20 μL菌液加入到添加相應抗生素的50 mL YEB液體培養基中培養至OD600為0.6。菌液于25℃,4000 r/min離心10 min,去上清,菌體沉淀用50 mL新鮮YEB液體培養基重懸使其最終OD600為0.6[18]。
1.2.3農桿菌介導的遺傳轉化、抗性愈傷的篩選和植株再生將下胚軸置于農桿菌(菌液OD600為0.6)懸浮液中浸染15 min,并于25℃共培養3 d后,將外植體材料轉移至含200 mg/L羧芐青霉素(Carb)的CIM培養基上恢復培養1周,隨后轉移至含15 mg/L Hyg和200 mg/L Carb的CIM培養基中進行篩選和再生。28 d后將抗性愈傷轉移至含15 mg/L Hyg和200 mg/L Carb的芽誘導胚芽培養基(表1,SIM)中,10~30 d后有體胚形成,并將成熟的體胚轉入含200 mg/L Carb的狀芽(表1,SEM)培養基中,待叢生芽長到2 cm時,從基部切斷叢生芽并轉移至含200 mg/L Carb的生根培養基(表1,RM)中培養,15 d后可獲得抗性再生植株。將生根良好的再生植株經閉瓶煉苗、開瓶煉苗和移栽后,即可定植。
1.2.4轉化條件的優化農桿菌菌液濃度摸索:取下胚軸分別置于含不同農桿菌菌液濃度(OD600為0.2,0.4,0.6和0.8)的懸浮液中浸泡15 min,無菌濾紙瀝干殘留的菌液,然后轉移至愈傷誘導培養基(表1,CIM)中,于25℃暗培養3 d后,進行恢復及篩選培養,通過GUS染色結果統計篩選后的陽性轉化愈傷數量。每個處理設置3個生物學重復。
農桿菌浸染時間摸索:取下胚軸分別置于OD600為0.6的農桿菌懸浮液中浸泡不同時間(5,10,15和20 min),無菌濾紙瀝干殘留的菌液,然后轉移至愈傷誘導培養基(表1,CIM)中,于25℃暗培養3 d后,進行恢復及篩選培養,通過GUS染色結果統計篩選后的陽性轉化愈傷數量。每個處理設置3個生物學重復。
共培養時間篩選:下胚軸于OD600為0.6的農桿菌懸浮液浸染15 min,無菌濾紙瀝干殘留的菌液,然后轉移至愈傷誘導培養基(表1,CIM)中,于25℃共培養1到4 d后,進行恢復及篩選培養,通過GUS染色結果統計篩選后的陽性轉化愈傷數量。每個處理設置3個生物學重復。
1.2.5GUS染色分析GUS染色參照Jefferson[19]方法進行。將轉化材料浸在GUS染液中,于37℃中反應8~10 h,取出放入75%乙醇中脫色12 h,然后在實體顯微鏡觀察外植體染色情況。
1.2.6PCR鑒定轉化植株提取再生柱花草植株葉片的基因組DNA后,通過PCR擴增GUS基因,引物序列分別為F:5′-TCGCGCAAGACTGTAACCAC-3′和 R:5′-CTTTAGGCATTGGTTTCGAAGC-3′。PCR 擴增條件為:94℃預變性5 min,94℃變性30 s,57℃退火30 s,72℃延伸30 s,30個循環,最后72℃延伸10 min,隨后將PCR擴增產物進行瓊脂糖凝膠電泳檢測。
轉化效率(%)=GUS染色陽性數/篩選后的愈傷總數×100
1.3數據統計分析
所有數據均用Microsoft office excel 2003進行處理,采用SPSS軟件(v13.0)進行數據統計分析。
2 結果與分析
2.1柱花草的遺傳轉化
以柱花草熱研5號下胚軸為外植體,農桿菌介導遺傳轉化的共培養時期、恢復培養時期、愈傷篩選、誘芽、壯芽、生根以及移栽等過程如圖1所示。
2.2不同農桿菌浸染條件對愈傷組織轉化效率的影響
在農桿菌介導的遺傳轉化中,農桿菌菌液濃度、浸染時間和共培養時間均對轉化效率有顯著的影響。從圖2A可以看出,隨著農桿菌菌液濃度升高,愈傷組織的轉化效率有增加的趨勢,當OD600為0.4到0.6時,轉化效率最高,約達60%;但是,隨著菌液濃度增加,轉化效率有降低的趨勢,當OD600為0.8時,轉化效率為52%,且愈傷組織分化率降低,并逐漸褐化。所以,OD600為0.4~0.6是最適合的農桿菌菌液浸染濃度。
從圖2B可以看出,隨著農桿菌浸染時間延長,愈傷組織的轉化效率有明顯增加的趨勢,當浸染時間為15 min時,轉化效率最高,轉化效率為浸染5 min時的2.3倍;但是,隨著浸染時間的繼續增加,轉化效率顯著降低,且對愈傷組織造成傷害,浸染時間20 min時的轉化效率僅為15 min時的16%,差異顯著。所以,最佳的農桿菌浸染時間為15 min。

圖2 不同農桿菌浸染條件對轉化效率的影響Fig.2 Factors affecting the transformation efficiencies of stylo A:農桿菌菌液濃度;B:浸染時間;C:共培養時間。A: Agrobacterium concentration; B: Infected time; C: Co-culture duration. 不同字母表示差異顯著(P<0.05)。Different letters indicate significant difference (P<0.05).
共培養時間顯著影響愈傷組織的轉化效率。圖2C結果表明,隨著共培養時間的延長,愈傷組織的轉化效率有顯著增加的趨勢,當共培養時間為3 d時,愈傷組織轉化效率最高,為72%,轉化效率分別為共培養1和2 d時的2.7和1.3倍;但是,隨著共培養時間繼續延長,愈傷組織轉化效率降低,共培養4 d時的轉化效率僅為3 d時的61%,且愈傷組織周圍有大量農桿菌形成,影響后期愈傷組織生長。所以,最佳的共培養時間為3 d。
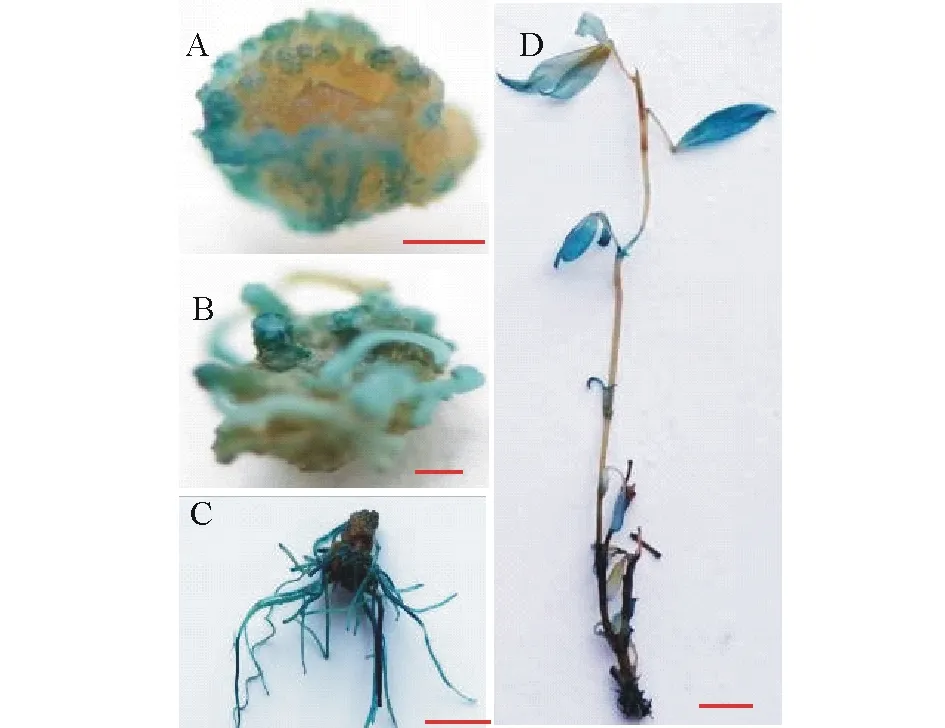
圖3 轉化材料GUS染色分析Fig.3 GUS staining analysis of transgenic material A:下胚軸外植體愈傷組織,標尺=100 μm;B:抗性芽,標尺=100 μm;C:根染GUS,標尺=1 cm;D:轉化植株,標尺=1 cm。A: Callus induced from hypocotyl, Bar=100 μm; B: Resistant shoots induced from callus, Bar=100 μm; C: Root dyeing GUS, Bar=1 cm; D:Putative transgenic plant, Bar=1 cm.
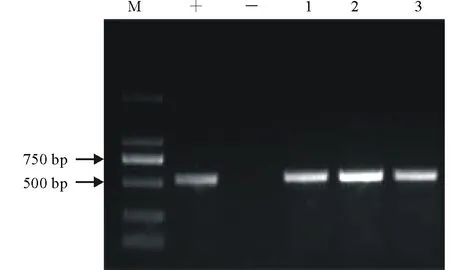
圖4 轉基因抗性植株PCR檢測Fig.4 PCR analysis of putative transgenic plant M:Mark;+:陽性對照(質粒);-:陰性對照(野生型植株);1~3:轉基因抗性植株。M: Mark; +: Positive control (plasmid); -: Negative (wild type plant); 1-3: Three putative transgenic plant.
2.3轉化材料GUS檢測
柱花草下胚軸根據上述優化后的農桿菌轉化條件進行處理,并經共培養和恢復培養、抗性愈傷組織誘導培養、抗性芽生長、生根和抗性苗移栽后,獲得可能的轉基因植株(圖1)。對不同階段的組織進行GUS染色分析,結果表明,處于篩選階段的愈傷組織經GUS染色后呈現出藍色,表明GUS基因已成功在愈傷組織中表達(圖3A);具有抗性的愈傷組織經過芽誘導后,GUS染色呈現藍色,表明GUS基因在抗性芽中表達(圖3B);抗性芽經生根和煉苗后,轉化植株和根的GUS染色呈現藍色,表明GUS基因已穩定的在柱花草植株中表達(圖3C,D)。
2.4轉基因植株的PCR檢測
本研究進一步對轉化后的再生植株在基因組水平上進行PCR檢測。我們從12株移栽的抗性植株隨機挑選3株并提取其葉片基因組DNA,通過PCR反應擴增GUS基因。結果表明,隨機挑選的3株轉化植株都能成功的擴增出563 bp的目的片段(圖4,1-3泳道),而野生型柱花草(-)則未能擴增出目的條帶。結果進一步證明了GUS基因已成功的整合到柱花草基因組中。
3 討論
根癌農桿菌介導的遺傳轉化已成為作物遺傳轉化的主要途徑之一,并可對植物性狀進行定向的遺傳改良[20-21]。在柱花草遺傳轉化研究中,國外對其組織再生和遺傳轉化方法進行了相關分析[5,12-13,15],國內就王冬梅等[22]從農桿菌浸染條件之農桿菌菌液濃度方面進行研究的相關報道。由于農桿菌介導的遺傳轉化效率受植物種類和農桿菌浸染條件等因素影響,因此,本研究主要從農桿菌浸染條件方面對柱花草遺傳轉化條件進行摸索和優化,結合GUS染色和PCR分析來鑒定轉基因柱花草植株。
農桿菌能否有效地附著并浸染外植體是遺傳轉化成功與否的關鍵。對農桿菌介導的紫花苜蓿(Medicagosativa)遺傳轉化條件進行摸索,包括農桿菌菌液濃度,浸染時間和共培養時間等,結果表明最佳的轉化條件為農桿菌菌液濃度OD600在0.3~0.5間,浸染時間為10~15 min,共培養時間為3 d,轉化效率高達72%[20]。在百脈根(Lotuscorniculatus),研究發現當農桿菌濃度OD600在0.5左右,浸染20 min和共培養3 d的條件下,百脈根遺傳轉化效率為50%[21]。在本研究中,我們發現當農桿菌菌液OD600為0.4~0.6時,浸染15 min和共培養3 d的條件下,可獲得較高的柱花草愈傷組織轉化效率(約72%),即為最適的農桿菌轉化條件,過低或過高的菌液濃度、浸染時間和共培養時間都對轉化效率和愈傷組織生長產生不利影響(圖2)。這與上述紫花苜蓿和百脈根轉化條件中的最適農桿菌菌液濃度和共培養時間相符,但與百脈根的浸染時間不一致,其可能是由于不同外植體材料受農桿菌浸染的敏感性不同。
柱花草的遺傳轉化始于1987年,Manners[12]以S.humilis為材料,將農桿菌懸浮液浸泡外植體2~5 min,共培養2 d,植株轉化效率約為0.3%。王冬梅等[22]以熱研二號為材料,將預培養2 d的外植體,用經10 μmol/L乙酰丁香酮預處理OD值為1.5的農桿菌和稀釋5倍番木瓜浸提液一起,采用農桿菌抽真空浸入法轉化柱花草,在加1.5 mg/L脯氨酸的共培養基上共培養,芽的轉化率可達20%。本研究在前人研究的基礎上通過對農桿菌浸染條件進行摸索后,使得柱花草的愈傷轉化效率高達72%,建立和優化了柱花草遺傳轉化體系,獲得轉基因柱花草。本研究結果對柱花草遺傳轉化和關鍵基因功能研究提供了可靠的依據,并為柱花草的遺傳改良奠定了基礎。
References:
[1]Liu G D, Phaikaew C, Stur W W.Stylosanthesdevelopment and utilization in China and south-east Asia. Journal of Tropical Grasslands, 1997, 31(5): 460-466.
[2]Liu G D, Bai C J, He H X,etal. The selection and utilization ofStylosanthesguianensiscv. Reyan No. 5. Acta Agrestia Sinica, 2001, 9(1): 1-7.
[3]Zhou B Y, Guo Z F. Effect of ABA and its biosynthesis inhibitor on chilling resistance and anti-oxidant enzymes activity. Acta Prataculturae Sinica, 2005, 14(6): 94-99.
[4]Jiang C S. The progress of studies onStylosanthes. Journal of Chinese Journal of Tropical Crops, 2005, 26(4): 104-108.
[5]Quecini V M, Alves A C, Vieiraet M L,etal. Factors influencing electroporation-mediated gene transfer toStylosanthesguianensis(Aubl.) Sw. protoplasts. Journal of Genetics and Molecular Research, 2002, 25(1): 73-80.
[6]Yang M X, Lin G B, Chen C H,etal. Microscopic observation ofStylosanthesinfected byColletotrichumgloeosporioides. Acta Prataculturae Sinica, 2015, 24(5): 175-181.
[7]Qin D J, Chen D X, Hu X,etal. Advances on genetic transformation of rice. Journal of Biology, 2008, 25(5): 5-9.
[8]Sun C b, Guo J, Tao R,etal. Study on genetic transformation system of maize mediated byAgrobacteriumtumefaciens. Journal of Chinese Agricultural Science Bulletin, 2012, 28(36): 71-75.
[9]Zhu L, Lang Z H, Li G Y,etal. Introduction of Btcry1Ahgene into sweet sorghum (SorghumbicolorL. Moench) byAgrobacteriumtumefaciens-mediated transformation. Journal of Scientia Agricultura Sinica, 2011, 44(10): 1989-1996.
[10]Muthukrishnan A, Kondeti S, Thankaraj S M,etal. Application of sonication in combination with vacuum infiltration enhances theAgrobacterium-mediated genetic transformation in indian soybean cultivars. Journal of Applied Microbiology and Biotechnology, 2015, 75: 2266-2287.
[11]Manners J M. Transformation ofStylosanthesspp. usingAgrobacteriumtumefaciens. Journal of Plant Cell Reports, 1987, 6: 204-207.
[12]Manners J M. Transgenic plants of the tropical pasture legumeStylosantheshumilis. Journal of Plant Science, 1988, 55: 61-68.
[13]Manners J M, Way H. Efficient transformation with regeneration of the tropical pasture legumeStylosantheshumilisusingAgrobacteriumrhizogenesand a Ti plasmid-binary vector system. Journal of Plant Cell Reports, 1989, 8: 341-345.
[14]Sarria R, Calderón A, Thro A M,etal.Agrobacterium-mediated transformation ofStylosanthesguianensisand production of transgenic plants. Journal of Plant Science, 1994, 96: 119-127.
[15]Wang D M, Zhu J B, Peng M,etal. Induction of a protective antibody response toFMDVin mice following oral immunization with transgenicStylosanthesspp. as a feed stuff additive. Journal of Transgenic Research, 2008, 17(6): 1163-1170.
[16]Bao G G, Zhuo C L, Guo Z F,etal. Co-expression ofNCEDandALOimproves vitamin C level and tolerance to drought and chilling in transgenic tobacco and stylo plants. Journal of Plant Biotechnology Journal, 2016, 1(14): 1-9.
[17]Chuan X J, Chen C H, Luo L J. Callus induction ofStylosanthesguianensiscv. Reyan No.5. Pratacultural Science, 2015, 32(1): 78-84.
[18]Tippani R, Yarra R, Bulle M,etal. In vitro plantlet regeneration andAgrobacteriumtumefaciensmediated genetic transformation of Indian Kino tree (PterocarpusmarsupiumRoxb.). Journal of Acta Physiologiae Plantarum, 2013, 35: 3437-3446.
[19]Jefferson R A. Assaying chimeric genes in plants: the GUS gene fusion system. Journal of Plant Molecular Biology Reporter, 1987, 5: 387-405.
[20]Liu J L, Zhang Z L, Wu Y M,etal. Establishment of an efficientAgrobacterium-mediated genetic transformation system ofLotuscorniculatus. Acta Prataculturae Sinica, 2006, 15(3): 128-131.
[21]Ma H L, Lu X S, Cao Z Z,etal. Analysis of factors influencing gene transformation inMedicagosativa. Acta Prataculturae Sinica, 2006, 15(5): 94-102.
[22]Wang D M, Tang Y Q, Zhou P. An investigation of approaches to optimize gene transformation system ofStylosanthesguianensisReyanⅡ. Pratacultural Science, 2005, 22(10): 25-30.
[2]劉國道, 白昌軍, 何華玄, 等. 熱研5號選育研究. 草地學報, 2001, 9(1): 1-7.
[3]周碧艷, 郭振飛. ABA及其合成抑制劑對柱花草抗冷性及抗氧化酶活性的影響. 草業學報, 2005, 14(6): 94-99.
[4]蔣昌順. 柱花草的研究進展. 熱帶作物學報, 2005, 26(4): 104-108.
[6]楊茂霞, 林國彪, 陳彩虹, 等. 膠胞炭疽菌侵染柱花草葉片的顯微觀察. 草業學報, 2015, 24(5): 175-181.
[7]秦代錦, 陳德西, 胡曉, 等. 水稻遺傳轉化研究進展. 生物學雜志, 2008, 25(5): 5-9.
[8]孫傳波, 郭嘉, 陶蕊, 等. 農桿菌介導玉米遺傳轉化體系的研究. 中國農學通報, 2012, 28(36): 71-75.
[9]朱莉, 郎志宏, 李桂英, 等. 農桿菌介導甜高粱轉Btcry1Ah的研究. 中國農業科學, 2011, 44(10): 1989-1996.
[17]釧秀娟, 陳彩虹, 羅麗娟. 熱研5號柱花草高頻、優質愈傷組織的誘導. 草業科學, 2015, 32(1): 78-84.
[20]劉建利, 張占路, 吳燕民, 等. 百脈根農桿菌快速高效遺傳轉化體系的建立. 草業學報, 2006, 15(3): 128-131.
[21]馬暉玲, 盧欣石, 曹致中, 等. 紫花苜蓿基因轉化的影響因素分析. 草業學報, 2006, 15(5): 94-102.
[22]王冬梅, 唐燕瓊, 周鵬. 熱研二號柱花草轉化體系優化的研究. 草業科學, 2005, 22(10): 25-30.
*Factors affecting genetic transformation efficiency for stylo (Stylosanthesguianensis) withAgrobacteriumtumefaciens
CHEN Cai-Hong1, CHUAN Xiu-Juan1, WANG Hui1, JIA Yan-Xing1, CHEN Zhi-Jian2, LIU Guo-Dao2, LUO Li-Juan1*
1.HorticultureandLandscapeofHainanUniversity,Haikou570228,China;2.TropicalCropGeneticResourcesInstitute,ChineseAcademyofTropicalAgriculturalSciences,Danzhou571737,China
The objective of this study was to investigate effects ofAgrobacteriumconcentration, infection time and co-culture duration on the genetic transformation efficiency for stylo (Stylosanthesguianensis) using a high-efficiency regeneration system that had been developed previously. Hypocotyls from stylo seedlings were used as plant material and the β-glucuronidase (GUS) gene was used as the reporter gene. The callus transformation efficiency was evaluated by GUS staining. The callus transformation efficiency reached 72% under the following conditions:Agrobacteriumat a concentration of OD600=0.4-0.6, with 15 mins infection and 3 days of co-cultivation. The exogenous gene had been successfully introduced into the stylo genome as indicated by GUS staining and PCR detection after callus selection, shoot differentiation and rooting. The results indicate that thisA.tumefaciens-mediated transformation system is suitable for genetic improvement and functional gene analysis of stylo.
Agrobacteriumtumefaciens; genetic transformation; GUS staining;Stylosanthes
10.11686/cyxb2015532
http://cyxb.lzu.edu.cn
2015-11-26;改回日期:2016-01-26
國家自然科學基金(31360575), 國家牧草產業技術體系熱帶牧草育種(CARS-35-03), 海南大學優秀研究生學位論文培育計劃(M8K3124001001003002)資助。
陳彩虹(1992-), 女, 海南文昌人, 在讀碩士。E-mail:331202062@qq.com
Corresponding author. E-mail:Luoljd@126.com
陳彩虹,釧秀娟,王薈,賈艷星,陳志堅,劉國道,羅麗娟. 農桿菌侵染條件對柱花草遺傳轉化效率的影響. 草業學報, 2016, 25(6): 102-108.
CHEN Cai-Hong, CHUAN Xiu-Juan, WANG Hui, JIA Yan-Xing, CHEN Zhi-Jian, LIU Guo-Dao, LUO Li-Juan. Factors affecting genetic transformation efficiency for stylo (Stylosanthesguianensis) withAgrobacteriumtumefaciens. Acta Prataculturae Sinica, 2016, 25(6): 102-108.

