活血榮絡片對大腦中動脈缺血模型大鼠腦組織微囊蛋白-1表達的影響※
周德生 劉利娟 寇志剛 陳 瑤 胡 華 鐘 捷
(湖南中醫藥大學第一附屬醫院神經內科,湖南 長沙 410007)
?
實 驗 研 究
活血榮絡片對大腦中動脈缺血模型大鼠腦組織微囊蛋白-1表達的影響※
周德生劉利娟△寇志剛1陳瑤胡華鐘捷
(湖南中醫藥大學第一附屬醫院神經內科,湖南長沙410007)
目的觀察活血榮絡片對大腦中動脈缺血(MCAO)模型大鼠腦組織中細胞膜微囊蛋白-1(Caveolin-1)表達的影響,探討活血榮絡片對腦缺血后神經功能修復的作用機制。方法將96只SD大鼠隨機分為假手術組(24只)和造模組(72只),造模組采用線栓法制作MCAO模型,造模成功后再隨機分為模型組、對照組及實驗組,各24只。假手術組及模型組予蒸餾水2 mL灌胃,實驗組予活血榮絡片藥液灌胃,對照組以磷酸吡哆醛丁咯地爾膠囊藥液灌胃,均造模6 h后首次給藥,然后每日灌胃2次,直至處死為止。每日觀察大鼠的一般情況,進行神經功能缺損評分,并分別在造模1、3、5及7 d后各組隨機選取6只大鼠處死取材,觀察比較各組大鼠腦組織Caveolin-1的表達情況。結果造模1 d后,造模組各組大鼠神經功能缺損評分比較差異無統計學意義(P>0.05);造模3、5及7 d后對照組及實驗組大鼠神經功能缺損評分與模型組比較差異有統計學意義(P<0.05),均高于模型組,且對照組與實驗組組間比較差異均無統計學意義(P>0.05);模型組、對照組及實驗組造模1、3、5及7 d后Caveolin-1表達水平與假手術組同期比較差異均有統計學意義(P<0.05),均高于假手術組;對照組及實驗組造模1、3、5及7 d后Caveolin-1表達水平與模型組同期比較差異均有統計學意義(P<0.05),均高于模型組;實驗組在造模1、3及5 d后時Caveolin-1表達水平與對照組比較差異無統計學意義(P>0.05),在造模7 d后時Caveolin-1表達水平明顯高于對照組,比較差異有統計學意義(P<0.05)。結論活血榮絡片可明顯增加Caveolin-1在梗死周圍腦組織中的表達,促進腦血管新生,從而改善腦缺血后神經功能缺損。
腦梗死;中藥療法;動物,實驗;大鼠;疾病模型,動物
缺血性腦血管病是神經內科的常見病、多發病,具有病死率高、致殘率高的特點。目前相關研究顯示,腦缺血后神經功能的恢復及中樞神經的再生與血管新生有著密切的聯系,腦血管新生是缺血區組織抗損傷及神經元修復的結構基礎,而細胞膜微囊蛋白-1(Caveolin-1)可以參與調控血管內皮細胞生長因子(VEGF) 生理活性,由此推斷Caveolin-1與血管新生關系密切。本實驗擬采用Longa EZ等[1]改良線栓法制作大鼠大腦中動脈缺血(MCAO)模型,通過觀察活血榮絡片對MCAO模型大鼠梗死周圍腦組織Caveolin-1表達的影響,探討其對神經功能修復作用機制。
1 材料與方法
1.1實驗動物清潔級健康雄性SD大鼠120只,體質量(250±20)g,由湖南省中醫藥大學實驗動物中心提供,許可證號:SCXK(湘)2011-0003。所有大鼠均飼養于湖南中醫藥大學SPF動物實驗中心,室溫為24~26 ℃,濕度在55%~60%之間,自由進水及食物,定期更換墊料及清洗籠子。
1.2實驗藥品活血榮絡片(由天麻、白芷、忍冬藤、石菖蒲、木瓜、玄參、赤芍藥及桃仁按3∶2∶6∶2∶3∶3∶3∶3組成配制,由湖南中醫藥大學第一附屬醫院制劑科提供,湘藥制字Z20080472)每片0.35 g,每片含生藥量0.14 g,配成相當于含生藥量2.8 mg/mL的藥液;磷酸吡哆醛丁咯地爾膠囊(昆明積大制藥股份有限公司,國藥準字H20064618),配成2.1 mg/mL的藥液。均放置于冰箱中備用。
1.3主要試劑及儀器
1.3.1實驗試劑兔抗大鼠Caveolin-1多克隆抗體(上海翔升生物科技有限公司);即用鏈霉親和素-生物素-過氧化物酶復合物(SABC)免疫組化染色試劑盒及二氨基聯苯胺(DAB)顯色試劑盒(武漢博士德生物工程有限公司);水合氯醛、多聚甲醛、磷酸鹽緩沖液(PBS)、枸櫞酸緩沖液及蘇木素(長沙麗欣生物技術有限公司)。
1.3.2實驗儀器JY3002型電子天平(上海精密科學儀器有限公司);HHS-2電子恒溫不銹鋼水浴鍋(上海南陽儀器有限公司);LEICA DM LB2型雙目顯微鏡(德國萊卡微系統國際有限公司);SZ-93自動雙重純水蒸餾器(上海亞榮生化儀器廠);DNP-9162型電熱恒溫培養箱(上海精宏實驗設備有限公司);Motic B5 顯微攝像系統(麥克奧迪實業集團有限公司)。
1.4實驗方法
1.4.1模型制備120只SD大鼠在實驗室里飼養1周后,隨機選取其中96只,其余24只備用。將96只大鼠再隨機分為假手術組(24只)和造模組(72只)。造模組參照Longa EZ等[1]腔內線栓法制作MCAO模型,術前6 h禁食不禁水,先將大鼠用10%的水合氯醛(3 mL/kg)進行腹腔麻醉,將大鼠頭部及四肢仰臥位固定于臺面,備皮,消毒,在頸部中央切口,沿胸鎖乳突肌內緣鈍性分離皮下組織及肌肉,分離出右側頸總動脈、頸外動脈及頸內動脈,在頸總動脈遠心端和近心端、頸總分叉處及頸外動脈處掛線備用,沿頸內動脈繼續往頭部方向分離血管,直至頸內動脈與翼腭動脈分叉處,掛線將翼腭動脈結扎,將頸總動脈近心端及頸外動脈結扎,然后用動脈夾夾住頸內動脈,輕提近心端結扎頸總動脈的線,用眼科剪斜向頭部剪一小口,將已經準備好的栓線從頸總動脈分叉處沿頸內動脈插入顱內,直至遇到阻力,深度為18 mm左右(從頸總動脈分叉口算起),緊緊系牢頸總動脈遠心端的細線。將栓線放置于皮膚內,防止過長大鼠自行拔出,再涂撒青霉素預防感染,縫合頸部皮膚,消毒。造模后將大鼠單獨放置,保溫直至蘇醒,術后6 h再恢復喂食。假手術組則只切開皮膚后隨即縫上。缺血模型成功的標準為:手術操作順利,術中無大出血,參照Zausinger S等[2]方法進行神經功能缺損評分,<5分者則為造模成功。造模失敗及麻醉前即死亡者剔除,再隨機從備用大鼠中補充。
1.4.2分組及給藥方法造模組造模成功后再隨機分成模型組、實驗組及對照組,每組各24只。假手術組及模型組每次予蒸餾水2 mL灌胃,實驗組予活血榮絡片藥液(1 mL/100 g)灌胃,對照組以磷酸吡哆醛丁咯地爾膠囊藥液(1 mL/100 g)灌胃。各組大鼠造模6 h后首次給藥,然后每日灌胃2次,直至處死為止。
1.5觀察指標及方法造模后每日觀察各組大鼠的精神狀態、飲食、活動及毛發色澤等一般情況,參照Zausinger S等[2]方法進行神經功能缺損評分:0分,不能自發行走;1分,自由走動狀態下向病變對側旋轉;2分,抓住鼠尾,大鼠向病變對側旋轉;3分,對施向病變對側的側壓力抵抗力下降;4分,不能伸直病變對側前爪,甚至全身向對側屈曲;5分,無神經功能缺損。分別于造模1、3、5及7 d后各組隨機選取6只大鼠處死取材(在末次給藥2 h后處死)。先用10%水合氯醛(3 mL/kg)腹腔麻醉,剪斷頸動脈放血以處死大鼠,打開顱腔取出大腦,將整個大腦組織保存于4%的多聚甲醛溶液中,固定24 h 然后進行腦組織切片顯微鏡觀察及Caveolin-1表達的免疫組織化學檢測,嚴格按照檢測試劑盒說明書步驟進行。

2 結 果
2.1造模組大鼠造模1、3、5及7 d后神經功能缺損評分比較見表1。
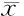
表1 造模組大鼠造模1、3、5及7 d后神經功能缺損評分比較 分,±s
與模型組比較,*P<0.05
由表1可見,造模1 d后,造模組各組大鼠神經功能缺損評分比較差異無統計學意義(P>0.05);造模3、5及7 d后對照組及實驗組大鼠神經功能缺損評分與模型組比較差異有統計學意義(P<0.05),均高于模型組,且對照組與實驗組組間比較差異均無統計學意義(P>0.05)。
2.2各組大鼠造模1、3、5及7 d后腦組織中Caveolin-1表達情況比較
2.2.1顯微鏡觀察結果比較在光鏡下觀察(×400),假手術組各個時間點可見較少的Caveolin-1棕黃色陽性表達灶,造模組與假手術組相比各個時間點Caveolin-1表達增多,可見強弱不等的陽性表達,陽性表達大多位于胞漿。假手術組大鼠各個時間點Caveolin-1表達無明顯變化;模型組大鼠Caveolin-1表達在3 d時達最高,以后逐漸下降;實驗組與對照組各個時間點Caveolin-1的表達強度均較高于模型組。各組大鼠造模7 d后Caveolin-1的表達,見封3,圖1。
2.2.2免疫組織化學檢測結果比較見表2。


組 別n1d3d5d7d假手術組60.12±0.030.21±0.040.18±0.030.20±0.05模型組60.27±0.04*0.48±0.05*0.39±0.06*0.37±0.03*對照組60.36±0.05*△0.64±0.09*△0.49±0.01*△0.44±0.10*△實驗組60.35±0.02*△0.59±0.07*△0.54±0.11*△0.59±0.06*△#
與假手術組同期比較,*P<0.05;與模型組同期比較,△P<0.05;與對照組同期比較,#P<0.05
由表2可見,模型組、對照組及實驗組造模1、3、5及7 d后腦組織Caveolin-1表達水平與假手術組同期比較差異均有統計學意義(P<0.05),均高于假手術組;對照組及實驗組造模1、3、5及7 d后Caveolin-1表達水平與模型組同期比較差異均有統計學意義(P<0.05),均高于模型組;實驗組在造模1、3及5 d時Caveolin-1表達水平與對照組比較差異無統計學意義(P>0.05),在造模7 d時Caveolin-1表達水平明顯高于對照組,比較差異有統計學意義(P<0.05)。
3 討 論
微囊是細胞質膜向內凹陷所形成的一種特化細胞質膜囊狀結構,具有膽固醇轉運、信號傳導、大分子物質轉輸等理化功能[3-5]及調節細胞生長、凋亡、血管生成等生物學功能[6]。Caveolin-1是微囊蛋白家族成員之一,在維持微囊的結構及上述的功能當中具有重要作用,是內皮細胞對大分子物質轉運中的一種敏感型載體,并參與、調控VEGF生物活性的發揮,同時其還具有促進內皮細胞遷移的功能[7],而血管新生的過程包括內皮細胞增殖、遷移和分化,故Caveolin-1也參與了血管新生的過程。由于內皮型一氧化氮合酶(eNOS)、血管內皮細胞生長因子受體(VEGFR)、前列環素合成酶等與血管的生成密切相關,同時它們在血管內皮細胞的微囊含量豐富,因此Caveolin-1可能是血管生成的促進劑與抑劑共同作用的靶點[8]。現代醫學也對Caveolin-1展開了一系列研究,在一氧化氮(NO)介導的血管新生中,Caveolin-1在內皮細胞分化與管腔形成及對VEGF與eNOS激活方面具有重要作用[9],Caveolin-1表達升高可促進肝細胞癌的侵襲轉移,其作用機制可能是通過誘導肝細胞癌表達VEGF,促進腫瘤新生血管生成而實現[10];芹菜素可上調腦缺血再灌注后Caveolin-1的表達,對大鼠局灶性腦缺血再灌注損傷具有保護作用[11];腦缺血后可促進腦內細胞增殖和膠質活化,而Caveolin-1缺失可減弱腦缺血早期腦內細胞增殖,增強膠質活化[12];向Caveolin-1缺陷的小鼠體內注入腫瘤細胞后,與野生型小鼠相比,其血管生成顯著降低[13-14],并且受到缺血損傷時,小鼠缺乏血管新生能力,梗死面積擴大,細胞凋亡增加[15-16]。綜上所述,Caveolin-1能促進內皮細胞增殖及血管新生形成,所以對缺血性疾病可通過正調節因子誘導血管新生,從而在梗死區形成更多的新生血管或側支循環,減輕缺血組織損傷,促進神經功能恢復,為臨床治療提供了新靶點。
中醫學認為,缺血性中風基本病機為陰陽失調、氣血逆亂所致,故我們認為對本病治療的關鍵是平衡陰陽,基本原則是調理氣血,并在榮氣虛滯論[17]基礎上研制了活血榮絡片。方中忍冬藤清熱解毒,通絡止痛;木瓜養陰生津,舒筋活絡;天麻熄風止痙,祛風通絡;玄參清熱生津,滋陰潤燥;赤芍藥涼血止血,活血散瘀止痛;桃仁活血祛瘀;石菖蒲開竅醒神,豁痰辟穢,寧神益智;白芷祛風止痛。諸藥合用,具有養陰活血、祛風化痰、化瘀通絡的功效。前期研究也已表明,活血榮絡片可有效治療血管性癡呆[18],明顯減輕大鼠腦梗死的面積,降低基質金屬蛋白酶-9(MMP-9)的表達[19-20],改善腦組織功能。
本實驗即從血管新生的機制著手,以Caveolin-1為研究對象,結果顯示模型組在各時間點Caveolin-1陽性細胞數較假手術組均明顯增多(P<0.05),可以證明在腦缺血灶及缺血半暗帶存在Caveolin-1的表達;在實驗組和對照組中各時間點Caveolin-1的表達均高于模型組(P<0.05),說明在缺血性腦病發生后,大腦組織在缺血、缺氧的情況下,腦代謝降低,腦血流灌注隨之減少,進而使缺血區VEGF合成減少,內皮細胞增殖減少,而通過相關干預治療,促進Caveolin-1在缺血區的表達,啟動正反饋調節機制,可使VEGF合成增多,促進梗死灶邊緣區有代償性的血管新生,使神經功能得到改善;另外,實驗組造模7 d后Caveolin-1表達明顯高于對照組,提示活血榮絡片遠期療效可能更佳。
本實驗研究結果表明,活血榮絡片可明顯增加MCAO模型大鼠Caveolin-1的表達,改善大鼠神經功能缺損評分,遠期療效更佳,推測其相關作用機制是通過增加Caveolin-1表達促進梗死區周圍腦組織血管新生。但本實驗尚未對Caveolin-1與其他血管新生因子之間的相互作用及在分子基因水平的研究,有待于將來進一步深入探討。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]Zausinger S,Hungerhuber E,Baethmann A,et al.Neurological impairment in rats after transient middle cerebral artery occlusion: a comparative study under various treatment paradigms[J].Brain Res,2000,863(1-2):94-105.
[3]Luo DX,Cao DL,Xiong Y,et al.A novel model of cholesterol efflux from lipid-loaded cells[J].Acta Pharmacol Sin,2010,31(10):1243-1257.
[4]郝長春,孫潤廣,張靜.DOPC,DOPE和神經酰胺對鞘磷脂/膽固醇雙層膜結構的影響[J].高等學校化學學報,2009,30(5):913-918.
[5]Frank PG.Endothelial caveolae and caveolin-1 as key regulators of atherosclerosis[J].Am J Pathol,2010,177(2):544-546.
[6]Senetta R,Stella G,Pozzi E,et al.Caveolin-1 as a promoter of tumour spreading: when, how, where and why[J].J Cell Mol Med,2013,17(3):325-336.
[7]周德生,寇志剛,陳瑤,等.Caveolin-1與血管新生相關性的研究進展[J].中國臨床新醫學,2013,6(3):270-272.
[8]劉輝,熊國祚.Caveolae/Caveolin-1在血管生成中的作用[J].現代衛生醫藥,2012,28(8):2792-2794.
[9]潘一明,姚永忠,朱章華,等.Caveolin-1在一氧化氮介導的三維纖維蛋白凝膠血管新生模型中的作用[J].中華實驗外科雜志,2011,28(10):1693-1695.
[10]張志波,何慶良,石錚,等.Caveolin-1在肝細胞癌表達及與腫瘤血管生成的關系[J].中國普通外科雜志,2012,21(1):53-57.
[11]牛文澤,李雪梅,王果,等.芹菜素對局灶性腦缺血再灌注大鼠腦內Caveolin-1表達的影響[J].中草藥,2010,41(10):1658-1662.
[12]劉柏炎,易健,劉富林,等.局灶性腦缺血對Caveolin-1敲除小鼠細胞增殖與神經膠質纖維酸性蛋白表達的影響[J].中華行為醫學與腦科學雜志,2012,21(3):216-218.
[13]Woodman SE,Ashton AW,Schubert W,et al.Caveolin-1 knockout mice show an impaired angiogenic response to exogenous stimuli[J].Am J Pathol,2003,162(6):2059-2068.
[14]Sainz-Jaspeado M,Huertas-Martinez J,Lagares-Tena L,et al.EphA2-induced angiogenesis in ewing sarcoma cells works through bFGF production and is dependent on caveolin-1[J].PLoS One,2013,8(8):e71449.
[15]Massimino ML,Griffoni C,Spisni E,et al.Involvement of caveolae and caveolae-like domains in signalling, cell survival and angiogenesis[J].Cell Signal,2002,14(2):93-98.
[16]Jasmin JF,Malhotra S,Singh DM,et al.Caveolin-1 deficiency increases cerebral ischemic injury[J].Circ Res,2007,100(5):721-729.
[17]周德生,張雪花,譚靜.榮氣虛滯論[J].中醫藥通報,2005,4(2):22-25.
[18]彭勃,周德生,高曉峰,等.活血榮絡片治療血管性癡呆36例[J].光明中醫,2012,27(11):2194-2196.
[19]Zhou D,Li M,Hu H,et al.Huoxue Rongluo Tablet reduces matrix metalloproteinase-9 expression in infarcted brain tissue[J].Neural Regen Res,2013,8(34):3216-3224.
[20]李媚.活血榮絡片對大鼠急性腦梗死MMP-9蛋白表達影響的研究[D].長沙:湖南中醫藥大學,2013.
(本文編輯:石康)
Effects of Huoxue-rongluo tablets on the expression of Caveolin-1 in brain tissue of middle cerebral artety occlusion rats
ZHOUDesheng*,LIULijuan,KOUZhigang,etal.
*DepartmentofNeurology,FirstHospitalAffiliatedtoHunanUniversityofChineseMedicine,Hunan,Changshan410007
ObjectiveTo study the effect of Huoxue-rongluo tablets on the expression of Caveolin-1 in brain tissue of middle cerebral artery occlusion (MCAO) rats, and investigate nerve function recovery mechanism. Methods 96 SD rats were divided into sham operation group (24 cases) and modeling group (72 cases). Rats in modeling group were constructed in MCAO model by suture-occluded method. After successful modeling, rats in modeling group were randomly divided into model group, control group and experimental group, 24 rats in each group. Rats in sham operation and model group were received distilled water (2 mL) via gastrogavage. Rats in experimental group were received Huoxue-rongluo liquid, and rats in control group were received buflomedil pyridoxal phosphate liquid at 6 h after modeling, twice a day until death. The daily general condition and neurological function defect score was observed. 6 rats in each group were randomly selected, sacrificed at 1, 3, 5, 7 d after molding respectively. The expressions of Caveolin-1 in mice brain tissue were observed in all groups. Results One day after modeling, there was no statistical difference on neurological function defect score in each group of modeling group (P>0.05). The neurological function defect scores 3, 5, 7 d after modeling in control and experimental group were higher than those in model group (P<0.05), and there was no statistical difference between control and experimental group (P>0.05). The expression of Caveolin-1 1, 3, 5, 7 d after modeling in model control and experimental group was higher than that in sham operation group at same period (P<0.05). There were no statistical differences on Caveolin-1 expression in experimental and control group at 1, 3 and 5 d after modeling (P>0.05). The expression of Caveolin-1 in experimental group 7 d after modeling was obviously higher than that in control group (P<0.05). Conclusion Huoxue-rongluo tablets can significantly increased the expression of Caveolin-1 in brain tissue around infarction, can promote cerebral vascular growth then improve the neurological function.
Cerebral infarction; Traditional Chinese medicine; Animal; Experiment; Rat; Disease model; Animal
10.3969/j.issn.1002-2619.2016.01.025
△湖南中醫藥大學2013級博士研究生,湖南長沙410208
周德生(1965—),男,主任醫師,教授,博士。研究方向:中醫藥防治神經系統疾病研究。
R-33;R285.5;R743.33
A
1002-2619(2016)01-0080-05
2014-02-28)
※ 項目來源:湖南省中醫藥管理局中醫藥科研計劃項目(編號:201136);長沙市科學技術局基礎性研究與軟科學資金專項項目(編號:K1308023-31)
1河南省鄭州市第三人民醫院康復科,河南鄭州450000

