采用流式細胞術分選EAE模型小鼠小膠質細胞
浦穎艷,孫定亞,黃愛軍,曹莉
·論著·
采用流式細胞術分選EAE模型小鼠小膠質細胞
浦穎艷,孫定亞,黃愛軍,曹莉
目的獲取實驗性自身免疫性腦脊髓炎(EAE)模型小鼠小膠質細胞,并檢測其特性。
方法取 8 周齡,雌性 C57BL/6 小鼠行 EAE 造模,待至發病高峰期(第 15 天)時以 PBS 灌注后取小鼠后腦和脊髓,切碎后加胰酶消化,消化完成后通過 100 μm 濾網濾過,而后采用 Percoll 密度梯度離心法分離獲取單個核細胞,進一步利用 CD11b 與 CD45 抗體染色,通過流式細胞儀分選 CD11b+CD45high和 CD11b+CD45low細胞,即分別得到相對活化和靜息的小膠質細胞,最后對流式分選獲取的小膠質細胞行 qPCR 檢測。
結果通過形態比較,獲得了高純度的小膠質細胞。FIZZ-1基因行qPCR 檢測,結果顯示在 EAE 急性期 M2 型小膠質細胞明顯增多,符合文獻報道。
結論該方法能從 EAE 小鼠體內分離獲取高純度的小膠質細胞,可用于相關目的基因后續檢測。
小膠質細胞;流式細胞術;實驗性自身免疫性腦脊髓炎
www.cmbp.net.cn中國醫藥生物技術, 2016, 11(4):295-299
小膠質細胞在中樞神經系統中約占 12%[1],是中樞主要的固有免疫細胞。靜息狀態下的小膠質細胞主要發揮中樞神經系統的監視作用。中樞的病理損傷可以激活小膠質細胞,發生形態學和分子表達譜的變化,參與吞噬、抗原呈遞、調節血腦屏障和調控炎癥反應強度等多種作用。作為中樞神經系統主要的免疫活性細胞,小膠質細胞與神經免疫性和神經退行性疾病高度相關。實驗性自身免疫性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型是研究神經免疫性疾病——多發性硬化癥(multiple sclerosis,MS)的經典動物模型。已有文獻報道,在 EAE 小鼠的中樞神經系統,小膠質細胞的功能狀態與 EAE 病情進展密切相關[2-4]。對于小膠質細胞基因表達的分析有助于了解其生理病理情況下的功能狀態。
目前國內對小膠質細胞的功能研究主要采用BV-2 等細胞系和體外原代培養的小膠質細胞,直接分離成年小鼠的小膠質細胞用于研究的報道較少。細胞系和體外培養的小膠質細胞與體內細胞存在一定差異,無法準確反映某一生理病理狀態下小膠質細胞表型狀況。目前在中樞神經系統中,CD11b+CD45+細胞群是較公認的小膠質細胞/巨噬細胞群(小膠質細胞是定植于中樞的巨噬細胞)[5],且 CD11b+CD45high與 CD11b+CD45low分別代表活化與靜息的小膠質細胞[6-7]。結合以上情況,本研究采用改良的消化分離方法結合流式分選,獲取高純度的 EAE 小鼠小膠質細胞,并能夠較準確反映其在炎性疾病某一過程中的表型狀況,為研究小膠質細胞在炎性疾病不同病程中的功能動態變化提供了良好手段。
1 材料與方法
1.1實驗動物和實驗材料
1.1.1實驗動物C57BL/6 小鼠,8 周齡,雌性,18 ~ 20 g,購自上海斯萊克實驗動物有限公司,飼養于清潔級動物房。
1.1.2試劑MOG 蛋白購自吉爾生化公司;百日咳毒素(PTX)購自美國 Calbiochem 公司;結核菌素購自美國 Difco 公司;弗氏不完全佐劑、Trizol和胰蛋白酶均購自美國 Invitrogen 公司;DNA 酶購自美國 Worthington 公司;Percoll 購自美國 GE公司;FC block、抗小鼠 CD11b-FITC 抗體、抗小鼠 CD45-PE 抗體均購自美國 BD 公司;RevertAid First Strand cDNA Synthesis kit 購自美國Thermo Fisher Scientific 公司;SYBGreen PCR Mix購自日本 Toyobo 公司。
1.1.3實驗儀器流式細胞儀為美國 Beckman公司產品。
1.2方法
1.2.1EAE 模型構建將不完全弗氏佐劑與結核菌素(終濃度為 4 mg/ml)在研缽中充分研磨,得到完全弗氏佐劑,再與溶解在 PBS 中的MOG 蛋白(終濃度為 1 mg/ml)按 1∶1 比例在三通管中充分混勻。百日咳毒素在 PBS 中稀釋為終濃度 1 μg/ml 備用。在 C57BL/6 雌性小鼠背部選取 3 個點,皮下注射結核菌素和 MOG 蛋白混合液,總量 150 μl/只。小鼠腹腔注射百日咳毒素200 μl/只,計為第 0 天。第 2 天再腹腔注射百日咳毒素 200 μl/只。以空 PBS(無 MOG)與完全弗氏佐劑混合后造模作為對照。
1.2.2取材并制備單細胞懸液成年小鼠中樞內小膠質細胞分離純化過程見示意圖 1。在 EAE 發病高峰期(第 15 天)取正常組及 EAE 組小鼠各5 只,分別用 CO2窒息處死,冰上預冷 PBS 灌注去除血細胞后取后腦及脊髓置于 5 ml PBS 中,用刀片小心切碎至 1 mm3左右。加入等體積 0.25%胰酶和 1 ml DNA 酶,37 ℃ 水浴消化 15 min(每隔 5 分鐘搖晃一次)后取出用 1 ml 槍頭吹散組織塊,繼續置于 37 ℃ 水浴消化 10 min 后取出,用200 μl 槍頭吹散后過 100 μm 濾網,800 × g 離心10 min。
1.2.3Percoll 分離液配制首先配制 100% percoll(10 × PBS 1.4 ml + percoll 12.6 ml),然后用100% percoll 配制其余密度梯度的 percoll 分離液,具體如下:

圖1 成年小鼠中樞內小膠質細胞分離純化過程示意圖Figure 1 The sketch for isolation of microglia from EAE mice
37% percoll:100% percoll 3.7 ml + DMEM-F12 6.3 ml;70% percoll:100% percoll 7 ml + 1 × PBS 3 ml;30% percoll:100% percoll 3 ml + 1 × PBS 7 ml。
1.2.4密度梯度離心分離單核細胞將離心后沉淀細胞用 37% percoll 分離液 10 ml 重懸置于50 ml 離心管中,在其上下分別用微量注射器緩慢加入 30% 及 70% percoll 分離液各 10 ml,900 × g離心 30 min 后可見分層,去除上層呈白色的髓鞘片段,小心吸出位于 37% 與 70% percoll 分離液之間的單核細胞層約 8 ml,加入等量的 PBS 混勻,900 × g 離心 7 min,收集細胞沉淀。
1.2.5流式分選細胞沉淀用 200 ~ 500 μl FACS緩沖液重懸后加入 FC block 冰上靜置 30 min 進行抗原封閉,隨后離心,以 50 μl FACS 緩沖液重懸,每 106細胞中加入抗 CD11b-FITC 及抗CD45-PE 流式抗體 1 μl,冰上避光孵育 30 min 后離心棄上清,再以 FACS 緩沖液 400 μl 重懸,然后分別用流式細胞儀分選小膠質細胞,并用summit 軟件計算細胞中 CD11b+CD45low及CD11b+CD45high的小膠質細胞比例。
1.2.6基因表達水平檢測將分選得到的細胞用Trizol 法提取 RNA,按照試劑盒說明逆轉錄合成cDNA。Real-time PCR 檢測 FIZZ-1 基因表達水平。反應體系為10 μl,其中 2 × SYBGreen PCR Mix 5 μl,2 μmol/L 的正反引物(FIZZ-1 引物序列為上游:5′ ATGCCAACTTTGAATAGGATG 3′,下游:5′ CTTGACCTTATTCTCCACGAT 3′;GAPDH 引物序列為上游:5′ TCAACGACCCCTTCATTGAC C 3′,下游:5′ CTTCCCGTTGATGACAAGCTTC 3′)各 1 μl,以及 cDNA 和水共 3 μl。反應條件為95 ℃ 5 min 進行預變性,95 ℃ 10 s,60 ℃ 30 s 擴增 40 個循環后行溶解曲線驗證產物特異性。目的基因 FIZZ-1 的表達通過 GAPDH 為內參對其進行標化,并按計算公式 2-Δ(Δcq)計算得到倍數變化關系。
2 結果
2.1流式分選得到小膠質細胞比例
經過胰酶消化和 percoll 密度梯度離心后得到的單核細胞利用抗體標記后行流式分選,得到CD11b+CD45+細胞,結果顯示,EAE 小鼠中活化小膠質細胞(CD11b+CD45high)比例為 21%,明顯高于對照組小鼠(11%)(圖 2),符合預期結果。同時利用流式分析軟件觀察 FSC-SSC 參數比較CD11b+CD45high和 CD11b+CD45low小膠質細胞,發現活化的小膠質細胞(CD11b+CD45high)要比靜息的小膠質細胞(CD11b+CD45low)FCS 參數值高(圖 3),即細胞體積大,這也與細胞學實驗結果相符。
2.2FIZZ-1 在小膠質細胞中的表達
分選得到的小膠質細胞進一步經過 RNA 抽提,逆轉得到 cDNA 后進行 real-time PCR 檢測。結果顯示,與對照組相比 EAE 組小膠質細胞中M2 型小膠質細胞特異性標志物 FIZZ-1 水平顯著升高(圖 4)。這與文獻[8]報道相一致。并且為檢測活化小膠質細胞其他目的基因的表達提供了依據。
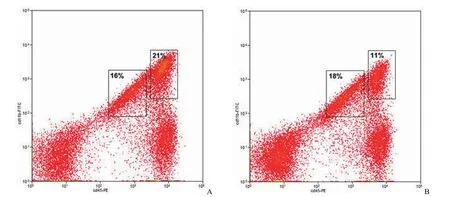
圖2 流式細胞儀分離小膠質細胞(A:EAE 小鼠分選小膠質細胞流式圖;B:對照組小鼠分選小膠質細胞流式圖)Figure 2 Isolation of microglia by flow cytometry (A: Representative image of microglia isolated from EAE mice; B:Representative image of microglia isolated from control adult mice)
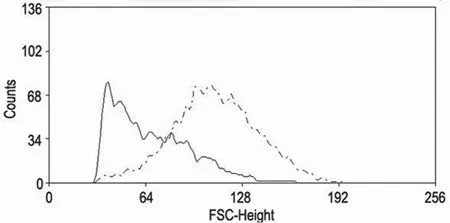
圖3 CD11b+CD45high(虛線)與 CD11b+CD45low(實線)小膠質細胞 FSC 參數比較Figure 3 A comparison of forward scatter (FSC) between CD11b+CD45high(dotted line) and CD11b+CD45low(solid line)cells
3 討論
小膠質細胞是中樞神經系統的重要組成部分,它既是病理損害的主要傳感器,能夠分泌神經營養因子等,具有神經保護作用,同時也是中樞神經系統的炎癥調節細胞,在病理狀態下,活化的小膠質細胞能夠通過釋放大量促炎因子、促凋亡因子、趨化因子(例如 IL-1β、IL-6、IL-12、TNF-α 等)和NO 等引起神經毒性,導致神經元功能異常和引起細胞死亡,因此被認為是一把雙刃劍[9-10]。如何能夠有效抑制小膠質細胞的炎性損傷作用,而保留其對中樞神經系統的神經保護作用是臨床治療中樞神經炎癥疾病的關鍵,也是目前研究的熱點。
目前對于小膠質細胞的研究主要是由新生鼠和胎鼠腦組織純化培養的原代小膠質細胞作為體外小膠質細胞模型。獲取方法主要是以 McCarthy 和 de Vellis[11]創立的原代膠質細胞混合培養為基礎,結合振蕩法、溫和消化法等綜合改良而成。體外培養的小膠質細胞主要取材于新生鼠或胎鼠,因此不是完全成熟的小膠質細胞,其表型與成年小鼠的小膠質細胞存在差異;同時長期培養也可能造成其表型與體內小膠質細胞存在差異。因此,這些體外小膠質細胞模型也許并不適用于成年動物的神經炎性疾病研究領域。而從成年小鼠取材得到小膠質細胞存在一定的難度,因此如何高效地從成年小鼠體內獲得高純度的原代小膠質細胞是關鍵。
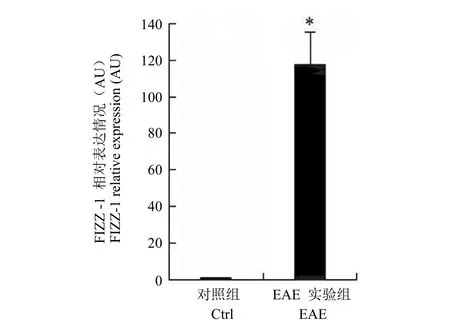
圖4 FIZZ-1 在對照組及 EAE 組來源小膠質細胞中的表達Figure 4 Relative FIZZ-1 expression in microglia between EAE mice and control
本研究從成年小鼠中樞神經系統取材,首次采用胰酶代替傳統木瓜蛋白酶[12],省去了繁瑣的酶激活等步驟,至少節約 60 min,大大縮短了細胞消化的時間,在較短時間內即可快速完成消化步驟,并且保證了細胞的活性;后續利用密度梯度離心的方法去除了在中樞神經系統中占比最高的髓鞘,成功分離出包含小膠質細胞的單核細胞層;最后通過抗體標記結合流式細胞分選技術分離得到成年小鼠小膠質細胞,并且能夠區分活化和靜息兩種狀態,以便用于后續分別對兩種小膠質細胞進行基因表達情況的分析[13]。
EAE 主要特征是中樞神經系統出現單核細胞浸潤及脫髓鞘現象,為自身免疫性疾病,其模型是研究 MS 的理想動物模型,對于臨床神經炎性疾病發生機制的研究具有重要意義。本研究利用流式分選得到對照組及 EAE 發病組小膠質細胞,通過流式細胞分析軟件比較發現 EAE 發病組小鼠活化小膠質細胞(CD11b+CD45high)顯著高于對照組小鼠。目前認為小膠質細胞的表型變化與其多種生理學功能有關,因此對于小膠質細胞基因表達的研究有助于了解其生理病理學功能,進而能夠為治療神經炎性疾病找到新的靶點。文獻報道 FIZZ-1 是M2 型活化小膠質細胞標記物[6],而 M2 型小膠質細胞在 EAE 急性期比例明顯升高[8]。本研究中分別提取兩組小鼠 CD11b+CD45low小膠質細胞RNA 進行基因表達分析發現,EAE 組 FIZZ-1 表達顯著升高,提示本研究分離得到的小膠質細胞能夠準確反映小鼠體內小膠質細胞基因表型變化,可以用于檢測其他目的基因的變化,并進一步為神經炎性疾病尋找新的發病機制和治療靶點。
綜上,本研究所采用小膠質細胞分離方法簡便快捷,同時得到的細胞能夠準確反映其在體情況,克服了目前小膠質細胞研究所采用模型的局限性,為臨床神經炎性疾病的研究提供了一種可靠的細胞模型。
[1] Block ML, Zecca L, Hong JS. Microglia-mediated neurotoxicity:uncovering the molecular mechanisms. Nat Rev Neurosci, 2007, 8(1):57-69.
[2] Napoli I, Neumann H. Protective effects of microglia in multiple sclerosis. Exp Neurol, 2010, 225(1):24-28.
[3] Almolda B, Costa M, Montoya M, et al. CD4 microglial expression correlates with spontaneous clinical improvement in the acute Lewis ratEAE model. J Neuroimmunol, 2009, 209(1-2):65-80.
[4] Benson MJ, Manzanero S, Borges K. Complex alterations in microglial M1/M2 markers during the development of epilepsy in two mouse models. Epilepsia, 2015, 56(6):895-905.
[5] David S, Kroner A. Repertoire of microglial and macrophage responses after spinal cord injury. Nat Rev Neurosci, 2011, 12(7):388-399.
[6] Yu Z, Sun D, Feng J, et al. MSX3 switches microglia polarization and protects from inflammation-induced demyelination. J Neurosci, 2015,35(16):6350-6365.
[7] Starossom SC, Mascanfroni ID, Imitola J, et al. Galectin-1 deactivates classically activated microglia and protects from inflammationinduced neurodegeneration. Immunity, 2012, 37(2):249-263.
[8] Miron VE, Boyd A, Zhao JW, et al. M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat Neurosci, 2013, 16(9):1211-1218.
[9] Aloisi F. Immune function of microglia. Glia, 2001, 36(2):165-179.
[10] Carson MJ. Microglia as liaisons between the immune and central nervous systems: functional implications for multiple sclerosis. Glia,2002, 40(2):218-231.
[11] McCarthy KD, de Vellis J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol,1980, 85(3):890-902.
[12] Cardona AE, Huang D, Sasse ME, et al. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat Protoc, 2006, 1(4):1947-1951.
[13] Gebicke-Haerter PJ. Microarrays and expression profiling in microglia research and in inflammatory brain disorders. J Neurosci Res, 2005,81(3):327-341.
【Abstract】
ObjectiveTo obtain microglia from EAE mice for qPCR analysis.
MethodsFirstly, after the induction of EAE model using C57BL/6 mice at the age of 8 week, EAE or control mice were perfused and the spinal cords and tritocerebrums were isolated. Then the mononuclear cells were collected by density gradient centrifugation after digestion. Secondly, microglia were separated by flow cytometry sorting after anti-CD11b and anti-CD45 staining. Finally,collected microglia were analyzed by qPCR.
ResultsHighly purified microglia were obtained observed by the cell morphology. The following qPCR analysis showed a high expression of FIZZ-1 which is a M2 marker in EAE mice, and this was consistent with previous report.
ConclusionHighly purified microglia could be obtained by our method from EAE mice and the cells were suitable for following gene expression analysis.
Author Affiliation: Institute of Neuroscience and Key Laboratory of Molecular Neurobiology of the Ministry of Education, Second Military Medical University, Shanghai 200433, China
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):295-299
Isolation of microglia from EAE mice by flow cytometry
PU Ying-yan, SUN Ding-ya, HUANG Ai-jun, CAO Li
Microglia;Flow cytometry;Experimental autoimmune encephalomyelitis
CAO Li, Email: caoli@smmu.edu.cn
10.3969/j.issn.1673-713X.2016.04.002
國家自然科學基金面上項目(81371326)
200433 上海,第二軍醫大學神經生物學教研室教育部分子神經生物學重點實驗室
曹莉,Email:caoli@smmu.edu.cn
2016-03-09

