腸道菌群對機體營養物質的代謝研究
郭慧慧,黃帥,王璐璐,韓燕星,蔣建東
·綜述·
腸道菌群對機體營養物質的代謝研究
郭慧慧,黃帥,王璐璐,韓燕星,蔣建東
人體腸道內寄居的微生物種類繁多,主要以厭氧菌為主,而且數量巨大,約為人體細胞總和的 10 倍[1]。正常的腸道菌群按一定的比例棲息于腸道內部,彼此之間互相制約,互相依存,共同維持人體腸道系統的平衡和穩定。
人類機體通過攝食從外界獲得的各種營養物質經過胃腸道的消化、吸收供給機體各種生命活動,而那些未消化、吸收的營養物質進入結腸后,將主要通過結腸內厭氧菌對其進行發酵,產生各種代謝產物[2]。這些代謝產物對維持腸道內環境起著不可忽視的作用。而且,腸道菌群可以利用機體提供的代謝產物合成多種氨基酸和維生素,補充人體生長所需的營養物質[3]。但是,一旦宿主與腸道微生物之間的穩態被打破,可能會誘發多種疾病,目前已經發現腸道菌群的營養物質代謝與糖尿病、血脂異常、慢性心腦血管疾病、結腸炎甚至癌癥的發生、進展和預后都有密切關系。本文主要介紹腸道菌群對糖類、膳食纖維、蛋白質、氨基酸、脂質和維生素等營養物質的代謝以及對機體產生的影響。
1 糖和膳食纖維代謝
食物中的抗性淀粉、低聚糖、非淀粉多糖和膳食纖維等進入人體后,不能在胃腸道酶的作用下消化吸收,它們經消化道進入結腸內,在結腸厭氧菌作用下,生成含 1 ~ 6 個碳原子的短鏈脂肪酸(short chain fatty acid,SCFA),其中最主要的是乙酸、丙酸和丁酸,三者比例大約為 3∶1∶1[4-6]。不同的腸道菌群產生不同種類的 SCFA,擬桿菌門以生成乙酸和丙酸為主,而厚壁菌門以生成丁酸為主[7]。那些未消化、吸收的糖和纖維素首先被腸道菌水解成單糖,然后經過菌群無氧糖酵解途徑生成丙酮酸,再在不同菌群內經過不同的代謝途徑生成不同種類的 SCFA[6-7],詳細代謝過程和代謝關鍵酶分別如圖 1 和表 1 所示。
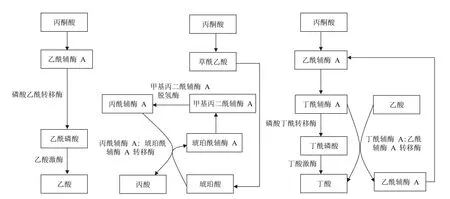
圖1 乙酸、丙酸和丁酸在腸道菌群內的合成途徑
擬桿菌門細菌首先將丙酮酸氧化成乙酰輔酶 A,然后經磷酸乙酰轉移酶、乙酸激酶生成乙酸[8],在生成乙酸時會產生 H2和 CO2,而 CO2經 Wood-Ljungdahl 通路也可生成乙酸,具體為:CO2首先被還原成 CO,然后經甲基轉移酶與甲基結合形成乙酸[9]。而且 H2和 CO2在古生菌內可生成甲烷,以免副產物堆積阻礙乙酸的生成。

表1 腸道菌產 SCFA 的基本情況
在擬桿菌門內生成的丙酮酸能與 CO2羧化形成草酰乙酸,經加氫、脫水和還原反應生成琥珀酸,然后轉化成甲基丙二酰輔酶 A 后,再經甲基丙二酰輔酶 A 脫氫酶生成丙酰輔酶 A,最后在丙酰輔酶 A∶琥珀酰輔酶 A 轉移酶作用下生成丙酸[10];此外,丙酮酸還可通過丙烯酸途徑形成丙酸(丙酮酸在乳酸菌內被還原成乳酸,經脫水、加氫還原生成丙酸)[8]。
丁酸是厚壁菌門的主要代謝產物,丙酮酸首先轉化成乙酰輔酶 A,經硫解、加氫、脫水、再加氫生成丁酰輔酶 A后,通過兩種途徑生成丁酸:①丁酰輔酶 A 通過磷酸丁酰轉移酶形成丁酰磷酸,然后在丁酸激酶作用下生成丁酸,其中丁酸激酶是該途徑的限速酶[8, 11];②丁酰輔酶 A 和乙酸直接經丁酰輔酶 A∶乙酰輔酶 A 轉移酶生成丁酸和乙酰輔酶 A[12],該通路將乙酸與丁酸的生成聯系在一起。而且,乳酸菌也可利用乳酸轉化成乙酰輔酶 A,再通過以上途徑生成丁酸[13]。研究還發現,有些產丁酸的腸道菌如Clostridium a cetobutylicum 有兩種丁酸激酶 BUK-1 和BUK-2,其中 BUK-1 對乙酰磷酸也有較高親和性,能催化乙酰磷酸生成乙酸,而 BUK-2 卻只能生成丁酸,基于此,敲除該菌的 buk-1 基因能大大提高丁酸產量[14]。
腸道菌群生成的 SCFA,約 95% 被宿主結腸細胞攝取,只有 5% 隨糞便排出體外,吸收的 SCFA 可為結腸細胞和機體其他組織提供能量,未吸收部分可調節腸道內環境的氧化還原平衡。近年來的研究發現,短鏈脂肪酸對肥胖、II 型糖尿病、胰島素抵抗代謝綜合征有顯著影響;乙酸和丙酸可抑制 TNF-α 的釋放,對結腸炎有良好的治療效果;而且研究發現丁酸能有效抑制結腸腫瘤細胞增殖、誘導腫瘤細胞分化的凋亡、影響原癌基因的表達,從而預防和治療結腸癌[15-19]。
2 蛋白質和氨基酸代謝
腸道中未消化的蛋白質和未吸收的氨基酸在腸道菌群作用下可生成多種活性代謝產物,主要包括 NH3、H2S、短鏈脂肪酸、多胺化合物、吲哚及酚類化合物。未消化的蛋白質先在腸道菌作用下分解成氨基酸,然后再進行氨基酸酵解,而且不同種類的氨基酸經腸道菌內的酶產生不同類型的產物(表 2)。
2.1芳香氨基酸代謝
芳香氨基酸經某些腸道厭氧菌如擬桿菌、乳酸菌、雙歧桿菌、梭狀芽孢桿菌、消化鏈球菌等代謝,主要生成酚類和吲哚類物質,但研究發現,僅約 10% 的腸道厭氧菌能代謝芳香氨基酸[20]。酪氨酸和苯丙氨酸經腸道厭氧菌群代謝主要生成苯酚、對甲酚、苯乙酸、苯丙酸等。測定結腸內這些物質的濃度時,發現在結腸近端這些產物的含量微量,而在結腸遠端產物的量明顯升高,說明能酵解酪氨酸和苯丙氨酸的腸道菌群主要位于結腸遠端[21]。

表2 腸道菌對氨基酸的代謝情況
色氨酸在腸道菌群的作用下生成吲哚、吲哚乙酸、吲哚-3-乳酸、3-甲基吲哚(糞臭素)等多種吲哚類化合物(圖 2)。色氨酸在色氨酸酶的作用下分解為吲哚、丙酮酸和氨,色氨酸酶是生成吲哚的關鍵酶,酶的活性易受底物色氨酸的誘導,因此當結腸環境內色氨酸的量發生改變時,機體吲哚的含量會有較大的波動[22];而色氨酸與 α-酮戊二酸在轉氨酶作用下生成吲哚-3-丙酮酸,然后再經吲哚丙酮酸脫羧酶生成吲哚乙酸,吲哚乙酸作為糞臭素的前體物質,可在某些腸道菌群如梭菌屬和桿菌屬作用下脫羧生成具有惡臭味的糞臭素,其中吲哚丙酮酸脫羧酶是生成吲哚乙酸和糞臭素的關鍵酶[23]。研究發現,能產生糞臭素的腸道菌群在腸道內并不廣泛存在,因此正常情況下,人體內糞臭素的量較少[24]。雖然糞臭素是由色氨酸代謝產生,但是大量研究發現,在腸道菌培養基中加入過量的色氨酸并不會顯著增加糞臭素的含量,但是當增加吲哚乙酸時,糞臭素的產生量顯著增加[25]。正常生理濃度下,這些吲哚類物質并不會對機體造成傷害,但是如果在結腸內過量集聚,會造成人結腸上皮細胞的損傷,甚至引發結腸癌[26],而且如果過量的糞臭素進入血液循環,易引發肺氣腫等呼吸道疾病[25]。
腸道菌群除了自身對色氨酸代謝影響機體生理功能外,還可通過其產生的各種代謝產物如 SCFA、脫氧膽酸、γ-氨基丁酸和酪胺等影響腸嗜鉻細胞對色氨酸代謝成 5-羥色胺[27];而且某些腸道菌自身也可利用色氨酸轉化為 5-羥色胺,但兩者的代謝方式不同,在腸道菌內,色氨酸首先經過脫羧反應生成色胺,再羥化成 5-羥色胺,而在腸嗜鉻細胞內,首先是在色氨酸羥化酶(限速酶)作用下生成 5-羥色氨酸,然后再脫羧生成 5-羥色胺[28]。腸道菌自身生成和腸道菌介導腸嗜鉻細胞生成的 5-羥色胺共同影響機體的腸道運動、血小板聚集和止血等生理功能。

圖2 色氨酸在腸道菌的主要代謝途徑
2.2含硫氨基酸代謝
半胱氨酸、甲硫氨酸等含硫氨基酸在腸道菌作用下產生比較特殊的產物——硫化物,它們主要是經過腸道菌群脫硫反應產生。半胱氨酸在半胱氨酸脫巰基酶作用下生成H2S[29];甲硫氨酸可在腸道菌作用下轉化成 α-酮丁酸、甲硫醇[30]。研究發現大腸內的大腸桿菌、沙門菌、梭狀菌和產氣腸桿菌等菌群可酵解含硫氨基酸[31]。H2S 在結腸內含量較高時,可穿透結腸上皮細胞的脂質雙分子層進入細胞,抑制線粒體內膜上細胞色素 C 氧化酶活性,干擾結腸細胞呼吸,影響能量代謝,甚至可以造成 DNA 鏈斷裂[32];但是生理濃度下的 H2S 對維持結腸細胞的正常能量供應和生命活動有非常重要的作用,因此飲食中含硫氨基酸的過多或過少都會引發機體結腸功能的紊亂,從而引發腸道甚至全身疾病[33]。
2.3脂肪族氨基酸代謝
精氨酸、鳥氨酸和甲硫氨酸在腸道菌群的作用下可產生多胺化合物,包括精胺、亞精胺、腐胺、尸胺,體外培養的類桿菌、乳酸菌、雙歧桿菌和梭狀菌等多種腸道菌都可產生多胺化合物[34];體內研究也發現對無菌鼠接種不同種類的腸道菌,其腸道內的多胺物質含量都會發生變化[35]。在正常生理濃度范圍內,這些多胺類物質可與周圍結腸細胞內的多種大分子物質結合,影響細胞的生長和增殖[36-37],如腐胺可促進結腸細胞的有絲分裂,誘發結腸癌[33, 38]。組氨酸、酪氨酸、賴氨酸經腸道菌脫羧反應可分別產生組胺、酪胺、胍丁胺等胺類物質[33, 39]。當菌群發生較大變化時,這些代謝產物作為神經遞質或生理活性物質作用于機體,產生不同的效應,如組胺與腸道內的組胺受體結合,使腸道平滑肌收縮,增強胃動力,引發腹痛、腹瀉;胍丁胺可抑制結腸癌細胞的增殖,發揮體外抗結腸癌活性[40]。
NH3是幾乎所有氨基酸都會產生的一種重要代謝產物。隨著飲食中蛋白質含量的增加,大腸內的氨濃度會顯著升高[41]。腸道內的 NH3主要是通過腸道菌對氨基酸脫氨或水解尿素所產生。氨在機體有非常重要的作用,如果結腸內產 NH3的腸道菌群過量繁殖,過量的氨可引發中樞性的氨中毒,影響大腦供能[42];過量的氨還會影響腸道內短鏈脂肪酸的氧化,干擾結腸細胞和某些腸道菌群的能量供應,引發機體的不良反應[17, 43];而且氨還有誘發結腸癌的風險[44]。
各種氨基酸經腸道菌脫氨、轉氨作用可產生多種結構不同的 α-酮酸或 α-羥基酸,然后再經過一系列復雜的氧化還原反應產生多種短支鏈脂肪酸[45],與糖類物質產生的短鏈脂肪酸一起發揮生物學效應。
3 脂代謝
腸道內寄生的腸道菌群在膽固醇的代謝過程中占有一席之地。腸道菌群對膽固醇的代謝有直接代謝和間接代謝兩種形式。直接代謝是指腸道內的某些正常菌群可產生膽固醇氧化酶,可將腸道內的膽固醇氧化成膽固烯酮,進而被降解成糞固醇和膽固烷醇,隨糞便排出體外,加速膽固醇的降解[46];間接代謝是指腸道菌群對膽固醇的肝臟代謝產物初級膽汁酸的代謝。正常腸道菌產生的初級膽汁酸水解酶能將結合膽汁酸轉變成游離膽汁酸,影響膽汁酸的腸肝循環,使血中的膽固醇更多的被轉化,從而降低血膽固醇[47]。而且,某些腸道菌可表達羥化類固醇 7α-脫氫酶,促進初級膽汁酸轉化成次級膽汁酸[47],抑制艱難梭狀芽胞桿菌的生長和繁殖,有效治療艱難梭狀芽孢桿菌感染[48];但也有研究稱,腸道菌產生的次級膽汁酸增多會對機體造成潛在的致癌效應[49]。
腸道菌對食物中的卵磷脂代謝與某些慢性心血管疾病有關。卵磷脂在體內水解形成膽堿后進入腸道,經由腸道菌的作用生成三甲胺,之后三甲胺被吸收進入血液,隨血流進入肝臟,在肝臟黃素單加氧酶作用下形成 N-氧化三甲胺。目前研究發現,機體 N-氧化三甲胺的增多與冠狀動脈粥樣硬化性心血管疾病、慢性收縮性心力衰竭等都有重要的關系[50-51]。
4 維生素的代謝
機體自身缺乏合成大多數維生素的能力,所需維生素主要由食物供給,因此當營養不良或者有不良的飲食習慣時,很容易造成維生素的缺乏。但研究發現,人體腸道內的微生物也是供給機體維生素的一種重要途徑,人體腸道內的正常菌群如雙歧桿菌、乳酸桿菌等可合成多種 B 組維生素(如維生素 B1、B2、B6、B12、維生素 PP、葉酸、泛酸、生物素)和維生素 K等。
腸道菌合成葉酸主要是利用人腸道提供的 6-羥甲基-7,8-蝶呤焦磷酸(DHPPP)和對氨基苯甲酸(PABA)合成的。雙歧桿菌屬和乳酸桿菌屬內的多種菌都含有合成葉酸的多種酶,而且不同種的菌合成葉酸的能力也大不相同[52-53]。但是 PABA 和 DHPPP 是合成葉酸所必需的底物,當腸道內缺乏這兩種物質時,幾乎所有菌株都無法合成葉酸[54]。
腸道菌群在機體提供 GTP 和 5-磷酸-D-核酮糖的基礎上依靠多種菌群產生的多種酶合成維生素 B2。研究發現,合成維生素 B2的酶并不存在同一種菌株內,而是一種菌只能合成其中的一個或者某幾個酶,因此,它的生物合成需要多種菌株共同協作完成[55-56]。目前已知枯草芽孢桿菌、大腸桿菌和沙門菌等可以合成維生素 B2[57]。
生物素可在多種腸道菌如大腸桿菌、球形芽孢桿菌和枯草芽孢桿菌中合成。研究發現,球形芽孢桿菌和枯草芽孢桿菌可利用自身合成的庚二酸,在菌體 bioW 基因編碼的庚二酰輔酶 A 合成酶作用下合成庚二酰輔酶 A,之后再在多種氨基酸及各種酶作用下合成生物素[58];而大腸桿菌體內缺乏合成庚二酸的酶,需依賴另外兩種基因 bioC 和 bioH表達的酶合成庚二酰輔酶 A 后,再按上述步驟合成生物素[59]。
維生素 K 在維持血液的正常凝固方面有非常重要的生理意義。人體缺乏合成維生素 K 的酶,機體所需主要由食物和腸道菌群供給。而且發現維生素 K1主要由植物合成,而 K2主要由人體腸道細菌合成。腸道中的一些專性厭氧菌如擬桿菌屬、真細菌屬、丙酸菌屬和蛛網菌屬是合成維生素 K2的主要菌群,而兼性厭氧菌如大腸桿菌、雙歧桿菌屬、乳酸菌屬、梭菌屬等不能合成[60]。
其他 B 族維生素如 B1、B6、B12等也可以在腸道菌群的某種或多種菌株內合成,如在腸道內含有嗜熱鏈球菌ST5 和瑞士乳桿菌 R0052 的動物比不含有這些菌株的動物體內的維生素 B1和 B6的含量要高[61]。
腸道菌群合成的維生素是機體補充維生素、維持維生素水平穩定的一種非常重要的方式,當疾病、抗生素治療導致腸道菌群失衡時,機體內的維生素水平有可能發生較大的波動,此時,一旦食物無法及時供應足夠量的維生素,機體就會出現各種維生素缺乏癥狀,影響機體的生命活動。
5 展望
Science 就曾預測腸道微生物研究可能成為世界范圍內的新熱點課題,而且隨著腸道微生物基因組計劃的實施和腸道宏基因組學、功能基因組學、代謝組學以及蛋白質組學的不斷發展,腸道微生物研究越來越受到眾多學者的重視[62]。調查研究發現,近期有多個國家的研究組在 Nature、Science等頂尖雜志上發表了有關這一領域的最新研究成果。腸道菌群對機體營養物質代謝產生的各種代謝產物與肥胖、II 型糖尿病、血脂異常、慢性心腦血管疾病、結腸炎和結腸癌等密切相關,因此在腸道微生物的研究中,腸道菌對機體營養物質的代謝研究將會越來越受到關注。
[1] Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. Curr Opin Clin Nutr Metab Care, 2007,10(6):729-734.
[2] Fischbach MA, Sonnenburg JL. Eating for two: how metabolism establishes interspecies interactions in the gut. Cell Host Microbe,2011, 10(4):336-347.
[3] Xu J, Gordon JI. Honor thy symbionts. Proc Natl Acad Sci U S A,2003, 100(18):10452-10459.
[4] Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol, 2010, 72:297-313.
[5] Hijova E, Chmelarova A. Short chain fatty acids and colonic health. Bratisl Lek Listy, 2007, 108(8):354-358.
[6] Flint HJ, Bayer EA, Rincon MT, et al. Polysaccharide utilization by gut bacteria: potential for new insights from genomic analysis. Nat Rev Microbiol, 2008, 6(2):121-131.
[7] Macfarlane S, Macfarlane GT. Regulation of short-chain fatty acid production. Proc Nutr Soc, 2003, 62(1):67-72.
[8] Miller TL, Wolin MJ. Pathways of acetate, propionate, and butyrate formation by the human fecal microbial flora. Appl Environ Microbiol,1996, 62(5):1589-1592.
[9] Ragsdale SW, Pierce E. Acetogenesis and the Wood-Ljungdahl pathway of CO2 fixation. Biochim Biophys Acta, 2008, 1784(12):1873-1898.
[10] Wang Z, Ammar EM, Zhang A, et al. Engineering Propionibacterium freudenreichii subsp. shermanii for enhanced propionic acid fermentation: effects of overexpressing propionyl-CoA: Succinate CoA transferase. Metab Eng, 2015, 27:46-56.
[11] Louis P, Flint HJ. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine. FEMS Microbiol Lett, 2009, 294(1):1-8.
[12] Duncan SH, Barcenilla A, Stewart CS, et al. Acetate utilization and butyryl coenzyme A (CoA): acetate-CoA transferase in butyrate -producing bacteria from the human large intestine. Appl Environ Microbiol, 2002, 68(10):5186-5190.
[13] Duncan SH, Louis P, Flint HJ. Lactate-utilizing bacteria, isolated from human feces, that produce butyrate as a major fermentation product. Appl Environ Microbiol, 2004, 70(10):5810-5817.
[14] Jang YS, Im JA, Choi SY, et al. Metabolic engineering of Clostridium acetobutylicum for butyric acid production with high butyric acid selectivity. Metab Eng, 2014, 23:165-174.
[15] Tedelind S, Westberg F, Kjerrulf M, et al. Anti-inflammatory properties of the short-chain fatty acids acetate and propionate: a study with relevance to inflammatory bowel disease. World J Gastroenterol,2007, 13(20):2826-2832.
[16] den Besten G, van Eunen K, Groen AK, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. J Lipid Res, 2013, 54(9):2325-2340.
[17] Darcy-Vrillon B, Cherbuy C, Morel MT, et al. Short chain fatty acid and glucose metabolism in isolated pig colonocytes: modulation by NH4+. Mol Cell Biochem, 1996, 156(2):145-151.
[18] Remely M, Aumueller E, Merold C, et al. Effects of short chain fatty acid producing bacteria on epigenetic regulation of FFAR3 in type 2diabetes and obesity. Gene, 2014, 537(1):85-92.
[19] Layden BT, Angueira AR, Brodsky M, et al. Short chain fatty acids and their receptors: new metabolic targets. Transl Res, 2013,161(3):131-140.
[20] Smith EA, Macfarlane GT. Enumeration of human colonic bacteria producing phenolic and indolic compounds: effects of pH,carbohydrate availability and retention time on dissimilatory aromatic amino acid metabolism. J Appl Bacteriol, 1996, 81(3):288-302.
[21] Macfarlane GT, Macfarlane S. Human colonic microbiota: ecology,physiology and metabolic potential of intestinal bacteria. Scand J Gastroenterol Suppl, 1997, 222:3-9.
[22] Yokoyama MT, carlson JR. Microbial metabolites of tryptophan in the intestinal tract with special reference to skatole. Am J Clin Nutr, 1979,32(1):173-178.
[23] Whitehead TR, Price NP, Drake HL, et al. Catabolic pathway for the production of skatole and indoleacetic acid by the acetogen Clostridium drakei, Clostridium scatologenes, and swine manure. Appl Environ Microbiol, 2008, 74(6):1950-1953.
[24] Cook KL, Rothrock MJ Jr, Loughrin JH, et al. Characterization of skatole-producing microbial populations in enriched swine lagoon slurry. FEMS Microbiol Ecol, 2007, 60(2):329-340.
[25] Sharma N, Doerner KC, Alok PC, et al. Skatole remediation potential of Rhodopseudomonas palustris WKU-KDNS3 isolated from an animal waste lagoon. Lett Appl Microbiol, 2015, 60(3):298-306.
[26] Nowak A, Libudzisz Z. Influence of phenol, p-cresol and indole on growth and survival of intestinal lactic acid bacteria. Anaerobe, 2006,12(2):80-84.
[27] Yano JM, Yu K, Donaldson GP, et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 2015, 161(2):264-276.
[28] Williams BB, Van Benschoten AH, Cimermancic P, et al. Discovery and characterization of gut microbiota decarboxylases that can produce the neurotransmitter tryptamine. Cell Host Microbe, 2014,16(4):495-503.
[29] Awano N, Wada M, Mori H, et al. Identification and functional analysis of Escherichia coli cysteine desulfhydrases. Appl Environ Microbiol, 2005, 71(7):4149-4152.
[30] Smith EA, Macfarlane GT. Dissimilatory amino Acid metabolism in human colonic bacteria. Anaerobe, 1997, 3(5):327-337.
[31] Kadota H, Ishida Y. Production of volatile sulfur compounds by microorganisms. Annu Rev Microbiol, 1972, 26:127-138.
[32] Vermeiren J, Van de Wiele T, Van Nieuwenhuyse G, et al. Sulfide- and nitrite-dependent nitric oxide production in the intestinal tract. Microb Biotechnol, 2012, 5(3):379-387.
[33] Davila AM, Blachier F, Gotteland M, et al. Intestinal luminal nitrogen metabolism: role of the gut microbiota and consequences for the host. Pharmacol Res, 2013, 68(1):95-107.
[34] Allison C, Macfarlane GT. Influence of pH, nutrient availability, and growth rate on amine production by Bacteroides fragilis and Clostridium perfringens. Appl Environ Microbiol, 1989, 55(11):2894-2898.
[35] Noack J, Dongowski G, Hartmann L, et al. The human gut bacteria Bacteroides thetaiotaomicron and Fusobacterium varium produce putrescine and spermidine in cecum of pectin-fed gnotobiotic rats. J Nutr, 2000, 130(5):1225-1231.
[36] Igarashi K, Kashiwagi K. Modulation of cellular function by polyamines. Int J Biochem Cell Biol, 2010, 42(1):39-51.
[37] Shah P, Swiatlo E. A multifaceted role for polyamines in bacterial pathogens. Mol Microbiol, 2008, 68(1):4-16.
[38] Ray RM, McCormack SA, Johnson LR. Polyamine depletion arrests growth of IEC-6 and Caco-2 cells by different mechanisms. Am J Physiol Gastrointest Liver Physiol, 2001, 281(1):G37-G43.
[39] Gale EF. The production of amines by bacteria: the production of putrescine from l(+)-arginine by Bacterium coli in symbiosis with Streptococcus faecalis. Biochem J, 1940, 34(6):853-857.
[40] Mayeur C, Veuillet G, Michaud M, et al. Effects of agmatine accumulation in human colon carcinoma cells on polyamine metabolism, DNA synthesis and the cell cycle. Biochim Biophys Acta,2005, 1745(1):111-123.
[41] Smith EA, Macfarlane GT. Enumeration of amino acid fermenting bacteria in the human large intestine: effects of pH and starch on peptide metabolism and dissimilation of amino acids. FEMS Microbiol Ecol, 1998, 25(4):355-368.
[42] Andriamihaja M, Davila AM, Eklou-Lawson M, et al. Colon luminal content and epithelial cell morphology are markedly modified in rats fed with a high-protein diet. Am J Physiol Gastrointest Liver Physiol,2010, 299(5):G1030-G1037.
[43] Cremin JD Jr, Fitch MD, Fleming SE. Glucose alleviates ammonia-induced inhibition of short-chain fatty acid metabolism in rat colonic epithelial cells. Am J Physiol Gastrointest Liver Physiol,2003, 285(1):G105-G114.
[44] Ichikawa H, Sakata T. Stimulation of epithelial cell proliferation of isolated distal colon of rats by continuous colonic infusion of ammonia or short-chain fatty acids is nonadditive. J Nutr, 1998,128(5):843-847.
[45] Millet S, Van Oeckel MJ, Aluwé M, et al. Prediction of in vivo short-chain fatty acid production in hindgut fermenting mammals:problems and pitfalls. Crit Rev Food Sci Nutr, 2010, 50(7):605-619.
[46] Li C, Cui LH. Relationship among intestinal flora, high-fat diets, and hyperlipidemia. World Chin J Digestology, 2013, 21(14):1273-1277. (in Chinese)
李超, 崔立紅. 高脂血癥、高脂飲食與腸道菌群的關系. 世界華人消化雜志, 2013, 21(14):1273-1277.
[47] Ridlon JM, Kang DJ, Hylemon PB. Bile salt biotransformations by human intestinal bacteria. J Lipid Res, 2006, 47(2):241-259.
[48] Buffie CG, Bucci V, Stein RR, et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature, 2015, 517(7533):205-208.
[49] Gill CI, Rowland IR. Diet and cancer: assessing the risk. Br J Nutr,2002, 88 Suppl 1:S73-S87.
[50] Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature, 2011,472(7341):57-63.
[51] Tang WH, Wang Z, Shrestha K, et al. Intestinal microbiota-dependent phosphatidylcholine metabolites, diastolic dysfunction, and adverse clinical outcomes in chronic systolic heart failure. J Card Fail, 2015,21(2):91-96.
[52] Pompei A, Cordisco L, Amaretti A, et al. Administration of folate-producing bifidobacteria enhances folate status in Wistar rats. J Nutr, 2007, 137(12):2742-2746.
[53] Lai?o JE, Leblanc JG, Savoy de Giori G. Production of natural folates by lactic acid bacteria starter cultures isolated from artisanal Argentinean yogurts. Can J Microbiol, 2012, 58(5):581-588.
[54] Ventura M, Turroni F, Zomer A, et al. The Bifidobacterium dentiumBd1 genome sequence reflects its genetic adaptation to the human oral cavity. PLoS Genet, 2009, 5(12):e1000785.
[55] Ventura M, Canchaya C, Fitzgerald GF, et al. Genomics as a means to understand bacterial phylogeny and ecological adaptation: the case of bifidobacteria. Antonie van Leeuwenhoek, 2007, 91(4):351-372.
[56] Bacher A, Eberhardt S, Fischer M, et al. Biosynthesis of vitamin B2 (riboflavin). Annu Rev Nutr, 2000, 20(1):153-167.
[57] Magnúsdóttir S, Ravcheev D, de Crécy-Lagard V, et al. Systematic genome assessment of B-vitamin biosynthesis suggests co-operation among gut microbes. Front Genet, 2015, 6:148.
[58] Ploux O, Soularue P, Marquet A, et al. Investigation of the first step of biotin biosynthesis in Bacillus sphaericus. Purification and characterization of the pimeloyl-CoA synthase, and uptake of pimelate. Biochem J, 1992, 287(Pt 3):685-690.
[59] Lemoine Y, Wach A, Jeltsch JM. To be free or not: the fate of pimelate in Bacillus sphaericus and in Escherichia coli. Mol Microbiol, 1996,19(3):645-647.
[60] Bentley R, Meganathan R. Biosynthesis of vitamin K (menaquinone)in bacteria. Microbiol Rev, 1982, 46(3):241-280.
[61] LeBlanc JG, Milani C, de Giori GS, et al. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol,2013, 24(2):160-168.
[62] Wang ZK, Yang YS. Intestinal microbiota and human diseases. Med J Chin PLA, 2012, 37(12):1168-1176. (in Chinese)王子凱, 楊云生. 腸道微生物與人類疾病. 解放軍醫學雜志, 2012,37(12):1168-1176.
10.3969/j.issn.1673-713X.2016.04.010
北京市科委重點實驗室項目(Z141102004414062)
100050 北京,中國醫學科學院北京協和醫學院藥物研究所藥理室(郭慧慧、黃帥、王璐璐、韓燕星、蔣建東);100050 北京,中國醫學科學院北京協和醫學院醫藥生物技術研究所病毒室(黃帥、蔣建東)
韓燕星,Email:hanyanxing@imm.ac.cn;蔣建東,Email:jiang.jdong@163.com
2016-03-04

