紅霉素高產菌株的推理選育
萬 丹,秦寶福,劉迎賓,張明明,董維平,李 強
(1 西北農林科技大學, 陜西 西安 712100 2 天方藥業有限公司 ,河南 駐馬店 463000)
紅霉素高產菌株的推理選育
萬 丹1,2,秦寶福1,劉迎賓1,2,張明明1,2,董維平1,2,李 強1,2
(1 西北農林科技大學, 陜西 西安 712100 2 天方藥業有限公司 ,河南 駐馬店 463000)
推理選育是一種應用廣泛的高通量篩選技術,本文以紅霉素生產菌紅色鏈霉菌HA-13-36為出發菌株,經過氯化鋰、紫外線、DES三重復合誘變后,定向篩選耐丙酸鹽高產突變株Ⅰ(B-14-30),耐紅霉素高產突變株Ⅱ(H-14-05),再利用原生質體融合技術將Ⅰ和Ⅱ融合后獲得新的高產融合子R-15-26,該重組子搖瓶效價為6532u/mL,比原始菌株提高了36.2%,比誘變菌株提高23.9% ,比高產突變菌株Ⅰ和Ⅱ分別提高了10.3%和16.0%,且經過多次傳代表明具有較強的遺傳穩定性,小試效價達到10000u/mL以上。
紅霉素 ; 復合誘變 ; 抗性篩選 ; 原生質體融合
紅霉素 (Erythromycin)是由紅色鏈霉菌所產生的14元大環內酯類抗生素,它抗菌譜廣,在臨床和日常生活中具有廣泛應用價值[1-3]。目前紅霉素品種存在生產菌種效價低,生產成本高等問題,滿足不了當今市場的需求,因此,選育紅霉素高產菌株是紅霉素生產中需要解決的關鍵問題。紅霉素菌種的誘變選育方法通常采用UV、快中子、離子束、微波、激光等物理誘變和氯化鋰、亞硝基胍、EMS、DES等化學誘變[4],隨著環境的變化,紅霉素的抗性能力顯著提高,單一的誘變方法很難較大程度的提高生產菌株的生產能力[5-6]。因此,本文采用氯化鋰、紫外線、DES三重復合誘變和定向篩選耐丙酸鹽及耐紅霉素高產突變株。最后采用原生質體融合技術[7],可大大提高獲得高產重組子的幾率,為生產提供優質高產菌株。
1 材料與方法
1.1 菌種
天方藥業菌種中心保藏的紅色鏈霉菌HA-13。
1.2 培養基及培養條件
(1)斜面與平板培養基配比(%):玉米淀粉1.2,硫酸銨0.5,蛋白胨1.0,玉米漿1.0,氯化鈉0.2,碳酸鈣0.3,瓊脂粉18~22;pH值7.0~7.2。培養條件: 36℃,時間6~8 d。
(2)種子培養基配比(%):玉米淀粉3.5,黃豆餅粉1.5,蛋白胨0.5,糊精2.0,葡萄糖2.0,氯化鈉0.4,碳酸鈣0.75,硫酸鎂0.05,磷酸氫二鉀0.02,硫酸銨0.75;豆油0.2mL/25 mL,pH值 7.0~7.2。培養條件:溫度34℃,相對濕度40%~60%,周期44~48 h,轉速220~240r/min。
(3)發酵培養基配比(%):黃豆餅粉4.0,淀粉4.5,硫酸銨0.2,碳酸鈣0.6,葡萄糖 2.0,玉米漿0.2,豆油0.2 mL/25 mL,pH值 6.8~7.0。
培養條件:溫度34℃,相對濕度40%~60%,轉速220~240 r/min,周期7 d,發酵0h和48h加正丙醇適量。
(4)菌絲培養基配比(%);葡萄糖1,蛋白胨0.4,酵母膏0.4,硫酸鎂0.05 ,磷酸二氫鉀0.2,磷酸氫二鉀0.4。
(5)P培養基配比(%);蔗糖10.3,硫酸鉀0.025,硫酸二氫鉀0.005,氯化鎂0.08,氯化鈣0.28,pH值7.2。
(6)再生培養基配比(%): 淀粉1.0,蛋白胨,1.0,玉米漿1.0,碳酸鈣0.25,硫酸銨0.3,氯化鈉0.3,蔗糖10.3氯化鈣0.28,氯化鎂0.1。
1.3 紅霉素效價測定方法:磷酸法[8]
1.4 紅霉素誘變及篩選方法
1.4.1 菌種復壯
取成熟的生產斜面一支,用10mL無菌水把斜面孢子洗下來,稀釋涂布平板,36℃,培養7d,挑選單菌落進行搖瓶初篩、復篩及遺傳穩定性試驗,結果見表1。
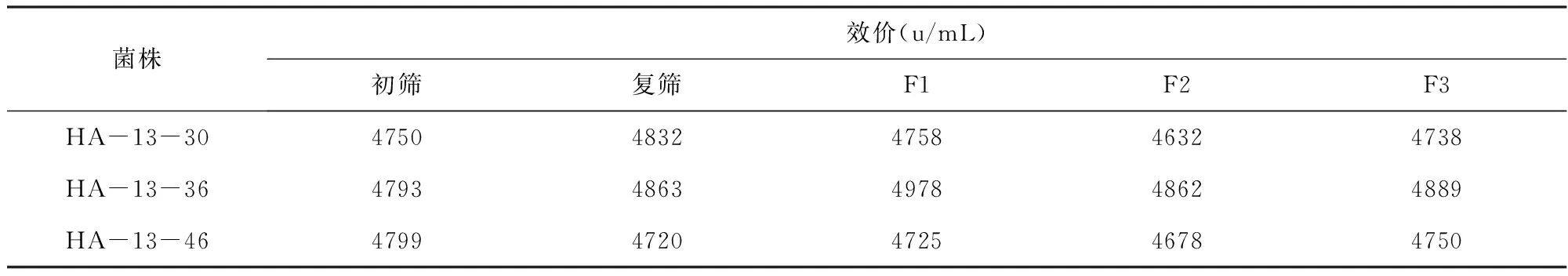
表1 原始菌株的遺傳穩定性實驗
1.4.2 紫外誘變處理
取制備好的菌懸液于直徑為90mm的平底平皿中。紫外燈打開預熱20min,以穩定波長。將盛有菌懸液的平皿放到15W,紫外波長253.7nm的紫外燈下300mm處,打開皿蓋,分別照射30s,45s,60s,75s,90s,105s邊攪拌邊照射,使細胞能夠均勻吸收紫外光線。吸取紫外處理過的菌液,作不同稀釋度,涂皿,同等條件下不經紫外線照射過的菌懸液作為對照樣,于36℃倒置培養7天。計算致死率和正突變率,選擇合適的照射劑量。結果見表2
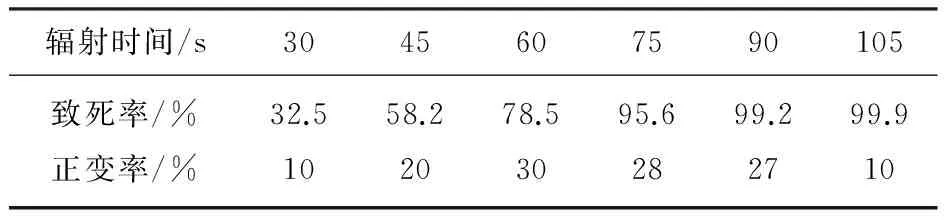
表2 紫外線輻照時間與孢子致死率和菌株正突變率的關系
1.4.3 紫外、氯化鋰復合誘變處理
將紫外誘變60S的孢子菌懸液涂布于濃度為0.3%、0.6%、0.9%、1.2%、1.5%、1.8% Licl平板培養基上,以涂布在原始分離培養基上的孢子懸浮液作對照,于36℃倒置培養7天。計算致死率和正突變率,選擇合適的Licl濃度。
1.4.5 UV-Licl-DES三重復合誘變
將經UV和Licl復合誘變的高產菌株進行DES處理,分別振蕩10min、20min、30min、40min、50min、60min,稀釋終止反應,涂平板培養。計算致死率和正突變率。獲得的高產突變株作為下一步實驗的出發菌株。
1.4.6 耐丙酸鹽突變株的篩選
將出發菌株制成孢子菌懸液,然后均勻涂布在丙酸鹽濃度為0.3%、0.5%、0.8%的選擇性培養基上,以原始分離培養基作為對照,篩選出高產菌株Ⅰ。
1.4.7 耐紅霉素突變株的篩選
將出發菌株制成孢子菌懸液,然后均勻涂布在紅霉素濃度為5000u/mL、6000u/mL、7000u/mL的紅霉素選擇性培養基上,以原始分離培養基作對照,篩選出高產菌株Ⅱ。
1.4.8 原生質體融合
將高產菌株Ⅰ,高產菌株Ⅱ,分別制備孢子菌懸液,然后接入菌絲培養基中,再用蔗糖溶液和P培養基洗滌,使細胞壁和原生質體分離,將制備的原生質體以1:1的比例在聚乙二醇的促融下進行原生質體融合,然后用P溶液稀釋涂布在再生培養基上。挑選穩定的融合子進行保藏。
2 結果與分析
2.1 原始菌株的復壯
由表1可以看出,紅霉素生產菌經搖瓶初篩、復篩及傳代實驗后,有三個單菌落的效價較高,選取效價最高且穩定的HA-13-36作為下一步實驗的出發菌株。
2.2 紫外線和氯化鋰誘變處理結果
菌株HA-13-36孢子菌懸液經過不同的紫外誘變處理后,結果見表2,紫外誘變60s時,致死率達到78.5%,據文獻報道[9],紫外誘變致死率在70%~80%時,產生正突變的幾率高。考慮到后續的誘變處理,最佳誘變時間為60S。復合誘變結果見表3。

表3 紅霉素不同誘變處理結果
由表3可以看出,復合誘變比單獨紫外誘變正變率要高,經紫外60s+Licl0.9%處理后搖瓶效價和正突變率最高。
2.3 UV-Licl-DES三重復合誘變處理結果
菌株HA-13-36經UV60S+licl0.9%處理后,然后加入0.1%的DES進行處理,DES處理40min的效果最為理想,誘變株U-14-30效價達到5267u/mL,由表4可以看出比出發菌株提高了9.88%。
2.4 抗性突變株的誘變結果比較
出發菌株U-14-30制成的孢子菌懸液,分別涂布于丙酸鹽和紅霉素梯度平板上,經過篩選,確定丙酸鹽濃度為0.5%,紅霉素添加濃度為6000u/mL,經過搖瓶初篩復篩和遺傳穩定性考察,分別獲得耐丙酸鹽突變株B-14-30,耐紅霉素突變株H-14-05,結果見表4。
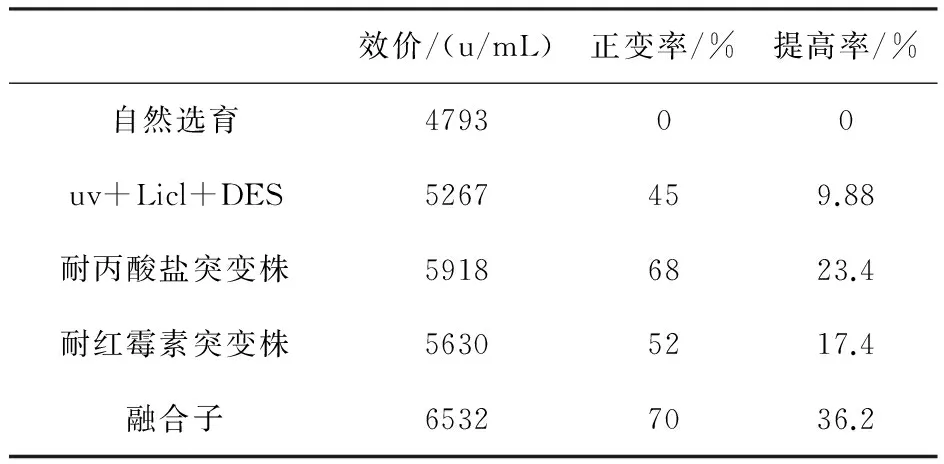
表4 復合誘變和抗性突變株生產能力比較
2.5 高產融合子的篩選結果
原生質體融合過程中的溶菌酶質量濃度為1.2mg/mL,34℃.酶解50min,突變株B-14-30和突變株H-14-05經原生質體融合再生后,涂布高滲培養基進行培養,篩選出穩定的高產融合子R-15-26,效價達到6532u/mL,比出發菌株提高了36.2%。結果見表5。

表5 菌株的遺傳穩定性實驗
2.6 FUS-50L(A)生物反應器發酵結果
為進一步考察突變菌株R-15-26的生產能力及其遺傳穩定性,將其F1-F3各代的菌種經搖瓶培養后接進 FUS-50L(A)生物反應器進行發酵,放罐效價見表6。 從表6可以看出:突變菌株R-15-26 F1-F3代在 FUS-50L(A)生物反應器上的發酵放罐效價與原始出發菌株HA-13-36相比,均有不同程度的提高,并且各代之間差異較小,說明融合子R-15-26生物學遺傳特性是相對穩定的。
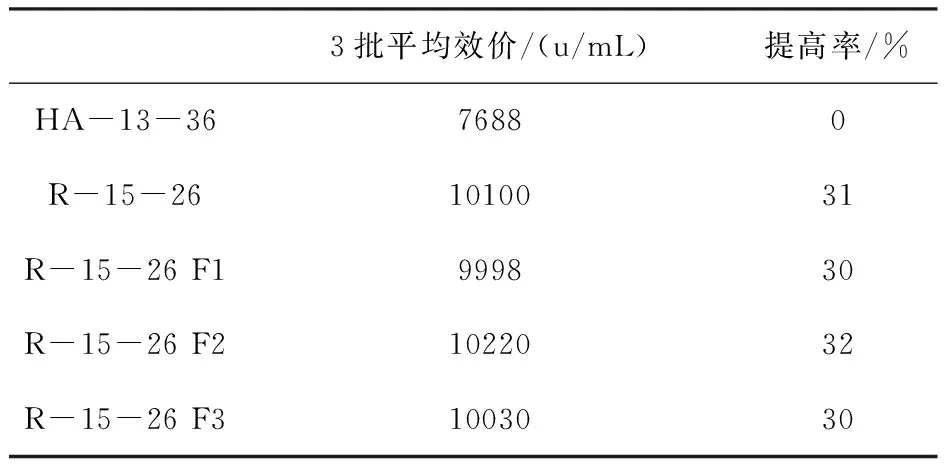
表6 FUS-50L(A)生物反應器發酵結果
3 討論
(1) 三重復合誘變能使紅霉素生產菌多種基因位發生變異,多種誘變劑交互作用[10],能提高篩選紅霉素高產菌株的幾率。
(2) 在紅霉素生物合成過程中,紅霉內酯的碳架來源于丙酸鹽和丙酰CoA[11],添加丙酸鹽對甲基丙二酰-CoA合成途徑有不同的調控作用,增加丙酸鹽的濃度有可能提高紅霉素的產率。抗生素對自身產生菌的生長繁殖具有抑制作用,并對終產物具有反饋調節作用[12],篩選紅霉素耐受菌株,會解除終產物的反饋抑制,從而提高紅霉素的產量。
(3)將兩種誘變方法獲得的突變株進行原生質體融合,提高了獲得高產融合子的幾率,有效的提高了菌種的代謝能力,豐富了基因庫的內容,是一種比較理想的微生物育種方法,在生產上具有一定的推廣應用價值。
[1] Venkata D V,Panda T.Optimization of microbiological Parameters for enhanced griseofulvin production using response surface methodology[J].Bioprecess Eng,2000,22(1):45-49.
[2] 李小輝,畢小玲.新一代紅霉素衍生物及其構效關系研究進展[J].藥學進展,2009,33(1 1):491-496.
[3] 馬春宏,李冬影,王仁章.紅霉素類抗生素分析研究進展[J].長春師范學院學報(自然科學版),2008,27(4):62-65.
[4] 龔文靜,張 宇,虞 龍,等.紅霉素高產突變菌株發酵工藝優化研究[J].中國釀造,2012,31(3):136-140.
[5] 王筱虹,倪文琴,劉 寒.原生質體紫外誘變技術篩選紅霉素高產菌株的研究[J].中國藥科大學學報,2000,31(4):63-65.
[6] 虞 龍,張 宇,龔文靜,等.氯化鋰一紫外一離子束復合誘變紅霉素高產菌株研究[J].原子能科學技術,2011,45(7):780-784.
[7] 劉敏躍,李 鵬,等.微生物原生質體融合育種技術及其應用研究進展[J].中國飼料,2014 (7):17-21.
[8] 左 勇,李 楊,任永利,等.紅霉素產生菌的誘變及培養基優化研究[J].四川理工學院學報:自然科學版,2012,25(1):14-18.
[9] 王智慧,楊 帥,劉宏民.氯化鋰-紫外-微波復合誘變紅霉素高產菌株的研究[J].鄭州大學學報,2013, 45(4):87-90.
[10] 孫 益,姚 瑜.大環內酯類抗生素的菌種選育、發酵和生物合成[J].國外醫藥抗生素分冊.1997,18(2):99-113.
[11] 張部昌,趙志虎,馬清鈞.紅霉素生物合成的分子生物學[J].生物技術通訊.2001, 12(2):151-160.
[12] 李 嘯,陳長華,李友元,等.紅霉素生產及其有效組分轉化的優化[J].中國抗生素雜志,2005,30(2):65-69.
(本文文獻格式:萬 丹,秦寶福,劉迎賓.紅霉素高產菌株的推理選育[J].山東化工,2016,45(08):65-67.)
Rational Selection of Erythromycin High-producing Strains
Wan Dan1,2, Qin Baofu1,2, Liu Yingbin1,2,Zhang Mingming1,2,Dong Weiping1,2,Li Qiang1,2
(1 Northwest A&F University Xi,an 712100,China;2 Henan Topfond Pharmaceutical Company Limited, Zhumadian 463000,China)
Reasoning breeding is a kind of widely used high-throughput screening technology, based on the production of erythromycin bacterium Streptomyces red HA-13-36 for starting strain, after uv and lithium chloride and DES triple compound mutagenesis, directional filter resistance to sodium propionate high yield mutant strainsⅠ(B - 14-30), erythromycin resistance and high yield mutant strainsⅡ(H - 14-05), reuse of protoplast fusion technology of new production after merge theirⅠandⅡR-15 -26, the reorganization of the son shake flask titer of 6532 u/mL, than the original strains increased by 36.2%, 23.9% higher than that of mutation strains, than the high yield mutant strainⅠandⅡincreased by 10.3% and 16.0% respectively, and after many batches showed strong genetic stability, small titer reached more than 10000 u/mL.
erythromycin ;copound mutation ;resistance screening;protoplast fusion
2016-03-09
萬 丹(1981—),女,河南扶溝人,學士學位,工程師,主要從事微生物遺傳育種及發酵工藝優化研究;通訊作者:秦寶福(1968—),西北農林科技大學生命科學學院副教授,主要從事微生物資源、發酵工程等領域的研發工作
Q93
B
1008-021X(2016)08-0065-03

