氟在內質網應激引起原代培養成釉細胞自噬與凋亡中的作用
王 琳, 王丹楊, 王 峰, 謝 娜
(西安醫學院口腔醫學系,西安 710021;*通訊作者,E-mail:815365619@qq.com)
?
氟在內質網應激引起原代培養成釉細胞自噬與凋亡中的作用
王琳*, 王丹楊, 王峰, 謝娜
(西安醫學院口腔醫學系,西安710021;*通訊作者,E-mail:815365619@qq.com)
目的探討氟在內質網應激引起原代培養成釉細胞自噬與凋亡中的作用及相關機制。方法分離SD大鼠上下頜磨牙牙胚中的成釉細胞進行原代培養。待細胞生長穩定后,采用0.8 mmol/L、1.6 mmol/L NaF分別干預體外培養成釉細胞24 h和48 h,倒置顯微鏡及透射電鏡觀察細胞形態及其超微結構。1.6 mmol/L NaF作用于成釉細胞24 h和48 h,利用real-time PCR和Western blot法分別檢測不同時間點下成釉細胞XBP1s mRNA、GRP78和CHOP蛋白的表達水平。結果倒置顯微鏡下觀察,0.8 mmol/L NaF干預成釉細胞24 h和48 h,與對照組相比均未見明顯差異。1.6 mmol/L NaF作用于成釉細胞48 h凋亡細胞數明顯多于同濃度氟作用于細胞24 h時。透射電鏡結果顯示,NaF干預成釉細胞24 h,0.8 mmol/L NaF組細胞粗面內質網池樣擴張,線粒體腫脹,體積增大,電子密度降低,溶酶體豐富,自噬樣結構可見。1.6 mmol/L NaF 組細胞內自噬樣結構明顯增加。1.6 mmol/L NaF作用下,成釉細胞內質網應激相關蛋白XBP1s mRNA、GRP-78及CHOP蛋白表達水平48 h時間點較24 h 時間點均明顯增加(P<0.01)。結論氟可導致成釉細胞內質網應激,啟動自噬,隨著氟處理時間延長,激活凋亡信號通路,誘導細胞凋亡。
氟;成釉細胞;內質網應激;自噬;細胞凋亡
牙齒發育期間攝入過量的氟會影響釉質的形成,導致氟牙癥。成釉細胞是釉質發育過程中的主要細胞[1]。有研究表明,高劑量的氟會引起成釉細胞內質網應激[2,3]。內質網是細胞膜蛋白和分泌蛋白加工成熟的主要場所[4],在應激狀態下會失去正確折疊的能力而導致未折疊或錯誤折疊蛋白的累積,進一步激活未折疊蛋白反應 (unfolded protein response,UPR),促進內質網對蓄積在網腔內的未折疊或錯誤折疊蛋白質的降解[5]或自噬[6],以維持細胞內穩態。
自噬是一種高度調節代謝過程,在許多細胞活動包括發育、分化、存活和維持內穩態都是至關重要的[7]。內質網應激-自噬可以維持細胞內環境的穩態平衡,具有一定的保護性作用。內質網應激時未折疊蛋白反應可以激活自噬,自噬又可以通過降解錯誤折疊或未折疊蛋白減輕內質網的負荷,抑制內質網應激的過度激活,同時產生的降解產物也為機體細胞新蛋白質的合成、細胞結構的重建以及ATP的生成提供原料。但過度激活的內質網應激-自噬又能夠加重細胞損傷,甚至導致細胞死亡[8]。
本研究將氟化鈉(NaF)作用于體外培養的大鼠原代成釉細胞(ameloblast),探討氟在內質網應激引起成釉細胞自噬與凋亡中的作用及相關機制。
1 材料和方法
1.1實驗動物
4 d齡同批次SD大鼠(西安交通大學醫學部動物實驗中心提供)。
1.2主要試劑和儀器
DMEM高糖培養基(HyClone公司,美國);胎牛血清(fetal bovine serum, FBS)(HyClone公司,美國);Ⅰ型膠原酶(Sigma公司,美國);牛血清白蛋白(bovine serum albumin, BSA)(Sigma公司,美國);胰酶(Sigma公司,美國);兔抗大鼠細胞角化蛋白14(cytokeratin14,CK14)單克隆一抗、兔抗大鼠成釉蛋白(ameloblastin,AMBN)單克隆一抗、免疫組化SABC試劑盒、DAB顯色試劑盒(武漢博士德生物工程有限公司,中國);兔抗大鼠葡萄糖調節蛋白78(glucose-regulated protein78,GRP78)一抗、小鼠抗大鼠C/EBP 同源蛋白(C/EBP homologous protein,CHOP)一抗(cell signaling公司,美國);各型號培養板、培養瓶、離心管(Corning公司,美國),Lab-TekTM腔室載玻片(NUNC公司,美國)等。
1.3原代成釉細胞的培養
4 d齡SD大鼠,脫頸處死,用75%乙醇浸泡10 min。無菌條件下解剖分離雙側上下頜骨內磨牙牙胚,用含1%青-鏈霉素的磷酸鹽緩沖液(PBS)浸洗。將牙胚組織切碎,1 000 r/min離心5 min。棄上清,加入2.5 mg/LⅠ型膠原酶(含1% BSA),37 ℃水浴箱內消化1 h,適度吹打,1 000 r/min離心5 min,棄上清,PBS洗滌,再次離心,棄上清,之后用新鮮配置的胰蛋白酶消化5 min,加入DMEM培養液終止消化。1 000 r/min離心5 min,棄上清,DMEM培養液洗滌后再次離心棄上清,加入含17% FBS的DMEM高糖培養液,將所有細胞懸液轉移至多聚賴氨酸包被的細胞培養瓶中。置飽和濕度、含5% CO2的37℃培養箱中培養。首次72 h換液,以后每48 h換液。待單層細胞生長到覆蓋瓶底的80%時,胰蛋白酶消化,將細胞轉置6孔板及Lab-TekTM腔室載玻片內,繼續培養,每48 h換液1次,待細胞狀態穩定后,進行細胞鑒定及指標檢測。培養期間進行形態學觀察。
1.4成釉細胞的鑒定
將成釉細胞接種于腔室載玻片的腔室內,細胞接種密度為1×104/ml,待細胞生長穩定后,95%乙醇固定細胞10 min,按照二步法抗兔/鼠通用型免疫組織化學檢測試劑盒說明書進行細胞角蛋白CK14和AMBN染色,中性樹脂封片,光學顯微鏡下觀察并拍照。
1.5氟干預成釉細胞及形態觀察
待成釉細胞生長穩定后,分別加入NaF濃度為0.8 mmol/L、1.6 mmol/L的含氟培養液,對照組為不含氟培養液。培養24 h、48 h,倒置顯微鏡下進行細胞形態學觀察。
1.6氟作用下成釉細胞的超微結構觀察
待成釉細胞生長穩定后,分別加入NaF濃度為0.8 mmol/L、1.6 mmol/L的含氟培養液,對照組為不含氟培養液。培養24 h,1 500 r/min離心10 min、固定及常規處理,透射電鏡下進行細胞超微結構觀察。
1.7實時定量PCR(real-time PCR)檢測XBP1s mRNA表達
成釉細胞經1.6 mmol/L NaF分別處理24 h和48 h,收集細胞,按照RNeasy試劑盒的說明書提取細胞總RNA,Nanodrop 2000測量RNA的濃度,利用反轉錄試劑盒將RNA反轉錄為cDNA,按照Starr等[9]條件將反轉錄產物用于real-time PCR檢測剪接型X盒結合蛋白1(X-box binding protein 1 spliced,XBP1s)mRNA的表達。GAPDH為內對照。所用引物如下:GAPDH 正向5′-GGCACAGTCAAGGCTGAGAATG-3′;GAPDH 反向5′-ATGGTGGTGAAGACGCCAGTA-3′;XBP1s 正向5′-TGCTGAGTCCGCAGCAGGTG-3′;XBP1s 反向5′-GCTGGCAGGCTCTGGGGAAG-3′。
1.8蛋白質印跡法(Western blot)檢測蛋白含量
成釉細胞經1.6 mmol/L NaF分別處理24,48 h,收集細胞并提取蛋白,通過BCA試劑盒測定蛋白濃度。蛋白質樣品經SDS-PAGE 電泳分離,轉至硝酸纖維素膜,室溫條件下5% 脫脂奶粉封閉2 h,加入含 5% BSA稀釋液稀釋的GRP78、CHOP和β-actin抗體(1∶1 000),4 ℃過夜,加入稀釋的相應二抗(1∶10 000),室溫孵育1 h。洗膜后用 ECL顯色,化學發光拍照,用軟件進行圖像灰度值分析。
1.9統計學分析
數據分析采用SigmaStat V3.5統計軟件。多組樣本間均數比較采用單因素方差(one-way ANOVA)分析,檢測水準為雙側α=0.05。
2 結果
2.1原代培養成釉細胞形態
當細胞密度較低時,倒置顯微鏡下成釉細胞邊界整齊,呈多角形(圖1A);當細胞數量較多時,成釉細胞間連接緊密,細胞呈鋪路石樣(圖1B)。細胞核明顯,細胞質內有蛋白樣物質。提示培養的細胞具有上皮來源細胞的典型形態特征。
2.2成釉細胞的免疫組織化學鑒定
免疫細胞化學染色顯示,AMBN和CK14表達呈陽性(圖2),且主要分布于細胞質內,提示培養的細胞為上皮來源并具有合成AMBN的功能,符合成釉細胞組織免疫學特征。
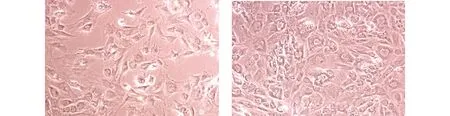
A. 低細胞密度 B.高細胞密度圖1 原代培養大鼠成釉細胞形態 (×10)Figure 1 Morphology of primary rat ameloblast under inverted phase contrast microscope (×10)

A. 陰性對照 B.AMBN染色(+) C.CK14染色圖2 免疫組化顯示AMBN和CK14在大鼠成釉細胞中的表達 (×10)Figure 2 Expression of CK14 and AMBN in rat ameloblast by IHC (×10)
2.3氟干預下成釉細胞形態學觀察
倒置顯微鏡下觀察不同濃度氟作用于成釉細胞不同時間細胞的形態及生長情況。對照組為不含氟培養液培養24,48 h,細胞呈多角形貼壁生長,突觸明顯(見圖3A,3B)。0.8 mmol/L NaF干預細胞24 h(見圖3C)、48 h(見圖3D),與對照組相較未見明顯差異。1.6 mmol/L NaF干預細胞24 h,成釉細胞體積縮小,突觸變短,期間有少量凋亡細胞存在(見圖3E)。48 h時,部分細胞縮小、變圓,凋亡細胞增多(見圖3F)。
2.4氟干預下成釉細胞超微結構觀察
對照組:培養細胞略呈圓形,表面可見少量的微絨毛樣突起;細胞核形狀不規則,核內染色質分布均勻,常染色質豐富,少量異染色質沿核膜分布,核仁常見;細胞質內細胞器豐富,粗面內質網短管狀,部分粗面內質網池樣擴張,線粒體圓形或桿狀,線粒體嵴結構清晰,初級及次級溶酶體豐富,電子密度較高,可見少量自噬樣結構(見圖4A)。
0.8 mmol/L NaF干預組:培養細胞體積較大,形態不規則;細胞核內常染色質豐富,核仁可見;細胞質內粗面內質網池樣擴張,線粒體腫脹,體積增大,電子密度降低,溶酶體豐富,可見自噬樣結構(見圖4B)。
1.6 mmol/L NaF干預組:部分培養細胞腫脹、壞死,細胞膜斷裂,連續性消失,細胞質內可見到自噬樣結構明顯增加,可見凋亡細胞(見圖4C)。

圖3 氟干預下成釉細胞的形態觀察 (×10)Figure 3 Morphology of ameloblast after treated with NaF (×10)

A.對照組 B.0.8 mmol/L NaF組 C.1.6mmol/L NaF組 圖4 氟干預下成釉細胞的超微結構觀察Figure 4 Changes of ultrastructures of ameloblast after treated with NaF
2.5氟引起成釉細胞內質網應激
1.6 mmol/L NaF分別處理成釉細胞24,48 h,qRT-PCR顯示24,48 h組XBP1s mRNA 表達水平顯著高于對照組(見圖5),差異具有統計學意義(P<0.01);Western blot顯示24 h組、48 h組GRP-78 和CHOP蛋白質水平顯著提高(見圖6),且表達隨著處理時間的延長而增加。
3 討論
原代培養大鼠成釉細胞較好地保存了原組織細胞的遺傳特征和生物學特性,是研究氟作用下成釉細胞的各種功能變化及氟斑牙發生相關分子機制的理想模型[10]。近年來發現在氟斑牙的形成過程中,內質網應激(endoplasmic reticulum stress, ERs)發揮著重要的作用[11]。當細胞內質網處于應激狀態,會產生大量的錯誤折疊蛋白,而蛋白質的降解對于維持細胞內環境的穩定是十分重要的,自噬過程通過降解長周期蛋白和損傷的細胞器,來清除細胞內的垃圾[12]。自噬發生時,細胞質內出現大量的雙層膜性結構,包裹即將被降解的蛋白質或細胞器,形成自噬小體。自噬小體形成后即被運送到液泡或溶酶體中被降解,其中的物質被循環利用。這一過程可以協助細胞在各種壓力脅迫狀態下得到緩解。

與對照組比較,**P<0.01圖5 氟對成釉細胞XBP1s mRNA表達影響Figure 5 Effect of fluoride on XBP1s mRNA levels in ameloblast

圖6 氟對成釉細胞GRP-78和CHOP蛋白表達水平的影響Figure 6 Effect of fluoride on GRP-78 and CHOP protein levels in ameloblast
本研究通過不同濃度的NaF作用于原代大鼠成釉細胞,觀察氟對成釉細胞形態及超微結構的影響。透射電鏡結果顯示,0.8 mmol/L NaF組與對照組相較,細胞粗面內質網池樣擴張,線粒體腫脹,體積增大,電子密度降低,溶酶體豐富,可見自噬樣結構。1.6 mmol/L NaF組自噬樣結構明顯增加,表明自噬被活化。通過倒置顯微鏡觀察,1.6 mmol/L NaF作用于成釉細胞48 h時,凋亡細胞數明顯多于同濃度氟作用于細胞24 h時。
近年研究發現,過量的氟作用于成釉細胞,首先引起ERs,進而導致UPR[11]。UPR通過啟動自噬清除錯誤折疊蛋白,維持內質網穩態,保護細胞減輕外界刺激損傷,使細胞存活[13];而當這種應激刺激延長達到一定的時間點時,UPR可能會促進凋亡信號途徑的活化[12]。
Caspase-12是介導ERS凋亡的關鍵分子,活化的caspase-12激活 caspase 家族的caspase-9、caspase-3 等,引起caspase介導的細胞凋亡[14]。UPR啟動后可引起一系列的分子改變,包括內質網伴侶蛋白GRP78/Bip、Calnexin、GRP94等的表達增加,CHOP表達增加,以及XBP1 mRNA的剪切等。GRP78/Bip參與并監控蛋白質折疊;CHOP則可以抑制 Bip和Bcl-2的表達,促進細胞凋亡[14]。Kubota 等[11]發現,過量氟能導致 LS8 細胞內內質網伴侶分子 GADD153、GRP-78、XBP-1 等的表達量升高。這些都為在氟斑牙的形成過程中,氟介導ERs并激活UPR提供了有力依據。本實驗通過對 XBP1s mRNA 和GRP78/Bip和CHOP蛋白水平檢測,結果表明隨著1.6 mmol/L NaF干預成釉細胞時間延長,XBP1s mRNA表達升高,GRP-78/Bip和CHOP蛋白表達量亦隨之升高,進一步驗證了在氟斑牙的形成過程中,過量氟導致了ERs并激活了UPR,并有可能通過激活內質網凋亡途徑引起成釉細胞凋亡。
綜上所述,本研究應用不同濃度的NaF作用于原代培養的成釉細胞,觀察其對細胞的影響。研究結果表明,氟可導致ERs,并進一步激活UPR,啟動自噬,ERs和自噬通過相互調控發揮保護性的作用,維持細胞內環境的穩態,當氟濃度達到一定水平或處理時間延長后,UPR不足以維持ER穩態, 細胞啟動由 ERs 所介導的凋亡信號通路,最終誘導細胞凋亡。
[1]Suzuki M,Bartlett JD.Sirtuin1 and autophagy protect cells from fluoride-induced cell stress[J].Biochim Biophys Acta,2014,1842(2):245-255.
[2]Sun Z,Niu R,Wang B,etal.Fluoride-induced apoptosis and gene expression profiling in mice sperm in vivo[J].Arch Toxicol,2011,85(11):1441-1452.
[3]Ito M,Nakagawa H,Okada T,etal.ER-stress caused by accumulated intracistanal granules activates autophagy through a different signal pathway from unfolded protein response in exocrine pancreas cells of rats exposed to fluoride[J].Arch Toxicol,2009,83(2):151-159.
[4]Brookes SJ,Barron MJ,Boot-Handford R,etal.Endoplasmic reticulum stress in amelogenesis imperfecta and phenotypic rescue using 4-phenylbutyrate[J].Hum Mol Genet,2014,23(9):2468-2480.
[5]Yoshida H.ER stress and diseases[J].FEBS J,2007,274(3):630-658.
[6]Yorimitsu T,Nair U,Yang Z,etal.Endoplasmic reticulum stress triggers autophagy[J].J Biol Chem,2006,281(40):30299-30304.
[7]Yeganeh B,Rezaei Moghadam A,Alizadeh J,etal.Hepatitis B and C virus-induced hepatitis:Apoptosis,autophagy,and unfolded protein response[J].World J Gastroenterol,2015,21(47):13225-13239.
[8]王偉偉.內質網應激—自噬對腦缺血再灌注能量代謝障礙與氧化應激的影響[D].吉林:吉林大學,2014.
[9]Starr TK,Scott PM,Marsh BM,etal.A Sleeping Beauty transposon-mediated screen identifies murine susceptibility genes for adenomatous polyposis coli(Apc)-dependent intestinal tumorigenesis[J].Proc Natl Acad Sci U S A,2011,108(14):5765-5770.
[10]Kukita A,Harada H,Kukita T,etal.Primary and secondary culture of rat ameloblasts in serum-free medium[J].Calcif Tissue Int,1992,51(5):393-398.
[11]Kutoba K,Lee DH,Tsuchiya M,etal.Fluoride induces endoplasmic reticulum stress in ameloblasts responsible for dental enamel formation[J].J Biol Chem,2005,280(24):23194-23202.
[12]劉寧.內質網-自噬途徑在S1誘導人卵巢癌耐藥細胞死亡中的作用及其機制研究[D].吉林:吉林大學,2013.
[13]于洋,徐冶,劉師兵,等.過氧化氫通過內質網應激信號通路對Hela細胞自噬和凋亡的誘導作用[J].吉林大學學報:醫學版,2015,41(3):437-441.
[14]Hassan M,Selimovic D,Hannig M,etal.Endoplasmic reticulum stress-mediated pathways to both apoptosis and autophagy:Significance for melanoma treatment[J].World J Exp Med,2015,5(4):206-217.
Roles of fluoride in autophagy and apoptosis of primary rat ameloblasts induced by endoplasmic reticulum stress
WANG Lin*,WANG Danyang,WANG Feng,XIE Na
(DepartmentofStomatology,Xi’anMedicalUniversity,Xi’an710021,China;*Correspondingauthor,E-mail: 815365619@qq.com)
ObjectiveTo investigate the effects and mechanisms of fluoride on endoplasmic reticulum(ER) stress-induced autophagy and apoptosis of primary rat ameloblastsinvitro.MethodsAmeloblasts were isolated from tooth germ of maxillomandibular molar and culturedinvitro. Ameloblasts were treated with 0.8 mmol/L and 1.6 mmol/L NaF for 24 h and 48 h, respectively. Cell morphology and ultrastructure were observed under phase contrast microscopy and TEM after the cell growth reached to a stable stage. After ameloblasts were treated with 1.6 mmol/L NaF for 24 h and 48 h,XBP1s mRNA levels, expression of GRP78 and CHOP proteins were measured by real-time PCR and Western blot at each time point.ResultsUnder the phase contrast microscope, the cell morphology showed no obvious difference after treated with 0.8 mmol/L NaF between 24 h and 48 h. After treated with 1.6 mmol/L NaF, the number of apoptotic cells statistically higher at 48 h than that at 24 h. The TEM results showed the extension of rough endoplasmic reticulum cistern, swelling of mitochondria, enlarged cell body, decreased electron density, increased lysosome, and appearance of autophagic structure after treated with 0.8 mmol/L NaF for 24 h. Compared with 0.8 mmol/L NaF group, autophagic structures increased in 1.6 mmol/L NaF group. After treated with 1.6 mmol/L NaF, ER stress-related XBP1s mRNA, GRP-78, and CHOP proteins were significantly higher at 48 h than that at 24 h (P<0.01).ConclusionThe results suggest that fluoride could cause ER stress of ameloblast and induce the autophagy, thus lead to apoptosis as the treatment continues.
fluoride;ameloblast;endoplasmic reticulum stress;autophagy;apoptosis
陜西省教育廳專項科研計劃資助項目(2013JK0784);西安醫學院口腔臨床醫學重點建設學科支持項目
王琳,女,1980-04生,碩士,講師,E-mail:815365619@qq.com
2016-01-11
R363
A
1007-6611(2016)03-0242-05
10.13753/j.issn.1007-6611.2016.03.011

