硅膠柱層析純化蓖麻堿
吳瑩,李希,馮建安,王歡,王佳
硅膠柱層析純化蓖麻堿
吳瑩1,李希2,馮建安2,王歡1,王佳1
目的:確定硅膠柱層析純化蓖麻中蓖麻堿的工藝條件。方法:采用薄層層析-硅膠層析,以蓖麻堿回收率與平均含量作為評價指標,考察了洗脫劑、上樣量對硅膠層析效果的影響。結果:硅膠柱層析純化蓖麻堿的最佳操作條件為:最佳洗脫溶劑氯仿-甲醇(12∶1),當上樣量為3.0 g時,經硅膠柱層析的蓖麻堿粗粉的純度可以達到89.3%。結論:該方法穩定可靠,可為蓖麻堿的純化工藝提供參考。
蓖麻堿;硅膠柱層析;純化
蓖麻是大戟科落葉或常綠一年生或多年生植物,具有很廣的用途與很大的經濟效益。蓖麻的主要產品蓖麻籽榨油后剩下的蓖麻餅粕,含豐富的蛋白質及多種氨基酸,營養豐富,但其含有的蓖麻堿毒素對牲畜有較強的毒性,不能直接被利用[1]。同樣,蓖麻堿具有使昆蟲麻痹中毒的藥理作用[2],因此,尋求有效提取純化蓖麻堿的方法將會極大地提高蓖麻資源的綜合利用程度,產生更大的經濟和生態效應。本試驗在蓖麻堿提取工藝的基礎研究上,采用薄層層析-硅膠柱層析對蓖麻堿的分離純化進行研究,為后期的蓖麻堿殺蟲劑的研制提供了依據。
1 材料與方法
1.1材料與試劑
蓖麻(四川新荷花中藥飲片股份有限公司),蓖麻堿標準品(自制),蒸餾水(自制),三氯甲烷、甲醇(均為分析純,成都市科龍化工試劑廠),乙腈、甲醇(色譜純,美國fisher公司)。
1.2儀器
Agilent 1260高效液相色譜儀(美國安捷倫);SENCO(R-201)旋轉蒸發器(上海申順生物科技有限公司);KQ-300DE型超聲波清洗器(昆山市超聲儀器有限公司);BT125D電子天平(北京賽多利斯儀器有限公司)。
2 方法
2.1蓖麻堿的含量測定
2.1.1色譜條件 以十八烷基硅烷鍵合硅膠為填充劑、色譜柱為Eclipse XDB-C18柱(5 μm,4.6×150 nm)、檢測波長308 nm、流動相(乙腈:水=15∶85)、柱溫25 ℃、進樣量10 μL、流速1.0 mL· min-1的色譜條件經高效液相色譜儀進行測定。2.1.2 對照品溶液的制備 精密稱取蓖麻堿標準品5.12 mg,置于10 mL量瓶中,加甲醇溶解并定容至刻度,再量取5 mL置于10 mL量瓶中,加甲醇定容至刻度,作為標準品溶液(質量濃度0.256 mg·mL-1)。
2.1.3供試品溶液的制備 精密稱取蓖麻藥材粗粉約5.0 g,置于圓底燒瓶中,分別以8倍量、6倍量蒸餾水提取,每次提取1 h,過濾,合并濾液,濃縮成稠膏。將所得稠膏與硅藻土(2∶1)混勻,于80℃干燥箱中干燥。然后將粉末裝入索氏提取器中,加入石油醚(60~90℃)脫脂4 h,殘渣揮干溶劑,再用氯仿回流3 h,取氯仿液蒸干。將所得殘渣用甲醇溶解,移入25 mL容量瓶中,用甲醇定容即得。
2.2蓖麻堿純化工藝研究
2.2.1洗脫劑的選擇 (1)薄層層析法選擇洗脫溶劑:取蓖麻堿標準品和供試品溶液(稱取一定量的蓖麻藥材粗粉,按照“2.1.3”項下的制備方法制備),在活化好的薄層板上點樣,然后放入展開槽中展開。分別選擇展開劑為氯仿:甲醇=8:1~20:1進行展開,然后記錄展開后薄層板的特征并計算各個點樣點的Rf值。
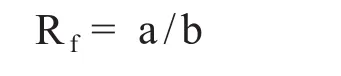
式中:Rf為比移值;a為原點到斑點中心的距離;b為原點到展開劑前沿的距離。
(2)柱層析選擇:使用經薄層層析確定的洗脫溶劑比例范圍進行洗脫,然后用50 mL容量瓶分段收集洗脫液,各個收集瓶中的洗脫液用薄層板進行檢測,尋找蓖麻堿所在的洗脫瓶,確定分離效果最好的洗脫劑比例。
2.2.2上樣量的選擇 準確稱取200~300目50 g硅膠進行裝柱,分別稱取加硅膠拌勻的“2.1.3”項下的樣品粉末5.0、4.0、3.0、2.0、1.0 g,用適量的甲醇溶解,然后上樣洗脫,收集得到的目標成分進行HPLC純度檢測。
2.2.3純化產物純度檢測 準確稱取5.0 mg硅膠柱層析純化后的結晶產物,定溶于100 mL的容量瓶中,進行HPLC檢測。
3 結果與分析
3.1洗脫劑的選擇
(1)用薄層層析法選擇洗脫劑,實驗結果見表1。由表1 可知,不同展開劑比移值差別較大。在選擇洗脫劑時,既要保證溶質適當的溶解性,又要考慮其選擇性。因此,根據蓖麻堿的Rf值和組分斑點之間的相對距離,篩選出氯仿-甲醇(12∶1)與氯仿-甲醇(15∶1)為柱層析的洗脫劑。

表1 不同展開劑的薄層層析結果
(2)用硅膠柱層析檢驗,硅膠預處理后作為固定相,結果見表2。由表2結果可知氯仿-甲醇(12∶1)作為洗脫劑的分離效果較好,蓖麻堿的含量和收率都較高;氯仿-甲醇(15∶1)作為洗脫劑時蓖麻堿的含量和回收率明顯偏低。因此,選定氯仿-甲醇(12∶1)為柱層析洗脫劑。
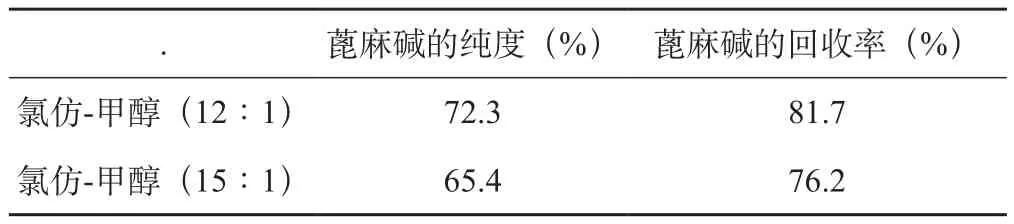
表2 不同洗脫劑的層析效果
3.2上樣量的選擇
使用上述討論確定的洗脫溶劑,即氯仿-甲醇(12∶1)時,不同上樣量的條件下洗脫得到的蓖麻堿樣品經HPLC檢測其含量和回收率見圖1。
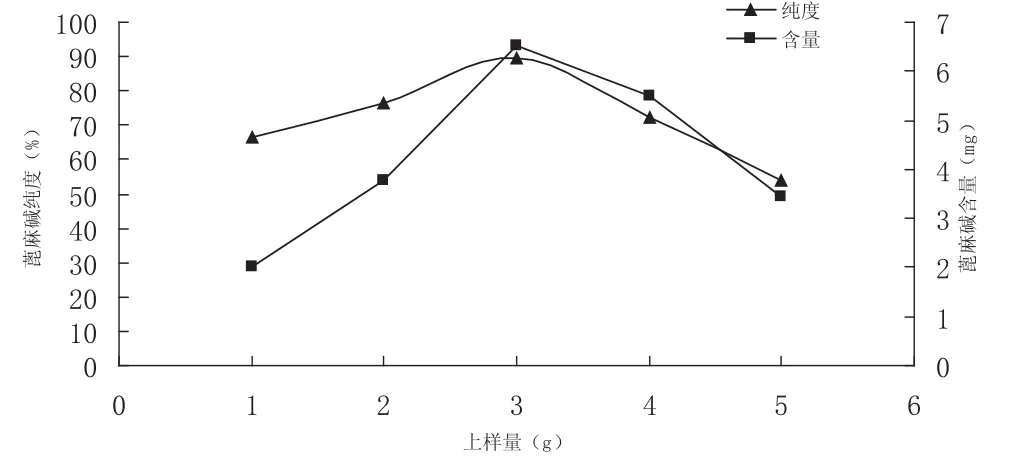
圖1 不同上樣量的層析效果
隨著上樣量的增加,蓖麻堿的含量和回收率逐漸增大。當上樣量為3.0 g時,有較高的含量和回收率,蓖麻堿和其他組分得到很好的分離;隨著上樣量的加大,蓖麻堿的含量和回收率稍有降低;當上樣量過大(過載)時,硅膠柱吸附飽和,蓖麻堿的含量和純度逐漸降低,達不到后續結晶處理的要求。綜合考慮,以一次上樣3.0 g,其純度可以達到89.3%。
4 結論
(1)由于蓖麻堿易溶于熱水與熱的氯仿, 所以本試驗選擇用水加熱回流提取蓖麻堿, 氯仿-甲醇系統洗脫分離純化得到蓖麻堿粗品, 再重結晶得到蓖麻堿純品。整個操作過程簡單、快速、安全。
(2)通過薄層層析和硅膠柱層析對洗脫溶劑的研究發現,在氯仿與甲醇之比為12∶1時,對目標產物即可達到很好的分離。
(3)在不同的上樣量進行的實驗條件下,通過硅膠柱層析得到的蓖麻堿純化產物,然后使用HPLC檢測其純度,發現上樣量為3.0 g時蓖麻堿的純度即可以達到最高。
(4)硅膠是氫鍵型固定相,其表面的終端是硅醇或硅氧烷。硅氧烷不具吸附性,硅醇基能與極性化合物或不飽和化合物形成氫鍵,具有吸附性,因此硅膠對復雜有機化合物地分離具有很高地效率。另外硅膠具有其他較多的優點,如線性容量較高,機械性能好,不溶脹,與大多數試樣不發生化學反應,便宜易得等。因此固定相選用硅膠。
[1] 鄭成,許麗珠,高曉明,等. 蓖麻堿的提取、純化、改性及其殺蟲活性研究[J].天然產物研究與開發,2007,19:785-790.
[2] 向愛民, 向春紅. Pesticide affection of the ricinine. 湖北省孝感師專林特系, 2002.
(責任編輯:傅舒)
Ricinine purification by silica gel column chromatography/
WU Ying1, LI Xi2, FENG Jian-an2, WANG Huan1, WANG Jia1// (1.School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, Sichuan; 2.Sichuan Academy of Traditional Chinese Medicine Sciences, Institute of TCM, Chengdu 610031, Sichuan)
Objective: To optimize the technological conditions of purification of ricinine by silica gel column chromatography. Method: The effects of eluting solvent, samples amount were investigated by thin layer chromatography -silica gel column chromatography with purity and recovery of ricinine as evaluation index. Result: The optimal operating conditions for ricinine purification by silica gel column chromatography was chloroform - methanol (12:1) as elution solvent with sample load 3.0 g. The purity of ricinine powder by the silica gel column chromatography was 89.3%. Conclusion: This method is stable and reliable, and can provide a reference for the purification process of ricinine .
Ricinine; silica gel column chromatography; purification
R 284.2
A
1674-926X(2016)03-008-02
四川省科技支撐計劃(2014F20092)
1.成都中醫藥大學藥學院,四川 成都 611137 2.四川省中醫藥科學院中醫研究所,四川 成都 610031
吳瑩(1989-),女,在讀碩士,主要研究方向:中藥新制劑、新劑型與新技術Tel:18384258516 Email:1127059921@qq.com
李希(1969-),女,碩士研究生導師,研究員,主任中藥師,主要從事中藥新制劑、新劑型與新技術方向研究Tel:028-68890148 Email:1836820767@qq.com
2015-07-22

