拐棗枝多糖提取工藝優化與其抗氧化性研究
張 保,李立天,張 萌,鄭朋朋,敖新宇
拐棗枝多糖提取工藝優化與其抗氧化性研究
張保,李立天,張萌,鄭朋朋,敖新宇*
(西南林業大學 生命科學院,云南 昆明 650224)
為確定拐棗枝多糖的生物活性,對拐棗枝多糖提取工藝進行優化,并評價其體外抗氧化性強弱,從而為拐棗枝多糖的合理開發和應用提供理論依據。以拐棗枝為試驗材料,在單因素試驗基礎上,采用響應面分析法優化拐棗枝多糖提取工藝;通過拐棗枝多糖對羥自由基(·OH)、ABTS自由基(ABTS+·)和DPPH自由基(DPPH·)的清除率的測定從而評價拐棗枝多糖的抗氧化性。結果表明:最佳多糖的最佳提取條件為料液比1∶30(g∶mL)、浸提溫度80℃、浸提時間2.0 h,拐棗枝多糖的提取率為2.44%。抗氧化性結果表明,拐棗枝多糖對·OH、DPPH·和ABTS+·均有較強的清除作用,最大清除率分別達到76.2%、91.3%和96.8%。
拐棗枝;多糖;響應面法;抗氧化性
拐棗(Hovenia acerbaLindl)學名枳椇,為鼠李科枳椇屬(Rhamnaceaehovenia)。在中國,拐棗分布廣泛,已有研究表明,拐棗果梗中含有豐富的維生素、有機酸、氨基酸和糖苷以及人體必需的礦物質等[1-2]。然而目前關于拐棗有效成分的提取主要集中在三萜皂苷類[3]、黃酮類[4]、生物堿類[5]、有機酸類[6],而對提取拐棗多糖的研究卻相對較少。經國內外許多的科研工作者研究發現,多糖在抗腫瘤[7]、抗氧化[8]、抗病毒[9]、免疫調節[10-11]、降血糖[12]等方面具有獨特的藥理活性,因此對拐棗多糖的研究具有重要意義。目前對提取拐棗多糖的研究主要集中在果梗和拐棗子,而對拐棗枝部位的研究較少。于剛等[13]采用不同pH值溶液提取拐棗子多糖,結果顯示pH值為9.00的碳酸氫鈉溶液提取效果最好且多糖提取率達到6.61%。鄭朋朋等[14]發現拐棗枝的乙醇溶液浸提物具有一定的抗氧化性,其效果僅次于拐棗果梗,但未做進一步的研究。本試驗采用水提醇沉法提取拐棗枝多糖(Hovenia acerbasticks polysaccharides,HASP),響應面法優化提取工藝,并通過對·OH、ABTS+·和DPPH·的清除率的測定從而評價拐棗枝多糖的抗氧化性,期望能為拐棗枝多糖的合理開發與利用提供理論依據。
1 材料與方法
1.1材料與試劑
1.1.1材料
拐棗枝:采購于云南省昆明市西南林業大學周邊市場,60℃條件下烘箱烘干后,研磨粉粹后過80目篩,備用。
1.1.2化學試劑
水楊酸、硫酸亞鐵、抗環血酸、過硫酸鉀(均為分析純):國藥集團化學試劑有限公司;氯仿、正丁醇、乙醇、濃硫酸、苯酚、葡萄糖、30%雙氧水(均為分析純):汕滇藥業有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS):美國Sigma公司。
1.2儀器與設備
M20粉碎機:德國KIKAWERKE公司;HWS-12水浴鍋、DHG-9240A型電熱恒溫鼓風干燥箱:上海一恒科學儀器有限公司;5430R離心機:德國Eppendorf公司;TU-1901紫外可見分光光度計:北京普析通用儀器有限責任公司;FD5-8冷凍干燥器:美國GOLD SIM公司;B490真空旋轉蒸發儀:瑞士BUCHI公司;BS224S電子天平:德國SARTORIUS公司。
1.3方法
1.3.1拐棗枝多糖的提取
稱取1.0 g拐棗枝干粉,置于50 mL的離心管中,按照設定的料液比、浸提時間和浸提溫度對拐棗枝干粉進行水浴浸提;浸提完成后于6 000 r/min的條件下離心10 min,取出后轉移上清液并加無水乙醇至乙醇體積分數為80%,4℃靜置沉淀14 h;然后于7 000 r/min的條件下離心5 min,保留沉淀并將多糖沉淀復溶于蒸餾水中,最后轉移至100 mL的容量瓶中定容待測。
1.3.2葡萄糖標準曲線繪制
精確稱取105℃干燥至恒質量的葡萄糖標準品100mg,用蒸餾水溶解后定容至1 L,得到葡萄糖標準溶液。分別精確量取0、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL的葡萄糖標準溶液,補水至1.0 mL,分別配制成0、20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的葡萄糖標準待測液,加1.0 mL 5%苯酚溶液,混合后再加入3.5 mL濃硫酸,迅速混勻,放置流水中冷卻5 min,然后在波長489 nm處測定吸光度值,以葡萄糖質量濃度(x)為橫坐標,吸光度值(y)為縱坐標繪制葡萄糖標準曲線。
1.3.3拐棗枝多糖的測定
量取1.0 mL多糖待測液,加1.0 mL 5%苯酚溶液,混合后加入3.5 mL的濃硫酸,迅速混勻,放置流水中冷卻5 min,在波長489 nm處測定吸光度值,并利用葡萄糖標準曲線方程計算拐棗枝多糖含量,多糖提取率計算式如下:
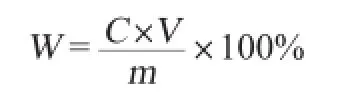
式中:W為多糖提取率,%;C為所得樣品吸光值經葡萄糖標準曲線方程計算后獲得的樣品多糖質量濃度,μg/mL;V為樣品多糖定容后體積,mL;m為拐棗枝樣品質量,g。
1.3.4單因素試驗
以蒸餾水為浸提溶劑,分別按料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)于浸提溫度65℃、70℃、75℃、80℃、85℃、90℃條件下提取0.5h、1.0h、1.5h、2.0h、2.5h、3.0h,每組3次平行試驗,以拐棗枝多糖提取率為評價指標,考察料液比、浸提溫度、浸提時間對拐棗枝多糖提取的影響。
1.3.5響應面優化試驗
在單因素試驗基礎上,采用Box-Behnken模型,以浸提溫度(A)、浸提時間(B)、料液比(C)3個影響因素作為自變量,以拐棗枝多糖提取率(Y)為響應值。并以-1、0、+1分別代表因素水平。響應面因素與水平設計見表1。

表1 響應面試驗因素與水平設計Table 1 Factors and levels of response surface experiments
1.3.6拐棗枝多糖樣品的制備
稱取100 g拐棗枝干粉,按響應面分析法優化的最佳提取工藝條件進行浸提,取出后進行抽濾,濾液經旋轉蒸發儀濃縮至1.0 L,加無水乙醇至乙醇體積分數為80%,靜置沉淀14 h,然后于7 000 r/min的條件下離心5 min,保留沉淀,真空干燥后得到拐棗枝粗多糖G1;將粗多糖G1復溶于水中,采用Sevag法[15]去除蛋白,在脫蛋白的多糖溶液中加入無水乙醇,沉淀真空冷凍干燥(-40℃、48 h)得到拐棗枝精多糖G2,-20℃保存待用。
1.3.7拐棗枝多糖的抗氧化性研究
清除·OH能力測定:按照參考文獻[16]的方法進行,羥自由基清除效率計算式如下:
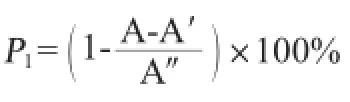
式中:P1為·OH清除率,%;A為不同樣品溶液吸光度值;A′為蒸餾水替代水楊酸的樣品本底吸光度值;A″為蒸餾水替代樣品的對照溶液吸光度值。
清除DPPH·能力測定:按照參考文獻[17]的方法進行,DPPH自由基清除率計算公式如下:
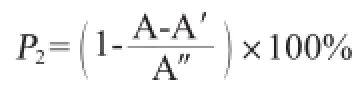
式中:P2為DPPH自由基清除率,%;A為不同樣品溶液吸光度值;A′為蒸餾水替代DPPH自由基液的樣品本底吸光度值;A″為蒸餾水替代樣品的對照溶液吸光度值。
清除ABTS+·能力測定:按照參考文獻[18]的方法進行,ABTS自由基清除率計算公式如下:

式中:P3為ABTS自由基清除率,%;A為不同樣品溶液吸光度值;A′為蒸餾水替代ABTS自由基液的樣品本底吸光度值;A″為蒸餾水替代樣品的對照溶液吸光度值。
2 結果與分析
2.1葡萄糖標準曲線
采用Origin 8.0軟件處理試驗數據,得到葡萄糖標準曲線見圖1。由圖1可知,葡萄糖標準曲線的線性回歸方程:y=0.01032x+0.07486,相關系數R2=0.997,在0~100 μg/mL的葡萄糖質量濃度范圍內,質量濃度與吸光度值呈良好的線性關系。
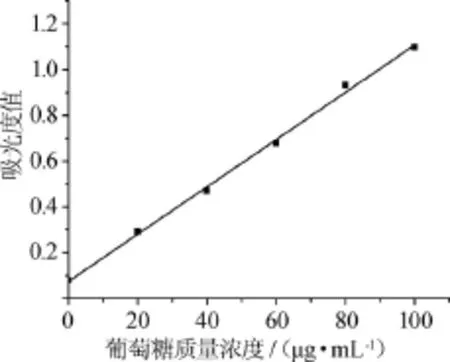
圖1 葡萄糖標準曲線Fig.1 Standard curve of glucose
2.2單因素試驗結果
2.2.1料液比對拐棗枝多糖提取率的影響
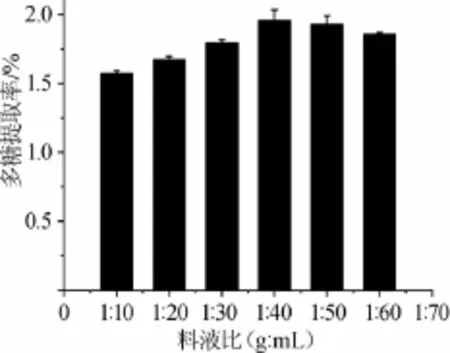
圖2 料液比對多糖提取率的影響Fig.2 Effect of solid-liquid ratio on extraction rate of polysaccharides
由圖2可知,料液比在1∶10~1∶40(g∶mL)時,拐棗枝多糖的提取率隨著料液比的增加而逐漸增大,當液料比達到1∶40(g∶mL)時,拐棗枝多糖的提取率達到最大值1.959%;繼續增加料液比,多糖提取率趨于穩定。結果表明,最佳料液比為1∶40(g∶mL)。
2.2.2浸提時間對拐棗枝多糖提取率的影響
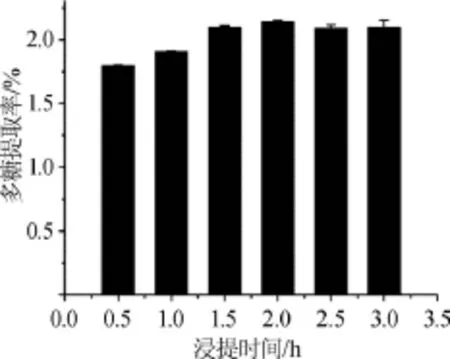
圖3 浸提時間對多糖提取率的影響Fig.3 Effect of extraction time on extraction rate of polysaccharides
由圖3可知,浸提時間在0.5~2.0 h時,拐棗枝多糖的提取率隨著浸提時間的增加而逐漸增大,當浸提時間達到2.0 h時,拐棗枝多糖的提取率達到最大值2.141%;繼續增加浸提時間,多糖提取率不再增加。結果表明,最佳浸提時間為2.0 h。
2.2.3浸提溫度對拐棗枝多糖提取率的影響
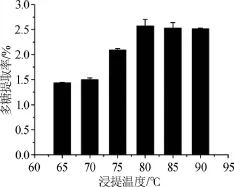
圖4 浸提溫度對多糖提取率的影響Fig.4 Effect of extraction temperature on extraction rate of polysaccharides
由圖4可知,浸提溫度在65~80℃時,拐棗枝多糖的提取率隨著浸提溫度的升高而逐漸增大,當浸提溫度達到80℃時,拐棗枝多糖的提取率達到最大值2.570%;繼續增加浸提溫度,多糖提取率不再增加。結果表明,最佳浸提溫度為80℃。
2.3響應面優化試驗結果
2.3.1回歸模型建立與方差分析
根據單因素試驗結果,采用Design Expert 8.0.5軟件中的Box-Behnken中心組合試驗設計原理,進行3因素3水平的響應面試驗。共15個試驗點,其中析因點12個,零點重復3個,用以估計試驗誤差,結果見表2,方差分析見表3。
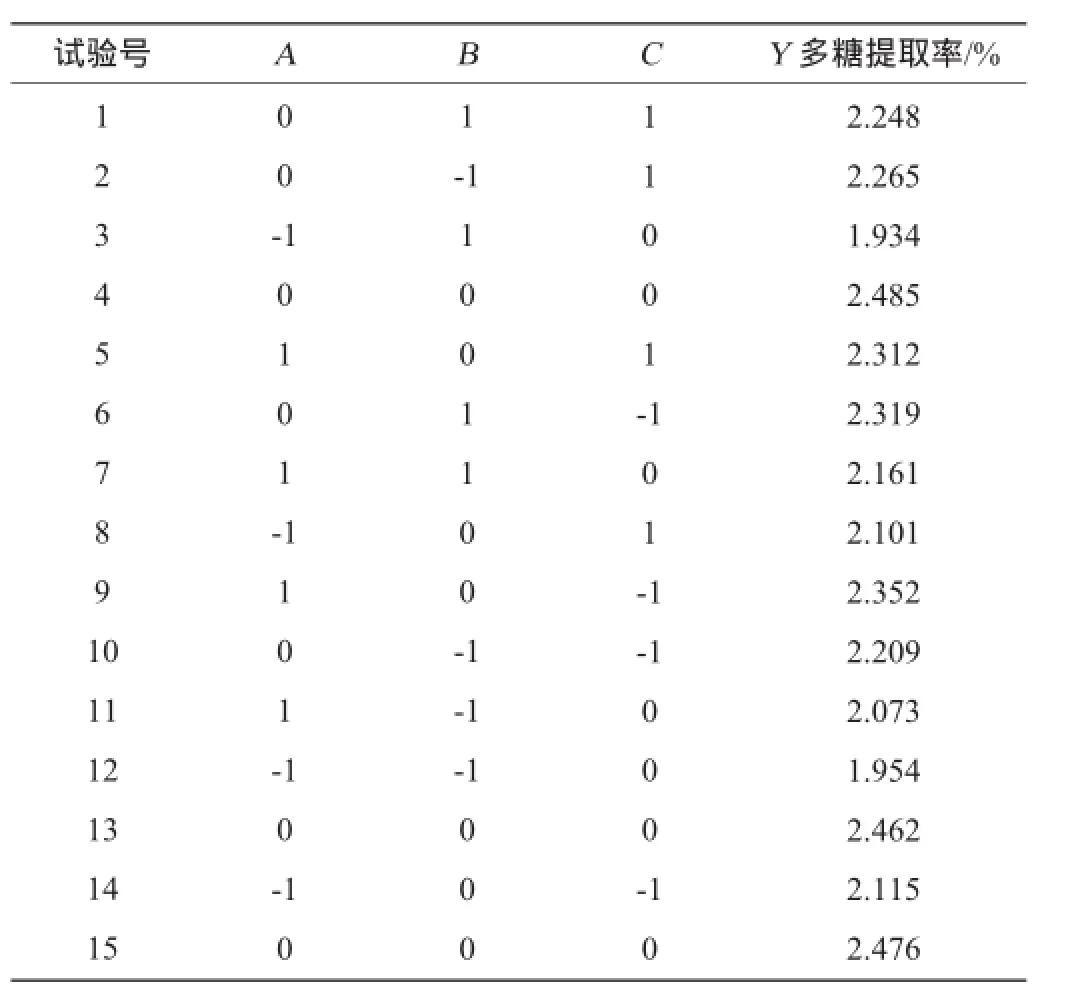
表2Box-Behnken試驗設計結果Table 2 Design and results of Box-Behnken experiments
表3 回歸模型方差分析Table 3 Variance analysis of regression model
根據試驗結果進行回歸擬合,得到二次多項式回歸方程:
Y=2.47+0.099A+0.02B-8.625×10-3C+0.027AB-6.5×10-3AC-0.032BC-0.24A2-0.2B2-0.012C2。
由表3方差分析可知,調整后的決定系數R2=0.988,表明該模型擬合良好,該回歸模型達到極顯著水平(P<0.01)。模型中的A、A2、B2對響應值影響極顯著(P<0.01),B、AB、BC對響應值影響顯著(P<0.05),這表明試驗因素對響應值不是簡單的線性關系。失擬項P=0.211 1>0.05,差異不顯著,表明建立的二次多項式回歸模型可以運用于拐棗枝多糖提取優化的理論預測。
2.3.2響應面圖分析
各個影響因子交互作用的響應面和等高線分析圖見圖5。由圖5可知,在所選的各影響因素的取值范圍內存在極大值,即拐棗枝多糖提取率最大。浸提溫度對拐棗枝多糖提取率的影響極顯著,表現為曲線較陡;浸提時間對拐棗枝多糖提取率的影響顯著,表現為曲線較緩;料液比對拐棗枝多糖提取率的影響不顯著,表現為曲線平緩。

圖5 浸提溫度、浸提時間和料液比對多糖提取率影響的響應面及等高線Fig.5 Response surface plots and contour line of effects of interactions between extraction temperature,time and solid-liquid ratio on extraction rate of polysaccharides
2.3.3最佳提取工藝條件
由Design Expert 8.0.5軟件分析得出:當浸提溫度(A)為80.87℃、浸提時間(B)為2.06 h、料液比(C)為1∶31.34(g∶mL)時,理論最佳拐棗枝多糖提取率為2.487%。考慮在實際操作上的方便性,將各因素修正為浸提溫度80℃、浸提時間2.0h、料液比1∶30(g∶mL)。然后在修正的各因素條件下進行驗證試驗。通過3次平行試驗得到的實際平均提取率分別為2.327%、2.486%、2.492%,平均提取率為2.435%,與理論值2.487%接近。因此,響應面法對拐棗枝多糖浸提條件的優化是可行的且具有實際應用價值。
2.4粗多糖的紫外光譜掃描結果
采用紫外可見分光光度計,對提取的拐棗枝粗多糖G1、拐棗枝精多糖G2,在800~200 nm波長范圍內進行紫外光譜掃描,結果見圖6。由圖6可知,粗多糖G1在波長260~280 nm范圍內出現紫外吸收峰,此范圍內的吸收峰為蛋白質吸收峰,表明粗多糖G1是含蛋白質的多糖;而經過Sevag試劑除蛋白后的精多糖G2在波長260~280 nm范圍內未出現紫外吸收峰,表明精多糖G1已經去除蛋白質,由此可見Sevag法可以有效除去拐棗枝多糖中蛋白質。
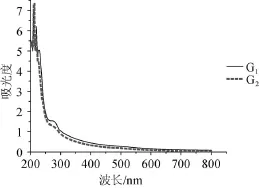
圖6 拐棗枝多糖紫外吸收光譜掃描結果Fig.6 UV spectra scan results of polysaccharides
2.5拐棗枝多糖抗氧化性分析
2.5.1清除·OH能力測定結果
羥基自由基能夠輕易地穿過細胞膜并與大多數生物分子(如糖類、脂類、蛋白質和DNA等)發生反應,最終導致細胞死亡,甚至組織損傷[19-20]。由圖7可知,在試驗質量濃度范圍內,隨著多糖質量濃度的增加,拐棗枝多糖對·OH清除率呈逐漸上升趨勢,多糖在1~4 mg/mL時,隨著質量濃度的增加,·OH清除率不斷增大,4~5 mg/mL時多糖對·OH清除作用趨于穩定,最大的清除率達到76.2%。VC在質量濃度0.2~1.0 mg/mL時,隨著質量濃度的增加,其對·OH清除率增加迅速,超過1.0 mg/mL后,·OH清除率基本沒有變化,維持在99.1%。結果表明,拐棗枝多糖對·OH有一定的清除能力,但比VC弱。
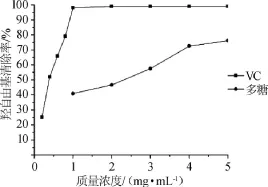
圖7 拐棗枝多糖對羥自由基的清除作用Fig.7 Scavenging activity of polysaccharides on hydroxyl radicals
2.5.2清除DPPH·能力測定結果
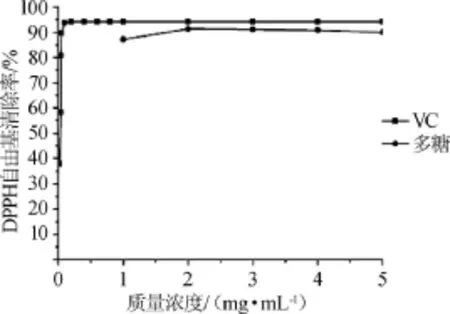
圖8 拐棗枝多糖對DPPH自由基的清除作用Fig.8 Scavenging activity of polysaccharides on DPPH radicals
由于DPPH自由基操作的簡單性和結果的可重現性,DPPH自由基被廣泛應用于各種天然化合物的抗氧化性能力的測定[21]。由圖8可知,在試驗質量濃度范圍內,隨著多糖質量濃度的增加,拐棗枝多糖對DPPH·清除率呈逐漸上升趨勢,多糖在1~2mg/mL時,隨著質量濃度的增加,DPPH·清除率不斷增大,2~5mg/mL時多糖對DPPH·清除作用趨于穩定,最大的清除率達到91.3%。VC在質量濃度0.02~ 0.10 mg/mL時,隨著質量濃度的增加,其對DPPH·清除率增加迅速,超過0.1mg/mL后,DPPH·清除率基本沒有變化,維持在94.2%。結果表明,拐棗枝多糖對DPPH·有較好的清除能力,但比VC稍弱。
2.5.3清除ABTS自由基能力測定結果
通過吸光度值的變化來檢測ABTS自由基的清除率,已經成為廣泛用于檢測化學成分的抗氧化活性的使用方法[22-23]。由圖9可知,在試驗質量濃度范圍內,隨著質量濃度的增加,拐棗枝多糖對ABTS+·清除率維持在95%左右,最大的清除率達到96.8%。VC在質量濃度0.01~0.05 mg/mL時,隨著多糖質量濃度的增加,其對ABTS自由基清除率增加迅速,多糖質量濃度超過0.05 mg/mL后,ABTS自由基清除率基本沒有變化,維持在98.2%。結果表明,拐棗枝多糖有較好對ABTS自由基清除能力,但比VC略弱。
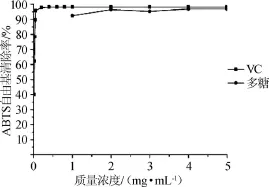
圖9 拐棗枝多糖對ABTS自由基的清除作用Fig.9 Scavenging activity of polysaccharides on ABTS radicals
3 結論
本研究在單因素試驗的基礎上,采用響應面分析法對拐棗枝多糖的提取工藝進行優化。結果表明,最佳提取工藝為:料液比1∶30(g∶mL),浸提時間2.0 h,浸提溫度80℃,多糖提取率為2.435%,與理論值2.487%接近。因此,響應面法對拐棗枝多糖的浸提條件的優化是可行的且具有實際應用價值。抗氧化性試驗研究結果表明,拐棗枝多糖對·OH、DPPH·和ABTS+·具有一定的清除作用,且隨著拐棗枝多糖的質量濃度增加而作用增強,最大清除率達分別到76.2%、91.3%和96.8%。試驗結果表明,拐棗枝多糖具有較強的抗氧化能力,可作為天然的抗氧化劑資源進行開發和利用。
[1]王艷林.拐棗的食用價值研究I:營養成分分析[J].天然產物研究與開發,1994,6(1):89-92.
[2]向進樂,李志西,甘峰,等.枳椇果梗不同類型酚酸含量及抗氧化活性[J].食品與發酵工業,2011,37(8):106-111.
[3]YOSHIKAWA K,NAGAI Y,YOSHIDA M,et al.Antisweet naturalproductsVIII.StructuresofhodulosidesVI-XfromHoveniadulcisThunb. Var.tomentellaMakino[J].Chem Pharm Bull,1993,41(10):1722-1725.
[4]ASE K,OHSUGI M,XIONG Q,et al.Hepatoprotective effect ofHovenia dulcisThunb.on experimental liver injuries induced by carbon tetrachloride or D-galactosamine/lipopolysaccharide[J].Biol Pharm Bull,1997,20(4):381-385.
[5]TAKAI M,OGIHARA Y,SHIBATA S.New peptide alkaloids from Hovenia dulcisandH.tomentella[J].Phytochemistry,1973,12(12):2985-2986.
[6]賈春曉,熊衛東,毛多斌,等.拐棗果梗中有機酸成分的GC-MS分析[J].中國食品學報,2005,5(1):72-74.
[7]SUN L,WANG L,ZHOU Y.Immunomodulation and antitumor activities of different-molecular-weight polysaccharides fromPorphyridium cruentum[J].Carbohyd Polym,2012,87(2):1206-1210.
[8]FAN L,LI J,DENG K,et al.Effects of drying methods on the antioxidant activities of polysaccharides extracted fromGanoderma lucidum[J]. Carbohyd Polym,2012,87(2):1849-1854.
[9]SAHA S,NAVID M H,BANDYOPADHYAY S S,et al.Sulfated polysaccharidesfromLaminariaangustata:Structuralfeaturesandin vitro antiviral activities[J].Carbohyd Polym,2012,87(1):123-130.
[10]YI Y,ZHANG M W,LIAO S T,et al.Structural features and immunomodulatory activities of polysaccharides ofLongan pulp[J].Carbohyd Polym,2012,87(1):636-643.
[11]LI J J,JI L,SUN L,et al.Analysis of Herba Asari polysaccharides and their immunological activity[J].Carbohyd Polym,2012,87(1):551-556.
[12]趙博,王一峰,侯宏紅.中國楤木粗多糖對糖尿病大鼠的降血糖作用[J].食品科學,2015,36(13):211-214.
[13]于剛,王立軍,曹曉鋼.枳椇子活性多糖的提取工藝及解酒功能研究[J].廣西輕工業,2007,23(10):3-4.
[14]鄭朋朋,李珊,楊正濤,等.拐棗不同提取物的體外抗氧化作用[J].中國釀造,2015,34(9):121-124.
[15]SUN Z,ZHANG L,ZHANG B,et al.Structural characterisation and antioxidant properties of polysaccharides from the fruiting bodies ofRussula virescens[J].Food Chem,2010,118(3):675-680.
[16]SHI M,ZHANG Z,YANG Y.Antioxidant and immunoregulatory activity ofGanoderma lucidumpolysaccharide(GLP)[J].Carbohyd Polym,2013,95(1):200-206.
[17]WANG J,ZHANG J,ZHAO B,et al.A comparison study on microwave-assisted extraction ofPotentilla anserinaL.polysaccharides with conventional method:Molecule weight and antioxidant activities evaluation[J].Carbohyd Polym,2010,80(1):84-93.
[18]CHENG H,FENG S,JIA X,et al.Structural characterization and antioxidant activities of polysaccharides extracted fromEpimedium acuminatum[J].Carbohyd Polym,2013,92(1):63-68.
[19]YUAN J F,ZHANG Z Q,FAN Z C,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides fromLigusticum chuanxiong Hort[J].Carbohyd Polym,2008,74(4):822-827.
[20]CHENG H,FENG S,SHEN S,et al.Extraction,antioxidant and antimicrobial activities ofEpimedium acuminatumFranch.polysaccharide[J]. Carbohyd Polym,2013,96(1):101-108.
[21]LEONG L P,SHUI G.An investigation of antioxidant capacity of fruits in Singapore markets[J].Food Chem,2002,76(1):69-75.
[22]MILLER N J,RICE-EVANS C,DAVIES M J,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clinical Sci,1993,84(4):407-412.
[23]LI X,HAN W,MAI W,et al.Antioxidant activity and mechanism of tetrahydroamentoflavonein vitro[J].Nat Prod Comm,2013,8(6):787-789.
Optimization of extraction technology ofHovenia acerbasticks polysaccharides and its antioxidant activity
ZHANG Bao,LI Litian,ZHANG Meng,ZHENG Pengpeng,AO Xinyu*
(College of Life Science,Southwest Forestry University,Kunming 650224,China)
To determine the biological activity ofHovenia acerbasticks polysaccharide(HASP),the extraction process condition of HASP was optimized and thein vitroantioxidant activity of HASP was evaluated.On the basis of single factor test,response surface analysis was used to optimize the extraction process of polysaccharides fromH.acerbasticks.The scavenging efficiency of HASP on hydroxyl radical,ABTS radical and DPPH radical were determined,to study the antioxidant activity.The results showed that the optimal extraction conditions were solid-liquid ratio 1∶30(g∶ml),extraction temperature 80℃and time 2.0 h,and the extraction rate of HASP was up to 2.44%.Thein vitroantioxidant activity tests revealed that HASP exhibited high hydroxyl radical,DPPH radical,and ABTS radical scavenging activities,and maximum scavenging rate were 76.2%,91.3% and 96.8%,respectively.
Hovenia acerbasticks;polysaccharide;response surface method;antioxidant activity
R284.2
0254-5071(2016)07-0155-06
10.11882/j.issn.0254-5071.2016.07.034
2016-03-10
云南省優勢特色重點學科生物學一級學科建設項目(50097505);西南林業大學科技創新基金(15125)
張保(1992-),男,碩士研究生,研究方向為生物化學與分子生物學。
敖新宇(1978-),男,副教授,碩士,研究方向為生物化學與分子生物學。

