SCN9A基因rs10930210位點多態性與癲癇發生的相關性
左松林, 李欣宇, 伍明剛, 張 昭, 王景濤, 朱金玲
?
SCN9A基因rs10930210位點多態性與癲癇發生的相關性
左松林1,李欣宇1,伍明剛1,張昭1,王景濤2,朱金玲3
目的探討SCN9A基因多態性與癲癇發生的相關性。 方法搜集134例癲癇患者及正常對照組73例血樣,提取全基因組DNA。聚合酶鏈反應-限制性片段長度多態(PCR-RFLP)、測序法檢測rs10930210位點多態性,比較該位點基因型和等位基因頻率的差異。結果SCN9A基因rs10930210位點多態性在癲癇組與對照組間無顯著差異(P>0.05)。結論SCN9A基因rs10930210位點多態性與癲癇易感性無關。
癲癇;SCN9A;單核苷酸多態性;遺傳易感性
癲癇是一種以身體痙攣為特征的慢性神經系統疾病,由于神經皮質細胞的異常放電而導致的陣發性行為。近年來對癲癇家系進行的一系列相關研究已經證實,癲癇具有家族遺傳性。另外,大量與癲癇相關的統計學研究表明,60%的癲癇患者在兒童期發病。目前,眾多研究表明癲癇與電壓門控鈉離子通道(voltage -gated sodium channels,VGSCs)的功能改變有密切聯系[1]。哺乳類動物腦細胞的VGSCs由一個α亞單位與一個或更多的輔助β亞單位組成的復合體所構成。負責編碼人的電壓門控性鈉離子通道α亞單位的基因是SCN1A-SCN11A。現有的研究已表明,基因突變很容易導致離子通道結構的改變,導致通道功能異常,從而使動作電位的產生和傳導發生紊亂、大腦神經元異常放電而導致癲癇的發生。
近年來,鈉離子通道編碼基因某些位點的單核苷酸基因多態性(single nucleotide polymorphism,SNP),是否與癲癇的發病及臨床療效相關,引起人們的關注,為此我們選擇SCN9A基因的TapSNPs研究其與癲癇發生的相關性,為癲癇的診斷、治療與預防提供理論基礎。
1 研究對象
研究對象為癲癇患者134例,正常對照組73例。患者均由佳木斯市中心醫院鑒定。收集對照組和患者晨起靜脈血3.0 ml。正常對照組的年齡和居住區域和患者組相匹配。
2 研究方法
2.1SNP位點的選擇NCBI Gene數據庫檢索SCN9A基因,得到該基因的染色體位置為Chromosome 2,NC_000002.12 (166195185..166375987, complement)。進入HapMap網站,選擇中文模式,HapMap 數據下選擇通用基因組瀏覽器,標志或區域填寫Chr2:166,195,185..166,375,987,數據來源,保存、查詢及其它選擇SNP genotype data,配置CHB,下載并保存dumped_region.hmp。運行Haploview,自動選擇TagSNPs。根據有無合適酶切位點,選擇本課題TagSNPs。最終選取SCN9A的TagSNP為rs10930210。
2.2SNP位點的引物設計在dbSNP數據庫中查得rs10930210SNP位點的序列,用Primer5.0軟件設計引物,對其用Oligo6.0軟件進行檢驗,正向引物序列為F:ACAGGGATGATACAGGCACAC;反向引物序列為R:GCCAATCATTCCTCAACCAGC。擴增片段長度為469 bp,引物由上海生工合成。
2.3基因組DNA提取用基因組DNA提取試劑盒提取DNA (BioTeKe全血基因組提取試劑盒),DNA置于-20℃冰箱保存備用。
2.4PCR擴增PCR反應體系為15 μl,包括2×Power Taq PCR Master Mix 8 μl,正反向引物各1 μl,模板DNA 1 μl,加ddH2O至15 μl。PCR反應條件:94 ℃預變性5 min,然后進行30個循環(94 ℃變性30 s、60 ℃退火30 s、72 ℃延伸30 s),72 ℃終末延伸5 min。瓊脂糖凝膠電泳檢測PCR產物大小及特異性。
2.5限制性酶切酶切PCR產物。Rs10930210位點的內切酶為SspI。酶切反應體系為:PCR產物5 μl,10×buffer 1 μl,SspI酶為0.5 μl,最后加8.5 μl的ddH20,總體積為15 μl。酶切反應體系配好振蕩混勻后,放置于37 ℃水浴箱中酶切5 min。65 ℃,8 min,終止酶切。
2.6瓊脂糖凝膠電泳及分型15 μl酶切產物電泳分型:2%瓊脂糖,電壓150 V,電泳30 min,紫外線凝膠成像分析系統拍照并進行基因分型。
2.7DNA測序選取該位點3種不同基因型個體的PCR產物,送上海生工生物工程股份有限公司完成測序。
2.8統計學分析分別計算基因型頻率和基因頻率并進行卡方檢驗,P>0.05驗證該群體為平衡群體。運用Microsoft Excel 2013統計癲癇組與對照組基因型頻率和基因頻率,實驗組與對照組的比較采用兩獨立樣本t檢驗,以P<0.05為具有統計學意義。
3 結 果
3.1Hardy-Weinberg遺傳平衡檢驗(見表1)。
3.2SNP位點測序圖及凝膠電泳圖。
3.2.1rs10930210位點基因分型相應測序結果(見圖1)。
3.2.2rs10930210位點基因分型相應凝膠電泳圖(見圖2)。
3.3癲癇組與對照組的SNP位點基因型及等位基因頻率分布情況(見表2)。癲癇組與對照組的rs10930210位點的基因型和等位基因頻率分布不存在顯著差異。SCN9A基因位點rs10930210在癲癇病例組和對照組間基因型頻率采用兩獨立樣本t檢驗,結果P>0.05,兩者之間不存在統計學意義;病例組和對照組之間的等位基因頻率采用兩獨立樣本t檢驗,結果P>0.05,兩者之間無統計學差異。
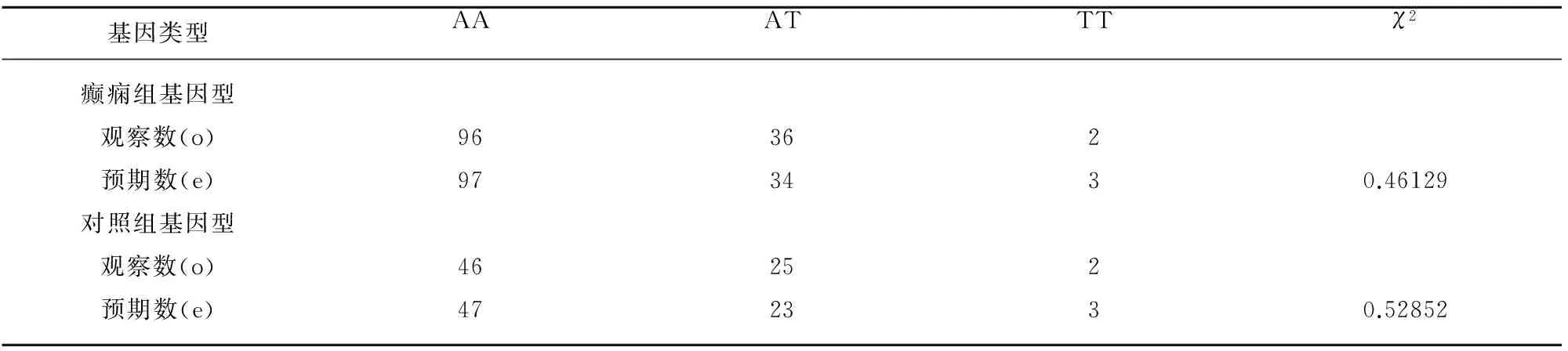
表1 病例組與對照組等位基因的Hardy-Weinberg遺傳平衡檢驗
注:自由度λ=2,癲癇組和對照組的觀察數與預期數之間比較P>0.05
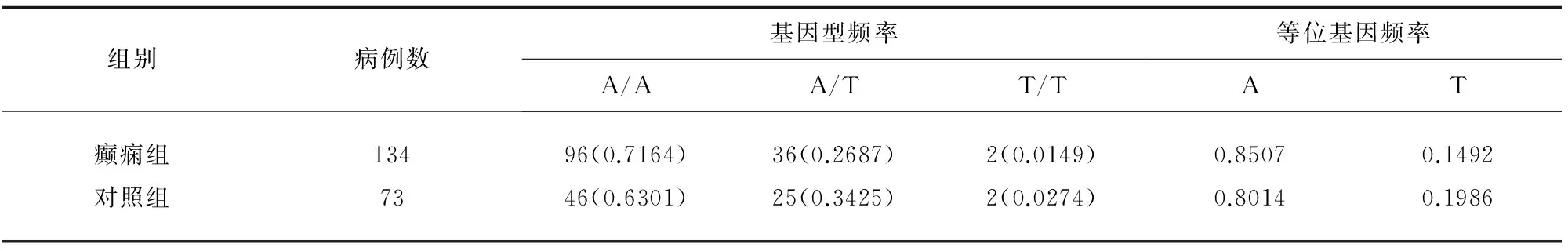
表2 癲癇組與對照組的rs10930210位點的基因型及等位基因頻率分布比較
注:癲癇組的基因型頻率與基因頻率與對照組之間比較P>0.05,無統計學差異
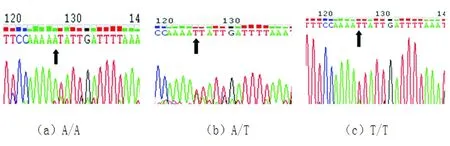
圖1a為野生型純合子AA;b為突變雜合子AT;c為突變純合子TT
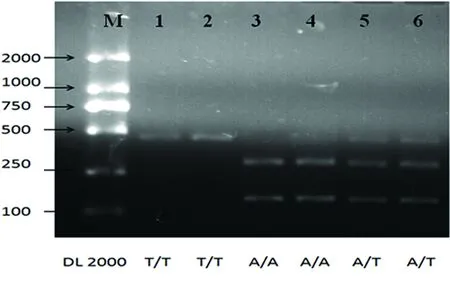
圖2M為DNA Marker,1為原樣本(不做酶切的PCR產物);2為突變純合子TT(酶切產物);3、4為野生型純合子AA(酶切產物);5、6為突變雜合子AT(酶切產物)
4 討 論
癲癇是一類常見的中樞神經系統疾患,是由于大腦神經元異常同步放電引起的大腦功能障礙,其具有發作性、突然性、短暫性以及重復性等特征[2]。癲癇發生的病理生理學基礎是大腦神經元細胞膜電生理興奮性增高,易于形成癲癇性放電。遺傳因素在癲癇發生機制中起到了很重要的作用。據唐章龍[2]等學者的資料顯示,他們按照 Falconer 方法,對89個癲癇高發家系的進行臨床遺傳學分析、計算后發現,特發性癲癇一級親屬的遺傳度為66.98%,介于60%~70%,證明了遺傳因素在癲癇的發病中具有明顯的作用。這一結論和其他大量癲癇相關的統計學、群體遺傳學研究結論相符,均表明遺傳因素在癲癇發病機制中不可忽視的作用。據統計,40%的癲癇為遺傳因素引起的癲癇。
近年來,電壓門控通道的基因突變與癲癇發生的關系引起了研究學者們的關注,包括電壓門控鉀、鈣、氯、鈉離子通道和γ-氨基丁酸受體(GABA)和乙酰膽堿受體[3,4]。電壓門控鈉離子通道(VGSCs)主要負責控制細胞興奮性,其結構和功能異常可引起細胞膜興奮性改變,在癲癇發病機制中具有重要作用。電壓門控鈉離子通道由α和β亞基構成,α亞基由同一家族的基因負責編碼,包括SCN1A~SCN11A,分別編碼不同的亞型:Nav1.1~Nav1.9。其中,SCN9A基因負責編碼Nav1.7[5]。SCN9A基因在機體中對鈉離子進入細胞以及神經元之間的交流起導向作用。當SCN9A基因發生突變后,將導致大腦中鈉離子通道功能發生改變,并阻礙神經元之間的聯系。
Nav編碼基因中某些單核苷酸基因多態性不同的等位基因及基因型與癲癇易感性具有相關性[5]。SCN9A基因是第五個被發現能引起熱性驚厥的基因[6,7]。研究發現,SCN9A基因不僅分布在外周神經,在中樞神經也有表達,且隨著年齡增長,在海馬的表達持續增加。2009年,Singh等學者在對定位于2q24 的全面性癲癇伴熱性驚厥附加癥(GEFS+)家系進行突變分析中,發現了兩個SCN9A的突變:I62V 和 P149Q。在對嬰兒嚴重肌陣攣性癲癇(SMEI) 家系進行SCN9A 突變分析時發現,數個患者同時攜帶SCN9A和SCN1A的突變[8,9]。但迄今為止,SCN9A導致癲癇的機制尚未見相關報道。因此我們選擇SCN9A的rs10930210作為篩查位點,以探討SCN9A基因的SNPs與癲癇發生的內在聯系。結果顯示,癲癇組與對照組間rs10930210的等位基因分布差異不顯著(P>0.05)。結果提示我們,從統計學意義角度考慮,SCN9A基因rs10930210不適合作為癲癇易感性的潛在遺傳標記物。
實驗結果顯示,rs10930210位點多態與癲癇發生無相關性。原因可能是:(1)不同地區、不同民族、不同人群、不同年齡的SNPS發生率存在差異;(2)本研究的研究個數偏少;(3)SCN9A的SNP位點眾多。我們將進一步擴大實驗樣本個數,對SCN9A的多個SNP位點與癲癇發生的相關性進行連鎖分析,探討SCN9A基因多態性與癲癇發生的相關性,為臨床上提示癲癇易感性、提早預防以及病情的控制和治療提供理論依據。
[1]張麗敏,康熙雄,丁成赟.鈉離子通道基因多態性在癲癇中的研究進展[J].中華臨床醫師雜志(電子版),2012,6(22):7324-7326.
[2]唐章龍.89個癲癇高發家系的臨床遺傳學分析[J].中華臨床醫師雜志(電子版),2010,8:1208-1211.
[3]周陽.癲癇的遺傳學研究進展[J].安徽醫科大學學報,2005,50(3):406-410.
[4]宋延民.電壓門控鈉離子通道與癲癇[J].中華中華臨床醫師雜志,2011,5(11):3262-3264.
[5]吳江紅,任栓成,楊秀明,等.電壓門控鈉離子通道與癲癇[J].國際病理科學與臨床雜志,2013,33(3):240-245.
[6]Yang Y,Wang Y,Li S,et al.Mutations in SCN9A,encoding a sodium channel alpha subunit,in patientswith primary erythermalgia[J].J Med Genet,2004,41(3):171-174.
[7]Miriam H,Meisler M,Janelle E,et al.Sodium channel gene family:epilepsy mutations,gene interactions and modifier effects[J].Physiol,2010,588(11):1841-1848.
[8]Mechaly I,Scamps F,Chabbert C,et al.Molecular diversity of voltagegated sodium channel alpha subunits expressed in neuronal and nonneuronal excitable cells[J].Neuroscience,2005,130(2):389-396.
[9]Singh NA,Pappas C,Dahle EJ,et al.A role of SCN9A in human epilepsies,as a cause of febrile seizures and as a potential modifier of Dravet syndrome[J].PLoS Genet,2009,5:e1000649.
Explore the relationship between SCN9A gene polymorphism and epilepsy
ZOUSonglin,LIXinyu,WUMinggang,etal.
(BasicMedicineDepartmentofJiamusiUniversity,Jiamusi154007,China)
ObjectiveExplore the relationship between SCN9A gene polymorphism and epilepsy.MethodsCollected peripheral blood on 73 cases of normal control and 134 cases of epilepsy patients,and extracted genomic DNA by kits.Polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP),sequencing detected rs10930210 polymorphism,comparing the genotypes and allele frequency differences.ResultsSCN9A gene rs10930210 polymorphism loci no significant differences between the epilepsy group and control group (P>0.05).Conclusionrs10930210 polymorphism of SCN9A gene were not associated with epilepsy.
Epilepsy;SCN9A;Single nucleotide polymorphisms
1003-2754(2016)08-0708-03
2016-04-12;
2016-08-02
2015年黑龍江省大學生創新創業訓練計劃指導項目資助(No.201510222043);佳木斯大學創新團隊項目資助(No.CXTDPY-201602)
(1.佳木斯大學臨床醫學院,黑龍江 佳木斯 154007;2.佳木斯大學科技處,黑龍江 佳木斯 154007;3.佳木斯大學基礎醫學院,黑龍江 佳木斯 154007)
朱金玲,E-mail:370786436@qq.com
R742.1
A

