西藏嵩草ISSR-PCR反應體系優化研究
胡延萍, 包 蕊, 王 莉, 石 琳,2, 李 毅*
( 1. 中國科學院西北高原生物研究所, 西寧 810008; 2. 中國科學院大學, 北京 100049 )
?
西藏嵩草ISSR-PCR反應體系優化研究
胡延萍1, 包蕊1, 王莉1, 石琳1,2, 李毅1*
( 1. 中國科學院西北高原生物研究所, 西寧 810008; 2. 中國科學院大學, 北京 100049 )
西藏嵩草(Kobresiatibetica)為莎草科嵩草屬多年生草本,根狀莖短,稈密集叢生。生于海拔2 550~4 950 m的河灘地、濕潤草地、高山灌叢草甸,分布于甘肅、青海、四川西部、西藏東部,其根系發達,喜濕,耐寒,生活力強。西藏嵩草繁殖以營養繁殖為主、有性繁殖為輔,其莖葉茂盛,有較高的營養價值,產草量高,是青藏高原夏、秋兩季的主要放牧飼草。該研究以青藏高原高寒沼澤化草甸的建群種和優勢種——西藏嵩草為材料,對影響其ISSR-PCR反應的因素(Mg2+、TaqDNA聚合酶、dNTP、引物和模板DNA)進行5因素4水平的正交試驗,以確定西藏嵩草ISSR分析的最佳反應體系,并篩選適宜的ISSR引物及各引物的最佳退火溫度。結果表明:建立了適宜于西藏嵩草ISSR-PCR反應的最佳體系為20 μL反應液中包括10 × PCR buffer 2 μL、1.5 mmol·L-1Mg2+、1.0 UTaqDNA聚合酶、0.100 mmol·L-1dNTP、0.3 μmol·L-1引物和30~40 ng DNA模板;同時從100條ISSR引物中篩選出了擴增結果清晰、穩定的12條引物,各引物的最佳退火溫度為48.0~53.2 ℃(引物不同,其最佳退火溫度也不同);西藏嵩草ISSR-PCR適宜的擴增程序為首先預變性94 ℃ 5 min,然后變性94 ℃ 20 s、復性48.0~53.2 ℃ 1 min、延伸72 ℃ 80 s、38個循環,最后72 ℃延伸6 min。體系穩定性驗證結果表明,該體系在西藏嵩草其他樣品中所得條帶清晰且多態性豐富,為后續西藏嵩草的遺傳多樣性分析和優良牧草種質資源篩選研究奠定了基礎。該研究結果對以西藏嵩草為優勢種的高寒沼澤化草甸研究及濕地生態系統的修復和保護具有重要意義。
西藏嵩草, 莎草科, ISSR-PCR, 反應體系, 正交設計
西藏嵩草(Kobresiatibetica),為莎草科(Cyperaceae)嵩草屬(KobresiaWilld.)多年生草本。根狀莖短。稈密集叢生,較粗壯,高5~15 cm,直徑1~2 mm,有鈍棱或圓柱形,具條紋,基部具淺褐色至深褐色枯死葉鞘。葉短于稈,絲狀,寬約1 mm,邊緣席卷。生于海拔2 550~4 950 m的河灘地、濕潤草地、高山灌叢草甸,分布于甘肅、青海、四川西部、西藏東部,其根系發達,喜濕,耐寒,生活力強(中國科學院中國植物志編輯委員會, 2000; 張勝邦和盧學峰, 2012)。西藏嵩草的繁殖以營養繁殖為主,有性繁殖為輔,其莖葉茂盛、有較高的營養價值,產草量高,是青藏高原夏、秋兩季的主要放牧飼草(鄧德山等, 1995; 馬玉壽和徐海峰, 2013)。以西藏嵩草為優勢種形成的高寒沼澤化草甸,具有典型的高原濕地生態特征,是青藏高原高寒草甸類草地的組成部分,其獨特的水源涵養功能,在維持青藏高原生態系統平衡及保護生物多樣性等方面發揮著重要作用;其泥炭的形成與儲存對降低大氣中溫室氣體和穩定全球變化有著重要意義(周興民, 2001; 李春秀和孫海松, 2009;田昆等, 2009)。
加拿大蒙特利爾大學Zietkiewicz et al(1994)創建了基于PCR的分子標記Inter-simple Sequence Repeats (ISSR)。該標記操作簡單、靈敏度高、穩定性好而且多態性豐富(Nagaoka & Ogihara, 1997; Devarumath et al, 2002)。鑒于ISSR的優點,現已在牧草遺傳結構分析、基因作圖與定位、親緣關系及種質資源篩選與育種等方面應用廣泛(Li et al, 2013; 李鈺瑩和董寬虎, 2014)。本研究設計正交試驗,優化影響青藏高原高寒草甸優勢種西藏嵩草ISSR的主要因子(如TaqDNA polymerase、Mg2+、dNTP、引物和DNA模板),旨在建立適合西藏嵩草ISSR的穩定性及重復性好,多態性豐富的最佳反應體系,為進一步開展ISSR標記在西藏嵩草遺傳多樣性及種質資源篩選等方面的研究提供理論依據與遺傳基礎。
1 材料與方法
1.1 材料
2013年7月赴青海省海北藏族自治州祁連縣境內的石棉礦(38°240′43.8″ N, 99°16′37.1″ E)地區采集西藏嵩草葉片材料,經中國科學院西北高原生物研究所盧學峰研究員鑒定為西藏嵩草(Kobresiatibetica),憑證標本放置于青藏高原生物標本館(HNWP,標本號2013003)。
1.2 試劑
dNTP、TaqDNA 聚合酶、100 bp和200 bp DNA molecular marker購于TaKaRa公司。所用引物(Set#9,由加拿大哥倫比亞大學University of British Columbia提供)委托上海生工合成。
1.3 方法
1.3.1 提取DNA與質量檢測基因組DNA提取采用Doyle JJ & Doyle JL(1987)改進的CTAB法。NanoDrop 2000c微量紫外分光光度計(Thermo Scientific)檢測DNA的純度和濃度,其OD260/280值均在2.04~2.12之間,濃度在95~450 ng·μL-1之間,滿足ISSR-PCR對DNA模板質量的要求。
1.3.2 ISSR-PCR反應體系的優化對TaqDNA 聚合酶、Mg2+、dNTP、Primer及DNA等進行5個因素4種不同梯度的L16(45)正交試驗篩選(表1)。優化試驗選用UBC855(其序列為5′-ACACACACACACACACYT-3′)引物。每個體系還含有2 μL的10×PCR buffer,用超純水補至20 μL。PCR擴增反應在C1000 TouchTMThermal Cycler型 (Bio-Rad) PCR儀上進行。擴增程序為預變性94 ℃ 5 min;變性94 ℃ 20 s,復性50 ℃ 1 min,延伸72 ℃ 80 s, 38 Cycles;72 ℃ 6 min延伸;并于4 ℃保存。PCR產物于水平板瓊脂糖凝膠(濃度為1.2%)上電泳,使用凝膠成像系統(ChemiDocTMMP, Bio-Rad)拍照的方法記錄實驗結果。
1.3.3 引物篩選及其最佳復性溫度優化在優化后的PCR體系上,從100條引物中篩選出擴增條帶豐富且清晰、穩定性和多態性好的引物。以引物UBC855(Tm=52 ℃)為例,在其Tm值上下浮動4 ℃,設置8個溫度梯度(48.0、48.5、49.6、51.2、53.1、54.7、55.6、56.0 ℃),其它反應程序同前文正交試驗的擴增程序,篩選出該引物的最佳退火溫度。
1.3.4 ISSR-PCR體系的穩定性驗證用引物UBC855對西藏嵩草不同材料進行ISSR-PCR擴增,進行ISSR-PCR擴增體系的穩定性檢測試驗。
1.4 統計與分析
采用正交設計直觀分析方法評分實驗結果,按照擴增條帶數量豐富度、清晰度及背景深淺的標準進行打分,條帶數量豐富、清晰且背景低的為16分,最差的為1分。用DPS 7.05軟件進行數據統計分析(唐啟義等, 2006)。
2 結果與分析
2.1 西藏嵩草正交設計數據分析
圖1是西藏嵩草ISSR-PCR正交實驗的結果,處理12擴增片段清晰,重復性好,亮度適中。16個處理的直觀打分結果如表1。

表 1 西藏嵩草正交試驗 (5因素4水平)
表2為方差分析統計結果,據F值,各因素對西藏嵩草ISSR-PCR的影響程度由強到弱依次為Mg2+、TaqDNA聚合酶、引物、模板DNA、dNTP,且每個因素的影響均達到了極顯著水平(P<0.01)。因此,為確定各個因素的最佳水平,需對5個因素分別進行因素內水平間的Duncan多重比較(表3)。
Mg2+是影響西藏嵩草ISSR-PCR反應最大的因素。當Mg2+濃度在0.9~1.5 mmol·L-1之間時,隨Mg2+濃度增加,其評分結果均值呈增大趨勢;當Mg2+濃度達1.8 mmol·L-1時,結果均值有減小趨勢(圖2)。Mg2+濃度為0.9~1.2 mmol·L-1,擴增條帶豐度低且淡弱;使用1.5~1.8 mmol·L-1的Mg2+時,所得條帶豐度高且清晰明亮,特別是1.5 mmol·L-1時,所得條帶是實驗中最清晰明亮的(處理12)。因此,1.5 mmol·L-1是Mg2+最適宜的濃度。
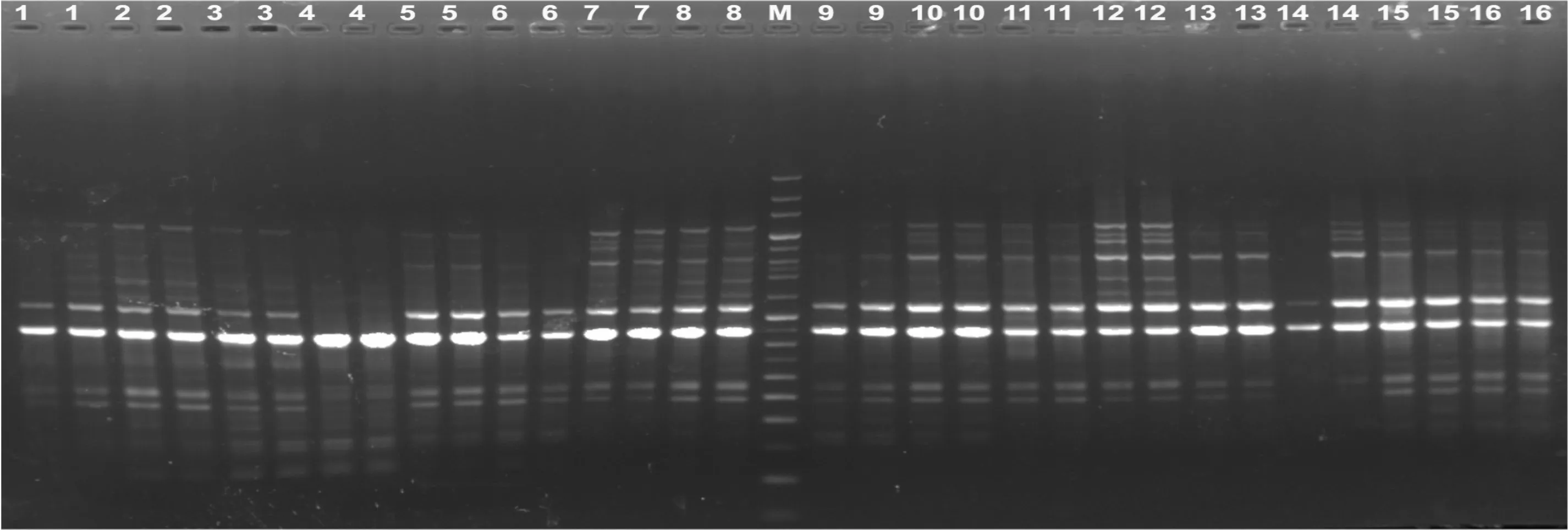
圖 1 西藏嵩草ISSR-PCR正交設計電泳結果(引物UBC855) 1-16. 處理編號(表1); M. 100 bp+200 bp標準分子量參照物。Fig. 1 Electrophoresis results of ISSR-PCR in Kobresia tibetica with orthogonal design (Primer UBC855) 1-16. Treatment numbers as showed in Table 1; M. 100 bp+200 bp molecular ladder.

表 2 不同因素對西藏嵩草ISSR-PCR影響的方差分析
注: **差異極顯著(P<0.01)。
Note: **Highly significant differences(P<0.01).

圖 2 Mg2+濃度與評分結果均值間的關系 Fig. 2 Relationship between Mg2+ concentration and mean grading results
TaqDNA聚合酶對西藏嵩草ISSR反應的影響僅次于Mg2+(表2),評分結果均值隨酶量的增加呈增大趨勢(圖3)。當TaqDNA聚合酶量為0.4~0.6 U時,擴增條帶少;TaqDNA聚合酶量為0.8~1.0 U時,所得條帶逐漸增多。由Duncan比較(表3)結果可知,僅水平3與4差異不顯著,其它水平間均差異顯著。綜上結果及酶量的經濟性原則,確定水平4(1.0 U·20 μL-1)是TaqDNA聚合酶的最佳用量。
對西藏嵩草ISSR-PCR影響較大的另一因素是引物濃度,引物濃度低時,擴增效率低;引物濃度偏高,則會導致錯配、非特異性擴增及引物二聚體生成等可能性(圖4),對不同分子量大小片段的擴增,引物濃度具有一定的選擇性。由圖1可知,引物濃度為0.3~0.4 μmol·L-1時,小于400 bp的片段未出現,而大于1 200 bp的片段被清晰明顯擴增出來;當濃度增加到0.6 μmol·L-1時(處理4、6、9、15),大于1 200 bp的條帶少且弱,出現了小于400 bp的片段。說明低濃度引物對大片段條帶的擴增有利,高濃度引物則有利于小片段條帶擴增。多重比較表明,水平1與水平2和3差異不顯著,水平1與水平4差異顯著。確定引物的適宜濃度為0.3 μmol·L-1。
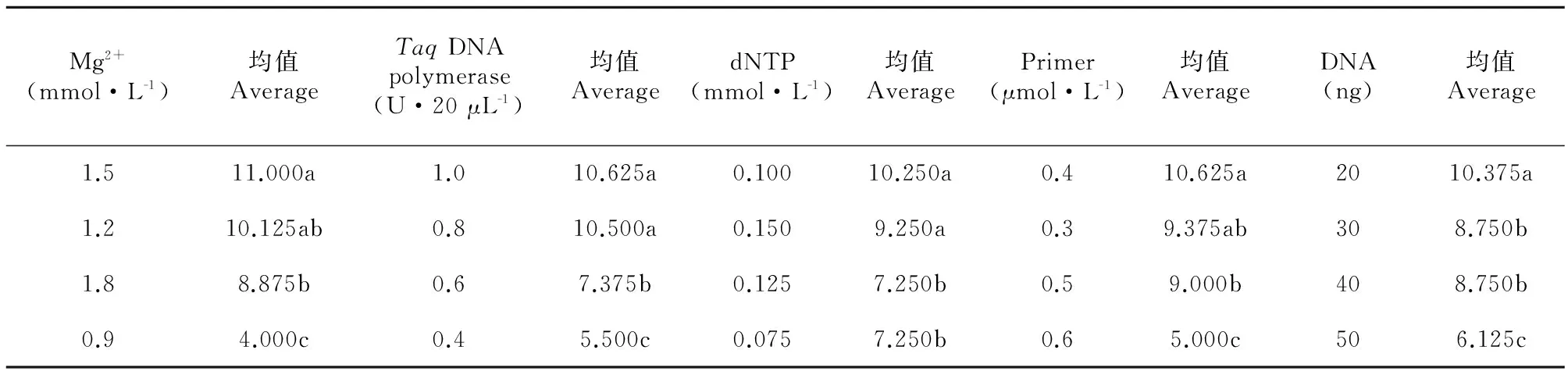
表 3 ISSR-PCR各因素水平間Duncan比較
注: 0.05顯著水平,不同字母表示處理間差異顯著,字母相同則表示不存在顯著差異。
Note: Data with different letters differ significantly while with the same letters not significantly at 0.05 level.
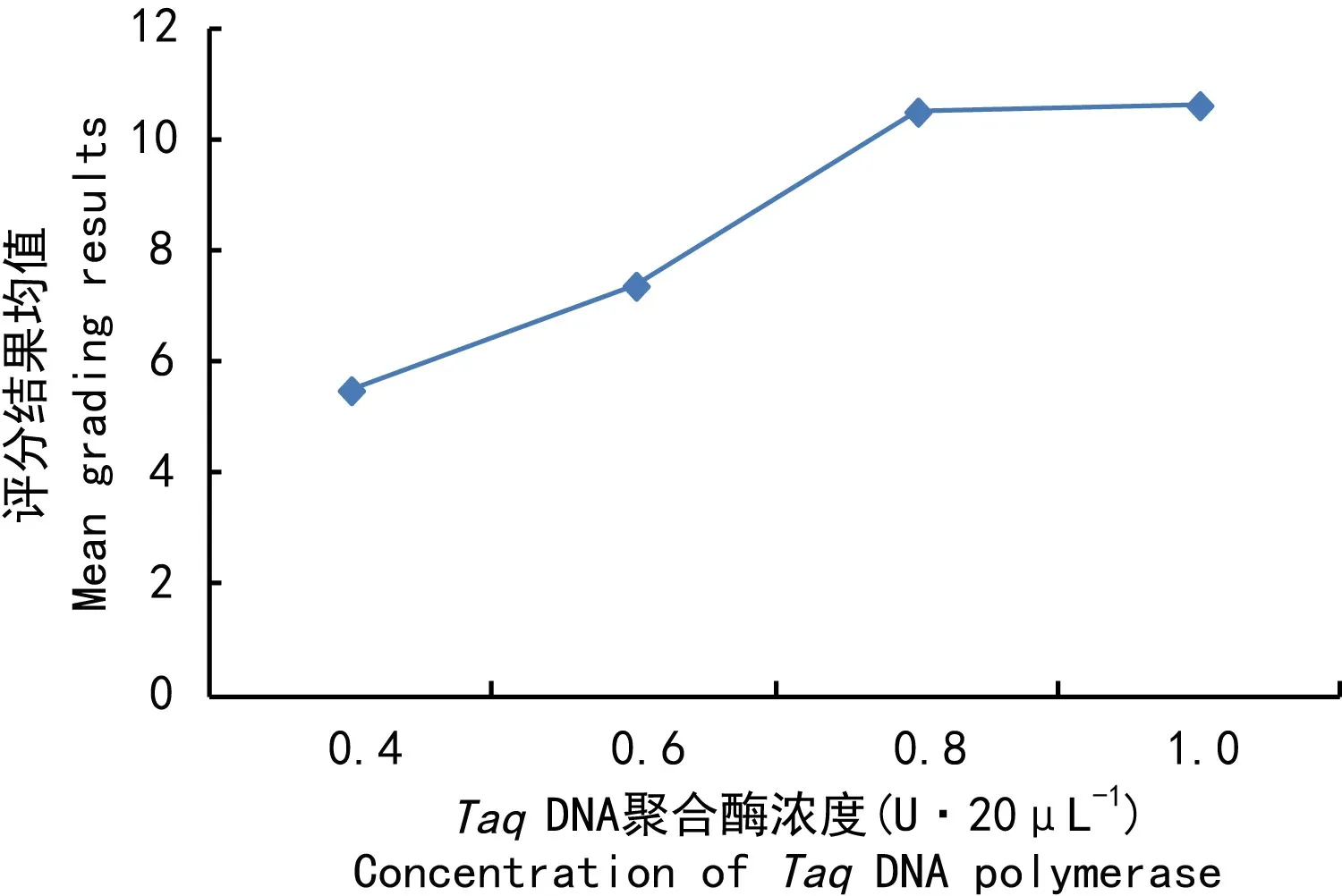
圖 3 Taq DNA聚合酶濃度與評分結果均值的關系Fig. 3 Relationship between the concentration of Taq DNA polymerase and the mean grading results

圖 4 引物濃度值與評分結果平均值的關系Fig. 4 Relationship between primer concentration and mean grading results
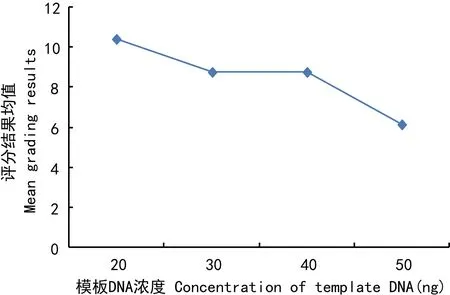
圖 5 模板DNA濃度對評分結果平均值的影響Fig. 5 Influence of the concentration of template DNA on the mean grading results
評分結果均值隨模板DNA用量的增加而減少(圖5)。當DNA用量為20 ng時(處理1、8、10、15),因模板量太少,擴增的穩定性差。僅水平2與水平3差異不顯著,水平1與其它3個水平差異顯著,水平4與水平2、3差異也顯著。因此,模板DNA的用量范圍在30~40 ng均可。
dNTP對ISSR-PCR反應的影響最小(表3),評分均值結果波動不劇烈(圖6)。當dNTP為0.075 mmol時(處理1、6、11、16),擴增條帶少且不清晰;當dNTP大于0.100 mmol時,擴增條帶逐漸增多。Duncan分析表明,水平1與水平3、水平2與水平4差異不顯著;水平1、3與水平2、4差異顯著。所以,選取dNTP的最佳濃度為0.100 mmol。
比較上述不同分析方法數據處理結果,本研究中每個因子(Mg2+、TaqDNA polymerase、 dNTP、primer和DNA template)的最適濃度組合是處理12,即20 μL反應體系中含有1.5 mmol·L-1Mg2+、1.0 U·20 μL-1TaqDNA聚合酶、0.100 mmol·L-1dNTP、0.3 μmol·L-1primer和40 ng 模板DNA。
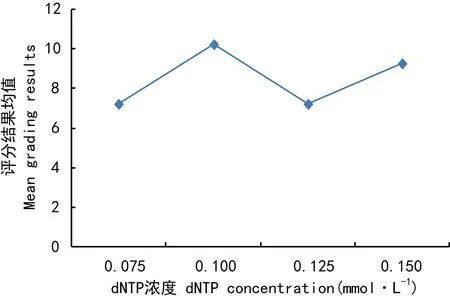
圖 6 dNTP濃度對評分結果均值的影響Fig. 6 Influence of dNTP concentration on mean grading results
2.2 引物篩選及其最佳退火溫度
圖7為退火溫度試驗(UBC855引物)結果,退火溫度對ISSR-PCR結果影響明顯。當退火溫度低于51.2 ℃時,小于800 bp的片段較少,1 200~1 400 bp的片段多,整體條帶亮度較弱。當退火溫度高于53.1 ℃時,400~800 bp的片段增多且逐漸清晰,大于1 600 bp的片段亮度增強,但1 200~1 400 bp的片段逐漸消失。退火溫度為53.1 ℃時,所得擴增條帶豐富且清晰穩定,因此引物UBC855的最佳退火溫度為53.1 ℃。據此方法,篩選出12條理想的引物,其序列及最佳退火溫度見表4。

圖 7 引物(UBC855)退火溫度試驗 1-8泳道的復性溫度分別為48.0、48.5、49.6、51.2、53.1、54.7、55.6、56.0 ℃; M. 200 bp標準分子量參照物。Fig. 7 Annealing temperature experiment of primer UBC855 Renaturation temperatures of lanes 1-8 were 48.0, 48.5, 49.6, 51.2, 53.1, 54.7, 55.6, 56.0 ℃ respectively; M. 200 bp molecular marker.
2.3 ISSR-PCR優化體系穩定性檢測
用引物UBC855和UBC846對西藏嵩草不同個體進行擴增,驗證優化體系的穩定性。從圖8中可以看出,擴增產物電泳條帶豐度高且清晰明亮。由此可見,優化后的ISSR反應體系是穩定可靠的,可用于西藏嵩草種質資源遺傳結構分析。
3 討論與結論
ISSR-PCR反應擴增結果受反應體系各組成成分、反應條件和實驗材料等諸多因素的影響(胡延萍等, 2007; 李猛等, 2013)。對不同物種而言,其ISSR-PCR反應的最佳條件各異,并且由于試驗設計的因素水平不同,各因素水平的影響也有差異。為確保ISSR分析結果的正確性及可重復性,須在實驗前事先對體系條件進行優化篩選。本研究中,西藏嵩草ISSR-PCR擴增反應的影響因素為Mg2+>TaqDNA聚合酶>引物>模板DNA>dNTP。Mg2+對西藏嵩草ISSR-PCR反應的影響最為顯著,這與蜆殼花椒(李猛等, 2013)和紫云英(孫清信等, 2012)中的研究結果一致。所以,確定合適的Mg2+濃度對西藏嵩草ISSR實驗來說是非常重要的工作。反應液中處于游離態的Mg2+不僅會影響反應過程中TaqDNA聚合酶的活性,還可進一步結合反應液中的DNA template、dNTP和primer,從而會改變primer與template的結合效率、template與PCR產物的解鏈溫度以及產物的特異性(胡延萍等, 2010)。因此,本研究適宜的Mg2+濃度為1.5 mmol·L-1。TaqDNA聚合酶對西藏嵩草ISSR-PCR的影響居第二位,僅次于Mg2+,TaqDNA聚合酶濃度過低會使PCR擴增片段少且條帶弱,濃度過高不僅成本高而且會引起非特異性擴增。本研究以1.0 U為合適用量。引物是ISSR-PCR特異性反應的關鍵,引物濃度過低僅能擴增出大片段的條帶,小片段的條帶不能有效擴增;濃度過高則會引起錯配和非特異性擴增,且會形成引物二聚體(胡延萍等,2014),本研究中適宜的引物濃度是0.3 μmol·L-1。模板DNA是ISSR-PCR的研究對象,在保證其質量的前提下,ISSR對模板DNA用量的要求范圍通常較廣,本試驗中模板DNA的用量為30~40 ng。dNTP是對西藏嵩草ISSR-PCR反應影響最小的因素。本研究表明,dNTP濃度為0.100 mmol·L-1時,擴增的結果最理想。
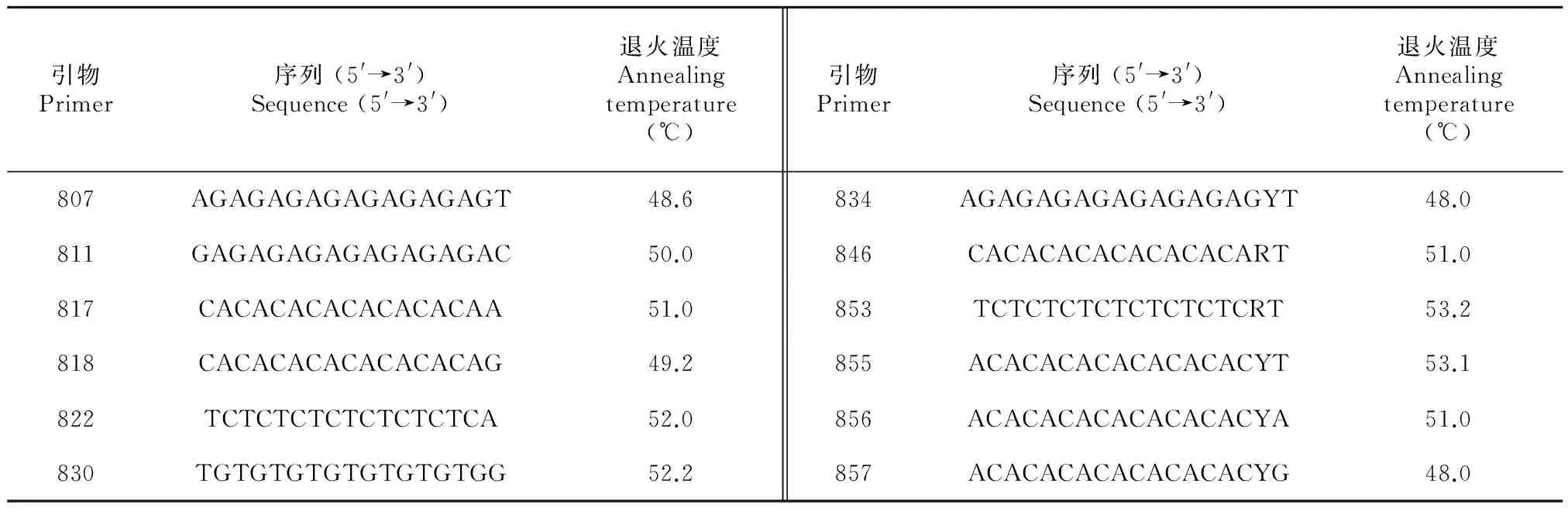
表 4 12條引物堿基組成及其最適復性溫度
注: R = (A, G); Y = (C, T)。
Note: R=(A, G); Y = (C, T).
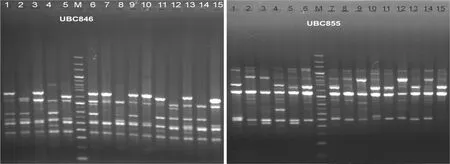
圖 8 引物UBC846和UBC855對西藏嵩草不同個體ISSR-PCR擴增的結果 M. 100 bp+200 bp標準分子量參照物。Fig. 8 Electrophoresis results of different individuals in Kobresia tibetica by UBC846 and UBC855 M. 100 bp+200 bp molecular marker.
西藏嵩草ISSR-PCR不同引物的退火溫度各異,其范圍為48.0~53.2 ℃。不同的物種,不同的引物其堿基組成和序列長短不同,引物的退火溫度也不同。包蕊等(2014)對華扁穗草ISSR分析時,引物UBC834的退火溫度為55.4 ℃,在唐古特大黃中UBC834的退火溫度為53 ℃(Hu et al, 2014),而本研究中,該引物的最適退火溫度為48 ℃。因此,在ISSR-PCR反應中,對于不同的引物,須根據其熔點各自篩選其適宜的退火溫度,不能統一而論。
正交試驗設計可以對ISSR-PCR反應體系中的多個因素同時進行篩選,能夠快速獲得滿意的水平組合,從而避免單因素試驗繁瑣且費時的缺點。本研究通過正交試驗設計,優化西藏嵩草ISSR中每個因子的最適濃度,并采用直觀分析和方差分析的方法,篩選出其最佳反應體系。即在20 μL反應體系中包括10 × PCR buffer 2 μL、1.5 mmol·L-1Mg2+、1.0 U·20 μL-1TaqDNA聚合酶、0.100 mmol·L-1dNTP、0.3 μmol·L-1primer和30~40 ng DNA模板。篩選出具有理想擴增結果的12條引物,并進一步確定了這12條引物對應的最適退火溫度。利用篩選出的最佳反應條件對西藏嵩草不同個體進行驗證,所得電泳圖譜清晰穩定,能夠迅速有效地檢測出不同個體之間的差異。西藏嵩草是青藏高原高寒沼澤草甸的優勢種,利用ISSR分子標記研究西藏嵩草種質資源遺傳多樣性和遺傳結構,對青藏高原退化草甸的修復和保護具有重要的意義。
BAO R, HU YP, WANG L, et al, 2014. Optimization of ISSR-PCR system and primer screening forBlysmussinocompressus[J]. Chin J Grassl, 36(6): 46-52. [包蕊, 胡延萍, 王莉, 等, 2014. 華扁穗草ISSR-PCR反應體系優化及引物篩選 [J]. 中國草地學報, 36(6): 46-52.]
DELECTIS FLORA REPUBLICAE POPULARIS SINICAE AGENDAE ACADEMIAE SINICAE EDITA, 2000. Flora Deipublicae Popularis Sinicae [M]. Beijing: Science Press, 12: 33-34. [中國科學院中國植物志編輯委員會, 2000. 中國植物志 [M]. 北京: 科學出版社, 12: 33-34.]
DENG DS, LIU JQ, DENG ZF, et al, 1995. A preliminary study on the reproductive characters ofKobresiaon Qinghai-Xizang Plateau [J]. J Qinghai Norm Univ:Nat Sci Ed, 21(2): 24-29. [鄧德山, 劉建全, 鄧自發, 等, 1995. 青藏高原嵩草屬植物繁殖系統生物學特性初探 [J]. 青海師范大學學報·自然科學版, 21(2): 24-29.]
DEVARUMATH RM, NANDY S, RANI V, et al, 2002. RAPD, ISSR and RFLP fingerprints as useful markers to evaluate genetic integrity of micropropagated plants of three diploid and triploid elite tea clones representingCamelliasinensis(China type) andC.assamicassp.assamica(Assam-India type) [J]. Plant Cell Rep, 21(2): 166-173.
DOYLE JJ, DOYLE JL, 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]. Phytochem Bull, 19: 11-15.
HU YP, WANG L, XIE XL, et al, 2014. Genetic variation in cultivated rhubarb (RheumtanguticumMaxim. ex Balf.) and the relationship with their wild relatives in China revealed by ISSR markers [J]. Plant Syst Evol, 300: 2 217-2 227.
HU YP, WANG L, BAO R, et al, 2014. Optimizing ISSR-PCR system ofCarexatrofuscausing orthogonal design [J]. Acta Agr Sin, 22(4): 911-914. [胡延萍, 王莉, 包蕊, 等, 2014. 正交設計優化黑褐苔草ISSR-PCR反應體系 [J]. 草地學報, 22(4): 911-914.]
HU YP, XIE XL, WANG L, et al, 2010. Establishment and optimization of ISSR-PCR reaction conditions forRheumtanguticum[J]. Guihaia, 30(1): 112-116. [胡延萍, 謝小龍, 王莉, 等, 2010. 唐古特大黃ISSR-PCR反應條件的優化 [J]. 廣西植物, 30(1): 112-116.]
LI CX, SUN HS, 2009.Kobresiatibeticaswamping grassland resources and its protection in Qinghai [J]. Prat Sci, 26(9): 77-83. [李春秀, 孫海松, 2009. 青海省西藏嵩草沼澤化草甸資源及保護 [J]. 草業科學, 26(9): 77-83.]
LI HY, LI ZY, CAI LY, et al, 2013. Analysis of genetic diversity of Ruthenia Medic (MedicagoruthenicaL. Trautv.) in Inner Mongolia using ISSR and SSR markers [J]. Gen Resourc Crop Evol, 60: 1 687-1 694.
LI M, WANG P, SUN JK, et al, 2013. Establishment and optimization of ISSR-PCR reaction system onZanthoxylumdissitum[J]. Guihaia, 33(2): 185-190. [李猛, 王平, 孫吉康, 等, 2013. 蜆殼花椒ISSR-PCR反應體系的建立及優化 [J]. 廣西植物, 33(2): 185-190.]
LI YY, DONG KH, 2014. ISSR analysis of genetic diversity of germplasm resources ofBothriochloaischaemumin Shanxi [J]. Acta Prat Sin, 23(1): 217-222. [李鈺瑩, 董寬虎, 2014. 山西白羊草種質資源遺傳多樣性的ISSR分析 [J]. 草業學報, 23(1): 217-222.]
MA YS, XU HF, 2013. Forage plants of three-river source region [M]. Beijing: Science Press. [馬玉壽, 徐海峰, 2013. 三江源區飼用植物志 [M]. 北京: 科學出版社.]
NAGAOKA T, OGIHARA Y, 1997. Applicability of inter-simple sequence repeat polymorphisms in wheat for use as DNA markers in comparison to RFLP and RAPD markers [J]. Theor Appl Gen, 94: 597-602.
SUN QX, CHEN J, ZHANG H, et al, 2012. Optimization of ISSR’s primer and PCR reaction system forAstragalussinicusL. [J]. J Plant Gen Resour, 13(5): 870-878. [孫清信, 陳堅, 張輝, 等, 2012. 紫云英ISSR引物的篩選及PCR反應體系的優化 [J]. 植物遺傳資源學報, 13(5): 870-878.]
TANG QY, FENG MG, 2006. DPS?data processing system-experimental design, statistical analysis and modeling [M]. Beijing: Science Press. [唐啟義, 馮明光, 2006. DPS?數據處理系統-實驗設計、統計分析及模型優化 [M]. 北京: 科學出版社.]
TIAN K, GUO HJ, YANG YM, 2009. The characteristic of ecological structure and research and practice of functional zoning in the conservation area of plateau wetland [M]. Beijing: Science Press. [田昆, 郭輝軍, 楊宇明, 2009. 高原濕地保護區生態結構特征及功能分區研究與實踐 [M]. 北京: 科學出版社.]
ZHANG SB, LU XF, 2012. Seed plants of Langcang River in Qinghai [M]. Xining: Qinghai Nationalities Publishing House: 362. [張勝邦, 盧學峰, 2012. 青海瀾滄江源種子植物 [M]. 西寧: 青海民族出版社: 362.]
ZHOU XM, 2001. Kobresia meadow of China [M]. Beijing: Science Press. [周興民, 2001. 中國嵩草草甸 [M]. 北京: 科學出版社.]ZIETKIEWICZ E, RAFALSKI A, LABUDA D, 1994. Genome fingerprinting by simple sequence repeats (SSR)-anchored polymerase chain reaction amplification [J]. Genomics, 20: 176-183.
Optimization of ISSR-PCR system onKobresiatibetica
HU Yan-Ping1, BAO Rui1, WANG Li1, SHI Lin1, 2, LI Yi1*
( 1.NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences, Xining 810008,China; 2.UniversityofChineseAcademyofSciences, Beijing 100049, China )
Kobresiatibetica, belonging to the genus ofKobresiaand the family of Cyperaceae, is a perennial herb. The rhizomes ofK.tibeticaare short and culms are densely tufted. It is mainly distributed in Qinghai, Gansu, west of Sichuan provinces and east of Tibet Autonomous Region at altitudes ranging from 2 550 m to 4 950 m and can be found in alpine swampy meadows, weedy plains, marshes and riversides. The root system ofK.tibeticais developed. Besides, it is hygrophilous, resistant to cold and strong in vitality. For the reproduction ofK.tibetica, vegetative propagation is prior to sexual propagation.K.tibeticaplants are of highly ecological and economic importance. The stem and leaf ofK.tibeticaare luxuriant.K.tibeticacontains high levels of crude proteins and fats and is preferred by livestock over other plants found on the plateau. The production ofK.tibeticagrass is of high yield. As a consequence, it is the major grazing forage grass of summer and autumn in Qinghai-Tibet Plateau. Furthermore,K.tibeticais the constructive and dominant species of alpine swamp meadows in Qinghai-Tibet Plateau.K. meadows are also highly involved in carbon storage and serve as important carbon sinks in China. Therefore,K.tibeticawas chosen as the research object in this study. In order to establish the suitable Inter Simple Sequence Repeats Polymerase Chain Reaction (ISSR-PCR) system inK.tibetica, factors which affect the ISSR-PCR amplification, such as magnesium ion (Mg2+),TaqDNA polymerase, dNTP, primer and DNA template, were optimized and selected by orthogonal designed experiment of five factors in four levels. In addition, suitable ISSR primers and the annealing temperature of selected primers were screened from 100 ISSR primers by gradient PCR. As a result, the optimal reactions of ISSR-PCR inK.tibeticawere performed in a 20 μL volume containing 2 μL 10× PCR buffer, 1.5 mmol·L-1Mg2+, 1.0 UTaqDNA polymerase, 0.100 mmol·L-1dNTP, 0.3 μmol·L-1primer and 30-40 ng template DNA. Out of 100 ISSR primers screened, twelve primers were selected with clear and steady bands and suitable annealing temperature of each primer was 48.0-53.2 ℃, depending on primers used. The appropriate program of ISSR-PCR forK.tibeticawas as follows: an initial step of 5 min at 94 ℃ followed by 38 cycles of denaturing at 94 ℃ for 20 s, annealing at appropriate annealing temperature 48.0-53.2 ℃ (different primers with different annealing temperatures) for 1 min and extending at 72 ℃ for 80 s, ending with a final extension of 6 min at 72 ℃. The stability of the ISSR-PCR reaction system indicated that clear and rich polymorphism bands were obtained in different individuals ofK.tibeticawith the optimal system. The establishment of ISSR-PCR system was beneficial to the analysis of genetic diversity and genetic structure ofK.tibeticagermplasms. This study will provide the information for further study of screening high quality forage. Furthermore, it is of great significance for the study ofKobresia-swamp meadows in Qinghai-Tibet Plateau as well as the restoration and conservation of the wetland ecosystem.
Kobresiatibetica, Cyperaceae, ISSR-PCR, reaction sytem, orthogonal design
10.11931/guihaia.gxzw201411003胡延萍, 包蕊, 王莉, 等. 西藏嵩草ISSR-PCR反應體系優化研究 [J]. 廣西植物, 2016, 36(8):915-922
HU YP, BAO R, WANG L, et al. Optimization of ISSR-PCR system onKobresiatibetica[J]. Guihaia, 2016, 36(8):915-922
2014-11-04
2015-05-07
國家自然科學基金(31200245);國家科技支撐計劃項目(2012BAC08B04);中國科學院青年創新促進會項目(2014386);青海省國際科技合作項目(2015-HZ-808) [Supported by the National Natural Science Foundation of China(31200245); National Key Technology R & D Program(2012BAC08B04); Youth Innovation Promotion Committee of Chinese Academy of Sciences(2014386); International Cooperation Program for Science and Technology of Qinghai Province(2015-HZ-808)]。
胡延萍(1981-),女,山東定陶人,博士,副研究員,主要從事植物生物技術研究,(E-mail)yphu@nwipb.cas.cn。
李毅,研究員,博士生導師,主要從事植物遺傳資源與繁育研究,(E-mail)liyi@nwipb.cas.cn。
Q945
A
1000-3142(2016)08-0915-08

