沙棘品種深秋紅莖尖組織培養(yǎng)
霍 川,趙 英,3*,張西珍,韓曉燕,牛建新,4*
(1.石河子大學(xué)農(nóng)學(xué)院園藝系,新疆石河子 832003;2.阿勒泰小漿果研究中心,新疆阿勒泰 836500; 3.新疆林業(yè)廳林果辦,新疆烏魯木齊 830000; 4.特色果蔬栽培生理與種質(zhì)資源利用兵團(tuán)重點實驗室,新疆石河子 832003)
?
沙棘品種深秋紅莖尖組織培養(yǎng)
霍 川1,2,趙 英1,2,3*,張西珍1,2,韓曉燕2,牛建新1,2,4*
(1.石河子大學(xué)農(nóng)學(xué)院園藝系,新疆石河子 832003;2.阿勒泰小漿果研究中心,新疆阿勒泰 836500; 3.新疆林業(yè)廳林果辦,新疆烏魯木齊 830000; 4.特色果蔬栽培生理與種質(zhì)資源利用兵團(tuán)重點實驗室,新疆石河子 832003)
[目的]篩選沙棘品種深秋紅莖尖組織培養(yǎng)基配方。[方法]選用不同培養(yǎng)基,以7月中旬至8月下旬采集的大田莖尖為外植體,對沙棘品種深秋紅的組織培養(yǎng)技術(shù)進(jìn)行研究。[結(jié)果]最適初代培養(yǎng)基為1/2MS+6-BA 0.5 mg/L,最適愈傷組織誘導(dǎo)培養(yǎng)基為1/2MS+6-BA 0.5 mg/L +IBA 0.5 mg/L,最適繼代培養(yǎng)基為1/2MS+6-BA 0.5 mg/L +IBA 0.2 mg/L,最適腋芽誘導(dǎo)培養(yǎng)基為1/2MS+6-BA 0.5 mg/L。[結(jié)論]該研究建立了沙棘品種深秋紅莖尖組織培養(yǎng)技術(shù),為其產(chǎn)業(yè)化生產(chǎn)奠定基礎(chǔ)。
沙棘;莖尖;組織培養(yǎng)
沙棘(HippophaerhamnoidesL.)為胡頹子科(Elaeagnaceae)沙棘屬(HippophaeL.)落葉灌木或小喬木,根系發(fā)達(dá),枝葉茂密,適應(yīng)能力極強(qiáng),抗嚴(yán)寒,抗風(fēng)沙耐干旱,是土壤貧瘠和沙漠化地區(qū)水土保持的先鋒樹種。沙棘主要生長在干旱、半干旱地區(qū),抗逆能力強(qiáng),有廣泛的適應(yīng)性,我國西北、華北、東北、西南各省均有分布,是一種集社會效益、生態(tài)效益、經(jīng)濟(jì)效益于一身的珍貴樹種。近年來,沙棘以其獨有的經(jīng)濟(jì)和生態(tài)上的雙重優(yōu)勢越來越受到廣泛關(guān)注,逐漸成為我國山區(qū)的一種寶貴植物資源。
隨著西部大開發(fā)步伐的加快,山區(qū)綠化、生態(tài)農(nóng)業(yè)建設(shè)急需大量的沙棘苗木,傳統(tǒng)的分株繁殖、幼枝扦插繁殖已無法滿足需要,而組織培養(yǎng)育苗由于不受季節(jié)和地域限制,既能達(dá)到快速繁育的目的,又能很好地保持良種特性的優(yōu)勢,尤其可對雌雄異株的沙棘做定性繁育,具有很大的發(fā)展前景。沙棘組織培養(yǎng)研究已有相關(guān)報道[1-6],但尚無可用于產(chǎn)業(yè)化生產(chǎn)的報道及配方。筆者以阿勒泰地區(qū)重點發(fā)展品種之一深秋紅為試驗材料,對其組織培養(yǎng)配方進(jìn)行篩選,為今后產(chǎn)業(yè)化生產(chǎn)奠定基礎(chǔ)。
1 材料與方法
1.1試驗材料供試材料于2015年7月中旬至8月下旬采于阿勒泰市沙棘莊園,取成年植株當(dāng)年生枝條的莖尖為外植體。
1.2試驗方法
1.2.1初代培養(yǎng)。以莖尖為試材,先用自來水沖洗,再用洗潔精浸泡10 min,期間不斷攪拌,然后用流動自來水清洗15 min,蒸餾水沖洗3遍,之后裝入消毒燒杯中立即置于超凈工作臺上,用0.1% HgCl2消毒3 min,期間不斷振搖,最后用滅菌蒸餾水沖洗6次。 將莖尖放在滅菌的濾紙上將水分吸干,切成0.5~1.5 cm長,將莖尖基部葉片剝離,接種于初代培養(yǎng)基上,每瓶接種3個莖尖。初代培養(yǎng)基分別以1/2MS和1/3MS為基本培養(yǎng)基,添加不同濃度的6-BA、IBA和NAA。初始培養(yǎng)基設(shè)計10個處理:①1/2MS+6-BA 1.0 mg/L+IBA 0.5 mg/L;②1/2MS+6-BA 0.5 mg/L+IBA 0.5 mg/L;③1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L;④1/3MS+6-BA 0.5 mg/L+IBA 0.2 mg/L;⑤1/3MS+6-BA 0.2 mg/L+IBA 0.2 mg/L;⑥1/2MS+6-BA 0.5 mg/L;⑦1/2MS+6-BA 0.2 mg/L;⑧1/2MS+6-BA 0.5 mg/L+NAA 0.2 mg/L;⑨1/3MS+6-BA 0.2 mg/L+NAA 0.05 mg/L;⑩1/3MS+6-BA 0.2 mg/L+NAA 0.02 mg/L。
1.2.2繼代培養(yǎng)。
1.2.2.1莖尖基部愈傷組織誘導(dǎo)。誘導(dǎo)愈傷組織時,將高于2 cm的初代芽接種至以1/2MS和1/3MS為基本培養(yǎng)基的繼代培養(yǎng)基上,添加不同濃度的6-BA和IBA。愈傷組織誘導(dǎo)培養(yǎng)基設(shè)計4個處理:①1/2MS+6-BA 0.5 mg/L+IBA 0.5 mg/L;②1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L;③1/3MS+6-BA 0.2 mg/L+IBA 0.2 mg/L;④1/2MS+6-BA 0.3 mg/L+IBA 0.05 mg/L。
1.2.2.2增殖培養(yǎng)。將初代無菌苗切下,再將莖尖和帶有2~3片葉的莖段切分,莖尖接種至1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L繼代培養(yǎng)基上,帶腋芽的莖段接種至1/2MS+6-BA 0.5 mg/L繼代培養(yǎng)基上。
1.3培養(yǎng)條件蔗糖30 g/L,瓊脂6 g/L,每瓶分裝培養(yǎng)基25~35 mL,pH 5.6~6.0,培養(yǎng)室溫度20~26 ℃,濕度40%~60%,光照強(qiáng)度2 000 lx,光照時間12~14 h/d 。
2 結(jié)果與分析
2.1初代培養(yǎng)的建立由表1可知,沙棘初代莖尖在培養(yǎng)基⑥和⑦上長勢最好。在培養(yǎng)基①、②、⑤、⑧上萌發(fā)率低或生長較慢,其他培養(yǎng)基長勢一般。6-BA濃度在0.2~0.5 mg/L未添加任何生長素時,對于7月中旬至8月下旬的莖尖有較好的側(cè)芽誘導(dǎo)效果,生長快,分化芽數(shù)最多。當(dāng)6-BA濃度在0.5 mg/L時,添加不同濃度的生長素IBA,結(jié)果表明,濃度低于0.2 mg/L時生長迅速,但后期易死亡,濃度達(dá)0.5 mg/L時,基部愈傷組織開始形成。而6-BA與NAA的組合則不適合深秋紅初代培養(yǎng)。其中,培養(yǎng)基⑥即1/2MS+6-BA 0.5 mg/L成活率可達(dá)92.3%,平均分化芽數(shù)可達(dá)2.53,為適宜初代培養(yǎng)基(圖1)。
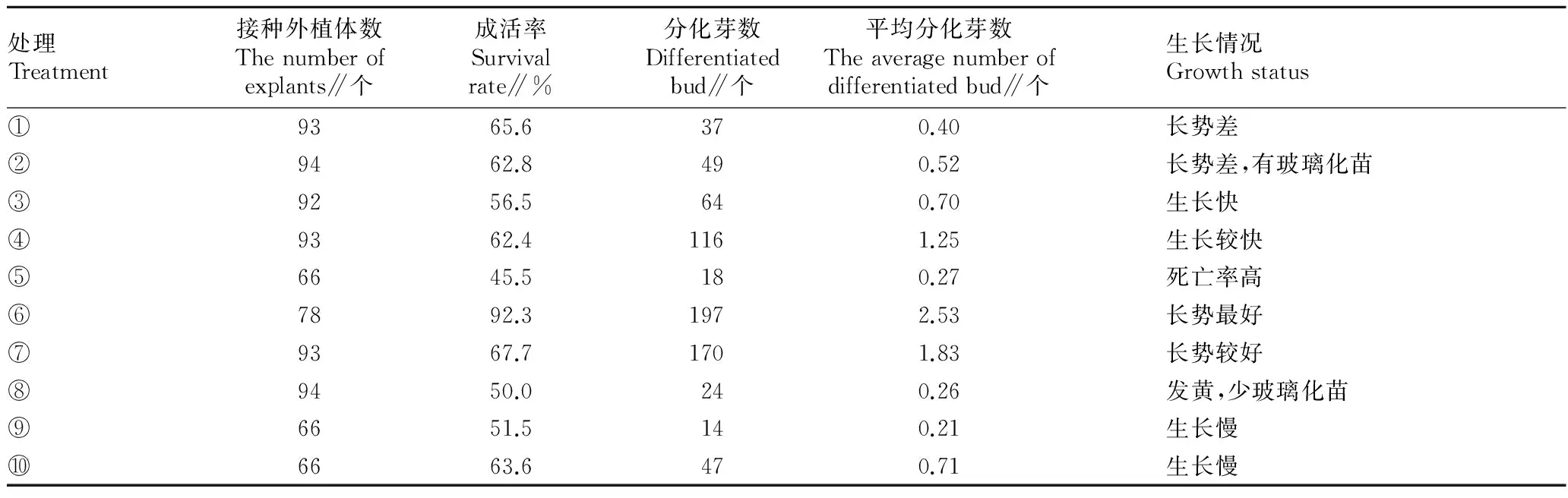
表1 不同培養(yǎng)基配方對初代培養(yǎng)的影響

圖1 初代莖尖組織培養(yǎng)Fig.1 Primary stem tip tissue culture
2.2愈傷組織的誘導(dǎo)將初代培養(yǎng)萌發(fā)的2~3 cm的側(cè)芽無菌苗切下,轉(zhuǎn)入繼代培養(yǎng)基中,成功誘導(dǎo)出愈傷組織。適合誘導(dǎo)愈傷組織的培養(yǎng)基是1/2MS+6-BA 0.5 mg/L+IBA 0.5 mg/L,誘導(dǎo)率達(dá)100%。在此培養(yǎng)基上,無菌苗生長迅速,15 d左右根部切口部位開始膨大,愈傷組織為黃綠色,繼續(xù)培養(yǎng)至30 d左右時,莖尖生長緩慢或停止,根部愈傷組織明顯增大,直徑可達(dá)1.5 cm左右,當(dāng)培養(yǎng)至40 d左右時,愈傷組織變深褐色失去活力甚至開始死亡。而在培養(yǎng)基1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L上愈傷組織誘導(dǎo)率為66.3%,愈傷組織塊較培養(yǎng)基1/2MS+6-BA 0.5 mg/L+IBA 0.5 mg/L的體積小,30 d時直徑約1 cm,繼續(xù)培養(yǎng)至40 d以上時,由愈傷組織萌發(fā)出少量芽,但愈傷組織轉(zhuǎn)黑褐色,萌發(fā)的芽有玻璃化現(xiàn)象,無法正常生長(表2、圖2)。
2.3繼代培養(yǎng)將初代形成的株高3 cm以上的無菌苗截成帶腋芽莖段誘導(dǎo)增殖,轉(zhuǎn)移至新的培養(yǎng)基上進(jìn)行繼代培養(yǎng),經(jīng)20 d左右培養(yǎng)后,當(dāng)新芽高2 cm以上時,再切分成小段轉(zhuǎn)接誘導(dǎo)增殖以達(dá)到擴(kuò)繁的目的。莖尖在1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L上長勢迅速,莖段在1/2MS+6-BA 0.5 mg/L上誘導(dǎo)腋芽萌發(fā)生長效果較好。但腋芽增殖系數(shù)較低,平均誘導(dǎo)腋芽數(shù)也少,難以滿足快繁的要求(表3、圖3、4)。
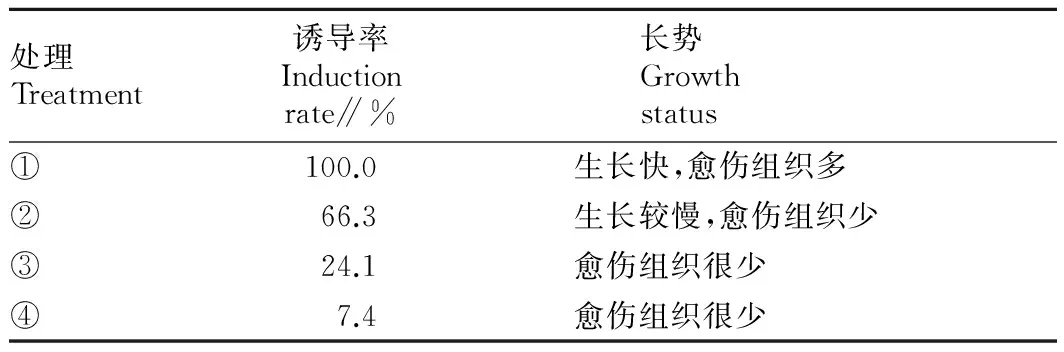
表2 不同培養(yǎng)基配方對愈傷組織誘導(dǎo)的影響

圖2 沙棘苗根部誘導(dǎo)的愈傷組織Fig.2 Callus induced by seabuckthorn roots

表3 沙棘品種深秋紅繼代培養(yǎng)效果

圖3 繼代莖尖組織培養(yǎng)Fig.3 Subculture of stem tip

圖4 繼代莖段誘導(dǎo)腋芽萌發(fā)Fig.4 Axillary buds germination induced by subculture of stem tip
3 結(jié)論與討論
該研究以7月中旬至8月下旬采集的大田莖尖為外植體,對沙棘品種深秋紅組織培養(yǎng)進(jìn)行研究。結(jié)果表明,適宜初代培養(yǎng)基為1/2MS+6-BA 0.5 mg/L,適宜愈傷組織誘導(dǎo)培養(yǎng)基為1/2MS+6-BA 0.5 mg/L+IBA 0.5 mg/L,適宜繼代培養(yǎng)基為1/2MS+6-BA 0.5 mg/L+IBA 0.2 mg/L,適宜腋芽誘導(dǎo)培養(yǎng)基為1/2MS+6-BA 0.5 mg/L。
在初代培養(yǎng)時,單一使用細(xì)胞分裂素效果優(yōu)于細(xì)胞分裂素和細(xì)胞生長素配合使用,其原因可能是此階段的內(nèi)源生長素含量較高。 在誘導(dǎo)腋芽時發(fā)現(xiàn),通常一個葉腋著生一個腋芽,但繁殖系數(shù)偏低,原因可能是尚未篩選出最適的培養(yǎng)基配方。
褐化是沙棘組織培養(yǎng)中常見的問題,其創(chuàng)傷分泌出的酚類物質(zhì)一旦接觸空氣便被氧化成醌類有毒物質(zhì),這些有毒物質(zhì)積累在培養(yǎng)基中而使培養(yǎng)材料死亡[7]。在木本植物組織培養(yǎng)過程中,褐變受培養(yǎng)溫度、外植體、激素濃度、光照等因素的影響[8~10]。在該試驗中,外植體接種前進(jìn)行低溫處理,即將沖洗過后的外植體密封置于4~6 ℃環(huán)境中3~5 h后接種,褐化現(xiàn)象受到一定程度的抑制,原因是低溫使外植體代謝速度減緩,減少了醌類物質(zhì)的形成[11]。
通過對沙棘品種深秋紅進(jìn)行組織培養(yǎng)試驗,發(fā)現(xiàn)不同樹齡、部位等的植株間外植體的差異對生長增殖影響較大。該試驗雖已獲得初步成功,但尚未達(dá)到快速繁殖及工廠化生產(chǎn)的目的,尚有許多問題有待進(jìn)一步研究。
[1] 孫蘭英,單金友,王春艷,等.沙棘組織培養(yǎng)基篩選試驗[J].沙棘,1998,11(3):14-16.
[2] 徐虹,王俊峰,梁宗鎖.沙棘組織培養(yǎng)技術(shù)研究現(xiàn)狀及存在問題[J].沙棘,1999,12(1):11-13.
[3] 李師翁,范小峰.大果良種沙棘愈傷組織誘導(dǎo)及植株再生的研究[J].西北植物學(xué)報,2001,21(2):262-266.
[4] 徐虹,梁宗鎖.沙棘組織培養(yǎng)技術(shù)的研究[J].西北植物學(xué)報,2001,21(2):267-272.
[5] 趙國林,劉金郎.沙棘的組織培養(yǎng)和植株再生[J].植物生理學(xué)通訊,1989,25(1):42.
[6] 郭春華,徐玉霞.沙棘優(yōu)良品系莖尖組織培養(yǎng)技術(shù)初探[J].沙棘,2000,13(1):26-27.
[7] 杜研,李毅,馬彥軍,等.幾種影響沙棘組織培養(yǎng)外植體褐化因子分析[J].河北農(nóng)業(yè)大學(xué)學(xué)報,2007,30(5):40-43.
[8] 陳正華.木本植物組織培養(yǎng)及其應(yīng)用[M].北京:高等教育出版社,1986.
[9] 徐振彪,傅作中.植物組織培養(yǎng)過程中的褐化現(xiàn)象[J].國外農(nóng)學(xué)—雜糧作物,1997(1):55-56.
[10] 高國訓(xùn).植物組織培養(yǎng)過中的褐變問題[J].植物生理學(xué)通訊,1999,35(6):501-505.
[11] 姬惜珠,王紅,張愛軍.木本植物離體快繁中常見問題及解決方法[J].河北果樹,2005(2):13-14.
Tissue Culture of Stem Tip of Seabuckthorn Variety Shenqiuhong
HUO Chuan1, 2, ZHAO Ying1, 2, 3*, ZHANG Xi-zheng1, 2, NIU Jian-xin1, 2, 4*et al
(1. Department of Horticulture, College of Agriculture, Shihezi University, Shihezi, Xinjiang 832003; 2. Altay Berries Research Center, Ataile,Xinjiang 836500; 3. Fruit Office of Xinjiang Forestry Department, Urumqi, Xinjiang 830000; 4. Xinjiang Production and Construction Corps Key Laboratory of Special Fruits and Vegetables Cultivation Physiology and Germplasm Resources Utilization, Shihezi, Xinjiang 832003)
[Objective] The aim was to screen out culture medium formula for stem tip of seabuckthorn variety Shenqiuhong. [Method] By using different culture mediums, with stem tip collected from middle Jul. to late Aug. as explants, tissue culture technology of seabuckthorn variety Shenqiuhong was studied. [Result] The optimal primary culture medium was 1/2MS+6-BA 0.5 mg/L, the optimal callus induction culture medium was 1/2MS+6-BA 0.5 mg/L +IBA 0.5 mg/L, the optimal subculture medium was 1/2MS+6-BA 0.5 mg/L +IBA 0.2 mg/L, the appropriate axillary bud induction medium was 1/2MS+6-BA 0.5 mg/L. [Conclusion] The cultivation technique for stem tip of seabuckthorn variety Shenqiuhong is established, which will lay a foundation for industrialized production.
Seabuckthorn; Stem tip; Tissue culture
中央財政林業(yè)科技推廣示范項目(ZYLYKJTG2015014)。
霍川(1992- ),男,河南太康人,碩士研究生,研究方向:沙棘組織培養(yǎng)。*通訊作者,趙英,高級工程師,博士,碩士生導(dǎo)師,從事沙棘良種選育和開發(fā)利用研究;*通訊作者,牛建新,教授,博士,博士生導(dǎo)師,從事果樹與生物技術(shù)研究。
2016-05-26
S 723.1
A
0517-6611(2016)18-127-03

