藏藥匙葉翼首草的快繁技術(shù)研究△
徐元江,甄梓娟,許永強(qiáng),曹芳,廖志華,蘭小中*
(1.西藏大學(xué) 農(nóng)牧學(xué)院 藥用植物研究中心,西藏 林芝 860000; 2.西南大學(xué)-西藏大學(xué)農(nóng)牧學(xué)院 藥用植物聯(lián)合研發(fā)中心/西南大學(xué) 生命科學(xué)學(xué)院,重慶 400715)
·中藥農(nóng)業(yè)·
藏藥匙葉翼首草的快繁技術(shù)研究△
徐元江1,甄梓娟1,許永強(qiáng)1,曹芳2,廖志華2,蘭小中1*
(1.西藏大學(xué) 農(nóng)牧學(xué)院 藥用植物研究中心,西藏 林芝 860000; 2.西南大學(xué)-西藏大學(xué)農(nóng)牧學(xué)院 藥用植物聯(lián)合研發(fā)中心/西南大學(xué) 生命科學(xué)學(xué)院,重慶 400715)
目的:建立藏藥匙葉翼首草組培快速繁殖體系。方法:采用不同濃度的植物生長調(diào)節(jié)劑誘導(dǎo)產(chǎn)生叢生芽與根,并篩選三種不同栽培基質(zhì)。結(jié)果:最好的消毒條件為75%酒精處理30 s+2.5% NaClO處理2.5 min+MS液(含2.5% PPM抗菌劑)處理3小時。誘導(dǎo)叢生芽的最佳培養(yǎng)基為MS+6BA 3 mg·L-1+NAA 0.5 mg·L-1,其次為MS+6BA 3 mg·L-1+NAA 0.2 mg·L-1。叢生芽生根的適宜培養(yǎng)基為MS+NAA 0.2 mg·L-1,小苗最適宜栽培基質(zhì)為蛭石:珍珠巖=1∶1。結(jié)論:通過本研究的方法可得到翼首草無菌苗與再生苗。
匙葉翼首草;萌發(fā);快繁;組培
翼首草為常用藏藥材,屬川續(xù)斷科(Dipsacaceae)翼首草屬Pterocephalus多年生草本,以全草入藥,藏語音譯名稱“榜子毒烏”、“榜孜毒烏”、“榜孜奪吾”等。在“南派藏醫(yī)藥”中,翼首草被喻為地上“七種仙草”之一[1],系西藏自治區(qū)二級瀕危藏藥材品種之一。在《四部醫(yī)典》、《晶珠本草》等藏醫(yī)典籍均有記載。《中華人民共和國藥典》規(guī)定其基原為匙葉翼首草Pterocephalushookeri(C.B.Clarke)H?eck,味苦,性寒;有小毒,解毒除瘟,清熱止痢,祛風(fēng)通痹[2]。翼首草生于海拔1800~4800 m的山野草地、高山草甸及耕地附近,分布于云南、四川、西藏東部和青海南部等藏區(qū)[3]。藥理研究表明,翼首草含有三萜皂苷類、環(huán)烯醚萜苷類、生物堿及多糖等,具有顯著的抗炎、鎮(zhèn)痛及免疫調(diào)節(jié)等作用[4]。最近郭晨旭研究表明其提取物還有一定抗腫瘤的功效[5]。
目前有關(guān)翼首草的研究主要有種子萌發(fā)[6-7]及人工栽培技術(shù)[8-9],化學(xué)成分[10-12],藥理活性與臨床應(yīng)用[13-14],質(zhì)量體系[15]等方面。關(guān)于翼首草組培與快繁技術(shù)的研究尚未見報道。植物組培技術(shù)在藥用植物中大量應(yīng)用,可以使難以有性繁殖的藥用植物大量增殖,減少對環(huán)境的依賴與破壞,保存與繁殖瀕臨滅絕的藥材資源[16]。本實(shí)驗對翼首草快繁技術(shù)體系進(jìn)行了初步探索,可以在較短時間內(nèi)獲取大量的幼苗用于生產(chǎn)種植,為今后開展相基因工程等后續(xù)工作提供支持。
1 材料與方法
1.1 材料
匙葉翼首草種子采自西藏林芝市西藏大學(xué)農(nóng)牧學(xué)院牧場,僅西藏大學(xué)農(nóng)牧學(xué)院蘭小中教授鑒定為匙葉翼首草P.hookeri。
1.2 試劑
蔗糖、無水乙醇等購自重慶川東化工廠;NaClO溶液(5.5%活性氯)購于成都市科龍化工試劑廠;PPM抗菌劑購于Plant Cell Technology公司;6BA,NAA分析純購于Sigma;其他試劑均為分析純。
1.3 方法
1.3.1 無菌苗萌發(fā)將種子剝?nèi)ネ夥N皮,選取飽滿正常的種子,放在培養(yǎng)瓶中,用紗布封好瓶口,自來水沖洗30 min。按表1的5種消毒方式進(jìn)行種子消毒,每種消毒劑處理后用無菌水沖洗3~5次。每種消毒處理選取種子30粒,在25 ℃,光照培養(yǎng)2周,統(tǒng)計種子污染率等數(shù)據(jù)。
1.3.2 翼首草增殖將萌發(fā)的無菌苗接到MS培養(yǎng)基的罐子中培養(yǎng)2個月。每苗取2~4片成熟葉片,去掉葉尖與葉柄,剪成0.5~0.8 cm長的葉段。將葉面朝上放置,葉的邊緣切口插入加不同植物生長調(diào)節(jié)劑的MS培養(yǎng)基(見表2)。每個處理12段葉片,設(shè)置3個重復(fù)。
1.3.3 翼首草芽生根處理將翼首草叢生芽放于無菌培養(yǎng)皿中,用鑷子與解剖刀分開叢生芽。選取大小相近,生長狀態(tài)良好的芽,插入MS加不同濃度的NAA的培養(yǎng)基中,深度約為0.5 cm,誘導(dǎo)生根,每個處理10株苗(表3)。
1.3.4 翼首草煉苗與移栽選取培養(yǎng)瓶中生長健壯,大小一致的翼首草幼苗,打開瓶口。煉苗3 d后洗凈根部的培養(yǎng)基,分別種植在三種栽培基質(zhì)(表4),三種培養(yǎng)基質(zhì)提前混勻并用含0.1%花無缺的水澆透。翼首草幼苗在溫室培養(yǎng)3d后放到室外培養(yǎng)。
1.3.5 統(tǒng)計分析數(shù)據(jù)錄入與整理用EXECL 2013,統(tǒng)計分析使用SPSS 16.0。
1.3.6 MS培養(yǎng)基pH值在5.80~5.85,瓊脂粉8.0 g·L-1,蔗糖30 g·L-1,121 ℃的條件下滅菌20 min。組培室溫度25℃左右,相對濕度40%左右,光照16 h·d-1,光照強(qiáng)度約為1400 Lx。
2 結(jié)果與分析
2.1 不同消毒方式的效果
消毒處理5的消毒效果最好,特別是對于霉菌污染的種子具有較強(qiáng)的消毒能力,同時對種子的損害較小。消毒處理3雖然沒有污染,但是種子已經(jīng)失活,結(jié)果詳情見表1。
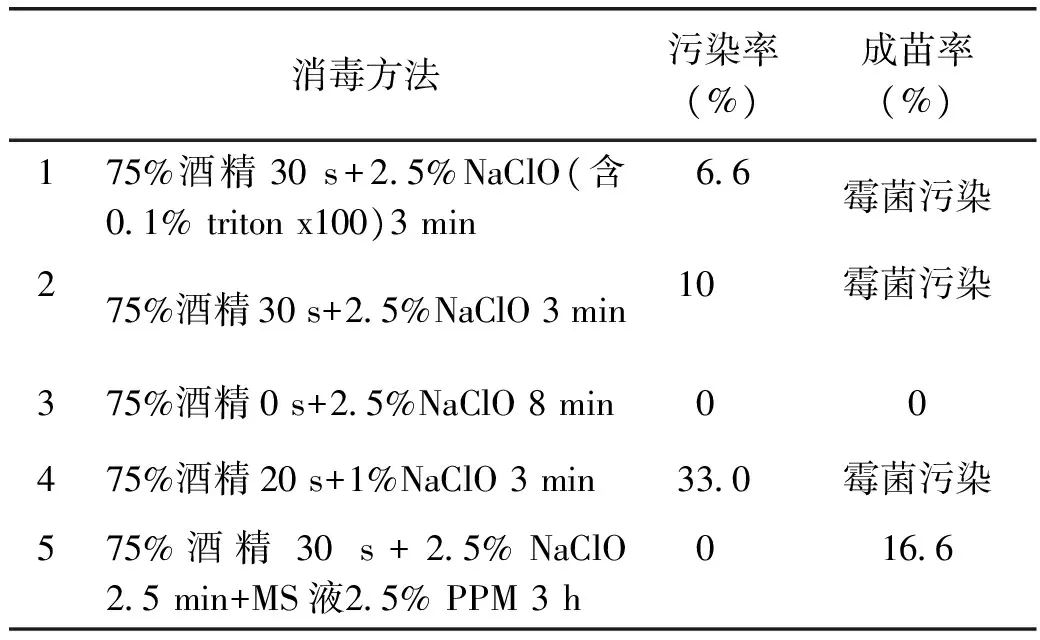
表1 翼首草種子不同消毒方式的效果
2.2 翼首草增殖
翼首草是多年生無莖草本,用于進(jìn)行快繁的組織有根、葉與莖尖。前期實(shí)驗發(fā)現(xiàn)其根的再生能力弱,不易出芽;莖尖較小剝?nèi)‰y度大,來源少且剝?nèi)∵^程易損傷故不適于進(jìn)行快繁。在MS固體培養(yǎng)基中加細(xì)胞分裂素6BA(分別為:1 mg·L-1、2 mg·L-1、3 mg·L-1、4 mg·L-1)與生長素NAA(分別為:0.2 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1)。當(dāng)6BA/NAA值大于3才有芽產(chǎn)生,在一定的范圍內(nèi)隨著6BA/NAA的值增加,芽的數(shù)量與質(zhì)量呈現(xiàn)增加的趨勢。當(dāng)6BA與NAA均為較高濃度時,僅僅能誘導(dǎo)出愈傷組織。翼首草芽誘導(dǎo)激素濃度范圍較廣,其中6BA為2 mg·L-1至4 mg·L-1,NAA為0.2 mg·L-1至1 mg·L-1均能誘導(dǎo)出芽。本實(shí)驗中最佳芽誘導(dǎo)培養(yǎng)基為7號,5號(表2)。
2.3 芽生根處理
生根培養(yǎng)基中的芽大約10 d開始生根,20 d根生長趨于穩(wěn)定。翼首草生根較容易,在未添加NAA時生根較慢;在MS+NAA 0.2 mg·L-1的培養(yǎng)基最好,根生長較快,根數(shù)適中;在較高濃度的MS+NAA 0.5 mg·L-1時根最多但較短,可能是較高濃度NAA對根的誘導(dǎo)有促進(jìn)作用卻對根生長有一定抑制作用。
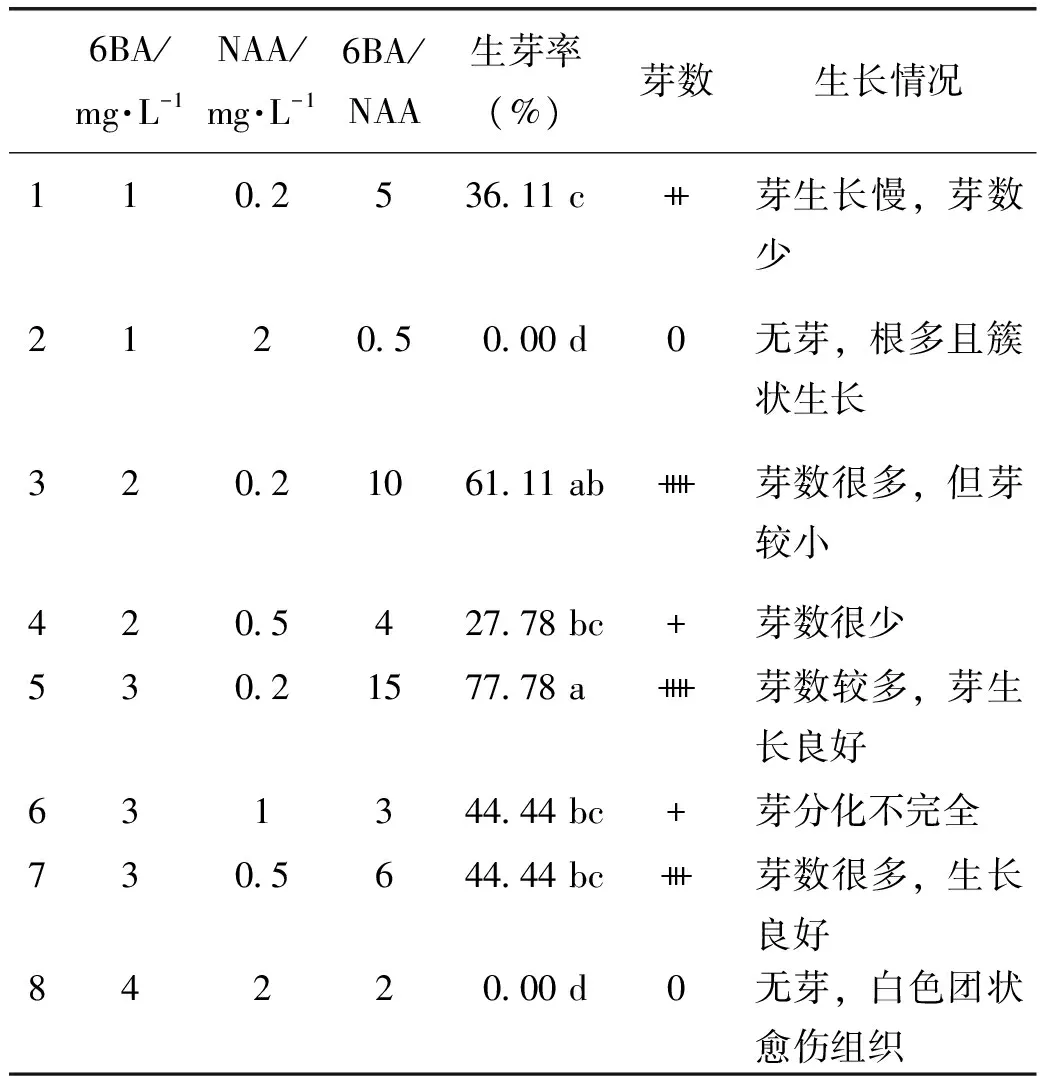
表2 不同激素配方對翼首草芽誘導(dǎo)的影響
注:叢生芽的數(shù)量:++++>+++>++>+>0,不同小寫字母間表示不同處理的差異達(dá)到顯著水平(P<0.05)
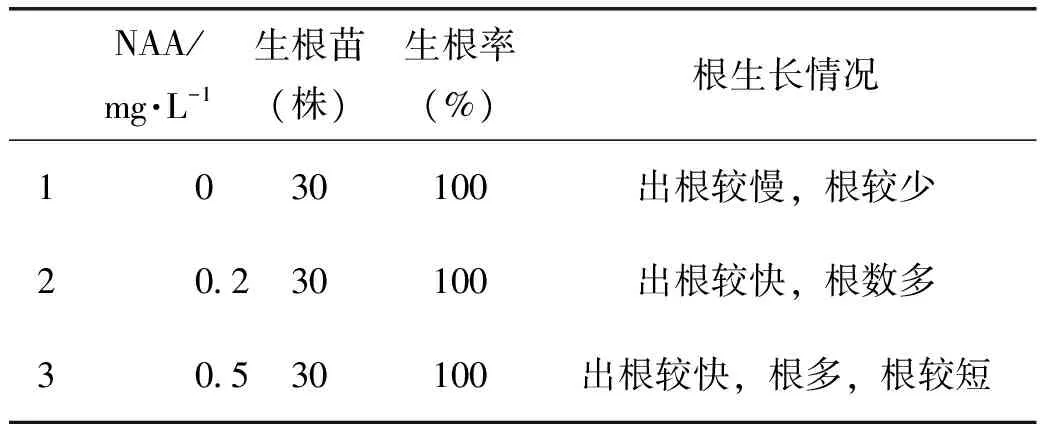
表3 不同栽培基質(zhì)對翼首草再生芽生根的影響
2.4 煉苗與移栽
選取大小適中的再生苗在25 ℃溫室中打開培養(yǎng)瓶瓶口,培養(yǎng)2 d后取出并洗凈根部培養(yǎng)基分別放入不同的栽培基質(zhì)。一周后統(tǒng)計成活率,發(fā)現(xiàn)根部特別容易感染霉菌,根部腐爛而枯萎。翼首草適應(yīng)西藏相對干燥的生長環(huán)境,在透氣較好,較干燥的1號栽培基質(zhì)中成活率相對較高為25%,而在菜園土等較多的3號基質(zhì)中存活率為0。
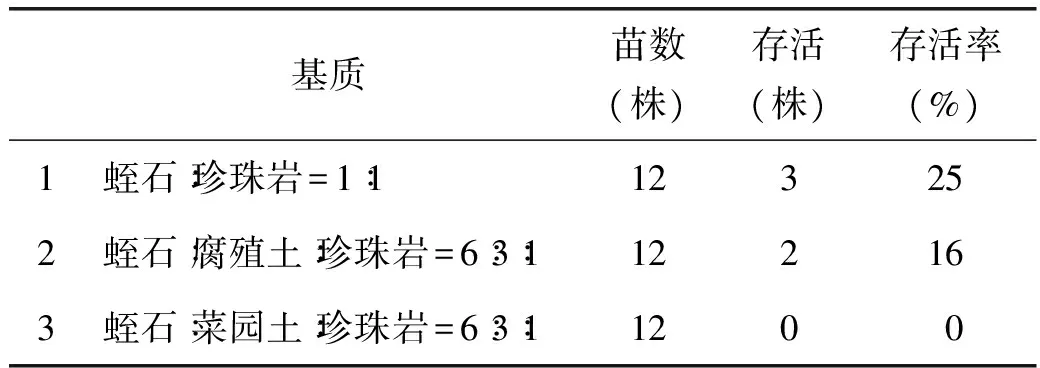
表4 翼首草栽培基質(zhì)篩選

注:A.萌發(fā)一周翼首草幼苗;B.翼首草葉再生出的叢生芽; C.翼首草生根的再生苗;D.翼首草再生苗移栽圖1 翼首草快繁的各階段
3 結(jié)論與討論
植物生長調(diào)節(jié)劑的種類與比例對于愈傷組織和叢生芽誘導(dǎo)具有重要影響,一般細(xì)胞分裂素與生長素的比值大于1促進(jìn)生芽,小于1促進(jìn)生根。翼首草葉片在一定激素濃度范圍內(nèi),6BA/NAA值大于4時有芽形成,比例為6時芽最多如激素處理7;處于高激素濃度時如激素處理8,則僅產(chǎn)生愈傷組織。翼首草葉片通過激素誘導(dǎo)產(chǎn)生叢生芽見圖1 b。
翼首草種子成熟季節(jié)是雨季易感染霉菌,且缺乏堅硬的外種皮保護(hù),消毒過度易失活。種子采集后應(yīng)及時曬干并在4 ℃陰涼環(huán)境中保存,可較好保證種子活力。翼首草的芽再生時使用培養(yǎng)皿沒有培養(yǎng)瓶的效果好,培養(yǎng)皿中可見芽點(diǎn),但培養(yǎng)基表面積較大,水分蒸發(fā)較快對培養(yǎng)基激素濃度改變較大,葉片易褐化死亡;培養(yǎng)瓶因為生長空間多、培養(yǎng)基較多更適于翼首草的快繁。翼首草再生苗煉苗與移栽過程可以通過控制水分,可以添加抗菌劑如多菌靈等方法增加存活幾率。
隨著藏藥產(chǎn)業(yè)的發(fā)展,翼首草的需求量也將增大。目前匙葉翼首草的來源主要是野外采集,僅見有少量的人工栽培。通常翼首草以干燥全草藥用,采收后需播種育苗而種子來源較少又不易儲藏,種子質(zhì)量與數(shù)量難以保證,采用翼首草葉片作為快繁材料,采用快繁技術(shù)將有望解決種子資源不足的問題。
[1] 龐偉.藏藥翼首草的研究與應(yīng)用[J].中國民族醫(yī)藥雜志,2007,13(5):63-65.
[2] 國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫(yī)藥科技出版社,2010:358.
[3] 中國科學(xué)院中國植物志編輯委員會.中國植物志:第73(1)卷[M].北京:科學(xué)出版社,1986:69.
[4] 張雪梅,楊豐慶,夏之寧.藏藥翼首草的藥理作用及其質(zhì)量評價研究進(jìn)展[J].中國藥房,2012,23(35):3356-3358.
[5] Guo C X,Wu Y C,Zhu Y Z,et al.In Vitro and In Vivo Antitumor Effects of n-Butanol Extracts ofPterocephalushookerion Hep3B Cancer Cell[J].Hindawi,2015:1-10.
[6] 楊敬軍,馬令法,何淑玲,等.匙葉翼首草種子特性及萌發(fā)最適條件的研究[J].西南農(nóng)業(yè)學(xué)報,2013,26(6):2489-2492.
[7] 楊敬軍,馬令法,何淑玲,等.豌豆苗浸出液對匙葉翼首草種子萌發(fā)特性的影響[J].廣東農(nóng)業(yè)科學(xué),2013,40(22):42-44.
[8] 常毓巍,何淑玲,楊敬軍,等.不同葉面肥對匙葉翼首草生長、產(chǎn)量和品質(zhì)的影響[J].貴州農(nóng)業(yè)科學(xué),2011,39(12):67-70.
[9] 蘭小中,周戰(zhàn).一種高海拔地區(qū)翼首草的高產(chǎn)人工栽培技術(shù)[P].CN:103141291A,2013-06-12.
[10] 田軍,吳鳳鍔,丘明華,等.匙葉翼首花的化學(xué)成分[J].天然產(chǎn)物研究與開發(fā),2000,12(1):35-38.
[11] 張藝,李文軍,孟憲麗.藏藥翼首草化學(xué)成分的研究[J].成都中醫(yī)藥大學(xué)學(xué)報,2002,25(3):41-42,46.
[12] Graikou K,Aligiannis N,Chinou I B.Chemical constituents from Pterocephalus perennis subsp.perennis(Dipsacaceae)[J].BiochemSystEcol,2006,34(5):438-441.
[13] 余鴿,龍鳳來,黃時偉.環(huán)烯醚萜藥理作用研究進(jìn)展[J].陜西林業(yè)科技,2009(2):69-73.
[14] 沈芃.藏藥翼首草抗類風(fēng)濕性關(guān)節(jié)炎作用與機(jī)理研究[D].成都:成都中醫(yī)藥大學(xué),2002.
[15] 張雪梅.藏藥翼首草化學(xué)成分及質(zhì)量評價方法研究[D].重慶:重慶大學(xué),2013.
[16] 王姝,趙玉橋,羅國坤,等.組織培養(yǎng)技術(shù)在藥用植物中的應(yīng)用研究進(jìn)展[J].貴州農(nóng)業(yè)科學(xué),2010,38(12):26-29.
RapidPropagationTechniqueforTissueCultureofPterocephalushookeri
XU Yuanjiang1,ZHEN Zijuan1,XU Yongqiang1,CaoFang2,LIAO Zhihua2,LAN Xiaozhong1*
(1.MedicinalPlantsResearchCentre,Agricultural&AnimalHusbandryCollegeofTibetUniversity,Nyingchi860000,China; 2.SWU-TAAHCMedicinalPlantsJointResearchandDevelopmentCentreSchoolofLifeSciences,SouthwestUniversity,Chongqing400715,China)
Objective:In order to establish the tissue culture rapid propagation system of Tibetan medicine ofPterocephalushookeri.Methods:The study took leaves as materials and adopted different concentration of plant growth regulators to induce cluster buds and roots,and then screened three different growing media.Results:The best disinfection conditions was for 30 s of 75 % alcohol,2.5 min of 2.5% NaClO,3 hours of MS liquid medium (containing 2.5 % PPM).It suggested that the best medium for inducing cluster buds is MS + 6BA 3 mg·L-1+ NAA 0.5 mg · L-1,and the second is MS+6BA 3 mg · L-1+ NAA 0.2 mg · L-1.The most suitable medium of inducing roots is MS + NAA 0.2 mg · L-1.The optimal cultivation substrate is vermiculite:perlite=1∶1.Conclusion:The sterile seedling and regeneration plants can be obtained by the study.
Pterocephalushookeri;germinate;propagation;tissue culture
10.13313/j.issn.1673-4890.2016.10.014
2016-01-19)
西藏自治區(qū)重大科技計劃(20131225);藏藥材資源與開發(fā)利用創(chuàng)新團(tuán)隊建設(shè);西藏特色農(nóng)牧資源研發(fā)協(xié)同創(chuàng)新中心;西藏大學(xué)農(nóng)牧學(xué)院研究生創(chuàng)新計劃項目(YJS2015-03)
*
蘭小中,教授,研究方向:藥用植物資源與開發(fā)利用;Tel:(0894)5826471,E-mail:lanxiaozhong@163.com