微小核糖核酸-24對內皮型一氧化氮合酶基因表達的調節及其對血管內皮細胞管腔形成的影響
陳偉,莫國君,羅雪蘭,王輝,楊鵬,歐和生
基礎與實驗研究
微小核糖核酸-24對內皮型一氧化氮合酶基因表達的調節及其對血管內皮細胞管腔形成的影響
陳偉,莫國君,羅雪蘭,王輝,楊鵬,歐和生
目的:探討微小核糖核酸(microRNA)-24(miR-24)對內皮型一氧化氮合酶(eNOS)基因表達調節的分子機制及其對血管內皮細胞增殖、遷移和管腔形成能力的影響。
方法:構建miR-24及其反義序列的高表達質粒,分別轉染人臍靜脈內皮細胞(HUVECs),根據轉染質粒將實驗細胞分為:miR-24高表達組、miR-24 干擾組和空白質粒對照組。用四甲基偶氮唑鹽(MTT)檢測HUVECs增殖能力,劃痕和Transwell試驗檢測細胞的遷移能力,人工基底膜檢測細胞的管腔形成能力;分別用逆轉錄-聚合酶鏈反應(RT-PCR)、蛋白免疫印跡法(Western blotting)檢測eNOS和Sp1轉錄因子mRNA和蛋白表達水平。
結果:(1)與空白質粒對照組比較,miR-24高表達組細胞增殖能力降低45.45%(0.36 ± 0.04 vs 0.66 ± 0.08,P<0.05);miR-24高表達組細胞遷移速度明顯減緩,且遷移數目降低74.75%(30.25±3.78 vs 119.80±10.94,P<0.01),未能形成明顯管腔樣結構。(2)與空白質粒對照組比,miR-24高表達組eNOS mRNA降低46.2%(0.49±0.02 vs 0.91±0.01,P<0.05),蛋白表達減少49.07%(0.55±0.05 vs 1.08±0.05,P<0.05);同時Sp1 mRNA降低44.9%(0.49±0. 01 vs 0. 89±0.02,P<0.05),其蛋白質表達量也相應減少54.90%(0.46±0.02 vs 1.02±0.04,P<0.05)。在miR-24抑制組中,上述指標較空白質粒對照組降低,但比miR-24高表達組顯著升高,特別是小管形成數量、及管腔長度與空白質粒對照組相近。
結論: miR-24顯著抑制HUVECs的增殖、遷移和管腔形成的能力,并且與miR-24對eNOS的表達調控有關;miR-24明顯抑制eNOS表達,Sp1的參與可能是這一調節過程的重要分子機制之一。
核糖核酸;管腔;一氧化氮合酶,內皮型
Abstract
Objective: To investigate the effects of miR-24 on endothelial nitric oxide synthase (eNOS) gene expression with regulation and endothelial cell proliferation,migration,tube formation in human umbilical vein endothelial cells (HUVECs).
Methods:Constructed high expression plasmid of miR-24 and miR-24 antisense sequence were introduced into HUVECs and the cells included in 3 groups: Control group,miR-24 group and miR-24 inhibitor group. HUVEC proliferation was detected by MTT test,migration was measured by Scratching and Transwell methods,tube formation was examined by Matrigel assay; mRNA and protein expressions of eNOS and Sp1were determined by RT-PCR and Western blot analysis respectively.
Results:①Compared with Control group,miR-24 group had decreased cell proliferation by 45.45% as (0.36 ± 0.04) vs (0.66 ± 0.08),P<0.05; miR-24 group had lower speed of cell migration,decreased number of cell migration by 74.75% as (30.25±3.78) vs (119.80±10.94),P<0.01 and there was no obvious tube formation.②Compared with Control group,miR-24 group showed reduced eNOS mRNA expression by 46.2% as (0.49±0.02) vs (0.91±0.01),P<0.05,reduced protein expression by 49.07% as (0.55±0.05) vs (1.08±0.05),P<0.05; meanwhile,decreased Sp1 mRNA expression by44.9% as (0.49±0. 01) vs (0. 89±0.02) P<0.05,decreased protein expression by 54.90% as (0.46±0.02) vs (1.02±0.04),P<0.05. In miR-24 inhibitor group,the above indexes were lower than Control group but higher than miR-24 group,the amount of tube formation and the length of tubes were similar between Control group and miR-24 inhibitor group.
Conclusion:MiR-24 may inhibit HUVECs proliferation,migration,tube formation and suppress eNOS expression; Sp1 might be one of the important regulators.
(Chinese Circulation Journal,2016,31:797.)
近年來研究顯示,一些微小核糖核酸(MicroRNA)可通過調控血管內皮細胞的增殖、遷移和形態變化進而調控血管生成。然而,這些miRNAs的表達異常參與了心血管疾病的發生、發展[1,2]。
內皮型一氧化氮合酶(eNOS)是內皮組織特異型基因,介導大部分的血管內源性一氧化氮(NO)合成,后者不僅是調節血管緊張度的舒張因子,而且在內皮細胞生長、遷移、血管重構和血管生成等方面起著至關重要的作用[3]。Sp1是鋅指蛋白家族中最具代表性的一員,通過三個保守的鋅指結構與DNA結合,在許多基因的表達過程中發揮重要調控作用。令人感興趣的是,eNOS核心啟動子區域的GC盒含有Sp1的高親和位點,且Sp1是eNOS的必需轉錄因子。我們前期研究提示microRNA-24 (miR-24)對內皮細胞增殖的調控與其抑制eNOS和Sp1的表達有關[4]。然而,miR-24抑制eNOS的表達是否參與血管生成的調控,目前尚不清楚。
為進一步探討miR-24對eNOS和Sp1表達調節的分子機制,以及該過程對內皮細胞增殖、遷移和管腔形成能力的影響,本實驗選取人臍靜脈內皮細胞(HUVECs)為實驗模型,構建的miRNA-24及其反義序列的高表達質粒,然后分別轉染HUVECs,觀測HUVECs的增殖、遷移和血管形成情況,并檢測 eNOS和核轉錄因子Sp1的表達變化情況。
1 材料與方法
試驗材料:HUVECs(Procell,中國武漢);1640細胞培養基(Gibco,上海立菲生物技術有限公司);胎牛血清(Gibco,澳洲);四甲基偶氮唑鹽(MTT)(索萊寶科技有限公司,中國北京);人工基底膜(Matrigel)(Corning,美國);載體 miRNA SelectTMpEGP-miR(Cell Biolabs,美國);質粒提取試劑盒(天根生化科技有限公司,中國北京);X-tremeGENE HP DNA 轉染試劑盒(Roche,德國);總RNA提取試劑盒(TRIzol法)(北京百泰克生物技術有限公司,中國北京);RT試劑盒(MBI公司,美國);PCR試劑盒(天根生化科技有限公司,中國北京);eNOS、Sp1兔源多克隆抗體(Abcam,英國);辣根過氧化物酶標記的羊抗兔二抗(Santa Cruz,美國)。
miR-24高表達質粒的構建及鑒定:miRNA-24序列(來 自 http://www.miRbase.org)為 5`UGGCUCAGUUCAGCAGGAACAG-3`;anti-miRNA-24用于下調 miR-24并干擾其作用,序列與miR-24互補,5`-ACCGAGUCAAGUCGUCCUUGUC-3`。對照組為隨機序列,5`-GUCAUCAGUCGAGCUAGACGAG-3`。使用脫氧核糖核酸(DNA)合成技術得到第一鏈DNA,通過DNA連接反應合成相應的雙鏈DNA,隨后經過聚合酶鏈反應(PCR)擴增并進行體外重組,最終插入pEGP-miR載體,載體分別命名為pEGP-miRNA-24、pEGP-anti-miRNA-24和 pEGP-control。分別將載體轉化入 E.coliDH5α感受態宿主菌并于氨芐抗性的平板上培養,挑取經酶切初步證實插入正確的單克隆菌落,搖菌后提取質粒DNA并寄上海生工進行DNA序列測定。
HUVECs的培養和轉染:HUVECs用含有1×105U/L青霉素、100 mg/L鏈霉素、10%胎牛血清的1640培養液培養,置于37℃、5% CO2、飽和濕度培養箱中。提取的質粒分別使用NANO核酸測定儀測定濃度,重復3次,取平均值。然后使用無血清1640培養液將質粒稀釋至濃度為0.01 μg/ μl,并將X-tremeGENE HP DNA轉染試劑與質粒按3 μl:1 μg比例混合,取生長正常的HUVECs孵育,24 h后更換含10%胎牛血清1640培養液,培養24 h觀察免疫熒光。根據轉染質粒將實驗細胞分為:miR-24高表達組、miR-24 干擾組和空白質粒對照組。
MTT檢測HUVECs的增殖能力:按文獻[5]的方法通過MTT檢測HUVECs的增殖能力。各組細胞分別以每孔5×103個接種到96孔板,待細胞達到50%融合時更換無血清培養基培養24 h實現細胞同步生長。接種后24、48和72 h,每孔加10μl MTT繼續孵育4 h,棄去培養液,每孔加入100μl二甲基亞砜,震蕩15 s,使用酶聯免疫檢測儀在570 nm的波長下測定吸光度(OD值),實驗重復3次。
劃痕和Transwell檢測HUVECs的遷移能力:按文獻[6]的方法通過劃痕檢測HUVECs的遷移能力。各組細胞分別以4×105個接種到6孔板,待細胞融合后用,用移液槍槍頭垂直培養板底部劃“一”字痕。接著,用磷酸緩沖鹽溶液(PBS)(磷酸根濃度=0.01 mol/L,pH=7.4)沖洗3遍,將懸浮細胞洗脫,加入無血清1640培養基繼續培養。分別于0 h和24 h觀察細胞遷移情況并測量劃痕寬度,遷移比例=(劃痕0 h后劃痕寬度-劃痕24 h后劃痕寬度)/劃痕0 h后劃痕寬度,實驗重復3次。
按文獻[3]的方法通過transwell檢測HUVECs的遷移能力。各組細胞預先用無血清1640培養基饑餓12 h,各組細胞消化后用無血清1640重懸并以1×104個接種到Transwell上層小室,下層小室均加入500 μl的含血清培養基,37℃、5%CO2孵育箱中培養。12 h后取出上層小室,用棉簽小心拭去小室內的細胞,4%多聚甲醛固定15 min,取出上層小室用PBS沖洗3次,結晶紫室溫染色1 h,自來水洗去多余結晶紫,倒置顯微鏡下觀察Transwell小室膜下的細胞(每組隨機取5個視野進行細胞計數,取平均值表示),實驗重復3次。
Matrigel檢測HUVECs的成管能力:按文獻[3]的方法通過人工基底膜(Matrigel)檢測HUVECs的成管能力。預先將Matrigel放置于4℃冰箱過夜解凍,以每孔20 μl鋪于96孔板中,冰上操作。然后將96孔板置于37℃、5%CO2培養箱中放置1 h。各組細胞消化后用無血清培養基重懸并以1×104個分別種于鋪好的Matrigel上,放回培養箱繼續培養,12 h后鏡下觀察并分析小管數量(隨機取5個視野)。
逆轉錄-聚合酶鏈反應(RT-PCR)檢測轉染前后eNOS和Sp1 mRNA的表達:按照TRIzol試劑盒說明書提取各組的細胞總RNA。利用Primer 5.0軟件設計合成人種屬eNOS、Sp1以及β-actin的引物(序列見表1)。分別取細胞總RNA 1μg,加入1.0 μl(0.5 g/L)Oligo(dT)18引物,70 ℃變性 5 min,迅速置于冰上冷卻。加入4μl 5×reaction buffer,1 μl RiboLockTM Ribonuclease Inhibitor(20 U/μl),2 μl 10 mmol/L dNTP Mix,37℃溫育5 min,加入1 μl逆轉錄酶,42℃1 h,之后 70℃10 min終止反應,合成cDNA第1條鏈。PCR擴增反應:94 ℃ 預變性5 min后,開始30個循環: 94℃ 30 s、56℃ 1 min、72℃ 1 min;最后72℃ 5 min,終止反應。取5μl PCR產物進行1.5%瓊脂糖凝膠電泳分析。

表1 引物序列
免疫蛋白印跡法檢測 eNOS 和 Sp1 蛋白的表達:分別將各組細胞裂解,以8000 g離心力、4℃離心15 min,取上清。各組分別取蛋白30μg進行SDS-PAGE(8%)分離并轉至聚偏二氟乙烯(PVDF)膜上。經脫脂奶粉封閉1 h后加入eNOS和Sp1Ⅰ抗濕盒過夜(4℃)。TBST(0.14 mol/L NaCl,2.7 mmol/L KCl,24.8 mmol/L Trise base,1%吐溫,pH=7.4)沖洗3次(每次10 min),加入Ⅱ抗(辣根過氧化物酶標記)孵育,1 h后重復用TBST沖洗(方法同上)。利用LI-COR公司的Odyssey紅外熒光掃描成像系統分析。
統計學處理:采用SPSS 16.0統計軟件分析數據。實驗重復3次,數據以均數±標準差(±s)表示,組間差異比較采用單因素方差分析,采用LSD-t和SNK-q檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1miR-24對HUVECs增殖的影響
MTT檢測結果顯示miR-24高表達組細胞增殖明顯受到抑制。培養72 h后,與空白質粒對照組相比,miR-24高表達組OD值降低45.45%(0.36±0.04 vs 0.66±0.08,P<0.05);miR-24干 擾 組OD值降低18.18%(0.54±0.05 vs 0.66±0.08,P<0.05)。與miR-24高表達組相比,miR-24干擾組OD值則增加50.00%(0.54±0.05 vs 0.36±0.04,P<0.05)。可見miR-24對HUVECs的增殖具有一定的抑制作用。
2.2miR-24對HUVECs遷移的影響
細胞劃痕實驗顯示(圖1),與空白質粒對照組相比,劃痕24 h后miR-24高表達組HUVECs的遷移比例降低42.68%(0.47± 0.02 vs 0.82±0.01,P<0.05);miR-24干擾組HUVECs的遷移比例降低18.29%(0.67± 0.01 vs 0.82±0.01,P<0.05)。與miR-24高表達組相比,miR-24干擾組HUVECs的遷移比例則增加42.55%(0.67± 0.01 vs 0.47± 0.02,P<0.05)。
為了闡明miR-24對HUVECs遷移能力的影響,本實驗選擇Transwell試驗進行再一次驗證。Transwell結果以鏡下被染色的細胞判定(見圖2),并計數對比各組差異。與空白質粒對照組比較,miR-24高表達組細胞遷移數目明顯降低74.75% (30.25±3.78 vs 119.80±10.94,P<0.01),miR-24干擾組細胞遷移數降低34.89%(78.00±4.30 vs 119.80±10.94,P<0.01); 而與 miR-24高表達組比較,miR-24干擾組細胞遷移數則增加157.85%(78.00±4.30 vs 30.25±3.78,P<0.01)。可見miR-24對HUVECs的遷移能力具有一定的抑制作用。
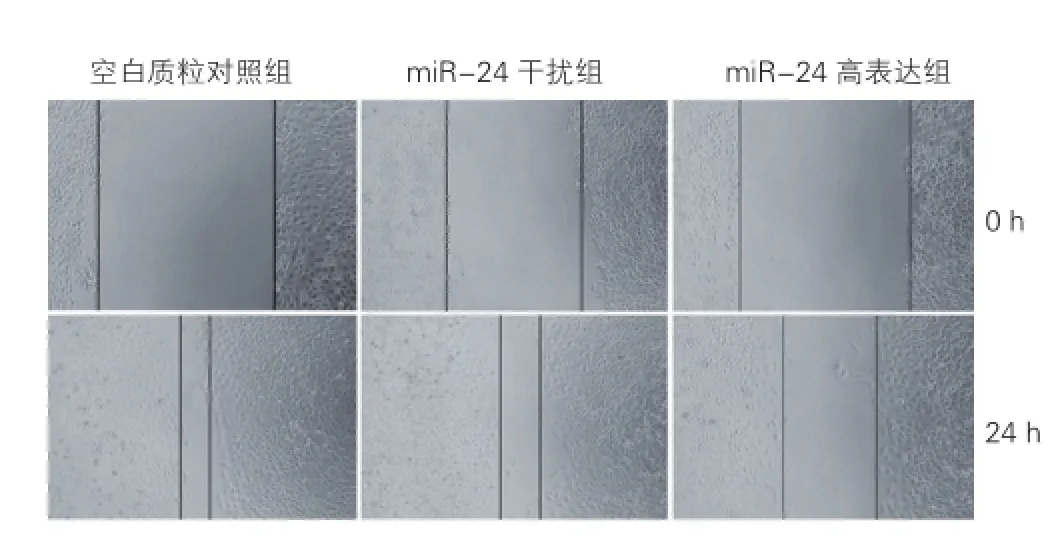
圖1 微小核糖核酸-24對人臍靜脈內皮細胞運動性的影響 (×100,n=3)
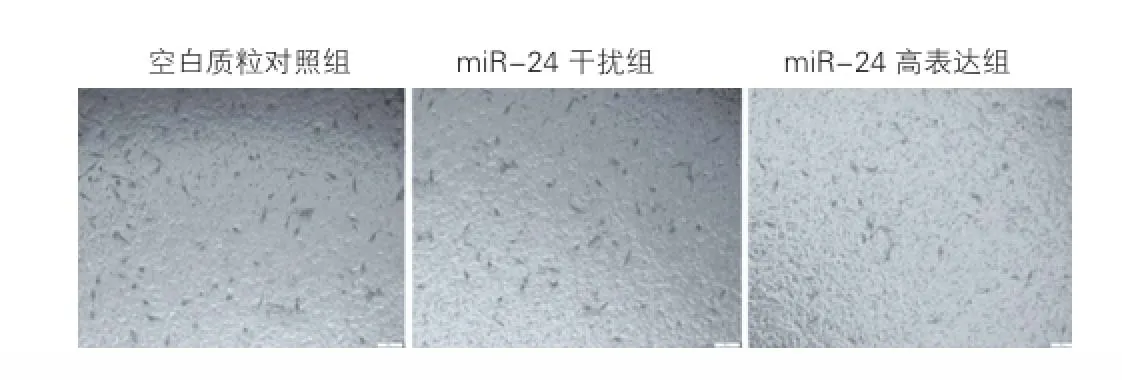
圖2 微小核糖核酸-24對人臍靜脈內皮細胞遷移的影響 (×100,n=3)
2.3miR-24對HUVECs管腔形成的影響(圖3)
HUVECs的增殖和遷移能力與管腔形成密切相關,為了明確miR-24對HUVECs管腔形成的影響,本實驗選擇Matrigel試驗進行驗證。結果顯示,與空白質粒對照組相比,miR-24干擾組HUVECs所形成的管腔數目、長度及寬度均較小,而miR-24高表達組HUVECs有聚集傾向,但未能形成管腔樣網絡結構。綜上,miR-24對HUVECs的管腔形成具有一定的抑制作用。
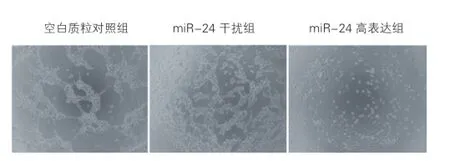
圖3 微小核糖核酸-24對人臍靜脈內皮細胞管腔形成的影響(×100,n=3)
2.4miR-24對HUVECs eNOS 和Sp1 mRNA表達的影響
RT-PCR結果顯示,與空白質粒對照組相比,miR-24高表達組的eNOS mRNA表達量降低46.2% (0.49±0.02 vs 0.91±0.01,P<0.05),miR-24干擾組的eNOS mRNA表達量降低 17.6% (0.75±0.03 vs 0.91±0.01,P<0.05)。 而 與miR-24高 表 達 組相比,miR-24干擾組增加了53.06%(0.75±0.03 vs 0.49±0.02,P<0.05)。 可 見miR-24明 顯 降 低HUVECs的eNOS mRNA水平。
與空白質粒對照組相比,miR-24高表達組的Sp1 mRNA表達量降 低44.9%(0.49±0.01 vs 0.89±0.02,P<0.05),miR-24干擾組的Sp1 mRNA 表 達 量 降 低 18.0%(0.73±0.02 vs 0.89±0.02,P<0.05)。而與miR-24高表達組相比,miR-24干擾 組 增 加 了 48.98%(0.73±0.02 vs 0.49±0.01,P<0.05)。可見miR-24明顯降低HUVECs的Sp1 mRNA水平。
2.5miR-24對HUVECs eNOS和Sp1蛋白表達的影響
Western blotting的檢測結果顯示,與空白質粒對照組相比,miR-24高表達組的eNOS蛋白表 達 量 下 降 49.07%(0.55±0.05 vs 1.08±0.05,P<0.05),miR-24干擾組下降20.37% (0.86±0.07 vs 1.08±0.05,P<0.05);而與miR-24高表達組比較,miR-24 干擾組增加了56.36%(0.86±0.07 vs 0.55±0.05,P<0.05)。結果顯示,miR-24明顯降低HUVECs 的eNOS蛋白水平。
通過Western blotting對Sp1蛋白表達量進行分析,miR-24高表達組轉錄因子Sp1 的表達量比對照組下調54.90%(0.46±0.02 vs 1.02±0.04,P<0.05);miR-24干擾組轉錄因子Sp1的表達量比對照組下調27.45%(0.74±0.02 vs 1.02±0.04,P<0.05)。與miR-24高表達組比較,miR-24 干擾組蛋白表達量增加了60.87%(0.74±0.02 vs 0.46±0.02,P<0.05)。結果顯示,miR-24明顯降低HUVECs轉錄因子Sp1蛋白水平。
3 討論
本研究發現,miR-24對HUVECs的eNOS和轉錄因子Sp1表達具有明顯的抑制作用,而且Sp1可能作為重要的調節分子與miR-24共同參與對eNOS的表達調控。進一步發現,該調控機制可能與miR-24抑制HUVECs的管腔形成有關。另外,我們再一次驗證了miR-24對HUVECs增殖的抑制作用,因此推測miR-24可能通過調控內皮細胞的增殖和管腔形成能力進而調控血管生成。
血管生成是從原有的血管上形成新血管的過程,不僅貫穿整個生命過程,而且在心血管疾病的發生、發展過程中發揮著重要作用。近年來,研究表明,血管生成與某些miRNA的調控密切相關。例如干擾內皮型miRNA的成熟將影響內皮細胞功能以及內皮細胞的血管形成能力;大鼠妊娠期敲除Dicer基因使血管發生異常,甚至導致胚胎死亡。miR-24屬于miR-23~27~24家族,在心臟特別是血管組織表達最高[7]。值得注意的是,在高血壓患者血漿中有16個miRNA明顯下調,而miR-24等14個miRNA則明顯上調,而且miR-24與高血壓的嚴重程度和并發癥呈現正相關。然而,雖然近年來有關miR-24在心肌梗死過程中調控心肌細胞凋亡的研究已取得重大進展,其相應的信號通路以及發揮的生物學效應也逐步被闡明,但miR-24通過調控內皮細胞功能促進血管生成的研究仍處于起步狀態。
eNOS是組織特異性基因,其產物NO不僅是調節血管緊張度的舒張因子,而且在內皮細胞生長、遷移、血管重構和血管生成等方面起著至關重要的作用[3]。然而,隨著年齡的增長或病理過程的發展,內皮細胞功能障礙引起的NO生成減少,將導致血管新生功能減弱,以及血管內皮受損區域的修復能力顯著降低[8]。例如,心血管疾病患者體內NO產量減少,且循環內皮祖細胞數量和血管內皮修復功能降低[9]。通過刺激內皮細胞遷移促進血管內皮修復及毛細血管的形成治療心血管疾病,得到了普遍認可。目前,在缺血性心臟病的治療中,干細胞移植療法是一個新穎而頗具前景的選擇[10,11]。近期體外試驗證實,eNOS的表達與間充質干細胞的遷移能力密切相關[12],有進一步研究提示,鋅指蛋白可通過促進內皮祖細胞的eNOS表達促進其定向內皮細胞分化。而Sp1是鋅指蛋白家族中最具代表性的一員,eNOS核心啟動子區域的GC盒含有Sp1的高親和位點,且Sp1是eNOS的必需轉錄因子。引人注目的是,miR-24可促進干細胞定向分化及表達心血管祖細胞(cardiovascular progenitor cells,CPC)功能,并提高CPC移植到心臟MI區域后的存活率[13],促進血漿中干細胞通過趨化作用富集并進入血管壁,使血管穩定成熟,但其調控機制尚不明晰。
綜上所述,本研究已證明miR-24可能通過調節eNOS和Sp1對HUVECs的增殖和管腔形成具有一定的抑制作用。然而該調控機制是否對血管生成具有調控作用,以及是否參與干細胞定向內皮細胞分化,仍需進一步探討。
[1]Zhou Q,Anderson C,Zhang H,et al. Repression of choroidal neovascularization through actin cytoskeleton pathways by microRNA-24. Mol Ther,2014,22: 378-389.
[2]Lorenzen JM,Kaucsar T,Schauerte C,et al. MicroRNA-24 Antagonism Prevents Renal Ischemia Reperfusion Injury. J Am Soc Nephrol,2014,25: 2717-2729.
[3]Huang JJ,Shi YQ,Li RL,et al. Angiogenesis effect of therapeutic ultrasound on HUVECs through activation of the PI3K-Akt-eNOS signal pathway. Am J Transl Res,2015,7: 1106-1115.
[4]Zhang W,Yan L,Li Y,et al. Roles of miRNA-24 in regulating endothelial nitric oxide synthase expression and vascular endothelial cell proliferation. Mol Cell Biochem,2015,405: 281-289.
[5]Hung HS,Chang CH,Chang CJ,et al. In Vitro Study of a Novel Nanogold-Collagen Composite to Enhance the Mesenchymal Stem Cell Behavior for Vascular Regeneration. PLoS One,2014,9: e104019.
[6]Pafumi I,Favia A,Gambara G,et al. Regulation of Angiogenic Functions by Angiopoietins through Calcium-Dependent Signaling Pathways. Biomed Res Int,2015,2015: 965271.
[7]Zhou Q,Gallagher R,Ufret-Vincenty R,et al. Regulation of angiogenesis and choroidal neovascularization by members of microRNA-23~27~24 clusters. Proc Natl Acad Sci U S A,2011,108:8287-8292.
[8]趙艷霞,格日力. 內皮型一氧化氮合酶脫偶聯在心血管疾病中的致病作用. 中國循環雜志,2014,4: 315-318.
[9]Schmidt-Lucke C,R?ssig L,Fichtlscherer S,et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation,2005,111: 2981-2987.
[10]Premer C,Blum A,Bellio MA,et al. Allogeneic Mesenchymal Stem Cells Restore Endothelial Function in Heart Failure by Stimulating Endothelial Progenitor Cells. E Bio Medicine,2015,2: 467-475.
[11]李玲,石蓓. 心臟干細胞移植治療缺血性心臟病的研究進展. 中國循環雜志,2015,3: 290-292.
[12]Lin YL,Yet SF,Hsu YT,et al. Mesenchymal Stem Cells Ameliorate Atherosclerotic Lesions via Restoring Endothelial Function. Stem Cells Transl Med,2015,4: 44-55.
[13]Hu S,Huang M,Nguyen PK,et al. Novel microRNA prosurvival cocktail for improving engraftment and function of cardiac progenitor cell transplantation. Circulation,2011,124(11 Suppl): S27-34.
Effects of miR-24 on Endothelial Nitric Oxide Synthase Gene Expression and Tube Formation in Human Umbilical Vein Endothelial Cells
CHEN Wei,MO Guo-jun,LUO Xue-lan,WANG Hui,YANG Peng,OU He-sheng.
College of Pharmacy,Guangxi Medical University,Nanning (530021),Guangxi,China
Corresponding Author: OU He-sheng,hsou01@yahoo.com
RNA; Tube formation; Endothelial nitric oxide synthase; Sp1
2015-11-22)
(編輯:許菁)
國家自然科學基金項目(81373403);廣西研究生科研創新項目(YCSZ2015119)
530021廣西壯族自治區南寧市,廣西醫科大學藥學院
陳偉碩士研究生主要研究方向:心血管分子藥理學Email:chenwei_mir2013@163.com通訊作者:歐和生Email:hsou01@yahoo.com
R54
A
1000-3614(2016)08-0797-05
10.3969/j.issn.1000-3614.2016.08.017

