氯化膽堿?水合草酸低共熔溶劑中ZnO的溶解行為
張遠,李林菲,李堅, 2,華一新, 2,徐存英, 2,柯平超
?
氯化膽堿?水合草酸低共熔溶劑中ZnO的溶解行為
張遠1,李林菲1,李堅1, 2,華一新1, 2,徐存英1, 2,柯平超1
(1. 昆明理工大學 冶金與能源工程學院,云南 昆明,650093;2. 省部共建復雜有色金屬資源清潔利用國家重點實驗室,云南 昆明,650093)
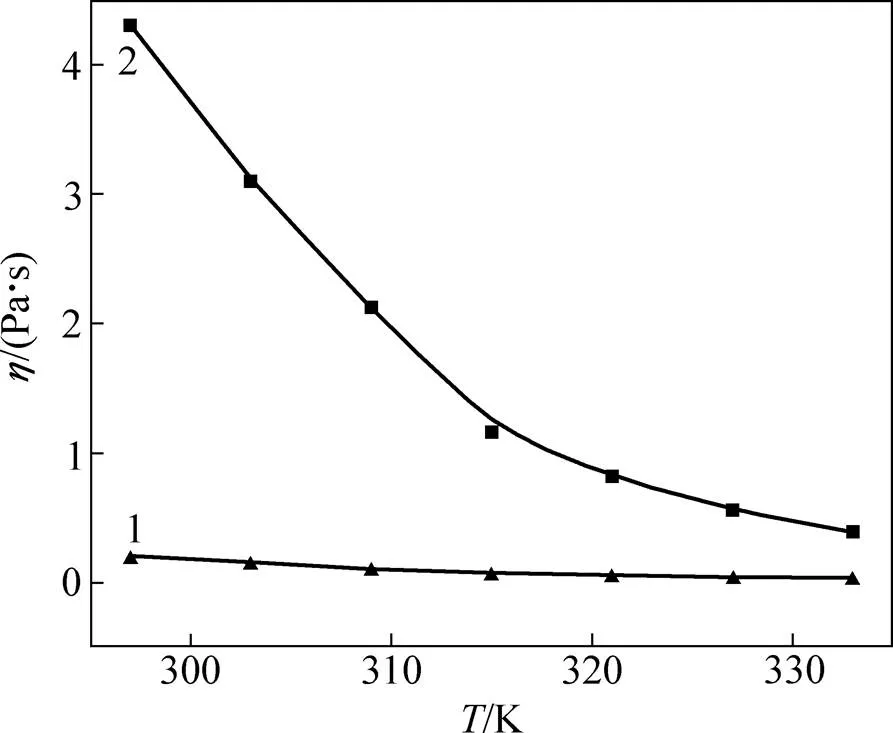
以氯化膽堿(ChCl)和水合草酸(H2C2O4·2H2O)為原料合成氯化膽堿/水合草酸低共熔溶劑(ChCl/H2C2O4·2H2O DESs)。研究ChCl/H2C2O4·2H2O DESs的組成與熔點的關系,1ChCl:1H2C2O4·2H2O DES的黏度、電導率與溫度的關系,ZnO在1ChCl:1H2C2O4·2H2O DES中的溶解度及溶解行為。研究結果表明:1ChCl:1H2C2O4·2H2O DES的低共熔點為9 ℃,在150 ℃以內具有熱穩定性;隨溫度從297 K升高到333 K,1ChCl:1H2C2O4·2H2O DES的黏度從199.4 mPa·s降低到35.6 mPa·s,電導率則從3.55 mS/cm增大至15.01 mS/cm,ZnO的溶解度由0.310 mol/L增至0.860 mol/L;未發現ZnO與體系中的正離子或負離子結合成離子物種形式存在,溶解于1ChCl:1H2C2O4·2H2O DES中的 ZnO與體系中的草酸反應生成可溶于該體系的ZnC2O4。
低共熔溶劑;氯化膽堿/水合草酸;熔點;黏度;電導率;溶解度;ZnO;ZnC2O4
通常,金屬氧化物僅在酸性或堿性水溶液中能溶解,而在絕大部分分子溶劑中是不溶解的。然而金屬氧化物的溶解性能對于金屬的電解沉積、腐蝕修復以及催化劑制備等過程卻是極為重要的。對于有色金屬銅、鋅等的氧化物,可通過酸、堿等溶解,再進行電沉積提取,但難處理金屬鈦、鋁等的提取卻需采用高溫熔鹽作為電解質[1?2]。為降低熔鹽的溫度,人們采用了鹽類的低共熔混合物,如將季銨鹽與金屬鹽混合形成了室溫熔鹽,這種類型的離子液體可視為低共晶(低共熔)。前期在這一領域的研究工作主要集中在咪唑類和吡啶類的氯鋁酸鹽[3?5],此后研究范圍擴展至其他的金屬氯化物,包括ZnCl2[6],SnCl2[7],FeCl3[8],NiCl2[9]和CrCl3·H2O[10]等。金屬鹵化物也可與氫鍵供體形成配合物,例如堿金屬的鹵化物與尿素混合可形成熔點低于150 ℃的共晶[11],而氯化膽堿(ChCl)與尿素(urea)按物質的量比為1:2混合時則形成最低共熔點為12 ℃的低共熔溶劑(deep eutectic solvents,DESs)[12]。這樣的溶劑與擁有單獨陰離子的離子液體相似,都具有不同尋常的溶劑性質,如較高的電導率、黏度和表面張力。DESs的數量眾多,按其組成的化合物不同分為季銨鹽(例如ChCl)/金屬氯化物、季銨鹽/水合金屬氯化物、季銨鹽/氫鍵供體以及水合金屬氯化物/氫鍵供體等4類[12?14]。與高溫熔鹽相似,低溫離子液體中金屬氧化物的溶解和配位化學行為也引起了人們的重 視[15?16],不少DESs對離子型金屬氧化物如ZnO,Cu2O和PbO2等具有良好的溶解性能,而對共價型金屬氧化物如Al2O3等卻基本不溶解[13]。60 ℃時ChCl/urea DES對ZnO,Cu2O和PbO2的溶解度分別為8 466×10?6,8 725×10?6和9 157×10?6[17],因此,可用于從煉鋼電弧爐煙塵中選擇性地提取鋅[18]。由于鋅在鍍鋅保護和電池制造工業是一種重要金屬,其生產主要是以硫化鋅礦為原料,因為采用傳統的浮選技術可以很容易地將硫化礦與脈石分離,實現浮選富集[19]。但隨著天然硫化鋅礦的消耗以及新的閃鋅礦床未能探明,人們將越來越重視氧化鋅礦的開發利[20]。采用酸性溶劑處理氧化鋅礦將使大量堿性脈石和硅酸鹽被溶出,不僅耗酸量巨大、而且礦漿的液固分離困難[21];若采用含氨的堿性溶劑處理,氨性溶劑揮發性大,氨的損失嚴重且惡化操作環境,對操作人員健康極為不利[21?22]。DESs因具有原料易得、價格低廉、合成簡單、熔點較低、無毒或低毒等優點,成為一類新型的綠色溶劑而受到廣泛關注[23?24]。考慮到部分DESs對ZnO的選擇性溶解能力,因而可作為氧化鋅礦潛在的浸出溶劑。本文作者以氯化膽堿和水合草酸混合共熔獲得一種新的DES(ChCl/H2C2O4·2H2O),研究該體系的熔點、黏度、電導率等物化性質以及ZnO在該體系中的溶解度和存在形態。
1 實驗
1.1 主要儀器及試劑
主要儀器有:RET basic加熱磁力攪拌器(德國IKA公司);FA1004N型電子天平(上海精密科學儀器有限公司);DZF?6090型真空干燥箱(上海精宏實驗設備有限公司);DU?20型電熱油浴鍋(上海一恒科技有限公司);SNB?2型數字旋轉黏度計(上海地學儀器研究所);DSSJ?308A型電導率儀(上海精密科學儀器有限公司);STA409PC同步熱分析儀(德國耐馳儀器制造公司);microTOF?Q11電噴霧質譜儀(德國Bruker公司)。
主要試劑有:氯化膽堿(HOC2H4N(CH3)3Cl,ChCl,99%(質量分數,下同),國藥集團化學試劑有限公司)在無水乙醇中重結晶提純,過濾并在353.15 K的溫度下真空干燥24 h;水合草酸(H2C2O4·2H2O,質量分數>99%,西隴化工股份有限公司);氧化鋅(ZnO,質量分數>99%,西隴化工股份有限公司)。將氯化膽堿和水合草酸按一定物質的量比加入到500 mL的錐形瓶中混合均勻,于50℃油浴鍋內加熱至形成均勻、透明的液體,即為氯化膽堿/水合草酸低共熔溶劑(ChCl/H2C2O4·2H2O DESs)。
1.2 測試與表征
采用毛細管法測定了不同物質的量比ChCl/H2C2O4·2H2O DESs的熔點,每種組成測試3次,取3次測試結果的平均值為該組成的熔點[25];采用溶解平衡法測定ZnO在物質的量比為1:1的1ChCl:1H2C2O4·2H2O DES中的溶解度[26];采用黏度計和電導率儀分別測定在297~333 K溫度范圍內1ChCl:1H2C2O4·2H2O DES的黏度及電導率,以及1ChCl:1H2C2O4·2H2O DES中溶解不同濃度的ZnO后體系的電導率。采用電噴霧質譜儀對溶解了0.4 mol/L ZnO的1ChCl:1H2C2O4·2H2O DES進行質譜分析,技術參數有:1) 離子源種類:ESI源(雙重離子漏斗型電噴霧離子源);2) 離子源溫度:180 ℃;3) 干燥氣流速:4.0 mol/L;4) 噴霧器氣壓:4×104Pa;5) 正離子模式和負離子模式。采用同步熱分析儀對溶解了 0.4 mol/L ZnO的1ChCl:1H2C2O4·2H2O DES進行熱 重?差熱分析,溫度范圍為25~400 ℃,升溫速率為 10 ℃/min,保溫時間為1 min。
2 結果與討論
2.1 ChCl/H2C2O4·2H2O DESs的熔點
ChCl和H2C2O4·2H2O按不同物質的量比形成的DESs的熔點如圖1所示。從圖1可以看出:ChCl與H2C2O4·2H2O形成的DESs的熔點明顯低于ChCl(302 ℃)和H2C2O4·2H2O(101 ℃)的熔點,當物質的量比為1:1的1ChCl:1H2C2O4·2H2O DES的熔點為9 ℃(最低共熔點),比1ChCl:1H2C2O4的熔點(34 ℃)低25 ℃[13];當物質的量比相同時,ChCl/H2C2O4·2H2O DESs的熔點明顯低于ChCl/H2C2O4DESs的熔點。

圖1 ChCl/H2C2O4·2H2O DESs的熔點與組成的關系
在ChCl/H2C2O4和ChCl/H2C2O4·2H2O DESs中,ChCl離解產生的Cl?可分別與H2C2O4和H2C2O4·2H2O形成氫鍵,如圖2所示。從圖2可見:H2C2O4是由分子中的羥基(—OH)與Cl?形成氫鍵,而H2C2O4·2H2O則是由分子中的水合水分子與Cl?形成氫鍵,[H2C2O4…Cl]?和[H2C2O4·2H2O…Cl]?的摩爾質量分別為125.5 g/mol和143.5 g/mol,后者的體積明顯大于前者的體積。