miRNA qPCR檢測方法研究進展及其應用
馮世鵬
(海南大學農學院 海南省熱帶生物資源可持續利用重點實驗室,海口 570228)
miRNA qPCR檢測方法研究進展及其應用
馮世鵬
(海南大學農學院 海南省熱帶生物資源可持續利用重點實驗室,海口 570228)
miRNA是目前國際研究的熱點領域之一,而miRNA表達檢測是miRNA研究的基礎內容。針對miRNA序列短小的特點,開發出了多種檢測方法,其中miRNA qPCR定量檢測是應用最廣泛的方法。就miRNA抽提,miRNA qPCR定量檢測原理及miRNA qPCR定量檢測流程包括引物設計、反應體系設置、內參基因篩選等方面進行了深入探討,并對miRNA定量檢測研究方法的發展趨勢進行了展望,以期為研究者進行miRNA qPCR定量檢測提供參考。
miRNA;stem-loop RT-PCR;poly(A)加尾法RT-PCR;延伸法RT-PCR;數字PCR
miRNA是真核生物體內普遍存在的一類非編碼序列長度約22個堿基的單鏈小RNA分子,由特定發卡結構(Stem-loop)的前體剪切加工而成。成熟的miRNA與相關蛋白組成沉默誘導復合體(RNA-induced silencing complex,miRISC)與靶基因mRNA結合,降解mRNA或者抑制mRNA翻譯成蛋白質,從而調控靶基因的表達[1,2]。目前在英國Sanger中心miRBase數據庫(最新版本21,2014年6月釋放)(http://www.mirbase.org/)中共有28 645條成熟miRNA記錄,涵蓋物種包括囊泡藻界(Chromalveolata)、后生動物亞界(Metazoa)、黏菌門(Mycetozoa)、綠色植物亞界(Viridiplantae)及病毒(Viruses)5大類,其中記錄的成熟miRNA人類(Homo sapiens)2 588個,小鼠(Mus musculus)1 915個,秀麗線蟲(Caenorhabditis elegans)434個,水稻(Oryza sativa)713個,擬南芥(Arabidopsis thaliana)413個[3,4]。
MiRNA參與生物體生長、發育、衰老和凋亡等多個進程,其發揮的作用越來越受到研究者的重視。根據miRNA序列短小的特點,開發了多種檢測方法,如Northern blot雜交法[5],Primer extension(引物延伸法)[6],Signal-amplifying ribozymes(核酶法)[7],Invader assay(侵入探針法)[8],Bead-based assay(磁珠法)[9],qPCR法[10],miRAGE(miRNA表達序列分析法)[11],深度測序法[12]等。
以上這些方法的優劣及使用情況已經有相關文獻[13]進行了報道,其中qPCR方法使用最多,本文將對近年miRNA qPCR方法的研究進展進行論述,以期對今后miRNA的qPCR定量檢測提供參考意見。
1 miRNA抽提方法
目前對于miRNA的抽提主要有兩類方法。一類是沉淀法,通過強有機試劑裂解細胞釋放RNA,再用乙醇、異丙醇、乙酸鈉、LiCl等試劑進行RNA沉淀,常見的裂解液如不同公司的Trizol試劑(含有強有機試劑異硫氰酸胍等);另一類是柱吸附法,通過裂解液裂解細胞釋放RNA后,用吸附柱分離純化小RNA分子(表1)。
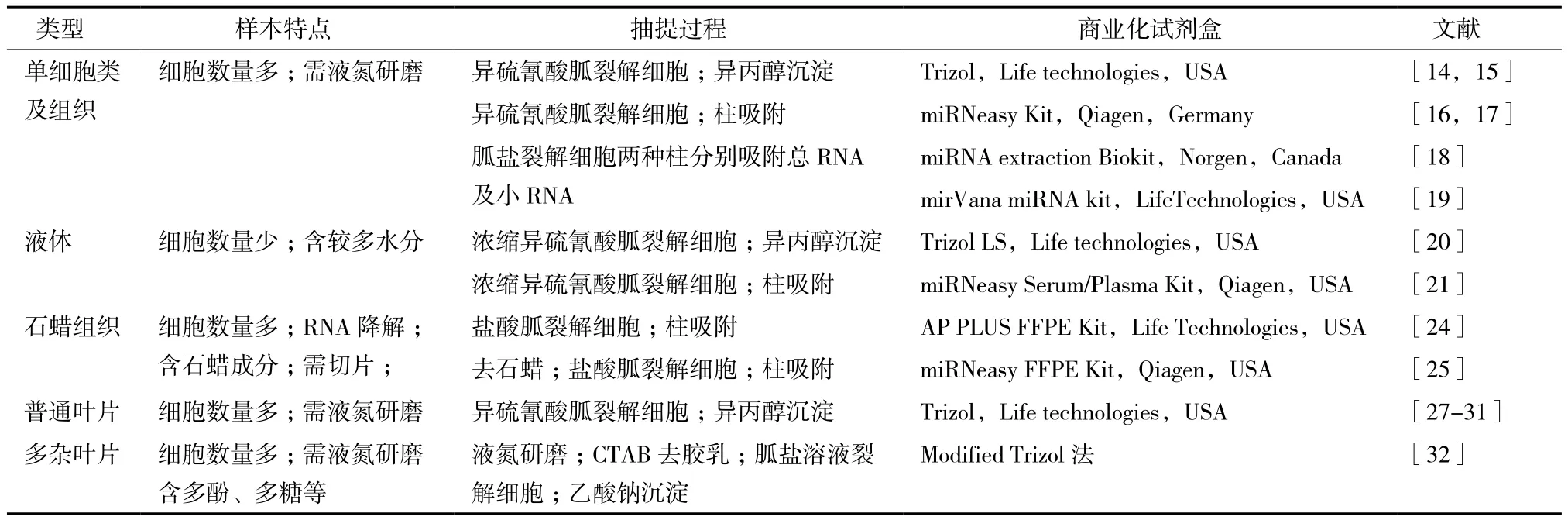
表1 常見樣本miRNA抽提方法匯總表
1.1 細胞類樣本及動物組織樣本miRNA抽提
對于人、動物、植物細胞,微生物細胞個體及人與動物組織樣本,常用沉淀法法抽提總RNA,該方法通過Trizol試劑裂解細胞釋放RNA,再進行總RNA的沉淀,此方法易于操作,所抽提的RNA里面包含miRNA等小RNA分子,并可滿足大多數情況下miRNA檢測之用[14,15];有些吸附柱可同時吸附所有類型的RNA,利用這種吸附柱也可抽提含miRNA的總RNA分子[16,17],也有部分吸附柱只能吸附大片段的RNA或者只能吸附小片段的RNA,基于這類吸附柱開發的試劑盒對于RNA的抽提則需要將大片段的RNA(>200 nt)與小片段(<200 nt)RNA分別提取[18,19]。有部分實驗需要較高純度的miRNA(如miRNA測序、miRNA的表達譜研究等),可在抽提的總RNA基礎上進一步采用吸附柱或凝膠電泳純化分離純化miRNA分子。
對于血樣、唾液、精液等液體樣本,因其所含細胞少、水分多等特點需用濃縮型的miRNA抽提試劑[20,21]。Ho等[22]比較了不同公司6款針對液體樣本的miRNA抽提方法,發現其抽提效果稍有差異,該結果可為研究者進行商業化試劑盒選擇時提供參考。Tzimagiorgis等[23]對于血漿、血清、唾液、腦髓液等體液樣本游離核酸的來源、樣本前處理及miRNA抽提方法進行了綜合討論,可為液體樣本miRNA抽提提供參考。
對于石蠟樣本,因其RNA有不同程度降解,所含石蠟會影響后續實驗反應,樣本miRNA抽提前需進行去石蠟操作[24,25],不同公司開發了針對石蠟樣本的miRNA抽提試劑盒,其實際使用使用效果有一定差異,選擇時需謹慎[26]。
1.2 植物組織樣本miRNA抽提
由于植物的根、莖、葉、花、果不同組織或者不同植物的同一組織中所含的次生代謝產物的種類及含量不一樣,導致植物組織的miRNA抽提方法更加多樣化。對于模式植物擬南芥、大部分禾本科植物、部分其他科植物的葉片來說,用Trizol進行總RNA抽提,其中所包含的miRNA分子可用于大多數情況下的miRNA表達檢測[27-31]。對于一些特殊植物,如橡膠樹葉片含有較多膠乳成分,香蕉和荔枝等水果樹葉片含多糖等成分,其總RNA及miRNA的抽提需要進行去除這些成分的前期處理[32]。
1.3 miRNA質控
包含miRNA的總RNA抽提完畢之后需進行質量檢測,包括RNA完整性、濃度、純度的檢測。其中RNA的完整性主要用兩種方法檢測:一是RNA凝膠電泳(PAGE或瓊脂糖凝膠電泳均可),28S條帶的亮度約為18S條帶的2倍,則證明所抽提總RNA完整性較好;二是進行RIN值(RNA integrity number)檢測(如用Agilent 2100進行芯片電泳),RIN值大于7則證明樣本所抽提RNA完整性較好。RNA的濃度及純度可用測吸光度的方法進行測定檢測260 nm、280 nm和230 nm三個波長的吸光值A260、A280和A230,常用A260吸光值與濃度換算關系是OD值相當于RNA濃度44 ng/mL;A260與A280的比值可評估是否有DNA或者蛋白質污染,該比值大于2.0則證明RNA純度較高;A260與A230的比值是看有機雜質殘留,該值越大則認為RNA樣本含有機雜質越少[33]。
2 miRNA qRT-PCR檢測
2.1 miRNA前處理
miRNA由于其自身特點,對其進行特異性檢測面臨一些挑戰。如序列長度太短,只有22 bp;GC含量不均一;缺少類似polyA的公共序列;存在初級轉錄本(pri-miRNA)、前體(pre-miRNA)、成熟miRNA三種形式;miRNA家族成員間序列相差幾個堿基,甚至只差一個堿基[14]。因此對于miRNA的檢測方法設計,從得到的RNA樣本即開始綜合考慮。
獲得含有miRNA的高質量RNA樣本后,在第一鏈cDNA合成之前,按照對該樣本RNA的處理方式分3種類型:一是不做任何處理(圖1-A);二是使用poly(A)聚合酶(poly(A)polymerase,PAP)在miRNA的3'端連接poly(A)尾(表2,圖1-B);三是在miRNA的3'端或兩端均添加linker(圖1-C,圖1-D)。

圖1 成熟miRNA的前處理
2.1.1 Poly(A)加尾法 其最顯著的好處在于為所有待檢測miRNA引入類似mRNA的poly(A)尾,便于后續反轉錄時通過帶poly(T)的反轉錄引物一次將所有的miRNA反轉錄為cDNA,對于用qPCR法進行miRNA表達譜研究來說非常實用。其缺點是加尾完畢需進行RNA純化,無論是用乙醇沉淀[34]還是通過吸附柱[35]回收來純化,均會損失一部分miRNA表達信息。另外,PAP酶的反應效率也很難達到100%,這也會導致一部分miRNA表達信息的損失,從而導致低表達的miRNA無法檢測,其他可檢測的miRNA表達量下降;另外由于不同公司的PAP酶及不同的反應條件會導致poly(A)尾的長短產生一定的差異,導致qPCR檢測時出現雜峰,在反轉錄引物設計時必須考慮這種情況,并盡力避免。Poly(A)加尾法所需的總RNA量目前文獻報道在0.5 μg以上,因該方法后續處理純化的損失,因此建議起始量在條件許可的情況下可適當增加(如2 μg),這樣有利于檢測低表達的miRNA,同時加尾處理后的RNA可用于其他miRNA檢測實驗,也不會浪費。
2.1.2 linker連接法 在成熟的miRNA一端或者兩端同時使用T4 RNA連接酶進行linker連接,其優點是:直接增加了miRNA的長度,使引物設計時可選擇引物結合范圍增大;在3'端引入linker,可用通用引物進行反轉錄;若同時在一端或者兩端引入公共接頭,如需要可設計通用引物。其缺點是:受T4 RNA連接酶反應效率影響,易導致低豐都表達的miRNA難以檢測[36]。
2.2 第一鏈cDNA合成
2.2.1 Poly(A)加尾法 對于通過poly(A)加尾處理過的RNA樣本來說,根據待檢測的miRNA數量,取適量RNA加入帶poly(T)的反轉錄引物進行反應即可(表2)。該反轉錄引物常用這種形式表示adapter(T)nVN,從5'端開始依次可分為3部分(圖2-C):(1)adapter部分,用于引入通用反向引物位點,文獻報道其長度范圍集中在32-75 nt,其結構為線性或者發卡狀。為了進一步引入通用taqman探針結合位點,或者后續實驗有其他應用如構建文庫,該部分可設計為較長的片段,并設計成發卡結構也增加其穩定性[37,38]。(2)poly(T)n部分,于miRNA的poly(A)尾互補配對,長度在12-25 nt之間(表2)。由于PCR反應過程中需擴增該片段,為避免擴增過程中出現聚合酶打滑現象,同時較長的引物片段會增加引物合成的困難,建議這部分的序列設計盡量不要太長。(3)VN部分,V代表A、G和C三者之一,N代表A、T、G和 C四者之一(表2),這一部分的作用是與miRNA互補配對,錨定反轉錄時的起始位置,避免由于poly(A)尾長短的差異導致qPCR時出現雜峰(圖2-C)。這部分的長度有1nt[38],2nt[24,35],5-7 nt[39],其中2 nt使用最多,該部分長度小于或等于2 nt的屬于通用引物,包含由3種(1 nt情況)或者12種(2 nt情況)引物的混合物,其反轉錄產物理論上可以檢測所有的miRNA;大于2 nt的屬于特異引物,主要用于進行特定miRNA的檢測,提高qPCR檢測的特異性[39]。
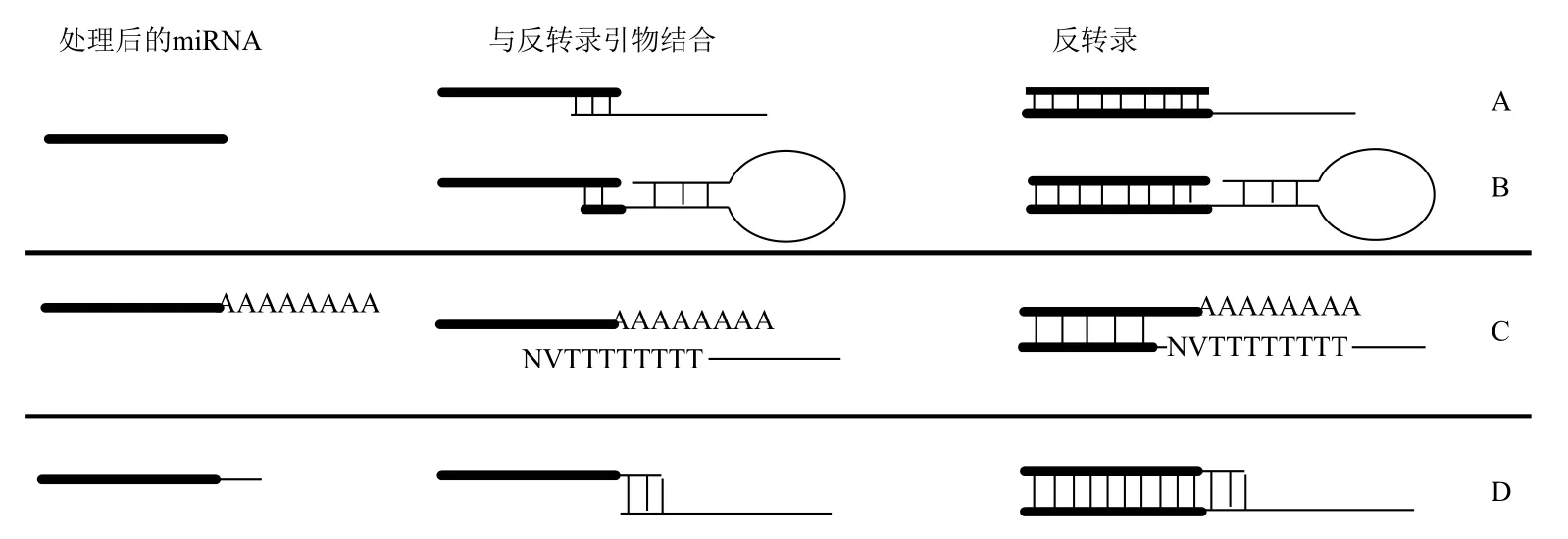
圖2 反轉錄反應流程圖
2.2.2 Stem-loop 引物反轉錄或線性引物反轉錄 對于未經加尾處理的RNA樣本來說,需加入miRNA的特異引物進行miRNA的反轉錄(圖2-A,2-B),若需同時檢測多個miRNA,則必須將這些miRNA的特異引物混合后進行反轉錄反應。miRNA特異引物一般包括2部分,從5'端開始依次是:(1)延長部分,該部分的作用是引入反向引物結合位點,其結構可分為線性和stem-loop發卡結構兩種。線性結構反轉錄引物可通過引物的聯合設計取得較理想的檢測效果,如qPCR正向引物LNA修飾[40];或通過RT反轉錄引物與反向引物的協同設計,使miRNA有特異的RT引物及qPCR反向引物等[41]。發卡結構可看成是在線性結構基礎上的改進,發卡結構對于線性結構來說,在反轉錄時可提高反轉錄引物與miRNA結合的穩定性,并由于發卡結構的位阻效應可避免反轉錄引物與前體miRNA的結合,從而提高miRNA檢測的靈敏度和特異性[10]。在發卡結構引物中還可引入dU堿基,在反轉錄完畢后加入鳥嘧啶DNA糖基化酶(uracil-DNA glycosylase,UDG),在dU堿基處將DNA斷裂為兩段,這樣可去除反轉錄過程中剩余的RT引物,而已經轉錄完畢的cDNA在dU處斷裂后余下的片段也可作為qPCR反應的模板,這樣進一步提高qPCR檢測的特異性[42]。(2)與miRNA互補配對部分,這部分與miRNA檢測特異性密切相關。這部分的長度集中在6-8 nt,Lao等[43]測試這部分長度對于RT引物與miRNA結合效率的影響,從5-10 nt,在8 nt之前,隨著長度的增加,RT引物結合效率顯著增加;在8 nt之后則增加不明顯。Jung等[44]測試獲得了類似的結果,同時發現發卡結構的序列與miRNA結合位點間的gap越大,RT引物與miRNA結合的效率越差。

表2 miRNA qRT-PCR方法匯總表
2.2.3 Linker引物反轉錄 在miRNA的3'端連上linker后,由于引入了通用的反轉錄引物接合位點,可直接使用通用反轉錄引物進行反轉錄反應(圖2-D);也可設計成miRNA特異的反轉錄引物。若設計為通用反轉錄引物,一般分為2部分,從5'端依次是延長部分,進一步引入通用qPCR反向引物位點;與linker配對部分,實現加尾后的miRNA反轉錄。若設計為miRNA特異的反轉錄引物,則設計時會進一步延伸若干堿基與miRNA配對,從而實現特定miRNA的反轉錄[36]。
2.2.4 反轉錄引物濃度設定 在引物濃度方面,進行特定miRNA檢測時的RT引物濃度集中在50 nmol/L范圍;如果要同時檢測多個miRNA,則將這些miRNA相應的RT引物混合,每條引物均為50 nmol/L;帶poly(T)的引物濃度序列明顯高于其他非poly(T)的引物濃度(500 nmol/L以上)(表2)。
2.3 qPCR反應
miRNA反轉錄成cDNA后,均經過適當延長,已經可以進行qPCR擴增,其檢測方法有染料法(如Sybr green染料)(圖3-A)和探針法(如Taqman探針)(圖3-B)。qPCR的引物根據其特點可分為以下幾種類型。
2.3.1 染料法 (1)特異正向引物(forward primer,FP)和通用反向引物(reverse primer,RP)。特異正向引物從5'端開始依次分為延長部分以及與miRNA序列一致部分兩部分:延長部分,序列為人為設計,可進行LNA修飾,主要用于調節引物的GC含量、Tm值、長度等,使其與下游引物相匹配;與miRNA序列一致部分是提供miRNA檢測特異性的最重要部分,對于部分polyA加尾法來說,miRNA檢測特異性直接決定于這一個部分的特異結合情況。通用反向引物來自與反轉錄引物的延長部分,所有的miRNA反轉錄引物這部分均設計相同的序列,導致可以采用通用反向引物[34,35]。(2)特異正向引物及特異反向引物。其中特異正向引物與前一種情況相同。特異反向引物來源于針對特定的miRNA設計的特異反轉錄引物,這些特異反轉錄引物除了與miRNA互補配對部分提供特異性外,針對不同的miRNA,其反轉錄引物延伸部分也不完全一樣,而qPCR反向引物必須根據反轉錄引物的序列進行設計,最終導致各個miRNA有不同的特異反向引物[41];或者是使用半嵌套引物,反向引物有部分序列與miRNA互補配對,也導致不同的miRNA有特異的反向引物[42]。(3)通用正向引物、通用反向引物。這是由于在PCR體系中除了正反向引物外,還加入了另一條引物,該引物從5'端開始依次分兩部分:延伸部分,提供了通用正向引物序列;與miRNA序列一致部分,提供了引物檢測的特異性;通用反向引物由反轉錄引物序列提供[46]。
2.3.2 探針法 (1)特異正向引物、通用反向引物、特異探針。其中特異探針是由于探針設計的位置有一部分與miRNA序列匹配,導致不同的miRNA需用特異探針,進一步提高了檢測的特異性[10]。(2)特異正向引物、通用反向引物、通用探針。其中探針的位置設計在反轉錄引物的延伸部分,由于不同miRNA其延伸部分相同或者至少探針結合位置序列相同,因此可使用通用探針[37-39,44,45]。

圖3 miRNA qPCR反應
2.3.3 qPCR反應體系 (1)引物濃度確定。qPCR正反向引物的使用濃度集中在0.1-1 μmol/L之間(表2),其中尤以0.1-0.2 μmol/L濃度使用較多,增加正反向引物的濃度,可提高檢測靈敏度,但同時也可導致非特異擴增現象的產生,因此引物濃度需經預實驗確定,一般起始濃度建議0.2 μmol/L。探針的濃度集中在0.1-0.5 μmol/L之間,其濃度也需預實驗確定,起始濃度建議0.1 μmol/L。(2)循環數設定。qPCR循環數集中在35 x-45 x之間(表2),循環數的增加也會導致非特異擴增現象,一般進行qPCR定量檢測結果統計時循環數在18-25之間,則數據分析結果比較可信,因此建議miRNA qPCR時的循環數設置在35x即可。(3)qPCR方法選擇。在miRNA進行qPCR檢測的眾多方法之中,何種是最好的尚無定論,從檢測特異性及實驗花費來說有相同的趨勢:特異探針法≥通用探針法≥Sybr green染料法,在實際操作中應結合實際情況綜合考慮。Adhikari等[47]比較poly(A)加尾法和stem-loop RT-PCR方法對于植物的miRNA檢測效果,認為由于植物miRNA的甲基化,導致stem-loop RT-PCR檢測方法比polyA加尾法更準確可信。Jung等[44]比較stem-loop RT-PCR時用通用探針獲得的qPCR檢測特異性和靈敏度與特異探針一致,但是通用探針可大幅降低實驗消耗費用。Varkonyi-Gasic等[45]比較認為stem-loop RT-PCR方法使用通用探針法檢測的特異性要優于Sybr green染料法。整體來說,poly(A)加尾法,操作過程較繁瑣,但是由于引入通用poly(A)尾,可使用通用反轉錄引物進行反轉錄,適合進行miRNA qPCR表達譜組學研究;stem-loop RT-PCR方法檢測靈敏度高,比較適合進行少數miRNA的特異檢測。如需同時檢測多個miRNA,可將這些miRNA的反轉錄引物混合反轉錄,但混合后可能會導致非特異擴增[43],因此在miRNA的反轉錄引物混合前最好通過預實驗確定這些引物混合的適用性。
2.3.4 其他qPCR檢測方法 (1)一步法qRT-PCR。Yan等[48]嘗試用一步法進行miRNA的qPCR檢測,該方法的原理是用一條反轉錄引物RT1將miRNA反轉錄為cDNA,用另一條引物RT2與cDNA模板結合并通過聚合酶延伸相互補齊,最后用P1與P2引物進行qPCR擴增,其中P1是RT1引入的結合位點,P2是RT2引入的結合位點。對于不同的miRNA其RT1與RT2引物均有部分與miRNA對應,因此這2條引物是特異的;P1與P2可根據需求使其變為通用引物或者miRNA特異引物。該方法的優點是一步完成qPCR檢測,減少操作步驟;其最大的缺點是4條引物在一起,可能導致非特異擴增。(2)鉗形探針法。Huang等[49]開發了一種鉗形探針方法(Prince probe)進行miRNA二步法qPCR檢測,其原理是用長鏈鉗形探針與miRNA配對,由于鉗形探針的5'端與3'端部分與miRNA完全互補配對,并且第一個堿基與最后一個堿基重疊同時利用反轉錄酶的活性特定,在40℃時5'端與miRNA完全互補配對,捕獲miRNA;溫度降低至25℃時,3'端與miRNA部分互補配對,實現miRNA的反轉錄;反轉錄產物即可用于qPCR擴增。該方法的靈敏度與特異性與stem-loop方法類似,但是其最大的優點在于可區分成熟miRNA及其前體。(3)數字PCR技術。數字PCR技術(digital PCR)是一項新的技術,目前已應用于進行miRNA的絕對定量檢測[50-52],該方法分4步完成,第一步將定量PCR技術的所使用的引物、探針或者染料(如Taqman探針或者EvaGreen染料)、特殊的數字PCR反應液混合均勻;第二步使用特殊的儀器及反應板制備微滴,10 000微滴以上,每一個微滴相當于一個單獨PCR反應;第三步將制備好含微滴的樣本轉入普通96孔PCR板并進行普通PCR擴增;第四步將PCR擴增產物使用特殊儀器進行熒光信號的檢測實現對基因的絕對定量。該技術最大的特點是儀器和試劑的改進導致可進行微量樣本的絕對定量檢測;其最大的缺點是須使用特殊的儀器、試劑、耗材,運行成本昂貴。
3 內參基因選擇
目前公認的理想內參基因需要符合以下幾個條件:在不同組織及不同生理條件下表達穩定;表達量較高,易于檢測;與目標基因有相似的性質,如目標基因與內參基因均為蛋白編碼基因或均為非編碼RNA等。其中第一條最重要也最難達到,不同物種不同生理條件下使用的內參基因各不相同(表3),即使被廣泛使用的內參基因Actin和GAPDH,在一定條件下,其表達會發生改變或受到其他基因的調控[69]。因此,對特定條件下的內參基因進行實驗篩選是一種嚴謹的做法,但要求每一位研究者對所使用的內參基因進行實驗測定也不現實。理論上不存在完全理想的內參基因,只能尋找相對表達穩定的基因,對于新鮮的組織及細胞樣本,用于miRNA檢測的常見內參基因是U6及5S;對于血樣,常見的內參基因是miR-16,借助外源加入其他物種的miRNA作內參,或者聯合使用多種內參基因(表3)。
4 結語
本文對目前所使用的miRNA qPCR定量檢測方法進行了總結,從RNA抽提,miRNA qPCR方法選擇,miRNA qPCR流程中的引物設計、模板濃度、引物濃度、循環數等反應條件設置,內參基因選擇等各方面進行了探討,并指出了在一般條件下進行實驗設計時的相應參數。miRNA qPCR技術今后的發展方向將是準確、易操作、所涉及到的試劑性價比高,如在不損失檢測靈敏度與特異性的條件下盡可能采用通用引物或者通用探針,在樣本量珍貴稀少時仍可準確檢測等。未來對于miRNA定量檢測的要求將會越發嚴格,包括樣本制備、抽提RNA質控、內參選擇、實驗重復性方面將會有越來越高的要求,這樣一方面可以保證實驗的可重復性,并提高不同研究者的實驗數據可比性;另一方面對研究者的實驗設計及實驗操作等方面提出了較高的要求,需要盡快適應。

表3 實驗所篩選的內參基因匯總
[1] Rana TM. Illuminating the silence:understanding the structure and function of small RNAs[J]. Nat Rev Mol Cell Biol, 2007, 8 (1):23-36.
[2] Schwarz DS, Zamore PD. Why do miRNAs live in the miRNP?[J]. Genes Dev, 2002, 16 (9):1025-1031.
[3] Kozomara A, Griffiths-Jones S. miRBase:annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Res, 2014, 42:D68-D73.
[4] Griffiths-Jones S, Saini HK, Van Dongen S, Enright AJ. miRBase:tools for microRNA genomics[J]. Nucleic Acids Res, 2008, 36:D154-D158.
[5] Lee RC, Feinbaum R, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5):843-854.
[6] Zeng Y, Cullen BR. Sequence requirements for micro RNA processing and function in human cells[J]. RNA, 2003, 9(1):112-123.
[7] Hartig JS, Grune I, Najafi-Shoushtari SH, et al. Sequence-specific detection of MicroRNAs by signal-amplifying ribozymes[J]. J Am Chem Soc, 2004, 126(3):722-723.
[8] Allawi HT, Dahlberg JE, Olson S, et al. Quantitation of microRNAs using a modified Invader assay[J]. RNA, 2004, 10(7):1153-1161.
[9] Babak T, Zhang W, Morris Q, et al. Probing microRNAs with microarrays:Tissue specificity and functional inference[J]. RNA, 2004, 10(11):1813-1819.
[10] Chen C, Ridzon DA, Broomer J, et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res, 2005,33(20):e179.
[11] Cummins JM, He Y, Leary RJ, et al. The colorectal microRNAome[J]. Proc Natl Acad Sci USA, 2006, 103(10):3687-3692.
[12] Kozomara A, Griffiths-Jones S. miRBase:annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Res, 2014, 42:D68-D73.
[13] Benes V, Castoldi M. Expression profiling of microRNA using realtime quantitative PCR, how to use it and what is available[J]. Methods, 2010, 50(4):244-249.
[14] Ding LF, Jiang Z, Chen QY, et al. A functional variant at miR-520a binding site in PIK3CA alters susceptibility to colorectal cancer in a Chinese Han population[J]. Biomed Res Int, 2015, clx.doi. org/10.1155/2015/373252.
[15] Chen R, Jiang N, Jiang Q, et al. Exploring microRNA-like small RNAs in the filamentous fungus Fusarium oxysporum[J]. PLoS One, 2014, 9(8):e104956.
[16] Halper B, Hofmann M, Oesen S, et al. Influence of age and physical fitness on miRNA-21, tgF-β and its receptors in leukocytes of healthy women[J]. Exec Intell Rev, 2015, 21:154-163.
[17] Tominaga N, Kosaka N, Ono M, et al. Brain metastatic cancer cells release microRNA-181c-containing extracellular vesicles capable of destructing blood-brain barrier[J]. Nat Commun, 2015, 6:6716. doi:10. 1038/ncomms7716. .
[18] Poudel S, Aryal N, Lu CF. Identification of microRNAs and transcript targets in Camelina sativa by deep sequencing and computational methods[J]. PLoS One, 2015, 10(3):e0121542.
[19] Cerdá-Olmedo G, Mena-Durán AV, Monsalve V, et al. Identification of a microRNA signature for the diagnosis of Fibromyalgia[J]. PLoS One, 2015, 10(3):e0121903.
[20] Lo YMD, Tsui NBY, Chiu RWK, et al. Plasma placental RNA allelic ratio permits noninvasive prenatal chromosomal aneuploidy detection[J]. Nat Med, 2007, 13(2):218-223.
[21] Sarrion I, Milian L, Juan G, et al. Role of Circulating miRNAs as biomarkers in idiopathic pulmonary arterial hypertension:possible relevance of miR-23a[J]. Oxid Med Cell Longev, 2015, 2015:792846.
[22] Ho YK, Xu WT, Too HP. Direct quantification of mRNA and miRNA from cell lysates using reverse transcription real time PCR:a multidimensional analysis of the performance of reagents and workflows[J]. PLoS One, 2013, 8(9):e72463.
[23] Tzimagiorgis G, Michailidou EZ, Kritis A, et al. Recovering circulating extracellular or cell-free RNA from bodily fluids[J]. Cancer Epidemiol, 2011, 35(6):580-589.
[24] Wakabayashi K, Mori F, Kakita A, et al. Analysis of microRNA from archived formalin-fixed paraffin-embedded specimens of amyotrophic lateral sclerosis[J]. Acta Neuropathol Commun,2014, 2(1):173.
[25] Pan LJ, Huang SN, He RQ, et al. Decreased expression and clinical significance of miR-148a in hepatocellular carcinoma tissues[J]. Eur J Med Res, 2014, 19(1):68.
[26] Doleshal M, Magotra AA, Choudhury B, et al. Evaluation and validation of total RNA extraction methods for microRNA expression analyses in formalin-fixed, paraffin-embedded tissues[J]. J Mol Diagn, 2008, 10(3):203-211.
[27] Reiche M, Li YJ, Li JY et al. Inhibiting plant microRNA activity:molecular SPONGEs, target MIMICs and STTMs all display variable efficacies against target microRNAs[J]. Plant Biotechnol J,2015, 13(7):915-926.
[28] Yin FQ, Qin C, Gao J, et al. Genome-wide identification and analysis of drought-responsive genes and microRNAs in tobacco[J]. Int J Mol Sci, 2015, 16(3):5714-5740.
[29] Wang YL, Zhao ZL, Deng MJ, et al. Identification and functional analysis of microRNAs and their targets in Platanus acerifolia under lead(Pb)stress[J]. Int J Mol Sci, 2015, 16(4):7098-7111.
[30] Zhou J, Cheng Y, Yin M, et al. Identification of Novel miRNAs and miRNA expression profiling in wheat hybrid necrosis[J]. PLoS One, 2015, 10(2):e0117507.
[31] Yu R, Wang Y, Xu L et al. Transcriptome profiling of root micro-RNAs reveals novel insights into taproot thickening in radish(Raphanus sativus L. )[J], BMC Plant Biol, 2015, 15(1):30.
[32] Peng J, Xia ZH, Chen L, et al. Rapid and efficient isolation of high-quality small RNAs from recalcitrant plant species rich in polyphenols and polysaccharides[J]. PLoS One, 2014, 9(5):e95687.
[33] Becker C, Hammerle-Fickinger A, Riedmaier I, et al. mRNA and microRNA quality control for RT-qPCR analysis[J]. Methods,2010, 50(4):237-243.
[34] Shi R, Chiang VL. Facile means for quantifying microRNA expression by real-time PCR[J]. Biotechniques, 2005, 39(4):519-524.
[35] Ro S, Park C, Jin JL, et al. A PCR-based method for detection and quantification of small RNAs[J]. Biochem Biophys Res Commun, 2006, 351(3):756-763.
[36] Mishim T, Mizuguchi Y, Kawahigashi Y, et al. RT-PCR-based analysis of microRNA(miR-1 and -124)expression in mouse CNS[J]. Brain Res, 2007, 1131(1):37-43.
[37] Reichenstein I, Aizenberg N, Goshen M, et al. A novel qPCR assay for viral encoded microRNAs[J]. J Virol Methods, 2010, 163(2):323-328.
[38] Luo X, Zhang J, Wang HJ, et al. PolyA RT-PCR-based quantification of microRNA by using universal TaqMan probe[J]. BiotechnolLett, 2012, 34(4):627-633.
[39] Kang K, Zhang XY, Liu HT, et al. A novel real-time PCR assay of microRNAs using SPoly(T), a specific oligo(dT)reverse transcription primer with excellent sensitivity and specificity[J]. PLoS One, 2012, 7(11):e48536.
[40] Raymond CK, Roberts BS, Garrett-engele P, et al. Simple,quantitative primer-extension PCR assay for direct monitoring or microRNAs and short-interfering RNAs[J]. RNA, 2005, 11(11):1737-1744.
[41] Wang XW. A PCR-based platform for microRNA expression profiling studies[J]. RNA, 2009, 15(4):716-723.
[42] Wan GQ, Lim QE, Too HP. High-performance quantification of mature microRNAs by real-time RT-PCR using deoxyuridineincorporated oligonucleotides and hemi-nested primers[J]. RNA, 2010, 16(7):1436-1445.
[43] Lao KQ, Xu NL, Yeung V, et al. Multiplexing RT-PCR for the detectio n of multiple miRNA species in small samples[J]. Biochem Biophys Res Commun, 2006, 343(1):85-89.
[44] Jung U, Jiang XO, Kaufmann SHE, et al. A universal TaqManbased RT-PCR protocol for cost-efficient detection of small noncoding RNA[J]. RNA, 2013, 19(12):1864-1873.
[45] Varkonyi-Gasic E, Wu RM, Wood M, et al. Protocol:a highly sensitive RT-PCR method for detection and quantification of microRNAs[J]. Plant Methods, 2007, 3:12.
[46] Sharbati-Tehrani S, Kutz-Lohroff B, Bergbauer R, et al. miR-Q:a novel quantitative RT-PCR approach for the expression profiling of small RNA molecules such as miRNAs in a complex sample[J]. BMC Mol Biol, 2008, 9:34.
[47] Adhikari S, Turner M, Subramanian S. Hairpin priming is better suited than in vitro Polyadenylation to generate cDNA for plant miRNA qPCR[J]. Mol Plant, 2013, 6(1):229-231.
[48] Yan JL, Zhang N, Qi C, et al. One-step real time RT-PCR for detection of microRNAs[J]. Talanta, 2013, 110:190-195.
[49] Huang TH, Yang J, Liu GP, et al. Quantification of mature micro-RNAs using pincer probes and real-time PCR amplification[J]. PLoS One, 2015, 10(3):e0120160.
[50] Faragó N, Kocsis áK, Lovas S, et al. Digital PCR to determine the number of transcripts from single neurons after patch-clamp recording[J]. Biotechniques, 2013, 54(6):327-336.
[51] Miotto E, Saccenti E, Lupini L, et al. Quantification of circulating miRNAs by droplet digital PCR:comparison of EvaGreen- and TaqMan-based chemistries[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(12):2638-2642.
[52] Li N, Ma J, Guarnera MA, et al. Digital PCR quantification of miRNAs in sputum for diagnosis of lung cancer[J]. J Cancer Res Clin Oncol, 2014, 140(1):145-150.
[53] Davoren PA, McNeill RE, Lowery AJ, et al. Identification of suitable endogenous control genes for microRNA gene expression analysis in human breast cancer[J]. BMC Mol Biol, 2008, 9:76.
[54] Ratert N, Meyer HA, Jung M, et al. Reference miRNAs for miRNAom e Analysis of urothelial carcinomas[J]. PLoS One,2012, 7(6):e39309.
[55] Wotschofsky Z, Meyer HA, Jung M, et al. Reference genes for the relative quantification of microRNAs in renal cell carcinomas and their metastases[J]. Anal Biochem, 2011, 417(2):233-241.
[56] Sanders I, Holdenrieder S, Walgenbach-Brünagel G, et al. Evaluation of reference genes for the analysis of serumn miRNA in patients with prostate cancer, bladder cancer and renal cell carcinoma[J]. Int J Urol, 2012, 19(11):1017-1025.
[57] Song JN, Bai ZG, Han W, et al. Identification of suitable reference genes for qPCR analysis of serum microRNA in gastric cancer patients[J]. Dig Dis Sci, 2012, 57(4):897-904.
[58] Zheng G, Wang H, Zhang X, et al. Identification and validation of reference genes for qPCR detection of serum microRNAs in colorectal adenocarcinoma patients[J]. PLoS One, 2013, 8(12):e83025.
[59] Li Y, Zhang LQ, Liu F et al. Identification of endogenous controls for analyzing serum exosomal miRNA in patients with hepatitis B or hepatocellular carcinoma[J]. Dis Markers, 2015, 893594 doi:10.1155/20151893594.
[60] Zhu HT, Dong QZ, Wang G, et al. Identification of suitable reference genes for qRT-PCR analysis of circulating microRNAs in hepatitis B virus-infected patients[J]. Mol Biotechnol, 2012, 50(1):49-56.
[61] Jurcevic S, Olsson B, Klinga-Levan K. Validation of suitable endogenous control genes for quantitative PCR analysis of microRNA gene expression in a rat model of endometrial cancer[J]. Cancer Cell Int, 2013, 13(1):45.
[62] Tea M, Michael MZ, Brereton HM, et al. Stability of small non-coding RNA reference gene expression in the rat retina during exposure to cyclic hyperoxia[J]. Mol Vis, 2013, 19:501-508.
[63] Wang Y, Tang NP, Hui TT, et al. Identifi cation of endogenous reference genes for RT-qPCR analysis of plasma microRNAs levels in rats with acetaminophen-induced hepatotoxicity[J]. J Appl Toxicol, 2013, 33(11):1330-1336.
[64] Giu Y, Li M, Zhang K, et al. Identification of suitable endogenous control microRNA genes in normal pig tissues[J]. Anim Sci J,2011, 82(6):722-728.
[65] Wessels JM, Edwards AK, Zettler C, et al. Selection and validation of reference genes for miRNA expression studies during porcine pregnancy[J]. PLoS One, 2011, 6(12):e28940.
[66] Li J, Wei HX, Li Y, et al. Identification of a suitable endogenous control gene in porcine blastocysts for use in quantitative PCR analysis of microRNAs[J]. Sci China Life Sci, 2012, 55(2):126-131.
[67] Li D, Liu H, Li Y, et al. Identification of suitable endogenous control genes for quantitative RT-PCRanalysis of miRNA in bovine solid tissues[J]. Mol Biol Rep, 2014, 41(10):6475-6480.
[68] Johansen I, Andreassen R. Validation of miRNA genes suitable as reference genes in qPCR analyses of miRNA gene expression in Atlantic salmon(Salmo salar)[J]. BMC Res Notes, 2014, 7:945.
[69] Kou SJ, Wu XM, Liu Z, et al. Selection and validation of suitable reference genes for miRNA expression normalization by quantitative RT-PCR in citrus somatic embryogenic and adult tissues[J]. Plant Cell Rep, 2012, 31(12):2151-2163.
[70] Lin YL, Lai ZX. Evaluation of suitable reference genes for normaliza tion of microRNA expression by real time reverse transcription PCR analysis during longan somatic embryogenesis[J]. Plant Physiol Biochem, 2013, 66:20-25.
[71] Ferdous J, Li Y, Reid N, et al. Identification of reference genes for quantitative expression analysis of microRNAs and mRNAs in barley under various stress conditions[J]. PLoS One, 2015, 10(3):e0118503.
[72] Sikand K, Singh J, Ebron JS, et al. Housekeeping gene selection advisory:glyceraldehyde-3-phosphate dehydrogenase(GAPDH)and b -Actin are targets of miR-644a[J]. PLoS One, 2012, 7(10):e47510.
(責任編輯 狄艷紅)
Research Advance on miRNA qPCR Methods and Its Application
FENG Shi-peng
(Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresource,College of Agriculture,Hainan University,Haikou 570228)
miRNA is one of the hottest research fields in the world. The detection of miRNA expression is the fundamental content in miRNA research. Due to the feature of miRNAs being short and small, varied methods were developed, and quantitative miRNA qPCR is the most widely used one. This paper reviews the developments of miRNA extraction method, quantitative detection principle of miRNA qPCR,primer design, the reaction condition, and reference gene selection. The developments of miRNA qPCR methods in the future are also discussed. All of these may provide a reference for researchers in the field when they detect miRNA by qPCR method.
miRNA;stem-loop RT-PCR;poly(A)tailing RT-PCR;extension RT-PCR;digital PCR
10.13560/j.cnki.biotech.bull.1985.2016.02.008
2015-04-30
國家自然科學基金項目(31460178),海南省自然科學基金項目(314042),海南省教育廳項目(HNKY2014-16),海南大學科研啟動項目(kyqd1306)
馮世鵬,男,博士,講師,研究方向:miRNA功能與作用機制;E-mail:feng_shipeng@hainu.edu.cn

