陸地棉GhPYR1基因的克隆和功能分析
劉妍 孟志剛 孫國清 王遠 周燾 郭三堆 張銳
(中國農業科學院生物技術研究所,北京 100081)
陸地棉GhPYR1基因的克隆和功能分析
劉妍 孟志剛 孫國清 王遠 周燾 郭三堆張銳
(中國農業科學院生物技術研究所,北京 100081)
植物激素脫落酸(Abscisic acid,ABA)在植物應對干旱、鹽堿等逆境脅迫以及植物種子萌發、根伸長、芽休眠等階段發揮重要作用。PYR/PYL/RCAR蛋白家族是ABA受體,與ABA結合后能夠啟動ABA信號傳導通路,誘導ABA應答基因的表達。利用電子克隆和RT-PCR技術從陸地棉中克隆了GhPYR1基因,其編碼的GhPYR1蛋白與擬南芥中AtPYR1蛋白相似度為73%。將GhPYR1蛋白序列與擬南芥14個PYR/PYL/RCAR家族成員蛋白序列進行比對并構建進化樹,發現它與擬南芥PYR/PYL/RCAR蛋白亞家族III親緣關系最近。過表達GhPYR1基因的T3代擬南芥在外源ABA處理下,其種子萌發和初期根生長均滯后于野生型,表現出對ABA更加敏感;高鹽和干旱脅迫對轉基因種子的萌發抑制更強烈,但苗期脅迫處理下轉基因擬南芥的長勢卻明顯優于野生型;同時在外源ABA誘導條件下ABA應答基因RD29A、RAB18的表達量較野生型有明顯提高。以上結果說明GhPYR1基因編碼的蛋白是ABA的受體,過表達該基因能夠提高植物對ABA的敏感性和增強應對逆境脅迫的能力。
陸地棉;GhPYR1基因;生物信息學分析;生理功能分析
植物激素脫落酸(Abscisic acid,ABA),在植物應對干旱、鹽堿等非生物脅迫及植物種子成熟、休眠等發育過程中發揮著重要作用[1,2]。2009年,Ma和Park[3,4]兩個實驗團隊分別通過遺傳篩選和酵母雙雜交的方法,在擬南芥中證實了PYR/ PYL/RCAR蛋白是ABA的受體。擬南芥中該家族有14個成員,分別命名為PYR1和PYL1-13,它們都是可溶性蛋白質,含有START(STAR-RELATED LIPID-TRANSFER)特征區域的蛋白質,分布于細胞質和細胞核內[5]。PYR/PYL/RCAR家族蛋白是ABA信號通路的起點,而ABA信號通路是一個雙重負調控系統[6,7],核心組分除PYR/PYL/RCAR外,還包括PP2Cs、SnRK2s。在通常情況下,未結合ABA的PYR/PYL/RCAR蛋白不與PP2C互作,PP2C通過解磷酸化抑制SnRK2的活性。當應答來自環境或發育的信號時,植物體內ABA的含量增加,并與PYR/PYL/RCAR結合使其發生變構[8-10],然后與PP2C互作,抑制PP2C的磷酸酶活性[3,4],從而使SnRK2被激活,活化的SnRK2磷酸化下游的轉錄因子[11,12],啟動ABA應答基因RD29A、RAB-18[13,14]等的表達。繼擬南芥之后,其他高等植物,如玉米、大豆、水稻、草莓、青蒿等[15-18]的ABA受體研究也逐步展開,結果表明,在這些作物中過表達PYR/PYL/RCAR家族基因成員,能夠提高轉基因作物對ABA的敏感性、抗旱性和促進果實成熟等。
本研究克隆了陸地棉中GhPYR1基因全長,構建了過表達載體,獲得了過表達GhPYR1基因的T3代擬南芥,并初步鑒定轉GhPYR1基因的擬南芥在種子萌發、根生長期間對ABA、鹽堿和干旱的敏感性以及苗期耐逆性和ABA應答基因的表達情況,旨在為解析ABA通路與植物逆境脅迫應答的關系提供依據。
1 材料與方法
1.1 材料
1.1.1 植物材料 陸地棉Gossypium hirsutum L. Y18、擬南芥Columbia Col-0由本實驗室保存。
1.1.2 載體和菌株 Gateway入門載體Hbskb1-HI-380、Gateway目的載體pEarelyGate330、農桿菌GV3101感受態均由本實驗室保存;大腸桿菌Trans-T1感受態和克隆載體pEASYTM-Blunt Zero購于北京全式金生物技術有限公司。
1.1.3 儀器與試劑 熒光定量PCR儀(Bio-Rad公司chromo4);原平皓公司RNA提取試劑盒;東洋紡公司ReverTra Ace反轉錄試劑盒;天根公司Fast HiFidelity PCR Kit;Promega公司GoTag qPCR Master Mix;Invitrogen公司 Gateway LR Clonase ⅡEnzyme Mix;各化學試劑均購于Sigma公司。
1.2 方法
1.2.1 DNA的提取和cDNA和合成 以陸地棉Y18葉片為材料,使用改良的CTAB法提取棉花的基因組DNA;RNA的提取過程參照EASYspin RNA提取試劑盒,提取的RNA用ReverTra Ace反轉錄試劑盒反轉錄成cDNA。反應體系20 μL:先將RNA 11 μL、Oligo(dT)201 μL混合后,65℃ 5 min;再加入5×RT Buffer 4 μL、RNase inhibitor(10 U/μL)1 μL、ReverTra Ace 1 μL、dNTP Mix(10 mmol/L)2 μL。反應條件:42℃ 30 min,99℃ 5 min,4℃ 5 min。

表1 引物序列表
1.2.2 陸地棉GhPYR1基因編碼區的克隆 因為雷蒙德氏棉的祖先被公認為是陸地棉(Gossypium hirsutum)D亞基因組的供體,所以在陸地棉基因組尚未公布的前提下,本研究以雷蒙德氏棉(Gossypium raimondii)的基因組序列為參考,以AtPYR1基因序列Blast雷蒙德氏棉基因組數據庫,并結合開放閱讀框預測工具ORF Finder 預測得到可能的GrPYR1基因的編碼序列。在基因編碼區兩側設計引物GhPYR1F/R(表1),以陸地棉DNA和cDNA為模板進行PCR擴增。擴增體系為50 μL:Fast HiFidelity Polymerase 1 μL、5×Fast HiFidelity PCR Buffer 10 μL、10 mmol/L上下游引物各2 μL、模板DNA/cDNA 2 μL、ddH2O 33 μL。PCR反應程序為:94℃預變性5 min;94℃變性30 s,58℃退火30 s,72℃延伸30 s,30個循環;最后72℃延伸10 min。回收純化PCR產物與克隆載體pEASYTM-Blunt Zero連接并轉入大腸桿菌感受態Trans-T1,挑取克隆子用GhPYR1F/R引物進行菌落PCR檢測,將陽性克隆子送北京擎科新業生物技術有限公司進行測序。
1.2.3 GhRYR1基因的序列分析 將GhPYR1基因編碼的蛋白序列Blast Swiss-Prot蛋白數據庫;利用MEGA 5.0將GhPYR1和AtPYR1、AtPYL1-13蛋白序列進行比對,構建NJ系統進化樹;利用Protparam tool(http://web.expasy.org/protparam/)在線程序對GhPYR1的基本性質進行分析。利用在線程序PSORT(http://psort.hgc.jp/form.html)進行亞細胞定位預測。
1.2.4 過表達載體的構建 在GhPYR1基因編碼序列的5'和3'端分別加上NotⅠ和SbfⅠ兩個酶切位點,PCR擴增獲得目的條帶,回收后連接到到pEASYTM-Blunt Zero克隆載體上,測序正確后與Gateway入門載體Hbskb1-HI-380同時進行NotⅠ/ SbfⅠ雙酶切,回收目的片段經T4連接酶連接后構建GhPYR1-380入門載體。然后通過Gateway LR反應構建過表達載體,反應體系5 μL:入門載體GhPYR1-380 1 μL、目的載體pEarlyGate330 3 μL、Gateway LR Clonase Ⅱ Enzyme Mix 1 μL,輕輕混勻后,25℃孵育6 h后加1 μL Proteinase K Solution 1 μL結束反應。產物轉化大腸桿菌Trans-T1感受態,進行菌落PCR和測序鑒定,獲得陽性克隆子,成功構建植物表達載體pOEGhPYR1。
1.2.5 擬南芥轉化和鑒定 將表達載體pOEGhPYR1通過熱激法轉化農桿菌GV3101感受態細胞,將鑒定為陽性的農桿菌通過蘸花法轉化野生型擬南芥植株。將T1代擬南芥種子在含50 mg/L 卡那霉素的MS固體培養基上進行篩選,提取 T1代抗性植株的DNA進行PCR鑒定,為保證檢測的正確性,每個抗性植株分別用兩對引物進行鑒定,一對特異擴增GhPYR1基因,另一對特異擴增部分CaMV 35S 啟動子和GhPYR1基因,引物序列見表1。收獲PCR鑒定為陽性的T1代植株種子,經T2代繁殖及進一步抗性篩選最終獲得純合T3代株系,并對T2、T3代轉基因株系進行PCR鑒定。
1.2.6 轉基因植株的生理實驗分析 為了分析種子萌發時轉基因擬南芥對ABA、高鹽及干旱的反應情況,將野生型和轉基因植株的種子分別播種到MS及分別含0.5 μmol/L ABA、200 mmol/L甘露醇、100 mmol/L NaCl的MS固體培養基上。每種培養基上,野生型和轉基因植株的3個株系分別點40-50粒種子,每種處理做3個重復。然后4℃冰箱黑暗春化3 d,于氣候培養箱23℃/20℃,16 h光照/8 h黑暗條件下萌發5 d后進行拍照和種子萌發率的統計分析。
為了分析外源ABA、高鹽及干旱條件下轉基因擬南芥根生長初期的生長情況,首先將WT、OEGhPYR1-1、OEGhPYR1-2在MS上萌發7 d,7 d后將植株轉移至含5 μmol/L ABA、200 mmol/L甘露醇、100 mmol/L NaCl的MS固體培養基上繼續培養,7 d后進行拍照并統計根長。
1.2.7 ABA應答基因的表達分析 將在MS培養基上生長10 d的野生型和轉基因型擬南芥幼苗用10 μmol/L ABA 處理3 h。收集ABA處理前和ABA處理后的擬南芥材料后液氮速凍。提取擬南芥的RNA并反轉錄為cDNA作為模板。通過實時定量PCR進行ABA應答基因RD29A、RAB18的表達量分析,內參對照選擇擬南芥GAPDH基因。本實驗所用引物見表1。反應體系20 μL:GoTag qPCR Master Mix(2×)10.0 μL、cDNA 2 μL、上下游引物(10 μmol/L)各0.4 μL、ddH2O 7.2 μL,每次實驗設定3個重復。反應程序為:98℃ 2 min;98℃ 15 s,60℃ 15 s,72℃ 30 s,40個循環。統計每個反應的熒光強度達到閾值時對應的循環數(Ct)。目的基因相對于內參基因的相對表達量用2-△△Ct法計算。
2 結果
2.1 GhPYR1基因克隆、序列分析及載體構建
分別以陸地棉DNA和cDNA為模板進行PCR擴增,均獲得大小約600 bp左右、單一、清晰的條帶(圖1-A和B)。測序結果顯示,擴增產物長618 bp,編碼205個氨基酸殘基,ORF區無內含子。將GhPYR1基因序列Blast陸地棉基因組,結果顯示GhPYR1基因在陸地棉A基因組和D基因組的第3號染色體上各有一個拷貝,說明克隆得到GhPYR1基因。將GhPYR1序列Blast Swiss-Prot數據庫,顯示GhPYR1具有PYR/PYL/RCAR蛋白家族的特征結構域(圖2-A),且與擬南芥AtPYR1有最高相似度,為73%(圖2-B)。

圖1 GhPYR1基因的克隆及載體
利用MEGA 5.0軟件分析GhPYR1和擬南芥中14個PYR/PYL/RCAR家族成員,并進行NJ進化樹分析,結果(圖3)表明,擬南芥的PYR/PYL/ RCAR家族被分成了3個亞家族,而GhPYR1與擬南芥第Ⅲ亞家族的親緣關系最近。利用Protparam tool在線程序分析GhPYR1的基本性質,結果表明,其由205個氨基酸殘基組成,蛋白分子式為C1001H1584N280O318S7,分子量為22853.6 Da,等電點pI為5.47,親水性平均數為-0.364,屬于水溶性蛋白。利用在線程序PSORT預測GhPYR1的亞細胞定位特性,結果表明GhPYR1定位于細胞質的分值為0.65,而定位于葉綠體基質、葉綠體類囊體膜、葉綠體類囊體間隙的分值均為0.2,因此推測GhPYR1主要分布于細胞質中。
將GhPYR1基因首先克隆到pEASYTM-Blunt Zero載體上,隨后經NotⅠ和SbfⅠ雙酶切與載體Hbskb1-HI-380連接,構建成功GhPYR1-380入門載體(圖1-C和D)。最后入門載體GhPYR1-380與目的載體pEarelyGate330在定量后進行LR反應,構建成功表達載體pOEGhPYR1(圖1-E和F)。
2.2 轉GhPYR1基因擬南芥獲得
將pOEGhPYR1載體轉化農桿菌,PCR鑒定(圖4-A)為陽性后,利用蘸花法轉化野生型擬南芥,T1代轉基因擬南芥PCR鑒定結果如圖4-B所示。每個抗性植株分別用兩對引物進行鑒定,產物大小分別為615 bp和826 bp,野生型受體擬南芥無特異擴增。經鑒定最終獲得T1代轉株GhPYR1基因擬南芥陽性植株39株。收獲T2代擬南芥種子進行篩選后得到各個株系的擬南芥單株,經PCR鑒定(圖4-C)后進行繁代,收獲得到T3代種子后進行抗性篩選,選擇在篩選平板上不分離的株系進行PCR鑒定后(圖4-D),最終獲得3個純合轉基因株系,分別命名為OEGhPYR1-1、OEGhPYR1-2、OEGhPYR1-3。

圖2 GhPYR1蛋白Blast NCBI Swiss-Prot結果

圖3 GhPYR1與擬南芥14個PYR/PYL/RCAR蛋白的進化樹分析
2.3 轉GhPYR1基因擬南芥的生理鑒定
2.3.1 T3代轉GhPYR1基因擬南芥的種子萌發實驗 以野生型擬南芥為對照,在MS和分別含0.5 μmol/L ABA、100 mmol/L NaCl、200 mmol/L 甘露醇的MS固體培養基上進行轉基因擬南芥種子萌發實驗,結果如圖5所示。圖5-A顯示,在MS培養基上,野生型和轉基因型擬南芥表現一致,均能正常萌發,長出綠色的子葉,萌發率在95%-98%之間(表2);而在含0.5 μmol/L ABA MS的培養基上,轉基因擬南芥和野生型之間表型表現出顯著差異,野生型種子大多數能正常萌發,并長出綠色的子葉,5 d萌發率在90%以上,3個轉基因株系則表現為萌發滯后,同期觀察長出綠色子葉的種子數量很少,萌發率在75%-87%之間(圖5-B,表2),野生型和轉基因株系間存在極顯著差異(圖6)。在含100 mmol/L NaCl的培養基上,所有擬南芥的萌發率都下降,但野生型相對下降幅度較小,5 d萌發率仍維持在80%以上,3個轉基因株系則大幅度下降,5 d萌發率僅有5%-8%左右(圖5-C,表2),野生型和轉基因株系間存在極顯著差異(圖6)。類似地,在含200 mmol/L 甘露醇培養基上,3個轉基因株系的5 d萌發率下降至6%-14%(圖5-D,表2),與野生型之間同樣表現出極顯著差異(圖6)。干旱、高鹽等生理逆境會引起細胞內脫水[19]進而植物通過增加ABA的合成和ABA代謝的調整使得植物體內ABA的含量上升[20],上述結果表明,轉GhPYR1基因擬b .5 b .5南芥植株比野生型對ABA更敏感,而ABA含量的增加,無論是外源的,還是內源的,都會影響擬南芥種子的萌發,使其萌發率下降,萌發期滯后。
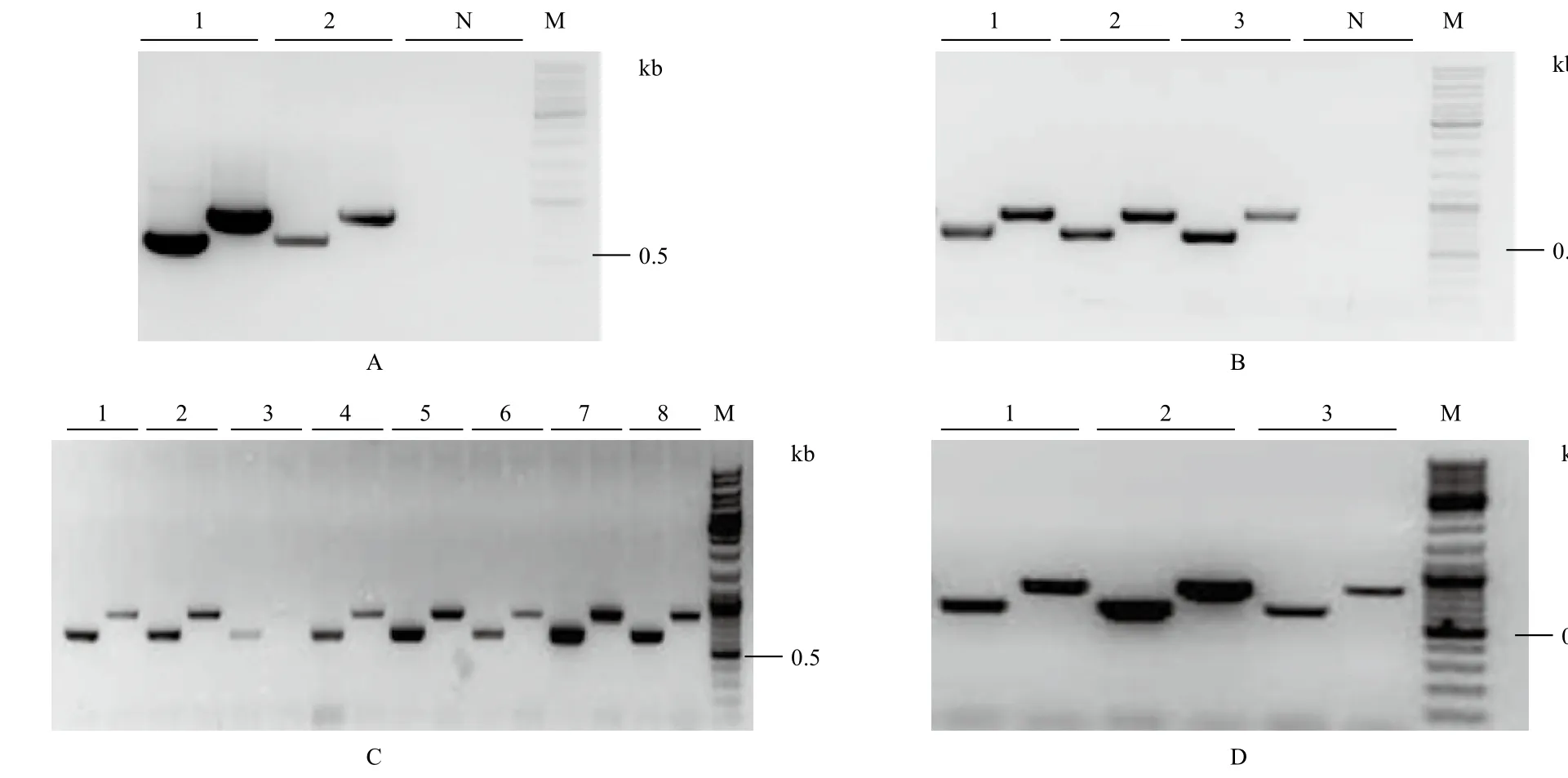
圖4 農桿菌及轉基因擬南芥的鑒定

圖5 T3代轉GhPYR1基因擬南芥的種子萌發實驗

圖6 不同處理下野生型和轉基因型擬南芥的萌發率
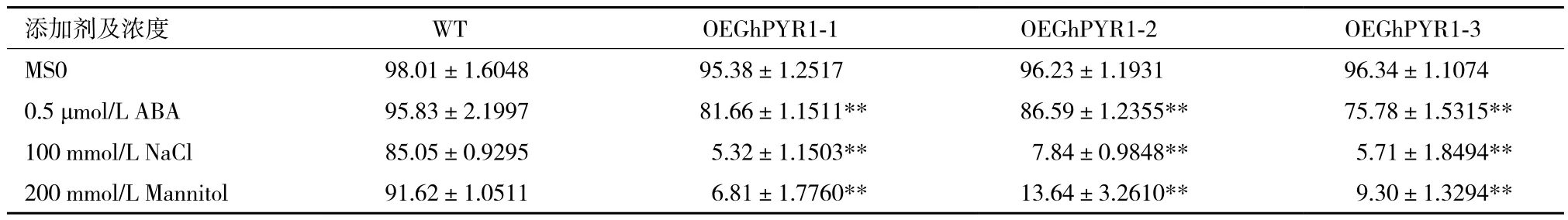
表2 不同處理下野生型和轉基因型擬南芥萌發率/%
2.3.2 轉GhPYR1基因擬南芥苗期耐逆實驗 擬南芥在MS平板上萌發生長7 d后,轉移至分別含5 μmol/L ABA、100 mmol/L NaCl、200 mmol/L甘露醇的MS固體培養基上繼續培養7 d,生長狀況如圖7-9圖所示。在5 μmol/L 外源ABA處理下(圖7-A),轉GhPYR1基因的擬南芥植株的平均根長不足5 cm,而野生型擬南芥的平均根長在6.5 cm以上,極顯著于轉基因擬南芥(圖7-B)。這一結果表明ABA具有抑制擬南芥根生長的特性,而且,轉基因擬南芥的根生長被抑制程度更深,說明轉基因擬南芥比野生型對ABA更加敏感。

圖7 苗期野生型和轉基因擬南芥在外源ABA條件下生長情況
在100 mmol/L NaCl處理下,轉GhPYR1基因的擬南芥植株生長狀況優于野生型(圖8-A),轉基因擬南芥的平均根長在4.4 cm以上,而野生型的在3.7 cm左右,顯著短于轉基因擬南芥(圖8-B)。結果表明,在種子萌發后期根的生長過程中,過表達GhPYR1基因的擬南芥較野生型更能適應高鹽環境。同樣地,在模擬干旱條件下,GhPYR1基因過表達植株根的生長優于野生型(圖9-A),轉基因擬南芥的平均根長在6.8 cm以上,而野生型的根長在6.0 cm左右,差異極顯著于轉基因擬南芥(圖9-B)。上述結果表明,100 mmol/L NaCl和200 mmol/L甘露醇均為擬南芥苗期生長的逆境,會抑制擬南芥的生長,但轉基因擬南芥相對生長狀況要優于野生型,說明轉基因擬南芥具有較強的耐逆性。

圖8 苗期野生型和轉基因擬南芥在高鹽條件下生長情況
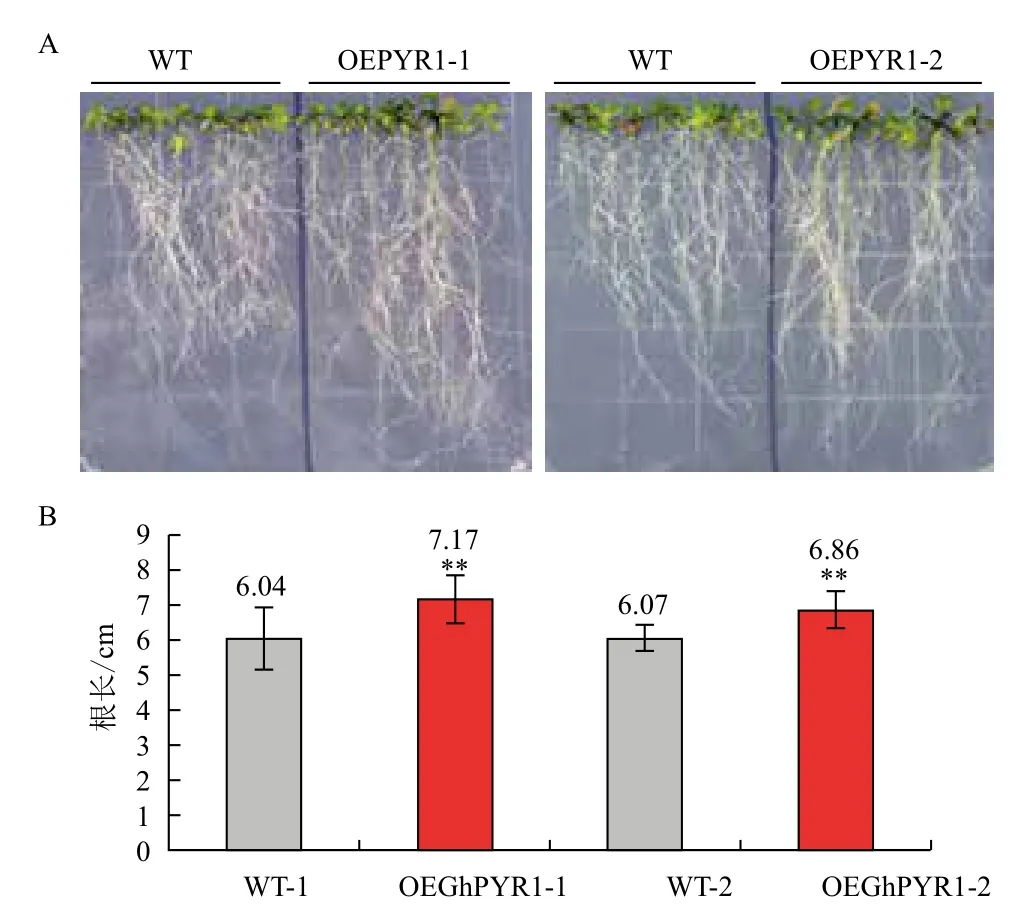
圖9 苗期野生型和轉基因擬南芥在模擬干旱條件下的生長情況
2.4 ABA應答基因的表達分析
為了探明ABA與受體結合后,是否能啟動下游應答基因的表達,利用qRT-PCR的方法,分析了在外源ABA處理前和處理后,野生型和轉GhPYR1基因擬南芥中ABA應答基因RD29A和RAB18B的表達量變化,結果如圖10所示。在ABA處理前,轉GhPYR1基因的擬南芥中RA29A基因的表達量略高于野生型,是野生型的1.81倍,RAB18基因的表達量略低于野生型,無明顯差異;在ABA處理后,轉GhPYR1基因的擬南芥和野生型中,RD29A基因的表達量都有所增加,野生型中增加了20%,而轉基因中增加了622%,達到處理前野生型的8.08倍;類似地,RAB18基因的表達量在處理后的野生型和轉GhPYR1基因擬南芥中均有所增加,在野生型中增加了56%,在轉基因中增加了457%,達到處理前野生型的5.38倍。這些結果表明,在轉GhPYR1基因的擬南芥中,ABA通路的活性要高于野生型,特別是經ABA處理后,活性大幅提升,應答基因大量表達,以使植物應對干旱、高鹽等逆境。

圖10 野生型和轉基因型擬南芥中ABA應答基因表達量比較
3 討論
ABA通路在植物應對干旱、鹽堿等非生物脅迫及植物種子成熟、休眠等發育過程中發揮著重要的作用。植物遭遇干旱、鹽堿等逆境脅迫時,體內ABA含量增加,ABA受體通過與ABA結合感知這一信號,從而激活ABA通路,提高植物體內耐逆相關基因表達,從而使植物度過逆境脅迫期。因此,提高植物對ABA信號的敏感性,有助于植物對逆境脅迫作出快速及時的反應,提高植物的抗逆性。
本研究通過同源克隆的方法,從陸地棉中克隆了GhPYR1基因。該基因在陸地棉中只有一個外顯子,ORF長618 bp,編碼205個氨基酸殘基,編碼序列含有PYR/PYL/RCAR蛋白家族的特征結構域,與擬南芥中AtPYR1蛋白相似度為73%,與擬南芥中的AtPYR1、AtPYL1、AtPYL2及AtPYL3關系最近,同屬于第Ⅰ亞家族,亞細胞定位預測其最可能分布于細胞質。過表達GhPYR1基因的擬南芥在添加外源ABA的情況下表現出種子休眠期延長,萌發滯后,苗期生長發育遲緩的現象,說明其對ABA的敏感性增強,這一結果和在擬南芥中過表達青蒿的PYR/PYL/RCAR家族基因AaPYL9,提高了轉基因擬南芥種子在萌發時對ABA的敏感性[17]相一致。
種子萌發包括吸脹、萌動和萌發等連續的生理過程,是一個需水較多的生理時期。干旱、鹽堿等逆境,由于缺水會抑制種子萌發,導致萌發滯后等現象發生,這是植物的一種自我保護手段,而ABA通路應該是參與這一自我保護調控過程的主要因子。干旱、鹽堿等逆境會誘導植物體內ABA含量增加,從而激活和增強ABA通路,引起下游耐逆基因的大量表達,同時抑制萌動、萌發等相關基因的表達。本研究中擬南芥種子萌發時添加外源ABA的實驗,證實了植物在種子萌發期對ABA信號的應答,擬南芥將環境中ABA含量升高這一現象,解讀為存在干旱、鹽堿等逆境,從而啟動植物體內的逆境應答反應,而不是正常狀態下的萌發,因而出現了和干旱、鹽堿狀態下相似的表型。過表達GhPYR1基因的擬南芥,因為對ABA的信號更加敏感,所以在相同濃度的外源ABA或逆境條件下,其種子的萌發被抑制得更為強烈。
在植物生長期,ABA通路是植物應對逆境的主要信號通路。本研究對苗期的擬南芥進行干旱和高鹽處理,轉基因擬南芥表現出更好的生長勢即說明了這一點,因為在轉基因擬南芥中,ABA通路被激活的程度,要數倍強于野生型在同等條件下被激活的程度。RD29A基因的表達量,在逆境下野生型只增加20%,而在轉基因擬南芥中卻增加了622%,達到處理前野生型的8.08倍;RAB18B基因的表達量,在逆境下野生型中增加56%,而在轉基因中則增加了457%,是處理前野生型的5.38倍。也正因為轉基因擬南芥對ABA更敏感,所以在只添加ABA的模擬逆境環境下,轉基因擬南芥的生長勢要弱于野生型,因為擬南芥將環境中的ABA信號,解讀為逆境信號,而同等信號強度下,轉基因擬南芥激活的ABA通路的基因表達要數倍于野生型,而對應的它抑制的與促進植物生長有關的通路基因的表達,也應數倍于野生型。而恰恰因為這只是一個模擬逆境的狀態,并不存在真實逆境對植物生長的傷害,所以,ABA通路表達弱的野生型擬南芥反而長勢優于通路表達強的轉基因擬南芥。
本研究結果證明了GhPYR1基因編碼的蛋白是ABA的受體,同時證明了過表達GhPYR1基因的擬南芥植株提高了對ABA的敏感性和增強了應對逆境脅迫的能力,但同時也會抑制種子的萌發,所以將該基因用于植物基因工程,用以提高植物耐旱、耐鹽堿性的時候,最好避免使用CaMV 35S這種組成型表達的啟動子,而代之以組織特異性或誘導表達型啟動子,以期在提高目的基因在靶標組織表達的同時,降低其對種子萌發的抑制。
4 結論
GhPYR1基因是擬南芥中AtPYR1基因的同源基因,在擬南芥中過表達GhPYR1基因能夠提高轉基因植株對ABA的敏感性。表現為在外源ABA存在、干旱和高鹽脅迫條件下,其種子的休眠期延長,萌發率下降。同時,在苗期,轉基因擬南芥對外源ABA敏感,更能適應高鹽及干旱環境。在外源ABA條件下,ABA應答基因的表達量提高,使得植物能夠對ABA信號做出及時反應,以啟動植物體內的信號傳導機制,使植物安全度過逆境脅迫期。
[1]Cutler SR, Rodriguez PL, Finkelstein RR, et al. Abscisic acid:emergence of a core signaling network[J]. Annu Rev Plant Biol,2010, 61:651-679.
[2]Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annu Rev Plant Biol, 2006, 57:781-803.
[3]Ma Y, Szostkiewicz I, Korte A, et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J]. Science, 2009, 324(5930):1064-1068.
[4]Park SY, Fung P, Nishimura N, et al. Abscisic Acid Inhibits Type 2C Protein Phosphatases via the PYR/PYL Family of START Proteins[J]. Science, 2009, 324(5930):1068-1071.
[5]余小林, 胡帥, 王芳展, 等. PYR/PYL/RCAR蛋白介導植物ABA的信號轉導[J]. 遺傳, 2012, 34(5):560-572.
[6]Umezawa T, Sugiyama N, Mizoguchi M, et al. Type 2C protein phosphatases directly regulate abscisic acid-activated protein kinases in Arabidopsis[Z]. 2009:106, 17588-17593.
[7]Vlad F, Rubio S, Rodrigues A, et al. Protein phosphatases 2C regulate the activation of the snf1-related kinase OST1 by abscisic acid in Arabidopsis[J]. The Plant Cell, 2009, 21(10):3170-3184.
[8]Santiago J, Dupeux F, Round A, et al. The abscisic acid receptor PYR1 in complex with abscisic acid[J]. Nature, 2009, 462(7273):665-668.
[9]Nishimura N, Hitomi K, Arvai AS, et al. Structural mechanism of abscisic acid binding and signaling by dimeric PYR1[J]. Science,2009, 326(5958):1373-1379.
[10] Santiago J, Dupeux F, Round A, et al. The abscisic acid receptor PYR1 in complex with abscisic acid[J]. Nature, 2009, 462(7273):665-668.
[11]Fujii H, Verslues PE, Zhu J. Identification of two protein kinases required for abscisic acid regulation of seed germination, root growth, and gene expression in Arabidopsis[J]. The Plant Cell Online, 2007, 19(2):485-494.
[12]Furihata T, Maruyama K, Fujita Y, et al. Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(6):1988-1993.
[13]Jeannette E, Rona JP, Bardat F, et al. Induction of RAB18 gene expression and activation of K+outward rectifying channels depend on an extracellular perception of ABA in Arabidopsis thaliana suspension cells[J]. Plant J, 1999, 18(1):13-22.
[14]Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annu Rev Plant Biol, 2006, 57:781-803.
[15]Kim H, Hwang H, Hong JW, et al. A rice orthologue of the ABA receptor, OsPYL/RCAR5, is a positive regulator of the ABA signal transduction pathway in seed germination and early seedling growth[J]. Journal of Experimental Botany, 2012, 63(2):1013-1024.
[16]Bai G, Yang D, Zhao Y, et al. Interactions between soybean ABA receptors and type 2C protein phosphatases[J]. Plant Molecular Biology, 2013, 83(6):651-664.
[17]Zhang F, Lu X, Lv Z, et al. Overexpression of the Artemisia orthologue of ABA receptor, AaPYL9, enhances ABA sensitivity and improves artemisinin content in Artemisia annua L.[J]. PLoS One, 2013, 8(2):e56697.
[18] Chai YM, Jia HF, Li CL, et al. FaPYR1 is involved in strawberry fruit ripening[J]. Journal of Experimental Botany, 2011, 62(14):5079-5089.
[19] Fujita Y, Fujita M, Shinozaki K, et al. ABA-mediated transcriptional regulation in response to osmotic stress in plants[J]. Journal of Plant Research, 2011, 124(4):509-525.
[20] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism[J]. Annual Review of Plant Biology, 2005, 56(1):165-185.
(責任編輯 李楠)
Cloning and Function Analysis of Gene GhPYR1 in Gossypium hirsutum L.
LIU Yan MENG Zhi-gang SUN Guo-qing WANG Yuan ZHOU Tao GUO San-dui ZHANG Rui
(Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081)
The phytohormone abscisic acid(ABA)plays an important role in response to drought, salinity and other abiotic stress. It is also a key regulator involved in different plant developmental stages such as seed germination, root elongation, and bud dormancy. The PYR/ PYL/RCAR protein family is the ABA receptor, which can initiate the ABA signaling pathway and induce the expression of ABA response genes. In this study, gene GhPYR1 was cloned from Gossypium hirsutum L. with electronic cloning and RT-PCR technology. GhPYR1 protein exhibited 73% sequence identity with Arabidopsis AtPYR1 protein. Protein sequence alignment among GhPYR1 and 14 family members of PYR/PYL/ RCAR in Arabidopsis as well as the construction of phylogenetic tree revealed that gene GhPYR1 was most closely related to subfamily III of PYR/PYL/RCAR protein in Arabidopsis. T3generation Arabidopsis over-expressing gene GhPYR1were more sensitive to exogenous ABA, as its seed germination and early root growth lagged behind than wild type. The germination of transgenic seeds was more strongly inhibited by high salt and drought stress, however, the transgenic lines were significantly better than the wild ones in the seeding stage. Moreover, the ABA-responsive gene RD29A and RAB18 in transgenic Arabidopsis were significantly induced by ABA compared to the wild type. The above results show that the protein encoded by gene GhPYR1 is the receptor of ABA and over-expression of GhPYR1 can improve the sensitivity of plant to ABA and enhance the ability to respond to stress in plants.
Gossypium hirsutum L.;GhPYR1 gene;bioinformatics analysis;physiological function analysis
10.13560/j.cnki.biotech.bull.1985.2016.02.012
2015-05-13
“863”項目(2013AA102601)
劉妍,碩士研究生,研究方向:植物基因工程;E-mail:liuyan4368@sina.com
張銳,研究員,博士生導師,研究方向:棉花基因工程;E-mail:zhangrui71@126.com

