牦牛GDF9和BMP15基因的克隆、表達分析及miRNA研究
李明霞潘和平閻萍吳曉云王英杰
(1.西北民族大學生命科學與工程學院,蘭州 730070;2.中國農業科學院蘭州畜牧與獸藥研究所,蘭州 730050;3.甘肅省牦牛繁育工程重點實驗室,蘭州 730050)
牦牛GDF9和BMP15基因的克隆、表達分析及miRNA研究
李明霞1,2,3潘和平1閻萍2,3吳曉云2,3王英杰1,2,3
(1.西北民族大學生命科學與工程學院,蘭州 730070;2.中國農業科學院蘭州畜牧與獸藥研究所,蘭州 730050;3.甘肅省牦牛繁育工程重點實驗室,蘭州 730050)
以牦牛GDF9和BMP15基因為研究對象,采用PCR方法分別克隆出GDF9和BMP15的兩個外顯子片段,RT-PCR方法分析了GDF9和BMP15及靶定miRNA在各組織中的表達情況。實驗結果顯示,克隆擴增獲得外顯子區進行生物信息學分析。牦牛GDF9基因外顯子片段長分別411 bp和1 082 bp,編碼453個氨基酸;BMP15基因外顯子片段長分別為323 bp和802 bp,編碼372個氨基酸。GDF9編碼蛋白是親水蛋白,含有一個信號肽和15個潛在磷酸化位點;BMP15編碼蛋白是親水蛋白,不含信號肽,有6個潛在磷酸化位點。通過實時熒光定量PCR方法分析牦牛GDF9和BMP15基因在不同組織中的表達量,結果表明GDF9在卵巢和子宮中表達相對較高,且卵巢表達顯著高于其他組織,心、腎、胰和脾中無表達。BMP15僅在卵巢中表達。TargetScan預測靶定牦牛GDF9和BMP15基因的靶定miRNA,分析GDF9靶基因bta-miR-193a-3p和bta-miR-193b在心、脾、肺、腎和子宮中的表達量,結果顯示bta-miR-193a-3p脾中表達量顯著高于其他組織,但在心、肺和子宮中均不表達。bta-miR-193b在心和腎中沒檢測到表達,在肺中的表達量顯著低于脾和子宮中。
牦牛;GDF9;BMP15;miRNA
生長轉化因子9(Growth differentiation factor 9,GDF9)和骨形態發生蛋白15(Bone morphogenetic protein 15,BMP15)都作為轉化生長因子(TGF-β)超家族的成員,參與早期卵泡的生長和分化。1978年TGF-β由Delarco和Todaro在研究病毒時發現,它因具有促進單層培養的成纖維細胞轉化并形成克隆而得名,TGF-β是目前發現最大的細胞內信號蛋白家族[1]。其成員以自分泌和旁分泌的形式參與細胞生物活性的調節[2,3]。GDF9最早由Lee以TGF-β家族的保守區域為模板設計簡并引物克隆得到,采用Northern blotting在小鼠卵巢中檢測到mRNA表達[4]。而BMP15最早是在綿羊中發現的,Aaltonen[6]根據其基因的保守性首次克隆了小鼠的BMP15基因,后期以它為模板相繼得到了人、大鼠及羊的BMP15的序列[5]。Aaltonen在卵母細胞中發現BMP15的特異性表達。研究初期認為它們表達模式相似且僅在動物卵巢組織特異性表達,后期經深入研究發現不同物種表達定位存在不同。對牛羊的研究發現GDF9在睪丸和下丘腦組織中也表達,同時對人的研究顯示在非性腺組織也檢測到GDF9的表達。表明GDF9不僅在卵母細胞的排卵過程中表達[7,8]。后期有研究者對嚙齒類動物研究發現GDF9在睪丸和下丘腦組織中也表達,同時對人的研究顯示在非性腺組織也檢測到GDF9的表達。BMP15也不僅在卵巢中表達,在人[6]和牛[9]睪丸及小鼠[10]垂體中均檢測到微量表達。隨著對GDF9和BMP15的深入研究表明這些生長因子可能潛在調節垂體和睪丸的功能,參與調節動物生殖過程[11]。
miRNA是一類非編碼小分子RNA,長約20 nt,通過結合靶mRNA的3' UTR導致其或抑制翻譯,參與調控轉錄后過程,進而參與生命進程。有研究表明,miRNA在卵巢及睪丸組織中參與調控。2007年Ro等[12]小鼠卵巢中克隆得到122個miRNA,并對其進行半熒光定量PCR分析,發現其在卵巢和睪丸組織中均表達,而后發現包含miR-ov15和miR-ov9共4個miRNA在卵巢中特異性表達。2008年Otsuka[13]發現Dicer(d/d)小鼠不育,將正常小鼠卵巢移植到此小鼠上可得到后代,將Dicer(d/d)小鼠卵巢移植到正常小鼠中無懷孕現象,說明卵巢發育是影響繁殖的關鍵因素。對Dicer(d/d)小鼠研究發現,miR-17-5p和let-7b影響黃體血管長度和數量,將其注射到Dicer(d/d)小鼠中可恢復黃體血管生成,但不能使胎兒發育,可能還有其他miRNA共同參與調節。Tang等[14]在Dicer基因敲除小鼠卵泡中檢測到有些mRNA和蛋白質高分度表達,說明敲除Dicer基因可減少成熟miRNA產生,可減少靶mRNA的降解和翻譯抑制作用。Byrne[15]研究發現miR-125a可靶調節Ped基因調控小鼠胚胎發育。
牦牛作為高寒地區的特有牛種,主要分布于青海、西藏、四川、甘肅和云南等高寒草原區[16]。牦牛具有適應能力強,耐粗飼,耐寒冷等特點,從而可在含氧量低,牧草季節短,氣候寒冷的條件下生存繁衍,它也是一種經濟價值很高的物種,可為當地牧民提供肉、奶、皮及役力等生活生產資料。
牦牛屬于單胎動物,一胎一犢且世代間隔較長的特點極大地限制了牦牛的數量,以期采用常規的遺傳選擇法進行優化提高雙胎率進展緩慢。加大與排卵數相關主效基因的研究,這是提高繁殖性能最直接且有效的方法。目前關于GDF9和BMP15影響動物繁殖力的研究逐漸增多,但關于GDF9、BMP15在牦牛生殖過程中的研究有限。因此,本研究對牦牛GDF9、BMP15基因外顯子區克隆并進行相關生物信息學分析,旨在為進一步開展牦牛GDF9、BMP15基因的研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 組織樣、細菌菌株和載體 用于本研究的牦牛樣品采自于甘肅省大通牦牛育種場。用常規的酚氯仿提取法提取血樣中基因組DNA;利用TRizol法提取各組織中的總RNA;大腸桿菌E.coli DH5α購自TIANGEN公司;pGEM-T easy克隆載體購自Promega公司。
1.1.2 分子生物學試劑 DNA提取試劑盒、瓊脂糖凝膠回收試劑盒、質粒提取試劑盒、Taq酶、IPTG和Amp均購于TIANGEN公司;TRizol Reagent購自Invitrogen公司;熒光定量試劑盒SYBR Premix Ex TaqTMII購自TaKaRa。
1.1.3 引物設計與合成 根據GenBank已知的牦牛GDF9(NW_005393189)和BMP15(NW_005393997)基因序列分別設計克隆引物、表達引物。根據TargetScan預測得到miRNA設計表達引物,引物(表1)由英濰捷基貿易有限公司合成。

表1 GDF9和BMP15基因引物序列
1.2 方法
1.2.1 牦牛總DNA提取 健康成年牦牛血液組織為材料,使用DNA提取試劑盒提取牦牛總DNA,利用紫外分光光度計測定260 nm 波長下OD值,檢測濃度和純度。
1.2.2 RNA的提取 組織樣品采自3頭青海牦牛均為雌性,根據廠商說明利用TRizol法提取各組織中的總RNA,使用瓊脂糖凝膠電泳檢測其質量,Thermo公司的NanoDrop 2000檢測其濃度及純度。
1.2.3 反轉錄 根據TaKaRa反轉錄試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser說明依次進行,但miRNA實時熒光定量表達研究所用反轉錄引物采用反轉錄引物混合液,各取1 μL RT primer加到78 μL ddH2O中均勻混合用作反轉錄引物混合液。GDF9和BMP15基因在各組織中的表達以β-actin為內參,擴增條件:95℃ 30 s,95℃ 5 s,60℃ 30 s,65℃ 5 s,72℃ 45 s,40個循環。bta-miR-193a-3p和bta-miR-193b表達以U6為內參基因,擴增條件:95℃ 30 s,95℃ 5 s,58℃ 30 s,72℃ 45 s,45個循環。
1.2.4 GDF9和BMP15基因的克隆 瓊脂糖凝膠電泳檢測PCR 產物,利用DNA凝膠回收試劑盒回收,瓊脂糖凝膠電泳檢測回收物質量。再將回收產物連接pGEM-T easy載體,T4連接酶16℃過夜連接,以此構建重組質粒。將重組質粒轉化感受態細胞E.coli DH5α,37℃震蕩培養60 min后,涂布于含有Amp和IPTG等成分的LB 固體培養基,培養基37℃過夜培養。挑取白色陽性菌落接種于LB液體培養基過夜培養。提取質粒雙酶切鑒定,將鑒定為陽性的菌落送至公司測序。
1.2.5 GDF9和BMP15基因序列的生物信息學分析
1.2.5.1 理化性質分析 采用ExPASy(http://www. expasy.org/)等軟件進行生物信息學分析,包括開放閱讀框,氨基酸組成,等電點,疏水性質等理化性質,信號肽,跨膜區,磷酸化位點;運用SOPMA(http://nhjy.hzau.edu.cn/kech/swxxx/jakj/dianzi/Bioinf7/ Expasy/Expasy8.htm)和SWISS-MODEL(http://www. swissmodel.expasy.org/)軟件預測蛋白質的二級和三級結構。
1.2.5.2 進化分析 運用Clust W軟件進行多序列同源性比對,NCBI數據庫分別下載GDF9和BMP15基因編碼蛋白的序列,其中包括人(NP_005251.1;NP_005439.2),小鼠(XP_006532283.1;NP_0338-87.1),豬(NP_001001909.1;NP_001005155.1),山羊(NP_001272637.1;NP_001272517.1),狗(XP_ 005626415.1;XP_003640322.1),駱駝(XP_01097-9701.1;XP_010996367.1),黃牛(XP_010805521.1;NP_001026922.1),水牛(XP_006050617.1;XP_00-6059547.1),熊貓(XP_002912947.1;XP_0029305-52.1),狒狒(NP_001162234.1;XP_003917771.1)和牦牛共11個物種,運用MEGA5.10軟件基于鄰位歸并法(NJ法)構建系統發生樹。
1.2.6 GDF9和BMP15基因靶標miRNA預測 運用TargetScan在線預測軟件(http://www.targetscan. org/),以GDF9和BMP15基因作為靶基因,參數為系統默認,預測靶定此基因的miRNA。
2 結果
2.1 牦牛GDF9和BMP15基因的序列分析
以大通牦牛血液總DNA為模板擴增GDF9基因兩個外顯子區,PCR產物電泳結果(圖1)顯示,得到兩條清晰的條帶,大小分別是500 bp和1 265 bp,與預期目的條帶相符,測序后得到長度分別為411 bp(位于1-411 bp處)和1 082 bp(位于410-1 491 bp處)的兩條核苷酸序列,拼接后得到完整外顯子區序列(圖2)。運用在線BLAST比對測序得到序列與公布的GDF9 mRNA序列只有1個堿基(位于112位)的差異,相似性達99%,具有較高的同源性,初步認為得到序列是牦牛GDF9外顯子區序列。

圖1 牦牛GDF9和BMP15基因PCR擴增產物的電泳圖

圖2 牦牛GDF9基因編碼蛋白序列
以大通牦牛血液總DNA為模板擴增BMP15基因外顯子區,PCR產物電泳結果(圖1)顯示,得到兩條清晰大小分別是450 bp和1 055 bp的片段,結果與預期相似,測序得到長度分別為323 bp(位于1-323 bp處)和802 bp(位于321-1 122 bp處)的兩條核苷酸序列,拼接后得到外顯子區序列如圖3。運用在線BLAST比對得到序列與公布的BMP15 mRNA序列相似性高達100%,初步認為得到序列是牦牛BMP15外顯子區序列。

圖3 牦牛BMP15基因編碼蛋白質序列
2.2 牦牛GDF9和BMP15蛋白的生物信息學分析
2.2.1 牦牛GDF9和BMP15基因編碼蛋白一級結構序列分析 運用在線ExPASy 軟件(http://www. expasy.org/)分析牦牛GDF9基因編碼蛋白理化性質,此蛋白分子量為51.947 6 kD,理論等電點pI=8.99。含有20種氨基酸,其中Leu以11.3%最多且遠高于其他氨基酸,Trp以1.5%最少。通過ORF Finder軟件對所得序列進行開放閱讀框分析,得到長為1 362 bp的開放閱讀框,編碼453個氨基酸,編碼蛋白為親水性蛋白。SignalP 4.1預測信號肽表明,該基因編碼蛋白質含有一個信號肽,切割位點位于25和26位氨基酸之間。TMHMM預測無跨膜區,非跨膜蛋白。GDF9基因編碼蛋白15個潛在磷酸化位點。
運用在線ExPASy 軟件分析牦牛BMP15基因編碼蛋白理化性質,此蛋白分子量為40.838 9 kD,理論等電點pI=9.62。含有20種氨基酸,其中Leu以11.7%最多遠高于其他氨基酸,Cys和Met以1.7%最少。有長為1 119 bp的開放閱讀框,編碼372個氨基酸。無信號肽、跨膜區,為非跨膜蛋白。磷酸化位點預測顯示,BMP15基因編碼蛋白共有6個潛在磷酸化位點。

圖4 牦牛GDF9基因編碼蛋白二級結構分析
2.2.2 牦牛GDF9和BMP15基因編碼蛋白二級和三級結構序列分析 運用SOPMA在線軟件預測GDF9二級結構。結果(圖4)顯示,該基因編碼蛋白二級結構中無規則卷曲占據最多,而β轉角最少,其中α螺旋區為138個氨基酸,延伸鏈為76個氨基酸,β轉角為23個氨基酸,無規則卷曲為216個氨基酸,分別占30.36%、16.78%、5.08%和47.68%。利用SwissModel進行同源建模預測牦牛GDF9基因編碼蛋白三級結構,結果如圖5所示。

圖5 牦牛GDF9基因編碼蛋白三級結構預測
運用SOPMA在線軟件預測BMP15二級結構結果(圖6)顯示,該基因編碼蛋白二級結構與GDF9相似,其中α螺旋區為99個氨基酸占27.65%,延伸鏈為67個氨基酸占18.72%,β轉角為29個氨基酸占8.10%,無規則卷曲為163個氨基酸占45.53%。同源建模預測牦牛BMP15基因編碼蛋白三級結構,結果如圖7所示。

圖6 牦牛BMP15基因編碼蛋白二級結構分析

圖7 牦牛BMP15基因編碼蛋白三級結構預測
2.2.3 牦牛GDF9和BMP15基因編碼蛋白的系統發育樹分析 運用MEGA5.10軟件基于NJ法分別構建GDF9和BMP15基因系統發生樹,結果(圖8,圖9)表明,牦牛GDF9和BMP15基因均與黃牛親緣關系最近,與水牛次之。

圖8 牦牛GDF9基因編碼蛋白系統發育樹(NJ法)
2.3 牦牛GDF9和BMP15組織表達分析
采用RT-PCR技術分別對心、腎、肝、肌肉、胰、脾、卵巢和子宮等八種組織進行差異表達分析(圖10)。以GDF9在肌肉中的表達量為內對照,GDF9在卵巢和子宮中表達相對較高,在胰和脾中不表達,BMP15僅在卵巢中表達。

圖9 牦牛BMP15基因編碼蛋白系統發育樹(NJ法)

圖10 牦牛GDF9(A)和BMP15(B)基因在各組織表達量
2.4 牦牛GDF9和BMP15靶定miRNA的預測篩選與表達分析
運用TargetScan在線軟件預測,GDF9共預測得到28個miRNA,BMP15無結果。本研究選擇屬于microRNA-193家族的bta-miR-193a-3p和bta-miR-193b進行研究,采用RT-PCR技術分別對篩選得到的兩個miRNA在心、脾、肺、腎和子宮5種組織進行差異表達分析,以bta-miR-193a-3p在脾中的表達量為內對照,結果見圖11。bta-miR-193a-3p整體表達量低于bta-miR-193b,但脾中表達量相對較高,且顯著高于其他組織,在心、肺和子宮中均不表達。bta-miR-193b在心和腎中未檢測到表達,在肺中的表達量顯著低于脾和子宮中。
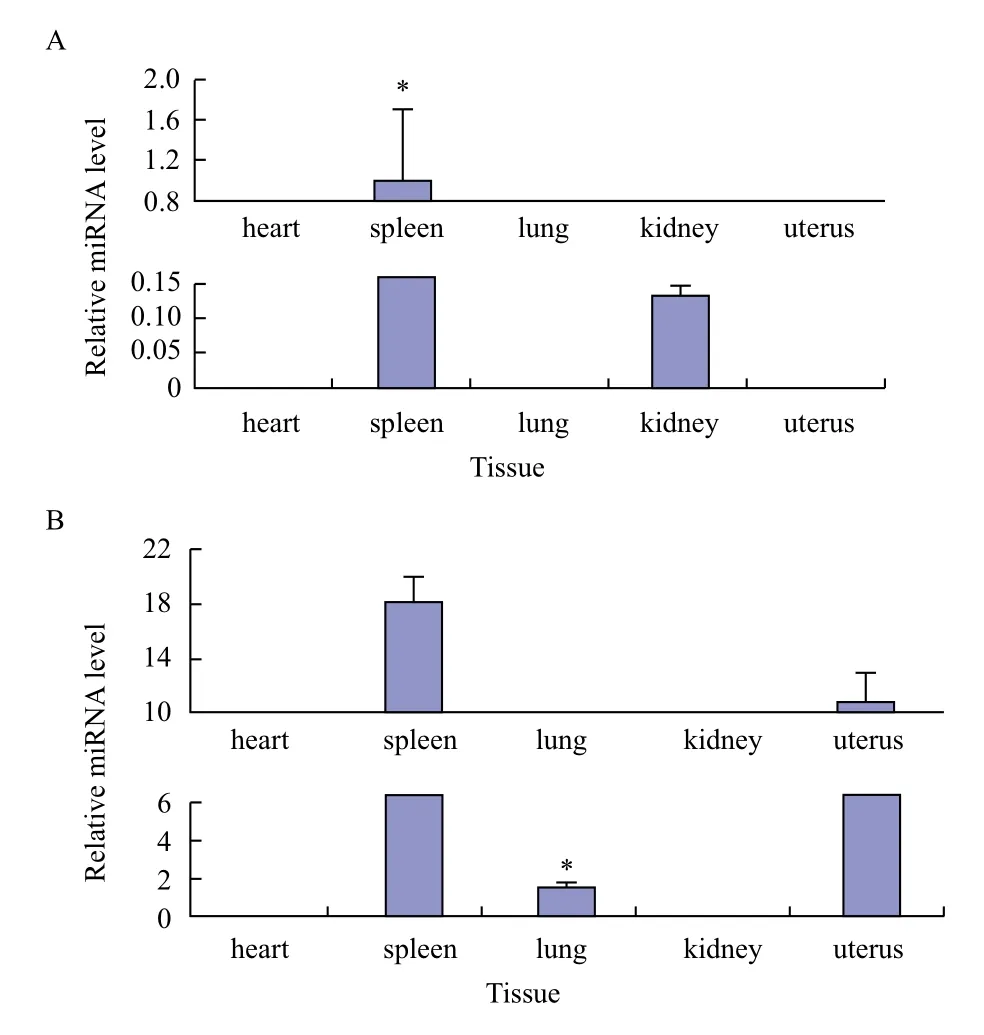
圖11 bta-miR-193a-3p(A)和bta-miR-193b(B)牦牛各組織中表達量
3 討論
近年來,對于GDF9和BMP15基因的研究備受關注,已有研究證明GDF9和BMP15影響羊繁殖力,其中GDF9通過旁分泌的方式影響卵泡的生長分化,而BMP15則是主要借助卵泡發育過程中抑制FSH受體在顆粒細胞中的表達來發揮調節作用,它們之間同源性較高且結構相似,功能上表現出協同效應。
本研究運用生物信息學方法預測了牦牛GDF9和BMP15基因編碼蛋白的結構和功能。通過對其二級結構預測可知GDF9的α螺旋占30.36%、延伸鏈16.78%、β轉角5.08%,無規則卷曲47.68%,BMP15的α螺旋占27.65%,延伸鏈18.72%,β轉角8.10%,無規則卷曲45.53%,從而形成高級結構發揮其特定功能,均完成了三維建模。它們分別作為TGF-β家族中GDF 和BMP亞家族成員參與細胞生物活性的調節,因其一級和二級結構相似于家族成員,其功能也具有相似性。有研究表明轉錄起始位點二級結構穩定性決定翻譯起始效率,穩定性越高表達率越低[17]。而對綿羊的研究發現GDF9突變形成突變雜合體,使其表達量降低致使卵巢排卵數增加引起多胎現象[18]。原因之一可能是牦牛二級結構不如綿羊穩定使其多胎現象少于綿羊。但牦牛GDF9和BMP15基因編碼蛋白質真正的生物學功能有待于進一步研究。利用編碼氨基酸序列同其他10個物種進行聚類分析并構建系統發育樹,從物種之間的進化關系可看出牦牛GDF9和BMP15基因編碼蛋白與黃牛最為接近,符合動物之間的分類地位。
GDF9和BMP15表達模式相似,研究初認為兩者僅在卵巢中表達,經過深入研究發現不同物種之間有所區別。Fitzpatrick[19]在對大鼠和小鼠的研究中發現GDF9僅在卵巢、睪丸和下丘腦中表達,子宮中未檢測到表達,而后期在對人的研究中發現,在性腺和非性腺組織,如垂體、子宮和骨髓中也檢測到GDF9的表達。Elis[20]發現雞BMP15在卵巢和其他組織中均有表達。Clelland[21]對斑馬魚的研究發現,BMP15在卵巢和睪丸中高表達,而在心臟、肝臟、肌肉、腸道和腦組織中也表達。本研究檢測牦牛GDF9和BMP15在各組織中表達情況,發現GDF9基因不僅在卵巢和子宮中表達,在肝臟和肌肉中也檢測到表達,而BMP15僅在卵巢中表達;但GDF9和BMP15均主要在性腺組織中高表達。
miRNA在卵泡生成、排卵、卵母細胞成熟和黃體功能等方面起到重要作用[13]。目前對于miRNA影響繁殖力的研究主要集中于對卵巢周期排卵影響。Fiedle等[22]研究發現經過hCG處理前后的顆粒細胞,有13個miRNA差異表達,其中miR-132和miR-212經處理后表達量明顯上調,后經研究確定miR-132和miR-212可通過結合寡核苷酸阻礙cAMP介導的成熟miRNA表達與功能。2010年Yao[23]曾用TFG-β1處理小鼠腔前顆粒細胞后發現miR-224表達量明顯上調,后經TFG-β超家族Ⅰ型受體抑制劑阻斷效應物Smad2/3磷酸化處理后,發現上調作用減弱,表明TFG-β1/Smads通路可調節miR-224的表達,發現miR-224可通過靶定Smad4增加顆粒細胞增生和細胞雌二醇釋放,而內源性miR-224的抑制能夠阻礙由TFG-β1介導的顆粒細胞增生。Yao[24]研究發現孕酮分泌過程中,經FSH處理12 h后,miR-29a和miR-30d表達量明顯下降,處理48 h后表達量又顯著增加。有研究表明micro-193家族成員miR-193b可通過靶定GRB7蛋白,侵襲人子宮內膜腺癌細胞系HEC-1B,抑制GRB7蛋白表達從而參與子宮內部調節[25]。通過對micro-193家族的btamiR-193a-3p和bta-miR-193b進行表達量分析,發現子宮作為影響產仔數的關鍵因素之一,bta-miR-193a-3p在子宮中無表達,在脾和腎中表達量相對較高,而bta-miR-193b在子宮中表達量較高,推測bta-miR-193b可能總用于靶定GDF9基因,為調控牦牛多胎性的miRNA。
4 結論
牦牛GDF9基因克隆得到兩個片段長分別411 bp和1 082 bp,共編碼453個氨基酸;BMP15基因克隆得到片段長分別為323 bp和802 bp,共編碼372個氨基酸,系統進化分析表明牦牛GDF9和BMP15均和黃牛親緣關系最近,結果符合理論。
GDF9在卵巢和子宮中表達相對較高,BMP15僅在卵巢中表達。預測GDF9和BMP15的靶定miRNA,對micro-193家族的bta-miR-193a-3p和btamiR-193b進行表達量分析發現bta-miR-193a-3p整體表達量低于bta-miR-193b,但脾中表達量相對較高,顯著高于其他組織。bta-miR-193b在心和腎中未檢測到表達,在肺中的表達量顯著低于脾和子宮中。推測bta-miR-193b可能作用于靶定GDF9基因,參與牦牛多胎性的調控。
[1]Massague J, Blain SW, Lo RS. TGFbeta signaling in growth control,cancer, and heritable disorders[J]. Cell, 2000, 103(2):295-309.
[2]Peng C. The TGF-beta superfamily and its roles in the human ovary and placenta[J]. Journal of Obstetrics and Gynaecology Canada,2003, 25(10):834-844.
[3]Knight PG, Glister C. TGF-13 superfamily members and ovarian follicle development[J]. Reproduction, 2006, 132(2):191-206.
[4]McPherron AC, Lee SJ. GDF-3 and GDF-9:two new members of the transforming growth factor-beta superfamily containing a novel pattern of cysteines[J]. Journal of Biological Chemistry, 1993,268(5):3444-3449.
[5]Dube JL, Wang P, Elvin J, et al. The bone morphogenetic protein 15 gene is X-linked and expressed in oocytes[J]. Molecular Endocrinology, 1998, 12(12):1809-1817.
[6]Aaltonen J, Laitinen MP, Vuojolainen K, et al. Human growth differentiation factor 9(GDF-9)and its novel homolog GDF-9B are expressed in oocytes during early folliculogenesis[J]. Journal of Clinical Endocrinology & Metabolism, 1999, 84(8):2744-2750.
[7]Bodensteiner K, Clay C, Moeller C, et al. Molecular cloning of the ovine growth/differentiation factor-9 gene and expression of growth/ differentiation factor-9 in ovine and bovine ovaries[J]. Biology of Reproduction, 1999, 60(2):381-386.
[8]Jayawardana BC, Shimizu T, Nishimoto H, et al. Hormonal regulation of expression of growth differentiation factor-9 receptor type I and II genes in the bovine ovarian follicle[J]. Reproduction, 2006, 131(3):545-553.
[9] Pennetier S, Uzbekova S, Perreau C, et al. Spatio-temporal expression of the germ cell marker genes MATER, ZAR1, GDF9, BMP15, and VASA in adult bovine tissues, oocytes, and preimplantation embryos[J]. Biology of Reproduction, 2004, 71(4):1359-1366.
[10] Otsuka F, Shimasaki S. A novel function of bone morphogenetic protein-15 in the pituitary:selective synthesis and secretion of FSH by gonadotropes[J]. Endocrinology, 2002, 143(12):4938-4941.
[11]Juengel JL, Bodensteiner KJ, Heath DA, et al. Physiology of GDF9 and BMP15 signalling molecules[J]. Animal Reprod Sci, 2004,(82-83):447-460.
[12] Ro S, Song R, Park C, et al. Cloning and expression profiling of small RNAs expressed in the mouse ovary[J]. RNA, 2007, 13(12):2366-2380.
[13] Otsuka M, Zheng M, et al. Impaired microRNA proce-ssing causes corpus luteum insufficiency and infertility in mice[J]. The Journal of Clinical Investination, 2008, 118(5):1944-1954.
[14]Tang KF, Song GB, Shi YS, et al. Dicer knockdown induces fibronectin-1 expression in HEK293T calls via induction of Egr1[J]. Biochimica et Biophysica Acta, 2010, 1800(3):380-384.
[15]Byrne MJ, Warner CM. MicroRNA expression in preimplantation mouse embryos from Ped gene positive compared to Ped gene negative mice[J]. Journal of Assisted Reproduction and Genetic,2008, 25(5):205-214.
[16]郭憲, 閻萍, 曾玉峰, 等. 中國牦牛遺傳資源現狀分析[J].中國畜禽種業, 2008, 1:60-62.
[17]Desmit MH, Van DJ. Control of translation by mRNA secondary structure in Escherichia coli. A quantitative analysis of literature date[J]. Journal of Molecular Biology, 1994, 244(2):144-155.
[18]Hanrahan JP, Greqan SM, Mulsant P, et al. Mutations in the genes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovis aries)[J]. Biology of Reproduction, 2004,70(4):900-909.
[19]Fitzpatrick SL, Sindoni DM, Shuqhrue PJ, et al. Expression of growth differentiation factor-9 messenger ribonucleic acid in ovarian and nonovarian rodent and human tissues[J]. Endocrinology,1998, 139(5):2571-2578.
[20]Elis S, Dupont J, Couty I, et al. Expression and biological effects of bone morphogenetic protein-15 in yhe hen ovary[J]. Journal of Endocrinology, 2007, 194(3):485-497.
[21]Clelland E, Kohli G, Campbell RK, et al. Bone morphogenetic protein-15 in the zebrafish ovary:complementary deoxyribonucleic acid cloning, genomic organization, tissue distribution, and role in oocyte maturation[J]. Endocrinology, 2006, 147(1):201-209.
[22]Fiedler SD, Carletti MZ. Hormonal regulation of MicroRNA expression in periovulatory mouse mural granulose cells[J]. Biol Reprod, 2008, 79(6):1030-1037.
[23]Yao G, Yin M, Lian J, et al. Micro-224 is involved in transforming growth factor-beta-mediated mouse granulose cell proliferation and granulose cell function by targeting Smad4[J]. J Mol Endocrinol,2010, 24(3):540-551.
[24]Yao N, Yang BQ, et al. Follicle-stimulating hormone regulation of microRNA expression on progesterone production in cultured rat granulose cell[J]. Endocrine, 2010, 38(2):158-166.
[25]李榮, 陳雪梅, 何俊琳, 等. Has-miR-193b抑制人子宮內膜腺癌細胞株HEC-1B侵襲能力[J]. 第三軍醫大學學報, 2011,33(15):1594-1597.
(責任編輯 李楠)
Cloning,Expression Analysis and miRNA Study of Gene GDF9 and BMP15 in Yak
LI Ming-xia1,2,3PAN He-ping1YAN Ping2,3WU Xiao-yun2,3WANG Ying-jie1,2,3
(1. College of Life Science and Engineering of Northwest University for Nationalities,Lanzhou 730070;2. Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences,Lanzhou 730050;3. Key Laboratory of Yak Breeding Engineering,Lanzhou 730050)
Gene GDF9(growth differentiation factor 9)and BMP15(bone morphogenetic protein 15)of yak were used as research subject;then 2 exon fragments of GDF9 and BMP15 were cloned by PCR, and the expressions of GDF9 and BMP15 as well as targeted miRNA were analyzed by RT-PCR. The results were as follows. The cloned and amplified exon fragments were analyzed by bioinformatics;the exons of yak gene GDF9 were 411 bp and 1 082 bp, encoding 453 amino acids;the lengths of exons in yak gene BMP15 were 323 bp and 802 bp separately, encoding 372 amino acids. The protein encoded by GDF9 was hydrophilic, containing one signal peptide and 15 potential phosphorylation sites;the protein encoded by BMP15 was also hydrophilic, and owing no signal peptide and 6 potential phosphorylation sites. The expressions of GDF9 and BMP15 in different tissues were examined by RT-PCR. The results showed that GDF9 expressed relatively high in ovary and uterus, and higher in ovary than others tissues, and no expression in heart, kidney, pancreas, and spleen;BMP15 was only detected in ovary. With TargetScan, the target miRNA of yak gene GDF9 and BMP15 were predicted and the expressions of target gene bta-miR-193a-3p and bta-miR-193b of GDF9 in heart, spleen, lung, kidney and uterus were analyzed. miRNAs genes were examined with RT-PCR;the results indicated that bta-miR-193a-3p in the spleen expressed significantly higher than in others tissues, and no expression in heart, lung and uterus;bta-miR-193b expressed lower in lung than spleen and uterus, and no expression was detected in heart and kidney.
Yak;GDF9;BMP15;miRNA
10.13560/j.cnki.biotech.bull.1985.2016.02.013
2015-07-23
西北民族大學研究生科研創新項目(ycx14166),甘肅省農業生物技術研究與應用開發項目(GNSW-2011-23)
李明霞,女,碩士研究生,研究方向:動物遺傳育種與繁殖;E-mail:1031082498@qq.com
潘和平,男,教授,碩士生導師,研究方向:動物遺傳育種;E-mail:panheping62@163.com

