黑曲霉C112纖維二糖酶基因的克隆與生物信息學分析
朱永瑞 曾柏全 曾磊 劉輝
(中南林業科技大學 生命科學與技術學院,長沙 410004)
黑曲霉C112纖維二糖酶基因的克隆與生物信息學分析
朱永瑞 曾柏全 曾磊 劉輝
(中南林業科技大學 生命科學與技術學院,長沙 410004)
以紫外誘變獲得的高產纖維素酶黑曲霉C112菌株為模板,采用RT-PCR技術克隆黑曲霉C112的纖維二糖酶基因bgl(GenBank登錄號:KP307454);該基因全長2 934 bp,含有非編碼序列,編碼860個氨基酸,等電點為4.70,核酸序列與數據庫的Aspergillus niger(GenBank登錄號JX982101.1)同源性達到了99%;生物信息學分析表明,纖維二糖酶為具有一定親水性的穩定酸性分泌蛋白;二級結構以α-螺旋、β-折疊和無規則卷曲為結構元件;該基因經IPTG 誘導重組蛋白表達,SDS-PAGE 檢測結果表明,重組表達產物的相對分子量約為93.3 kD,與預期相符;纖維二糖酶在大腸桿菌BL21中胞內融合表達,重組蛋白pNPG酶活為5.847 U/mL,最適反應溫度為50℃,最適pH值為5.0。
黑曲霉C112;纖維二糖酶;克隆;生物信息學
纖維二糖酶又稱為β-葡萄糖苷酶[1],能夠水解纖維二糖產生兩分子的葡萄糖[2],并能極大地促進內切葡聚糖酶和外切葡聚糖酶的水解作用,加快纖維素酶系的整體水解速度,促使纖維素的水解更完全[3]。現在對真菌中纖維二糖酶產生菌研究較多的是絲狀真菌,主要為曲霉屬和木霉屬[4],而細菌中研究較多的是芽孢桿菌屬[5,6]。
黑曲霉(Aspergillus niger)是纖維二糖酶的高產菌株[7,8],但是關于黑曲霉纖維二糖酶基因的研究報道仍然較少[9,10]。2000年,美國Dan等[11]研究者在GenBank上登錄了第一個黑曲霉纖維二糖酶的全基因序列。2007年,荷蘭工業化學公司首次完成了對一株黑曲霉的全基因組測序,該黑曲霉基因組有3 390萬個堿基對,并且構成超過14 000個獨特的基因,其中編碼纖維二糖酶的基因已被完全確定[12]。國內2006年首次出現關于黑曲霉纖維二糖酶基因克隆研究的報道。
本研究通過參照GenBank上已發表的黑曲霉纖維二糖酶基因序列(登錄號:AJ132386)設計引物,實驗菌株是經過紫外誘變篩選獲得的高產纖維素酶黑曲霉菌,以此菌株總RNA為模板克隆了纖維二糖酶的基因,進行基因序列測序。國內外對該基因生物學信息還未見報道,因此本研究對該基因進行初步的生物信息學分析,以更好地了解纖維二糖酶的功能性質,并且實現該基因在大腸桿菌BL21中胞內融合表達。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 黑曲霉(Aspergillus niger)C112[13],保存于中南林業科技大學發酵工程實驗室。大腸桿菌DH5α、BL21(DE3),pEASY-T1購自北京全式金生物技術有限公司。
1.1.2 酶與試劑 總RNA提取試劑(Trigol)、焦碳酸二乙酯(DEPC),北京鼎國昌盛生物技術有限公司;普通瓊脂糖凝膠DNA回收試劑盒、質粒小提試劑盒,北京天根公司;M-MLV逆轉錄試劑、EasyTaq PCR SuperMix,北京全式金生物公司;其它試劑均為國產分析純。
1.1.3 培養基 PDA培養基:馬鈴薯200 g/L(將馬鈴薯切成方塊,置于1 000 mL水中煮沸,過濾收集液體,即得),葡萄糖20 g/L,瓊脂粉15 g/L。纖維素酶誘導培養基:蛋白胨10 g/L,麥芽糖4 g/L,MgSO40.5 g/L,KH2PO41 g/L。LB液體培養基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,加入去離子水950 mL,用10 mol/L NaOH調pH值至7.0,加去離子水定容1 L。LB固體培養基:配方和液體培養基一樣,并加入15 g瓊脂粉。所配的培養基均在1×105Pa滅菌20 min,4℃保存備用。
1.2 方法
1.2.1 引物設計 參照GenBank上已發表的黑曲霉纖維二糖酶(bgl1)基因序列(GenBank登錄號為AJ132386),利用Primer premier 5.0設計引物,引物序列為上游引物P1:5'-CGGAATTCATGAGGTTCACT TTGATCGAGGCGG-3',下游引物P2:5'-ATGCGGCCGC TTAGTGAACAGTAGGCAGAGACG-3',由蘇州金唯智生物科技有限公司合成。為了便于與載體連接,在引物中加入酶識別位點,bgl1的引物中加入了EcoR I和Not I位點(引物中的劃線部分)。
1.2.2 黑曲霉C112的復蘇和保藏 從真空凍干菌管中用接種環刮下少量細胞接于PD液體培養基,30℃培養24 h,用接種環從培養液中蘸取少量菌液畫線于PDA斜面,30℃靜置培養到長出孢子,于 4℃保存。
1.2.3 黑曲霉C112總RNA提取及cDNA的合成總RNA的提取方法參照北京鼎國昌盛生物技術有限公司的Trigol試劑盒的說明。cDNA的合成按照北京全式金生物公司的RT-PCR試劑盒說明書操作。
1.2.4 纖維二糖酶基因的測序及系統發生分析 將PCR產物回收純化后,克隆到pEASY-T1載體中,轉化大腸桿菌DH5α,經藍白斑篩選重組子,挑取經菌落PCR驗證的陽性克隆子進行序列測定。利用Blast工具進行序列相似性分析,選取部分同源序列,利用Clustal X 軟件包進行序列同源進化比對,形成一個多重序列匹配排列矩陣,構建系統發育進化樹。
1.2.5 測序及序列的生物信息學分析 測序結果采用在線軟件對纖維二糖酶基因氨基酸序列進行物理性質(http://web.expasy.org/protparam/)、二級結構(http://npsa-pbil.Ibcp.fr/cgi-bin/npsa-auomat. pl/page=/NPSA/npsa-hnn.html)、三級結構(http:// swissmodel.expasy.org/SWISS -MODEL.html)及信號肽(http://www.cbs.dtu.dk/services/SignalP-3.0)等信息的預測分析,氨基酸序列同源比對用Blast在線工具和DNAMAN8.0軟件完成。
1.2.6 纖維二糖酶的誘導表達驗證 將陽性重組子接種到新鮮含有相應抗體的液體LB培養基中,37℃、200 r/min過夜培養,以1%的比例接種到30 mL抗性LB液體培養基,37℃、200 r/min培養細菌生長到對數生長期后(OD600=0.4-0.5),加入終濃度為1 mmol/L的IPTG誘導目的基因表達,30℃誘導3 h,取1 mL菌液,4℃、12 000 r/min離心2 min,收集菌體,用PBS緩沖液(pH7.0)洗滌沉淀,并溶于500 μL相同緩沖液中。超聲破碎細胞:功率200 W,超聲2 s間隔4 s,共60次。4℃、12 000 r/min離心30 min,得到上清液即粗酶液。取適量菌液做誘導表達效果的檢測,實驗以未加IPTG誘導為對照,并運用Western blotting技術對重組蛋白進行驗證。
1.2.7 纖維二糖酶的酶活檢測 采用國際通用的方法測定纖維二糖酶的活力[14]:取0.1 mL稀釋了適當倍數的粗酶液(對照管不加),加入1 mL pH4.8的0.05 mol/L檸檬酸緩沖溶液,于50℃水浴預熱10 min;加入已預熱10 min的0.9 mL 5 mmol/L pNPG 溶液,計時,10 min后立即加入1 mL 1 mol/L Na2CO3溶液終止反應;加入蒸餾水定容到25 mL;室溫放置5 min,于410 nm處測吸光度值A。在上述條件下,1 mL酶液1 min水解產生1 μmol 的對硝基苯酚的酶活力,定義為一個酶活單位(U)。
1.2.8 重組酶學性質的初步研究
1.2.8.1 溫度對酶活力的影響 粗酶液在不同溫度下(30、40、50、60、70、80℃)保溫30 min后,按照1.2.7中的方法測定酶活。
1.2.8.2 pH對酶活力的影響 粗酶液分別在不同pH值的醋酸緩沖液條件下(pH4.0、4.5、5.0、5.5、6.0、6.5、7.0)室溫處理30 min后,按照1.2.7中的方法測定酶活。
2 結果
2.1 纖維二糖酶基因的克隆
利用所設計的引物,以黑曲霉菌株的cDNA為模板進行PCR擴增,電泳結果(圖1)顯示擴增片段約為2 900 bp左右,與預期相符。

圖1 纖維二糖酶基因的PCR擴增電泳圖
2.2 纖維二糖酶的生物信息學分析
2.2.1 纖維二糖酶基因的序列分析 纖維二糖酶基因片段大小為2 934 bp,將該基因命名為bgl,GenBank數據庫登錄號為KP307454。其中A:644個、T:666個、G:834個、C:790個,G+C含量為55.35%。該基因編碼860個氨基酸和一個終止密碼子,以ATG為起始密碼子,含有非編碼序列。BLAST序列分析表明,該片段與數據庫的Aspergillus niger(GenBank登錄號JX982101.1)核苷酸序列有著99%的相似性(表1),由此可以確定PCR擴增產物確實是bgl基因。

表1 與部分微生物來源的纖維二糖酶基因相似性比較
2.2.2 纖維二糖酶基因的系統發生分析 Blastp同源性檢索表明,黑曲霉C112菌株纖維二糖酶基因與黑曲霉(GenBank登錄號:JX982101.1)的bgl1具有很高的同源性。采用Mega 4.0軟件(Neighbor-Joining法)對已報道的黑曲霉纖維二糖酶氨基酸序列進行系統發生分析(圖2),該基因與其他bgl基因聚類在一起,進一步表明克隆獲得的基因確實為bgl基因。
2.2.3 纖維二糖酶的氨基酸序列分析 采用在線軟件對纖維二糖酶的氨基酸序列進行分析(http://web. expasy.org/protparam/),結果顯示,纖維二糖酶的蛋白質理論分子量為93.33 kD;預測等電點為4.70;分子式為C4153H6311N1117O1300S20;不穩定系數為30.65,是物理性質穩定的蛋白質;疏水性分析的GRAVY值為-0.357,該蛋白為親水蛋白。酸性氨基酸殘基總數(Asp+Glu)為99,堿性氨基酸(Arg+Lys)為64,表明其為酸性蛋白質。20種氨基酸中甘氨酸(Gly)含量最高,為10.7%;丙氨酸(Ala)次之,為9.07%。
利用SignalP-NN軟件分析發現其1-20位氨基酸為該蛋白信號肽序列(圖3)。C score:酶切位點:數值越高說明其作為酶切位點的可能性越高;S score:單氨基酸數值:越高說明該氨基酸作為信號肽部分的可能性越高;Y score:C值和S值的派生值,更準確地確定酶切位點,數值最高處為酶切位點。

圖2 纖維二糖酶基因的系統發生進化樹

圖3 Bgl蛋白信號肽分析
2.2.4 纖維二糖酶的二級結構預測分析 通過國際蛋白質生物學和化學研究所(PBIL)在線分析網站對該基因進行蛋白質二級結構預測。分析結果(圖4)表明,該蛋白質富含無規卷曲(Random coil),含量高達60.35%;其次為α-螺旋(Alpha helix),含量為22.09%;而β-折疊(Extended strand)含量最低,只有17.56%。

圖4 纖維二糖酶二級結構預測
2.2.5 纖維二糖酶的三級結構預測分析 利用自動比較蛋白建模服務器SWISS-MODEL,與蛋白質數據庫中已知蛋白質的三級結構進行同源建模,從而預測該蛋白的三級結構模型(圖5)。該蛋白的三級結構與Aspergillus aculeatus的纖維二糖酶三級結構相似,相似度為83.10%,結果較可靠。
2.2.6 重組蛋白的誘導表達和SDS-PAGE分析 經過優化條件,最終獲得目的蛋白最優誘導表達條件為:30℃下用1 mmol/L的IPTG誘導表達3 h,SDSPAGE電泳(圖6)顯示,表達產物的分子量為93.3 kD。通過Western blotting對重組蛋白進行驗證,獲得目的條帶(圖7),再次說明表達的重組蛋白是纖維素酶Bgl。
2.2.7 不同發酵時間內重組纖維二糖酶的酶活 挑選酶活最高的重組酵母菌再進行誘導培養,每隔24 h測定一次酶活,其產酶曲線見圖8。其纖維二糖酶活在連續誘導的前72 h一直呈增長趨勢,72 h以后便不再增長,呈緩慢下降趨勢。

圖5 纖維二糖酶的三維結構預測圖

圖6 重組質粒蛋白表達產物的SDS-PAGE鑒定

圖7 重組蛋白免疫印跡
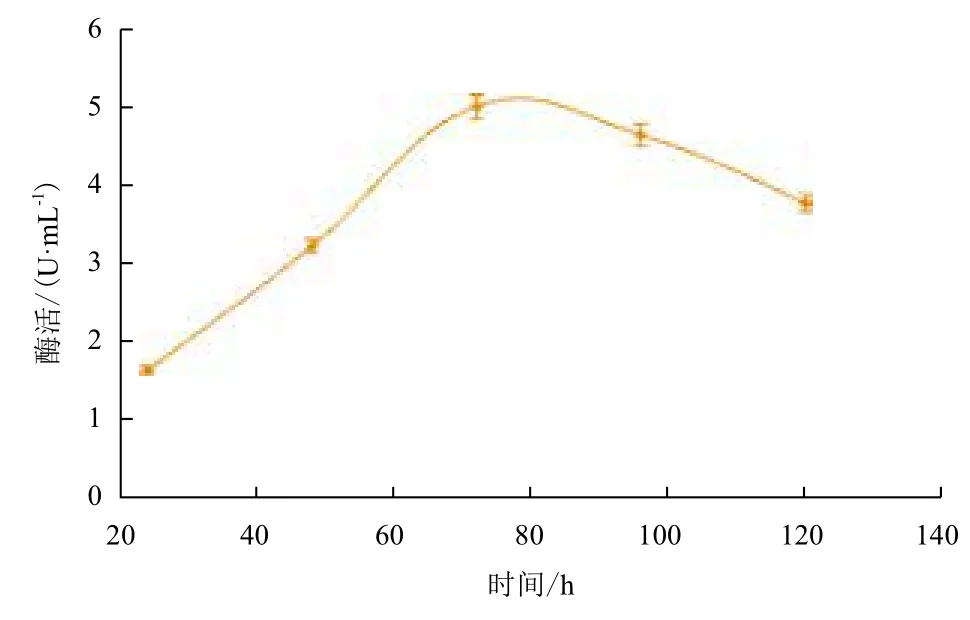
圖8 重組纖維二糖酶酶活測定曲線
2.2.8 溫度和pH值對重組纖維二糖酶的影響 重組后的菌株誘導72 h后,在不同溫度反應條件下測得酶活力。以溫度值為橫坐標,酶活力為縱坐標,作出溫度曲線(圖9),可以看出,纖維二糖酶的最適溫度為50℃。在最適溫度條件下(圖10),分別在pH4.0-7.0條件下測定重組纖維二糖酶的活力,該酶最適pH為5.0。

圖9 溫度對重組纖維二糖酶的影響

圖10 pH值對重組纖維二糖酶的影響
3 討論
纖維二糖酶是纖維素徹底降解為單糖的一個瓶頸[15],采用基因工程與蛋白質工程手段獲得酶活較高的纖維二糖酶已經成為研究熱點[16]。國外許多研究機構正致力于纖維二糖酶的分子生物學研究,從基礎領域研究酶的催化機制及表達調控機制,以期更好地改善纖維素酶的催化效率[17]。周曉明等[18]克隆了bgl基因,與黑曲霉已知序列同源性達到了99%;王冰冰等[19]克隆了纖維二糖酶基因,并且實現了在里氏木霉中的表達;朱龍寶等[20]在畢赤酵母中成功分泌表達了纖維二糖酶,蛋白酶活力達到38 U/mL。由于大腸桿菌表達系統遺傳背景清楚、操作手段較為成熟,并且大腸桿菌繁殖快、營養要求低,表達的外源蛋白穩定、易純化等特點,因此大腸桿菌在基因表達技術中應用廣泛[21]。本研究為了獲取高產量的重組纖維素酶,并進一步研究其酶學性質、功能與結構,將克隆到的纖維素酶基因與表達載體pEASY-T1構建重組表達載體pEASYT-bgl,并轉化大腸桿菌BL21得到了重組工程菌,實現了bgl基因的胞內融合表達。
1974年,Bause等[22]提出纖維二糖酶活性位點中的Asp是糖苷水解酶家族3的高度保守氨基酸,作為該酶的催化親和試劑,此位點以及周圍的幾個氨基酸序列GFVMSDW等在糖苷水解酶家族3中也是高度保守的。大多數微生物所產的β-葡萄糖苷酶也屬于家族3的成員,糖苷水解酶家族3有A區和B區兩個域構成,B區包括SDW序列,內有活性為點Asp(D)殘基。在分子水平上,糖苷水解酶家族3的編碼基因有5個典型的區域構成:N端區、N端催化區、非同源區、C端未知功能區和C端殘基[23]。本研究所得到的bgl的氨基酸序列也具有文獻提到這一特征,因此它屬于糖苷水解酶家族3的成員。
本研究構建的工程菌酶活低于原菌株,可能因為構建的重組菌的表達產物為胞內酶,而且本研究僅在搖瓶做了初步實驗,未對IPTG誘導濃度、金屬離子、溫度、pH值等影響目的基因表達的條件進行優化,也是影響重組蛋白表達和酶活力的原因之一。今后有必要對重組菌株的發酵條件進一步優化,為該基因的工業應用奠定基礎。
4 結論
本研究通過RT-PCR方法從菌株黑曲霉C112克隆了纖維素酶基因bgl,并測得了其核酸序列(GenBank登錄號KP307454)。序列分析表明bgl基因大小為2 934 bp,含有非編碼序列,編碼具有860個氨基酸分子的成熟纖維素酶,分子量大約為93.3 kD;二級結構以α-螺旋、β-折疊和無規則卷曲為結構元件。該基因成功在大腸桿菌中進行了胞內融合表達,重組蛋白pNPG酶活最大為5.847 U/mL,最適反應溫度為50℃,最適pH值為5.0;并且初步探索了誘導纖維素酶基因表達的條件,用1 mmol/L 的IPTG誘導重組菌3 h后能夠檢測到目的蛋白。
[1] Foreman P, Brown D, Dankmeyer L, et al. Transcriptional regulation of biomass-degrading enzymes in the filamentous fungus Trichoderma reesei[J]. The Journal of Biological Chemistry, 2003, 278:31988-31997.
[2] Watanabe H, Tokuda G. Animal cellulases[J]. Cellular and Molecular Life Sciences, 2001, 58(9):1167-1178.
[3] Dekker RFH. Kinetic, inhibition and stability properties of acommercial β-glucosidase(cellobiase)preparation from Aspergillus niger and its suitability in the hydrolysis of lignocellulose[J]. Biotechnology and Bioengineering, 1986, 28(9):1438-1442.
[4]Nina A, Marja I, Anu S, et al. ACEI of Trichoderma reesei is a repressor of cellulase and xylanase expression[J]. Applied and Environmental Microbiology, 2003, 69(1):56-65.
[5]Imjongjirak C, Amparyup P, Sittipraneed S. Cloning, genomic organization and expression of two glycosyl hydrolase family 10(GHF10)genes from golden apple snail(Pomacea canaliculata)[J]. Food Technology, 2008, 19(3):224-236.
[6]鐘斐, 葉秀云, 李仁寬, 等. 長梗木霉β-葡萄糖苷酶基因的克隆及表達[J]. 微生物學通報, 2012, 39(8):1102-1111.
[7]Iwashita K, Nagahara T, Kimura H, et al. The bglA gene of aspergillus kawachii encodes both extracellular and cell wall-bound β-glucosidases[J]. Applied and Environmental Microbiology. 1999, 65(12):5546-5553.
[8]Dharmawardhana DP, Ellis BE, Carlson JE. cDNA cloning and heterologous expression of coniferin β-glucosidase[J]. Plant Molecular Biology, 1999, 40(8):365-372.
[9]Shen XL, Xia LM. Production and immobilization of cellobiase from Aspergillus niger ZU-07[J]. Process Biochemistry, 2004, 39(11):1363-1367.
[10]Seidle HF, Marten I, Shoseyov O, et al. Physical and kinetic properties of the family 3 β-glucosidase from Aspergillus nigerwhich is important for cellulose breakdown[J]. The Protein Journal, 2004, 23(1):158-163.
[11]Dan S, Marton I, Dekel M, et al. Cloning, expression,characterization and nucleophile identification of family 3,Aspergillus niger β-glucosidase[J]. The Journal of Biologicai Chemistry, 2000, 275(7):4973-4980.
[12]Pel HJ, de Winde JH, Archer DB, et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513. 88[J]. Biotechnol, 2007, 25(2):221-231.
[13]先天敏, 陳介南, 張林. 黑曲霉改良株C112產β-葡萄糖苷酶的誘導及條件優化[J]. 中南林業科技大學學報, 2013, 33(11):154-161.
[14]Takashima S, Nakamura A, Hidaka M, et al. Molecular cloningand expression of the novel fungal β-glucosidase genes from Hu-micola griseaand Trichoderma reesei[J]. J Biochem, 1999, 125(4):728-736.
[15] Hong MR, Kim YS, Park CS, et al. Characterization of a recombinant β-glucosidase from the thermophilic bacterium Caldicellulosiruptor saccharolyticus[J]. Journal of Bioscience and Bioengineering, 2009, 108(1):36-40.
[16] 孟憲文, 宋小紅, 陳歷俊, 等. β-葡萄糖苷酶的研究進展[J].中國乳業, 2009(10):42-44.
[17]李泰明, 莊艦峰, Jean Louis Didier MEKOO, 等. 黑曲霉β-葡萄糖苷酶基因在大腸桿菌中的克隆與表達[J]. 安徽醫藥,2012, 16(5):576-578.
[18]周曉明, 莫雋穎, 陶冶, 等. 黑曲霉β-葡萄糖苷酶基因在大腸桿菌中的克隆與表達[J]. 化學與生物工程, 2010, 27(6):50-53.
[19]王冰冰, 夏黎明, 杜風光. 黑曲霉纖維二糖酶基因的克隆及其在里氏木霉中的表達[J]. 化工學報, 2011, 62(2):452-457.
[20]朱龍寶, 湯斌, 陶玉貴, 等. 黑曲霉β-葡萄糖苷酶基因克隆及在畢赤酵母中分泌表達[J]. 食品與生物技術學報, 2012, 31(9):973-977.
[21]王正祥, 劉吉泉, 諸葛健, 等. 微生物酶的分子改性和人工進化的研究進展[J]. 生物工程學報, 2000, 16:301-303.
[22]Bause E, Legler G. Isolation and amino acid sequence of a hexadecapeptide from the active site of beta-glucosidase A3 from Aspergillus wentii[J]. Hoppe-Seyler's Zeitschrift fur Physiologische Chemie, 1974, 355(4):438-442.
[23]Li YK, Chir FY. Catalytic mechanism of a family 3 β-glucosidase and mutageneais study on residue Asp-247[J]. The Biochemical Journal, 2001, 355(3):835-840.
(責任編輯 李楠)
Cloning and Bioinformatics Analysis of Cellobiase Gene from Aspergillus niger C112
ZHU Yong-rui ZENG Bai-quan ZENG Lei LIU Hui
(College of Life Science and Technology,Central South University of Forestry and Technology,Changsha 410004)
The cellobiase gene(GenBank accession number:KP307454)was cloned by RT-PCR from high-yield cellulase Aspergillus niger strain C112 mutated by UV. The whole length of cellobiase was 2 934 bp containing non-coding sequence, and encoding 860 amino acids with the pI of 4.70. The homology of nucleotide sequence with Aspergillus niger(GenBank accession number:JX982101.1)reached 99%. Bioinformatics analysis showed that cellobiase was a hydrophilic, stable, and secreted protein;its secondary structure consisted of the structural elements of α-helix, β-folding and random coil. As expected, recombinant fusion protein was expressed after IPTG induction, and the relative molecular mass was approximately 93.3 kD by SDS-PAGE. The fused β-Glucosidase was expressed in Escherichia coli BL21. The enzyme activity of recombinant protein pNPG was 5.847 U/mL, the optimal reaction temperature was 50℃, and the optimal reaction pH was 5.0.
Aspergillus niger C112;cellobiase;cloning;bioinformatics
10.13560/j.cnki.biotech.bull.1985.2016.02.015
2015-04-30
湖南省教育廳科學研究重點項目(13A123),中南林業科技大學研究生科技創新基金項目(CX2014B30)
朱永瑞,男,碩士研究生,研究方向:微生物方面的基因克隆與表達研究;E-mail:1006398396@qq.com
曾柏全,博士,教授,研究方向:生物資源利用與分子技術;E-mail:baiquanzhn@163.com

