法夫酵母中產類胡蘿卜素特性與其合成相關基因表達關系的研究
鄭晨華杜希萍李利君李天麗曹櫻倪輝,2
(1.集美大學食品與生物工程學院,廈門 361021;2.福建省食品微生物與酶工程重點實驗室,廈門 361021)
法夫酵母中產類胡蘿卜素特性與其合成相關基因表達關系的研究
鄭晨華1杜希萍1李利君1李天麗1曹櫻1倪輝1,2
(1.集美大學食品與生物工程學院,廈門 361021;2.福建省食品微生物與酶工程重點實驗室,廈門 361021)
為研究法夫酵母中類胡蘿卜素合成代謝調控機理,通過高效液相色譜法和實時定量PCR技術分別對JMU-VDL668和JMU-N3法夫酵母菌株中類胡蘿卜素和類胡蘿卜素合成相關基因的表達差異進行分析,并研究了在JMU-VDL668菌株培養過程中添加β-胡蘿卜素對其產蝦青素的影響。結果顯示,法夫酵母類胡蘿卜素代謝途徑的關鍵酶crtE,crtYB,crtI和crtS基因在JMUVDL668菌株中的表達水平整體低于JMU-N3菌株,而JMU-N3菌株中沒有檢測到crtR基因的表達。在JMU-VDL668菌株培養過程中添加β-胡蘿卜素發現,在72 h和96 h添加時能促進蝦青素的合成,其中96 h添加時所得蝦青素比對照組提高了83%。結果表明,這兩株菌的產類胡蘿卜素特性與類胡蘿卜素合成相關基因的表達量存在一定的正相關關系,且JMU-VDL668菌株中總類胡蘿卜素細胞產率在一定范圍內,可能存在反饋調節機制。
法夫酵母;蝦青素;實時定量PCR;代謝調控
蝦青素(3,3'-二羥基-4,4'-二β-胡蘿卜素)是一種橙紅色類胡蘿卜素,發現于多種微生物和海洋動物中,由于其獨特的共軛雙鍵結構和羥基,使得其具有比β-胡蘿卜素和番茄紅素更高的抗氧化活性。研究還發現蝦青素具有防皮膚癌、抗炎、抗胃癌活性、保肝、抗糖尿病、心血管疾病的預防、免疫反應、神經保護等作用,蝦青素由于其獨特的顏色和生物活性被廣泛應用于水產養殖、醫藥、保健食品、化妝品等行業中,具有巨大的前景價值[1]。
法夫酵母(Phafia rhodozyma/ Xanthophyllomyces dendrorhous)屬于真菌界、真菌門、半知菌亞門、擔子菌綱、隱球酵母科、法夫酵母屬[2,3],因其能天然合成蝦青素且具有發酵條件簡單易實現工業化生產等優點而受到廣泛關注。法夫酵母中蝦青素合成途徑經過學者們的研究已被報道[4,5],但是其調控機理還未完全闡明。法夫酵母中蝦青素合成途徑先由甲羥戊酸途徑(MVA)合成萜類化合物前體——異戊烯焦磷酸(IPP),IPP受異戊烯焦磷酸異構酶基因(idi)表達的異戊烯焦磷酸異構酶作用生成二甲基丙烯焦磷酸(DMAPP),之后DAMPP再結合兩分子的IPP生成法尼基焦磷酸(FPP),FPP在牻牛兒基牻牛兒基焦磷酸合成酶基因(crtE)表達的牻牛兒基牻牛兒基焦磷酸合成酶的作用下合成類胡蘿卜素合成前體——牻牛兒基牻牛兒基焦磷酸(GGPP)。GGPP之后再經過番茄紅素環化酶基因(crtYB)表達的八氫番茄紅素合成酶,和番茄紅素環化酶及八氫番茄紅素脫氫酶基因(crtI)表達的八氫番茄紅素脫氫酶催化生成β-胡蘿卜素,β-胡蘿卜素在蝦青素合成酶基因(crtS)表達的蝦青素合成酶的作用下合成最終產物蝦青素,其中蝦青素合成酶需要細胞色素P450還原酶基因(crtR)基因表達的細胞色素P450還原酶作為其輔酶[6]。
近年來有學者利用基因代謝工程技術,對類胡蘿卜素合成相關基因進行異源表達或過量表達研究法夫酵母中蝦青素合成途徑的代謝調控機理。Xie等[7,8]通過組合策略在釀酒酵母中構建一個可調控表達tHMG,crtE,crtYB和crtI基因的β-胡蘿卜素合成途徑,使β-胡蘿卜素產量提高300多倍,達到11 mg/g,之后又對前體FPP的上游、下游以及支路代謝流進行有序的調節,平衡類胡蘿卜素合成途徑中間產物的利用率,使得類胡蘿卜素的細胞產率達到20.79 mg/g;S?ren等[9]通過結合傳統誘變和基因工程技術的手段,在誘變得到高產蝦青素的法夫酵母菌株后過量表達tHMG、crtE、crtYB和crtS基因,最終得到一株蝦青素細胞產率達9.1 mg/g的蝦青素高產菌株;Shi等[10]通過比較不同溫度對釀酒酵母產β-胡蘿卜素以及相關基因的表達情況的影響,發現低溫促進β-胡蘿卜素的合成,同時相關基因的表達量也有少量提高;Csernetics等[11]通過在Mucor circinelloides中異源表達法夫酵母的crtS和crtR基因,總類胡蘿卜素的含量得到提高,同時蝦青素占總類胡蘿卜素比例比單獨表達crtS基因的高,說明crtR基因對crtS基因有協同促進作用。
本實驗室前期篩選得到兩株法夫酵母突變菌株,分別為JMU-VDL668和JMU-N3菌株,前者產蝦青素,但是總類胡蘿卜素細胞產率低。后者與前者相比積累較多的類胡蘿卜素,但是不產蝦青素。本研究從這兩株特征突變菌株出發,通過對這兩株菌的產類胡蘿卜素特性以及類胡蘿卜素合成相關基因的表達差異進行檢測,在代謝過程和基因表達兩個層面探索他們產類胡蘿卜素特性差異的原因,為進一步闡明蝦青素合成調控機理提供參考,同時也為后期對這兩株菌進行定向改造提供思路。
1 材料與方法
1.1 材料
1.1.1 菌種 JMU-VDL668和JMU-N3菌株由本實驗室保藏。
1.1.2 培養基 YPD培養基[12]:稱取10 g酵母膏、20 g蛋白胨溶解于900 mL水中,121℃高壓滅菌20 min,然后加入100 mL 200 g/L葡萄糖溶液(115℃高壓滅菌15 min)。
1.2 方法
1.2.1 種子液的培養 取-70℃保存的菌種,接種于裝有30 mL YPD培養基的250 mL搖瓶中,接種量為1 mL,22℃、190 r/min 條件下于搖床中培養3 d得1代搖瓶種子。取1 mL 1代搖瓶種子液轉接到新鮮的YPD培養基中,于相同的條件下培養48 h得到2代搖瓶種子。
1.2.2 搖瓶發酵培養 將5 mL搖瓶種子液接入裝有150 mL YPD培養基的500 mL搖瓶中,在22℃、190 r/min的條件下培養4 d,需要添加β-胡蘿卜素的樣品在設定的時間內添加4 mg/L β-胡蘿卜素。每12 h取樣一次。
1.2.3 生物量的測定 先將離心管置于105℃烘至恒重,稱重m1;取5 mL培養液加入離心管,離心棄上清,沉淀用蒸餾水洗滌兩遍,最后置于105℃烘至恒重,稱重m2;菌體干重m為m2、m1之差。
1.2.4 發酵液中殘糖的測定 采用DNS法[13](3,5-二硝基水楊酸法)測定發酵液中的還原糖。
1.2.5 總類胡蘿卜素含量的測定 采用二甲基亞砜(DMSO)法[2]破壁:取2.5 mL發酵液,離心后沉淀用蒸餾水洗滌2次,加入預熱至75℃的二甲基亞砜2 mL,充分振蕩搖勻后,加入5 mL乙醇振蕩均勻,3 500 r/min離心5 min取上清液,用乙醇定容至10 mL。紫外分光光度計在474 nm波長下進行檢測總類胡蘿卜素[14]。
1.2.6 類胡蘿卜素成分的測定 使用Aglient 1200高效液相色譜儀(G1315 DAD檢測器),Nova-Pak C18柱(3.9×150 mm,4 μm)檢測類胡蘿卜素中的不同成分,流速為1.0 mL/min,柱溫30℃,柱壓0-3 000 psi,進樣量20 μL,檢測波長474 nm。梯度條件如表1所示,用蝦青素、β-胡蘿卜素和β-隱黃質(Simga)標準品制作標準曲線。

表1 液相分析梯度條件
1.2.7 RNA的提取與逆轉錄 分別取24、36、48、60、72、84和96 h的發酵液,3 500 r/min,離心8 min收集法夫酵母菌體,然后用PBS緩沖液洗滌菌體兩次,對離心收集到的菌體進行液氮研磨。取0.1 g粉末,根據TRI REAGENT總RNA提取試劑盒使用說明提取法夫酵母總RNA。采用RS232C蛋白分析儀測定RNA的濃度及OD260/OD280值,并用2%的普通瓊脂糖凝膠電泳檢測RNA完整性,樣品保存于-70℃。利用TransScriptTMFirst-Strand cDNA Synthesis SuperMix(全式金)試劑盒對提取的RNA進行逆轉錄合成cDNA第一條鏈,作為后續實時定量PCR的模板。
1.2.8 引物的設計 選取法夫酵母中類胡蘿卜素合成相關基因crtE,crtYB,crtI,crtS和crtR基因進行實時定量檢測,β-actin作為內參基因。根據NCBI數據庫中法夫酵母β-actin,crtE,crtI,crtYB,crtS和crtR基因mRNA的序列,按照實時定量PCR引物設計原則[15],用Primer Premier 5.0軟件設計引物并合成,引物序列見表2。

表2 RT-qPCR引物序列
1.2.9 實時定量PCR擴增及數據分析 選用TransStart Top Green qPCR Mix(全式金)試劑盒,按說明書建立20 μL反應體系:SYBR GreenⅠMix(2×)10 μL,上下游引物各0.3 μL,Dye I 0.4 μL,cDNA模板2 μL,ddH2O 7.4 μL;反應程序:94℃ 30 s,94℃ 5 s,60℃ 31 s,40個循環。反應在ABI 7300實時定量PCR儀上進行,每個處理設置3次重復,記錄儀器輸出的RQ值,以β-actin基因為內參基因,所有結果以2-ΔΔCT法計算相對定量值。
2 結果
2.1 JMU-VDL668和JMU-N3菌株不同培養時間細胞生長特性比較
分析JMU-VDL668和JMU-N3菌株生物量隨時間變化趨勢(圖1-A),可知JMU-N3菌株生長旺盛,生長速率比JMU-VDL668菌株快,培養48 h生物量達到最大,為15.29 g/L,JMU-VDL668生物量最大可達12.22 g/L。48 h左右時JMU-VDL668和JMU-N3兩株菌進入穩定期,生物量略有下降,可能是由于細胞在生長后期破裂自溶引起的。
從圖1-B中可以看出,JMU-N3菌株的耗糖速率大于JMU-VDL668菌株。在培養36 h時,兩株菌培養基中的糖已基本耗盡,但對比這兩株菌的生長曲線,自36-48 h還有較大幅度的細胞增長,可能是因為在培養前期,培養基中葡萄糖濃度較高,產生了克雷布特里效應,對酵母的呼吸產生抑制作用,使酵母在發酵過程中生成乙醇、甘油等糖代謝副產物,葡萄糖耗盡后,解除了克雷布特里效應,菌株開始利用乙醇或甘油等糖代謝產物,所以可以繼續生長。隨著培養基中的葡萄糖消耗完全,兩株菌逐漸進入穩定期。
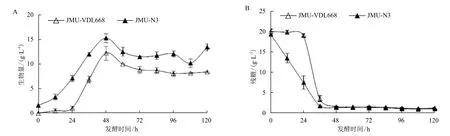
圖1 JMU-VDL668和JMU-N3菌株的細胞生長特性
2.2 JMU-VDL668和JMU-N3菌株的產類胡蘿卜素特性比較
JMU-VDL668和JMU-N3菌株的產類胡蘿卜素特效變化如圖2所示,JMU-VDL668菌株中的總類胡蘿卜素細胞產率低于JMU-N3菌株,其中以蝦青素為主。在整個發酵過程中,JMU-VDL668菌株中蝦青素的細胞產率始終占總類胡蘿卜素的80%以上,最高可達98.2%。在24-72 h期間JMU-VDL668菌株的總類胡蘿卜素和蝦青素均快速積累,隨后一段時間內總類胡蘿卜素和蝦青素的細胞產率變化不大,其中蝦青素細胞產率最高僅為0.25 mg/g。JMU-N3菌株中檢測到β-胡蘿卜素和β-隱黃質,但沒檢測到蝦青素,積累的類胡蘿卜素產物以蝦青素前體物質β-隱黃質為主,最高可達0.31 mg/g,而β-胡蘿卜素的細胞產率遠低于其下游產物β-隱黃質。總類胡蘿卜素細胞產率在0-108 h間不斷積累,至108 h時最高達0.52 mg/g。β-隱黃質的積累和總類胡蘿卜素積累的趨勢類似,β-胡蘿卜素在24 h處已達到最大積累量,僅為0.033 mg/g,隨后一直保持穩定。

圖2 JMU-VDL668(A)和JMU-N3(B)菌株的產類胡蘿卜素特性
2.3 JMU-VDL668和JMU-N3菌株中類胡蘿卜素相關基因表達差異
圖3顯示,crtE、crtYB、crtI和crtS基因均有在JMU-N3和JMU-VDL668菌株中表達。JMU-N3菌株不產蝦青素,卻有檢測到crtS基因的表達,而crtR基因則只在JMU-VDL668菌株中檢測到。JMU-N3菌株中crtE基因的表達量在24-96 h均高于JMUVDL668菌株,其中在72 h表達差異達到最大,到84 h表達差異顯著下降,到96 h又有所提高;crtYB基因的表達在整個發酵過程都高于JMU-VDL668菌株,其中分別在48 h和96 h有較大的表達差異;crtI基因的表達量在24-96 h均高于JMU-VDL668菌株,其中在24 h表達差異最大;crtS基因的表達量也在整個發酵過程均高于JMU-VDL668菌株,其中在96 h時表達差異較大。總體來說,JMU-N3菌株中crtE、crtYB、crtI和crtS基因的表達水平均比JMU-VDL668菌株的表達水平高。

圖3 JMU-VDL668和JMU-N3菌株中蝦青素合成途徑相關基因的表達差異結果
2.4 添加β-胡蘿卜素對JMU-VDL668菌株中產類胡蘿卜素的特性的影響
分析JMU-VDL668菌株中產類胡蘿卜素的特性可以看出,總類胡蘿卜素含量低可能是限制JMUVDL668菌株中蝦青素產量提高的因素。因此本研究在JMU-VDL668菌株培養的不同時間點添加4 mg/L β-胡蘿卜素,并檢測添加24 h后該菌產類胡蘿卜素的變化,采用SPSS軟件進行差異顯著性分析。結果(表3)顯示,與對照組相比,0 h添加β-胡蘿卜素,培養24 h后JMU-VDL668菌株的總類胡蘿卜素細胞產率提高到307 μg/g,β-胡蘿卜素細胞產率提高8倍,蝦青素細胞產率變化不大,表明0 h時JMU-VDL668菌株可以從外界攝入了β-胡蘿卜素,但是β-胡蘿卜素合成量的增加并不能提高蝦青素的細胞產率。在發酵24 h和36 h添加時,添加組和對照組總類胡蘿卜素細胞產率均在300 μg/g左右,添加組的不同類胡蘿卜素的細胞產率與對照組相比均無顯著差異,表明在這兩個時間點時JMU-VDL668菌株不能從外界攝入β-胡蘿卜素。在48 h添加時,兩個實驗組的類胡蘿卜細胞產率無明顯的差異,均大于400 μg/g,添加組的β-胡蘿卜素細胞產率為對照組的2倍,蝦青素細胞產率卻比對照組低了33 μg/g。在72 h和96 h添加時,添加組的總類胡蘿卜素細胞產率均在350 μg/g左右,高出實驗組近50 μg/g,β-胡蘿卜素和蝦青素的細胞產率均大于對照組,其中在96 h添加β-胡蘿卜素時JMU-VDL668菌株中蝦青素的細胞產率比對照組提高了83%。

表3 β-胡蘿卜素對JMU-VDL668菌株中類胡蘿卜素細胞產率/(μg·g-1)的影響
3 討論
蝦青素作為法夫酵母中的次級代謝產物,代謝途徑復雜,合成蝦青素的過程受多種機制的調控,其中類胡蘿卜素合成關鍵酶基因的表達水平直接影響法夫酵母菌株中類胡蘿卜素的合成,對類胡蘿卜素的合成具有重要作用[16]。本研究通過對JMU-VDL668和JMU-N3菌株進行發酵,結果發現JMU-N3菌株的生長速率較快,生物量也高于JMUVDL668菌株,葡萄糖的利用速率也比JMU-VDL668高,不過兩株菌的細胞生長的整體趨勢相差較小。兩株菌產類胡蘿卜素的特性發現JMU-N3菌株從發酵初期就迅速合成類胡蘿卜素,而JMU-VDL668菌株則是24 h后才開始迅速合成。JMU-VDL668菌株中總類胡蘿卜素細胞產率低于JUM-N3菌株,類胡蘿卜素的成分以蝦青素為主。JMU-N3菌株雖然積累較多的總類胡蘿卜素,但是其中主要為β-隱黃質,未檢測到蝦青素的合成。對JMU-N3和JMU-VDL668菌株中類胡蘿卜素合成相關基因的表達差異進行分析,發現兩者存在較顯著的差異,推測這兩株菌產類胡蘿卜素特性差異與類胡蘿卜素合成相關基因的表達差異存在一定的相關性。
法夫酵母中與類胡蘿卜素合成直接相關的關鍵酶基因有crtE、crtI和crtYB基因。Breitenbach等[17]在法夫酵母中過量表達crtE基因,其β-胡蘿卜素的產量增加了接近2倍,但蝦青素的含量卻沒有相應的提高;Miao等[18]發現在不同的生長時期,高產蝦青素的法夫酵母菌株的crtE基因的表達水平高于野生型菌株2-8倍,crtE的表達水平與GGPP的產量呈正相關,提高crtE的表達量在一定范圍內提高總類胡蘿卜素的含量;Verdoes等[19]將crtYB基因連接到一個同源的gpd啟動子上進行crtYB基因的過量表達,檢測到β-胡蘿卜素和海膽酮等產物的大量積累,由此推測可能是由于大量表達crtYB基因,導致更多的番茄紅素環化酶被合成,促進了雙環類胡蘿卜素的生產;Verdoes等[19]發現過量表達crtI基因則使類胡蘿卜素往單環途徑合成;Visser等[20]發現法夫酵母由crtI基因表達的八氫番茄紅素脫氫酶和crtYB基因表達的番茄紅素環化酶之間的競爭結果決定番茄紅素的代謝流是朝著β-胡蘿卜素轉化成蝦青素的方向,還是通過3,4-二氫番茄紅素生成HDCO。crtI基因的過量表達反而不利于雙環番茄紅素的大量積累,可能還需與crtYB基因協同調控才能起到促進蝦青素合成的作用。從這些學者的研究中可以發現,在crtI與crtYB基因協同作用的情況下,總類胡蘿卜素的含量與這3個基因的表達量呈正相關關系。本研究中JMU-N3菌株的crtE、crtI和crtYB基因的表達量整體均比JMU-VDL668菌株高,因此推測這些基因的高表達有可能是JMU-N3菌株中總類胡蘿卜素細胞產率較JMU-VDL668菌株高的主要原因。
crtS基因作為目前為止發現的唯一一個催化β-胡蘿卜素轉化成蝦青素過程中的基因,對于其表達的蝦青素合成酶的作用是同時具有酮化和羥化的功能還是只有羥化的功能還沒有定論[21,22],但是通過基因敲除以及比較高產菌株與低產菌株發現,crtS基因的表達與蝦青素產量存在正相關關系[18,23];Ukibe等[24]在釀酒酵母中異源表達來自法夫酵母中的crtI、crtYB和crtS基因時發現沒有蝦青素生成,但是在共表達來自法夫酵母的crtR基因后則有蝦青素合成,說明法夫酵母中crtS基因表達的蝦青素合成酶對于crtR基因表達的細胞色素P450還原酶有選擇特異性。crtS基因表達的蝦青素合成酶需要由crtR基因表達的細胞色素P450還原酶作為輔酶來完成從β-類胡蘿卜素到蝦青素的轉化[4],這些研究說明crtR基因對于蝦青素的合成是必不可少的。在本研究中JMU-VDL668菌株中的crtS基因整體表達量比JMU-N3菌株低,而JMU-N3菌株雖然有較高的crtS基因表達量,但是未檢測到crtR基因的表達,這個結果有可能是導致JMU-N3菌株不產蝦青素的主要原因。
本研究還在不同時間點往JMU-VDL668菌株的培養基中添加β-胡蘿卜素,結果發現在72 h和96 h添加時,JMU-VDL668菌株的蝦青素細胞產率得到一定的提高,其中在96 h添加β-胡蘿卜素時,JMUVDL668菌株中蝦青素的細胞產率與對照相比提高了83%,當吸收外界添加的β-胡蘿卜素后其蝦青素細胞產率就顯著提高,一定程度在代謝水平上解釋類胡蘿卜素合成相關基因的低表達有可能導致總類胡蘿卜素合成不足限制蝦青素的合成。Krivoruchko、Verwaal等[25,26]研究發現類胡蘿卜素因其高疏水性,只能儲存在膜系統中,如果大量積累的話會對細胞產生代謝壓力,不利于細胞生長。在本研究中也發現不同時間點添加β-胡蘿卜素時,添加組的總類胡蘿卜素細胞產率總是在300-400 μg/g之間。因此推測在JMU-VDL668菌種中總類胡蘿卜素的細胞產率可能存反饋調節機制,當JMU-VDL668自身合成的總類胡蘿卜素細胞產率低于這個范圍時,可以從環境中吸收β-胡蘿卜素,當高于這個范圍時則會受到反饋調節,抑制類胡蘿卜素的合成。
通過對JMU-VDL668和JMU-N3株菌在代謝水平和基因表達水平的研究發現,這兩株菌的產類胡蘿卜素特性與類胡蘿卜素合成相關基因的表達量可能存在一定的正相關關系,且JMU-VDL668菌株中總類胡蘿卜素細胞產率在一定范圍內,可能存在反饋調節機制。雖然通過提高類胡蘿卜素合成相關基因的表達量可以提高總類胡蘿卜素的產量,但是在微生物中,代謝產物的合成還受到轉錄后修飾,翻譯水平,酶的活性、基因和酶之間的相互關系等多方面的調控。結合本研究的一些發現以及Xie等[7]的研究結果表明,有效的提高法夫酵母中蝦青素含量不但要提高相關基因的表達水平,同時還需對法夫酵母中的蝦青素合成相關代謝流以及不同類胡蘿卜素合成相關基因之間的表達進行有序協調的控制。利用基因工程和代謝工程技術對法夫酵母菌株進行高效有目的性的改良還需對類胡蘿卜素合成途徑相關的調控機理進行更系統和深入的研究。
4 結論
本研究通過比較JMU-VDL668和JMU-N3株菌中產類胡蘿卜素特性,與類胡蘿卜素合成相關基因表達差異之間的關系來研究法夫酵母中的類胡蘿卜素合成的代謝調控機理。結果發現法夫酵母中類胡蘿卜素的合成和類胡蘿卜素合成相關基因的表達量存在一定的正相關關系,且crtR基因在蝦青素合成中具有重要作用。JMU-VDL668菌株中合成類胡蘿卜素相關基因的表達水平比JMU-N3菌株低,使得其總類胡蘿卜素細胞產率低,不能為蝦青素的合成提供足夠的前體,限制蝦青素的合成。而JMU-N3菌株中類胡蘿卜素合成相關基因的表達水平比JMUVDL668菌株高,使得其總類胡蘿卜素細胞產率比JMU-N3菌株高,但是由于crtR基因得不到表達或者表達量低,使得其不能產蝦青素。
[1] Ambati RR, Moi PS, Ravi S, et al. Astaxanthin:sources, extraction,stability, biological activities and its commercial applications—A Review[J]. Marine Drugs, 2014, 12(1):128-152.
[2] Johnson EA, Lewis MJ. Astaxanthin formation by the yeast Phaffia rhodozyma[J]. Journal of General Microbiology, 1979, 115(1):173-183.
[3] Johnson EA. Phaffia rhodozyma:colorful odyssey[J]. International Microbiology, 2003, 6(3):169-174.
[4] Verdoes JC, Sandmann G, Visser H, et al. Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous(Phaffia rhodozyma)[J]. Applied and Environmental Microbiology, 2003, 69(7):3728-3738.
[5] Schmidt I, Schewe H, Gassel S, et al. Biotechnological production of astaxanthin with Phaffia rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2011,89(3):555-571.
[6] Tao L, Wilczek J, Odom JM, et al. Engineering a β-carotene ketolase for astaxanthin production[J]. Metabolic Engineering, 2006, 8(6):523-531.
[7] Xie W, Liu M, Lv X, et al. Construction of a controllable β-carotene biosynthetic pathway by decentralized assembly strategy in Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering,2014, 111(1):125-133.
[8] Xie W, Ye L, Lv X, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 28:8-18.
[9] Gassel S, Breitenbach J, Sandmann G. Genetic engineering of the complete carotenoid pathway towards enhanced astaxanthin formation in Xanthophyllomyces dendrorhous starting from a highyield mutant[J]. Applied Microbiology and Biotechnology, 2014,98(1):345-350.
[10] Shi F, Zhan W, Li Y, et al. Temperature influences β-carotene production in recombinant Saccharomyces cerevisiae expressing carotenogenic genes from Phaffia rhodozyma[J]. World Journal of Microbiology and Biotechnology, 2014, 30(1):125-133.
[11] Cserneticsá, Tóth E, Farkas A, et al. Expression of Xanthophyllomyces dendrorhous cytochrome-P450 hydroxylase and reductase in Mucor circinelloides[J]. World Journal of Microbiology and Biotechnology, 2014, 31(2):321-336.
[12] 周德慶. 微生物學教程[M]. 北京:高等教育出版社, 1993.
[13] 王俊麗, 聶國興, 李素貞, 等. DNS法測定還原糖含量時最適波長的確定[J]. 河南農業科學, 2010(4):115-118.
[14] 倪輝. 法夫酵母蝦青素發酵條件的優化及提取與分析研究[D]. 杭州:浙江大學, 2005.
[15] Bustin SA. The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J]. Clin Chem, 2009, 55(3):611-622.
[16] Marcoleta A, Niklitschek M, Wozniak A, et al. Glucose and ethanoldependent transcriptional regulation of the astaxanthin biosynthesis pathway in Xanthophyllomyces dendrorhous[J]. BMC Microbiol,2011, 11:190.
[17] Breitenbach J, Visser H, Verdoes JC, et al. Engineering of geranylgeranyl pyrophosphate synthase levels and physiological conditions for enhanced carotenoid and astaxanthin synthesis in Xanthophyllomyces dendrorhous[J]. Biotechnology Letters, 2011, 33(4):755-761.
[18] Miao L, Chi S, Tang Y, et al. Astaxanthin biosynthesis is enhanced by high carotenogenic gene expression and decrease of fatty acids and ergosterol in a Phaffia rhodozyma mutant strain[J]. FEMS Yeast Research, 2011, 11(2):192-201.
[19] Verdoes J, Krubasik P, Sandmann G, et al. Isolation and functional characterisation of a novel type of carotenoid biosynthetic gene from Xanthophyllomyces dendrorhous[J]. Molecular and General Genetics MGG, 1999, 262(3):453-461.
[20] Visser H. Metabolic engineering of the astaxanthin-biosynthetic pathway of Xanthophyllomyces dendrorhous[J]. FEMS Yeast Research, 2003, 4(3):221-231.
[21] Ojima K, Breitenbach J, Visser H, et al. Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous(Phaffia rhodozyma)and its assignment as a β-carotene 3-hydroxylase/4-ketolase[J]. Molecular Genetics and Genomics, 2006, 275(2):148-158.
[22] lvarez V, Rodríguez-Sáiz M, De La Fuente JL, et al. The crtS gene of Xanthophyllomyces dendrorhous encodes a novel cytochrome-P450 hydroxylase involved in the conversion of β-carotene into astaxanthin and other xanthophylls[J]. Fungal Genetics and Biology,2006, 43(4):261-272.
[23] Lodato P, Alcaíno J, Barahona S, et al. Expression of the carotenoid biosynthesis genes in Xanthophyllomyces dendrorhous[J]. Biological Research, 2007, 40(1):73-84.
[24] Ukibe K, Hashida K, Yoshida N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied and Environmental Microbiology,2009, 75(22):7205-7211.
[25] Krivoruchko A. Opportunities for yeast metabolic engineering:Lessons from synthetic biology[J]. Biotechnology Journal, 2011,6(3):262-276.
[26] Verwaal R, Wang J, Meijnen JP, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous[J]. Applied and Environmental Microbiology, 2007,73(13):4342-4350.
(責任編輯 李楠)
The Relationship Between Characteristics of Yielding Carotenoid and Expression of Carotenogenic Genes in Phaffia rhodozyma
ZHENG Chen-hua1DU Xi-ping1LI Li-jun1LI Tian-li1CAO Ying1NI Hui1,2
(1. College of Food and Biological Engineering,Jimei University,Xiamen 361021;2. Key Laboratory of Food Microbiology and Enzyme Engineering of Fujian Province,Xiamen 361021)
In order to study the metabolic regulation mechanism of carotenoid synthesis in Phaffia rhodozyma, the carotenoid biosynthesis characteristics and the expression differences of carotenogenic genes in different strains of P. rhodozyma, JMU-VDL668 and JMU-N3 were analyzed by HPLC and real-time qPCR, respectively. The effects of adding β-carotene during the culture of strain JMU-VDL668 to the yield of astaxanthin were also analyzed. The results showed that, the expression levels of the carotenogenic genes crtE, crtI, crtYB and crtS of key enzymes in the metabolic pathway of carotenoid in P. rhodozyma were lower in JMU-VDL668 than JMU-N3, even the expression of crtR was not detected in JMU-N3. The synthesis of astaxanthin increased when β-carotene was added at 72 h and 96 h of culturing JMU-VDL668, and the astaxanthin increased 83% while adding β-carotene at 96 h compared to the control group. The results indicated that the characteristics of yielding carotenoid was positively correlated to the expression level of carotenogenic genes. Moreover, the productivity of cells for total carotenoid in JMU-VDL668 was in a certain range, suggesting that there was a feedback regulation.
Phaffia rhodozyma;astaxanthin;real-time qPCR;metabolic regulation
10.13560/j.cnki.biotech.bull.1985.2016.02.016
2015-04-30
國家自然科學基金項目(20702019),福建省自然科學基金項目(2012J01137),集美大學校科研啟動金項目(ZQ2007009)
鄭晨華,男,碩士,研究方向:微生物遺傳育種;E-mail:zch52840@163.com
李利君,女,博士,副教授,研究方向:微生物遺傳育種;E-mail:ljli@jmu.edu.cn

