高錳酸鉀及其性質系列實驗的探究
孫重陽 許燕紅 陳翩
摘要:探究了高錳酸鉀的部分性質。結果表明,其固體的熱穩定性較差,溶液的熱穩定性較好,對非金屬的腐蝕性和氧化性較強,對金屬則不明顯。介紹了高錳酸鉀主要的制備方法及其在醫藥衛生、工業生產等方面的應用價值。
關鍵詞:高錳酸鉀;理化性質;系列實驗;制備方法;實驗探究
文章編號:1005–6629(2016)9–0068–04 中圖分類號:G633.8 文獻標識碼:B
高錳酸鉀是中學生較早認識,也是接觸較多的化學物質,據對人教版九年級《化學》和高中選修5《有機化學基礎》教材的不完全統計(見表1),從氧氣的制備到有機物的檢驗,都一直存在著高錳酸鉀的身影。除了在教材中頻頻出現,高錳酸鉀在各種教輔和試題中也被視為考查熱點[1],總之對學生而言可謂耳熟能詳,因此在化學學習中具有重要的作用和意義。但回顧教材,僅僅在九年級學習氧氣制備時,簡單地介紹了“高錳酸鉀是一種暗紫色的固體,它受熱時,分解出氧氣,同時還有錳酸鉀和二氧化錳生成”[2],此外并無其他詳細資料,而相關文獻也大多集中在具體性質和應用上[3,4],并無系統闡述。鑒于此,為了便于師生更好地了解和應用,現從理化性質、制備方法和應用價值三個方面對高錳酸鉀進行系統分析,并通過實驗重點探究高錳酸鉀的穩定性、腐蝕性和氧化性。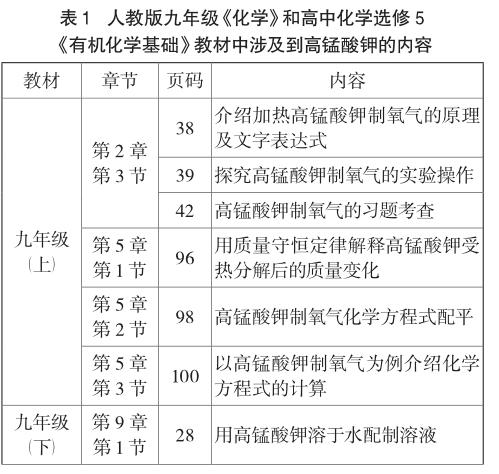
1 高錳酸鉀的物理性質
高錳酸鉀,俗稱“灰錳氧”、“PP粉”,是一種無機化合物,常溫常壓下為深紫色細長斜方柱狀晶體,有金屬光澤(見圖1)。易溶于水和堿液,水溶液呈紫色,微溶于乙醇、丙酮和硫酸。密度小(25℃時為1.01 g/mL),熔點為240℃。
2 高錳酸鉀的化學性質
2.1 穩定性
高錳酸鉀加熱可以分解產生氧氣,教材上的方程式為:2KMnO4△=K2MnO4+MnO2+O2↑,那么其分解溫度是多少?分解產物是否如方程式所示?它的水溶液又是否具有穩定性?我們設計以下實驗進行探究。
2.1.1 實驗用品
高錳酸鉀(純度為99.9%)、蒸餾水、容量瓶、量筒、膠頭滴管、試管、試管夾、恒溫水槽、溫度傳感器、電子天平、酒精燈
2.1.2 實驗步驟及現象
用電子天平稱取0.57g高錳酸鉀放入試管底部,在酒精燈上緩慢加熱,稱量剩余固體質量,測量溫度,記錄數據如表2。再稱量3.95g高錳酸鉀,用容量瓶配制成0.1 mol/L的中性溶液250mL,然后分別稀釋成0.05 mol/L、0.01 mol/L、0.001 mol/L不同濃度的溶液。用燒杯取不同濃度的高錳酸鉀溶液各50mL置于恒溫水槽,調至30℃、40℃、50℃并保持加熱5min,將燒杯取出擦干凈稱量質量變化,實驗數據如表3。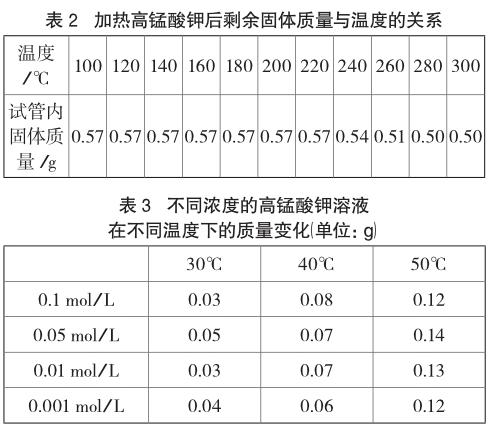
2.1.3實驗結論與啟示
由表3可以看出,同一濃度的高錳酸鉀溶液溫度越高質量減少越大,但相同溫度下不同濃度溶液之間質量變化的差異性并不明顯。總體來看相對于50mL的高錳酸鉀溶液而言,減少的質量微乎其微,再除去水分的蒸發基本可以忽略不計,這是因為高錳酸鉀溶液就算煮沸也達不到分解溫度。由此可以認為中性高錳酸鉀溶液相對穩定,可以長期存放[7]。
2.2 腐蝕性
實驗操作中,若不慎將高濃度的高錳酸鉀溶液觸及手上,會出現暗黃色塊,這說明其對皮膚組織有腐蝕性,那它的腐蝕性只是針對皮膚還是所有物質?為此,我們進行如下實驗探究。
2.2.1 實驗用品
0.1 mol/L的高錳酸鉀溶液、鋅粉、鐵粉、銅粉、硫粉、活性炭顆粒、聚氯乙烯、橡膠、豬皮、電子天平、試管、藥匙、鑷子、量筒、膠頭滴管
2.2.2 實驗步驟及現象
常溫下,分別稱取下列0.50g物質(聚氯乙烯、橡膠、豬皮為塊狀,其余均為粉末),放入不同試管中,再分別添加實驗2.1剩余的0.1 mol/L高錳酸鉀溶液5mL,觀察實驗現象,記錄如下: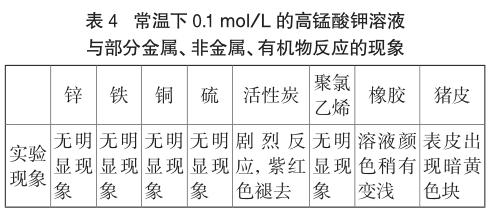
2.2.3實驗結論與啟示
由上表可以看出,常溫下高錳酸鉀溶液與金屬并無明顯反應現象,說明對金屬幾乎無腐蝕作用。但在實驗室中,卻會看到高錳酸鉀溶液腐蝕水管等金屬材料,這又是怎么回事?這是因為實驗室中高錳酸鉀溶液的配制多為酸性或堿性,與合金材料接觸就能形成原電池。合金中不同成分構成正負極,酸性或堿性高錳酸鉀溶液充當電解液,發生電化學腐蝕[8]。
對于非金屬單質,高錳酸鉀溶液與碳的反應現象明顯,腐蝕性強;與硫不反應,無腐蝕性。而對于有機物,飽和的聚氯乙烯不能被腐蝕,不飽和的橡膠易被腐蝕,對皮膚組織的腐蝕較強。總而言之,常溫下高錳酸鉀溶液的腐蝕性要視具體物質而言,主要是針對有機物,因此存放時不能使用橡膠塞,取用要小心操作或戴上手套防止腐蝕皮膚。
2.3 氧化性
高錳酸鉀在中學化學中最多的是被用作強氧化劑,因而成為眾多還原性物質的鑒定試劑。那它的氧化性到底有多強?是否都能氧化常見的還原劑?將其和濃硝酸對比,進行了如下的實驗探究。
2.3.1 實驗用品
0.1 mol/L的高錳酸鉀溶液、濃硝酸、鋅粉、鐵粉、銅粉、硫粉、活性炭顆粒、聚氯乙烯、橡膠、乙醇、乙醛、濃鹽酸、試管、電子天平、藥匙、量筒、膠頭滴管、鑷子
2.3.2 實驗步驟及現象
常溫下,分別稱取下列0.50g物質(聚氯乙烯、橡膠、豬皮為塊狀,其余固體均為粉末),放入不同試管中,再分別添加實驗2.1剩余的0.1 mol/L高錳酸鉀溶液和濃硝酸各5mL,觀察實驗現象,記錄如表5。將與高錳酸鉀溶液無明顯反應現象的幾組物質平均分為兩份,分別滴加2滴濃H2SO4和NaOH溶液,觀察現象如表6。
2.3.3 實驗結論與啟示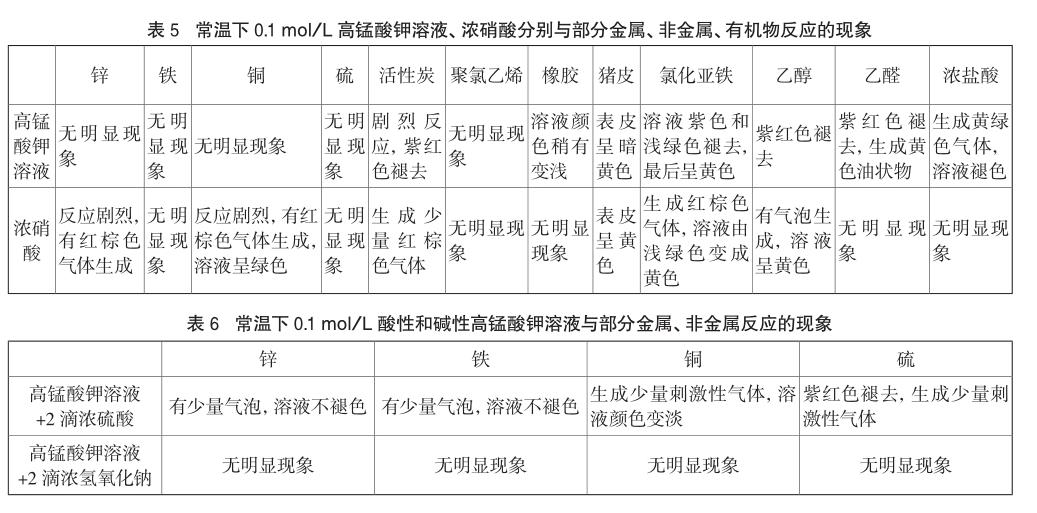
從表5可以看出,高錳酸鉀溶液不與金屬反應,而濃硝酸除了與鐵鈍化,和其他金屬均劇烈反應,這說明對于金屬濃硝酸氧化能力更強。對于有機物,高錳酸鉀可以氧化乙醇和乙醛,氧化能力較強,而與濃鹽酸的反應中,可以看出高錳酸鉀的氧化性更勝一籌。總之兩者和不同的物質反應現象和本質并不相同,不能直接進行對比。但從中可以初步得出結論,高錳酸鉀的氧化性主要針對兩類物質:低價態離子和有機物,再加上本身自帶指示劑的作用,因而成為不少物質的首選鑒定劑。
結合表5和表6,可以看出酸堿度對高錳酸鉀的氧化能力有一定的影響,這是因為pH會改變其標準氧化還原電位,具體規律為高錳酸鉀在酸性、中性、堿性條件下的氧化性依次減弱[9]。因此,在選擇高錳酸鉀作為氧化劑時,可以根據還原劑的特性和要求,適當調節pH來提升氧化能力和效率。
3 高錳酸鉀的制備方法
1659年西方人首次發現高錳酸鉀,隨著其在生活生產中的廣泛應用,人們開始不斷探索不同的制備方法。當前國內外高錳酸鉀的制備總的分為兩種方法:一步法和兩步法[10],具體見表7。
在以上眾多的制備方法中,很多都未能突破耗能高的瓶頸,因此要投入大規模的工業化生產,還需要進一步的探索。相比之下,液相法生產設備簡單,反應時間短,熔體攪拌動力消耗小且無粉塵,所得產品純度高,具有節能、環保、高效的特點,是世界高錳酸鉀工業的主要發展方向。
4 高錳酸鉀的應用價值
高錳酸鉀氧化性強、色彩鮮艷,應用廣泛,按照應用領域主要分為以下四個方面:
(1)化學藥品方面,作糖精、異煙肼、維生素C等物質的氧化劑,實驗室氧氣、氯氣等物質制備的原料,有機物的鑒定劑。
(2)醫藥衛生方面,一定濃度的高錳酸鉀溶液可以作身體傷口或其他部位的殺菌劑,也可以作室內或公共場合的除臭劑和消毒劑。
(3)工業生產方面,在廢水處理中作處理劑,除去硫化氫、鐵、有機物等各種污染物;在采礦冶金中,用于金屬的除雜和分離。
(4)生活用品方面,用作特殊紡織品、樹脂、油脂的漂白劑,也可以用作木材表面的著色劑。
參考文獻:
[1]王開山.例析化學試題中對高錳酸鉀強氧化性的考查[J].中學生理科應試,2016,(1):43~44.
[2]課程教材研究所化學課程教材研究開發中心.義務教育課程標準實驗教科書·化學(九年級上冊)[M].北京:人民教育出版社,2006:38.
[3]閆肅.談高錳酸鉀在給水處理中的應用[J].山西建筑,2013,(23):97~98.
[4]謝曉青,王偉群,顧菲菲.影響草酸與酸性高錳酸鉀溶液反應速率因素的探究[J].化學教學,2012,(12):56~59.
[5]王克強,馮瑞英.高錳酸鉀制取氧氣時的異常產率分析[J].化學教學,2001,(4):8~9.
[6]黃晗達,李友銀.高錳酸鉀加熱分解過程研究[J].化學教育,2009,(2):65~76.
[7]丁建剛,黃桂榮,王偉.中性高錳酸鉀溶液穩定性研究[J].中國環境監測,2006,(1):49~50.
[8]杜敦帥.鐵在堿性高錳酸鉀溶液中發生電化學腐蝕的實驗研究[J].中學化學教學參考,2014,(4):57.
[9]劉訓波.為什么一定要選擇“酸性”高錳酸鉀溶液[J].中學化學教學參考,2015,(4):59.
[10]彭東,王吉坤,馬進等.國內外高錳酸鉀制備方法概述[J].中國錳業,2011,(8):10~12.

