低氧環(huán)境下小鼠腎小球內(nèi)皮細(xì)胞通透性的變化及其機制
王妍君,羅朋立
(青海大學(xué)附屬醫(yī)院,西寧810001)
?
低氧環(huán)境下小鼠腎小球內(nèi)皮細(xì)胞通透性的變化及其機制
王妍君,羅朋立
(青海大學(xué)附屬醫(yī)院,西寧810001)
目的觀察低氧環(huán)境對小鼠腎小球內(nèi)皮細(xì)胞(MGEC)透通性的影響,并探討其機制。方法 取處于對數(shù)生長期的MGEC,將細(xì)胞分為低氧1組、低氧2組、抑制劑1組、抑制劑2組和對照組。低氧1、2組分別在10%、5%氧濃度的低氧環(huán)境中培養(yǎng)36 h;抑制劑1、2組細(xì)胞先加入重組人VEGF抑制劑繼續(xù)培養(yǎng)48 h,然后分別在10%、5%氧濃度的低氧環(huán)境培養(yǎng)36 h;對照組細(xì)胞常規(guī)培養(yǎng),不做特殊處理。各組細(xì)胞分別于低氧處理0、12、24、36 h測算單層MGEC對白蛋白的通透率,反映細(xì)胞通透性;采用real-time PCR法檢測小鼠MGEC中的VEGF mRNA。結(jié)果 低氧1組、低氧2組培養(yǎng)0、12、24、36 h時細(xì)胞通透率逐漸升高,同組不同時點相比,P均<0.05;低氧1、2組培養(yǎng)12、24、36 h細(xì)胞通透率高于抑制劑1、2組及對照組(P均<0.05)。低氧處理12、24、36 h低氧2組細(xì)胞通透率高于低氧1組。低氧1、2組培養(yǎng)0、12、24、36 h時細(xì)胞中VEGF mRNA相對表達(dá)量均逐漸升高,組內(nèi)不同時點相比,P均<0.05;低氧1、2組培養(yǎng)12、24、36 h細(xì)胞中VEGF mRNA相對表達(dá)量高于抑制劑1、2組及對照組,且低氧2組VEGF mRNA相對表達(dá)量高于低氧1組(P均<0.05)。結(jié)論 低氧環(huán)境下小鼠MGEC通透性升高,可能與細(xì)胞中VEGF mRNA表達(dá)上調(diào)有關(guān)。
低氧損傷;腎小球內(nèi)皮細(xì)胞;細(xì)胞通透性;血管內(nèi)皮生長因子
內(nèi)皮細(xì)胞有著復(fù)雜的生理和代謝功能,其結(jié)構(gòu)和功能受損已被確認(rèn)是創(chuàng)傷、休克、急性呼吸窘迫綜合征、多器官功能衰竭、腫瘤等多種疾病發(fā)生的病理基礎(chǔ)之一[1~3]。腎小球內(nèi)皮細(xì)胞(MGEC)可維持腎小球毛細(xì)血管結(jié)構(gòu)的完整性和濾過障礙功能,維持和調(diào)節(jié)腎小球血流動力學(xué)功能,還有抗凝、防血栓形成的作用。MGEC損傷后,細(xì)胞發(fā)生變性、脫落、增生[4,5]。低氧狀態(tài)可誘導(dǎo)一系列與血管新生、能量代謝、腫瘤轉(zhuǎn)移等密切相關(guān)的基因表達(dá),幫助機體適應(yīng)低氧微環(huán)境[6,7]。缺氧導(dǎo)致的MGEC完整性被破壞、通透性改變是腎臟組織病理改變和功能紊亂發(fā)生的重要原因[8,9]。2013年6月~2015年7月,本研究觀察了低氧環(huán)境對小鼠MGEC透通性的影響,并探討其機制,現(xiàn)報告如下。
1 材料與方法
1.1細(xì)胞與材料小鼠MGEC購自上海斯信生物科技有限公司,加入PRMI1640培養(yǎng)基,接種于24孔板,在5% CO2培養(yǎng)箱中培養(yǎng)。重組人VEGF抑制劑購自上海斯信生物科技有限公司,Streptavidin、HRP-streptavidin、生物素標(biāo)記牛血清白蛋白(Biotin-BSA)均購自西寧城北默克實驗儀器經(jīng)營部,其余試劑均為分析純。酶聯(lián)包被緩沖液(NaHCO30.05 mmol/L,Na2CO30.05 mmol/L,pH 9.6),PBS-BSA封閉液(NaCl 140 mmol/L,KCl 2.7 mmol/L,Na2HPO44.3 mmol/L,K2HPO41.4 mmol/L,0.5 %BSA,pH 7.4),PBS(含0.1%Tween-20,pH 7.4),PBS(含0.5%BSA、0.1%Tween-20)。
1.2細(xì)胞分組與低氧處理方法取處于對數(shù)生長期的小鼠MGEC,將細(xì)胞分為低氧1組、低氧2組、抑制劑1組、抑制劑2組和對照組。低氧1、2組分別在10%、5%氧濃度的低氧環(huán)境中培養(yǎng)36 h;抑制劑1、2組細(xì)胞先加入重組人VEGF抑制劑繼續(xù)培養(yǎng)48 h,然后分別在10%、5%氧濃度的低氧環(huán)境培養(yǎng)36 h;對照組細(xì)胞常規(guī)培養(yǎng),不做特殊處理。
1.3小鼠MGEC通透性檢測各組分別于低氧處理0、12、24、36 h參考文獻(xiàn)[10]的方法檢測細(xì)胞通透性。細(xì)胞通透性檢測裝置由6孔細(xì)胞培養(yǎng)板和微孔細(xì)胞培養(yǎng)嵌套組成。微孔細(xì)胞培養(yǎng)嵌套置于6孔培養(yǎng)板的小井中,構(gòu)成兩個相對隔離的小室(內(nèi)室和外室)。用PBS將Biotin-BSA稀釋為10 g/L,取15 μL加入內(nèi)室細(xì)胞培養(yǎng)液中,使Biotin-BSA 終濃度為100 mg/L,同時加入不同劑量的VEGF,定期收集內(nèi)室和外室培養(yǎng)液各10 μL,計算單層MGEC對Biotin-BSA的通透率(反映MGEC通透性):外室Biotin-BSA濃度/內(nèi)室Biotin-BSA濃度×100%。
1.4小鼠MGEC中VEGF mRNA檢測根據(jù)GenBank 提供Rat mRNA序列,采用Primer E×Press2.0軟件進(jìn)行引物設(shè)計。VEGF引物:上游5′-GGTGAGAGGTCTACTAGTTCCGA-3′,下游5′-CCATGAACTTTCTGCTCTTC-3′;GAPDH引物:上游5′-GTGCCAAAAGGGTCATCATCTC-3′,下游5′-GGTTCACACCCATCACAAACATG-3′;U6引物:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。分別于低氧處理0、12、24、36 h取各組細(xì)胞提取總RNA,取2 μg總RNA進(jìn)行逆轉(zhuǎn)錄合成cDNA,進(jìn)行real-time PCR反應(yīng)。PCR反應(yīng)體系包括DEPC水5.3 μL、real-time PCR緩沖液2 μL、上下游引物各0.1 μL、RNA酶抑制劑0.1 μL、混合酶0.4 μL、底物1 μL。PCR反應(yīng)條件:94 ℃預(yù)變性2 min,94 ℃ 15 s、64 ℃ 35 s擴增40個循環(huán),70 ℃ 5 min,64 ℃ 35 s。讀取熒光,以2-ΔΔCt表示目的基因的相對表達(dá)量。

2 結(jié)果
2.1各組細(xì)胞通透率比較低氧1組、低氧2組低氧處理0、12、24、36 h時細(xì)胞通透率逐漸升高,組內(nèi)不同時點相比,P均<0.05;低氧1、2組低氧處理12、24、36 h細(xì)胞通透率高于抑制劑1、2組及對照組(P均<0.05)。低氧處理12、24、36 h低氧2組細(xì)胞通透率高于低氧1組。詳見表1。

表1 各組細(xì)胞通透率比較
注:與同組培養(yǎng)0 h時相比,aP<0.05;與同組培養(yǎng)12 h時相比,bP<0.05;與同組培養(yǎng)24 h時相比,cP<0.05;與同時點抑制劑1組、抑制劑2組、對照組相比,*P<0.05。
2.2各組細(xì)胞中VEGF mRNA表達(dá)比較低氧1、2組培養(yǎng)0、12、24、36 h時細(xì)胞中VEGF mRNA相對表達(dá)量均逐漸升高,同組不同時點相比,P均<0.05;低氧1、2組培養(yǎng)12、24、36 h細(xì)胞中VEGF mRNA相對表達(dá)量高于抑制劑1、2組及對照組,且低氧2組VEGF mRNA相對表達(dá)量高于低氧1組(P均<0.05)。詳見表2。
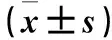
表2 各組細(xì)胞中VEGF mRNA相對表達(dá)量比較
注:與同組培養(yǎng)0 h時相比,aP<0.05;與同組培養(yǎng)12 h時相比,bP<0.05;與同組培養(yǎng)24 h時相比,cP<0.05;與同時點抑制劑1組、抑制劑2組、對照組相比,*P<0.05;與低氧1組相比,#P<0.05。
3 討論
MGEC是覆蓋于腎小球毛細(xì)血管壁腔側(cè)的內(nèi)皮細(xì)胞,與血流直接接觸,對白細(xì)胞、細(xì)菌有黏附作用,對基底膜有修復(fù)作用。有研究[11]認(rèn)為,低氧狀態(tài)會影響MGEC對NO的分泌功能。NO為內(nèi)皮源性舒張因子,生理水平的NO具有維持腎臟血流量、抗氧化應(yīng)激、降低內(nèi)皮細(xì)胞對蛋白質(zhì)的通透性及抑制血小板聚集等作用。而低氧狀態(tài)下MGEC分泌的NO水平降低,導(dǎo)致機體血管內(nèi)皮功能紊亂,破壞MGEC的完整性、通透性,最終導(dǎo)致腎臟組織發(fā)生病理改變和功能紊亂。蛋白尿是腎臟疾病常見臨床表現(xiàn),其與腎小球濾過膜通透性增高密切相關(guān)。MGEC是濾過膜的主要組成部分,其通透性改變將直接影響腎小球濾過膜的功能[12]。
VEGF在血管形成和病理血管生長過程中都發(fā)揮重要作用,低氧是引起VEGF表達(dá)的強效誘導(dǎo)劑[11]。VEGF具有調(diào)節(jié)調(diào)節(jié)血管生成、血管通透性和血管活性物質(zhì)合成等功能,其中調(diào)節(jié)血管生成是VEGF最重要的作用[13,14]。研究[15]發(fā)現(xiàn),小鼠在低氧環(huán)境中腦組織中VEGF表達(dá)最多,腎臟、睪丸、肺和肝臟的表達(dá)也有所增加。在體內(nèi),低氧可損害血腦屏障,引起血管源性腦水腫。低氧環(huán)境下,腦組織中VEGF mRNA及蛋白表達(dá)上調(diào),其表達(dá)水平與低氧程度有關(guān)。低氧時,體外培養(yǎng)的腦血管內(nèi)皮細(xì)胞對熒光素鈉的通透性較正常情況下增加2倍,而使用VEGF抗體中和VEGF則可消除低氧引起的腦血管通透性增高,這表明低氧時腦VEGF表達(dá)增加,是低氧引起腦血管內(nèi)皮細(xì)胞通透性增高的重要機制之一[16]。
VEGF在腎臟主要分布于MGEC及腎小球足細(xì)胞,其在MGEC中的作用機制目前尚不清楚。VEGF在病理狀態(tài)的腎臟組織中高表達(dá),且與蛋白尿程度呈正相關(guān)關(guān)系。MGEC是腎臟濾過屏障的重要組成部分,也是VEGF作用的靶細(xì)胞,VEGF可能通過增加其通透性在腎臟病患者蛋白尿形成中發(fā)揮作用,但上述觀點尚未得到充分的證據(jù)來證實[17,18]。本研究參考鮑永霞等[19]的研究,選擇10%和5%的氧濃度制作低氧模型。本研究分別采用10%、5%氧濃度條件培養(yǎng)小鼠MGEC,結(jié)果顯示低氧1組、低氧2組培養(yǎng)0、12、24、36 h時細(xì)胞通透率逐漸升高,且高于抑制劑1、2組及對照組,低氧處理12、24、36 h低氧2組細(xì)胞通透率高于低氧1組。提示低氧可造成MGEC通透性增高,且氧濃度越低對MGEC的損害越嚴(yán)重。本研究結(jié)果還顯示,低氧1、2組培養(yǎng)0、12、24、36 h時細(xì)胞中VEGF mRNA相對表達(dá)量均逐漸升高,高于抑制劑1、2組及對照組,且低氧2組VEGF mRNA相對表達(dá)量高于低氧1組,推測低氧狀態(tài)下VEGF表達(dá)上調(diào)可能與MGEC通透率增高有關(guān)。
目前對VEGF介導(dǎo)低氧性血管內(nèi)皮通透性增高相關(guān)的信號傳導(dǎo)通路還不了解。阻斷絲裂原蛋白激酶(MAPK)和蛋白C對血管內(nèi)皮通透性沒有影響,說明MAPK和蛋白C在低氧和VEGF誘導(dǎo)的血管內(nèi)皮通透性增高的病理過程中無明顯作用[20]。低氧和VEGF誘導(dǎo)的血管內(nèi)皮通透性增高與磷脂酶Cγ、磷脂酰肌醇3激酶和蛋白激酶G的激活有關(guān)。低氧可造成細(xì)胞膜緊密連接蛋白(閉鎖小帶1、閉鎖小帶2)間斷表達(dá),閉鎖小帶1、閉鎖小帶2的表達(dá)從細(xì)胞膜移至細(xì)胞質(zhì)甚至細(xì)胞核內(nèi),而阻斷磷脂酶Cγ、磷脂酰肌醇3激酶和蛋白激酶G則可消除低氧引起的這些改變,提示低氧或VEGF可通過重新排列內(nèi)皮細(xì)胞膜上的緊密連接蛋白引起血管內(nèi)皮細(xì)胞通透性增高。低氧時內(nèi)質(zhì)網(wǎng)儲存的鈣離子釋放入胞質(zhì),可能是低氧時VEGF表達(dá)增加的信號傳遞物質(zhì)。
綜上所述,低氧狀態(tài)可造成小鼠MGEC通透性增高,細(xì)胞中VEGF mRNA表達(dá)上調(diào),低氧對MGEC通透性的影響可能是通過調(diào)節(jié)VEGF表達(dá)實現(xiàn)的。
[1] 李明紅,袁志兵,高鈺琪.白藜蘆醇對低氧內(nèi)皮細(xì)胞炎癥反應(yīng)的影響及機制研究[J].中國病理生理雜志,2015,31(10):1798.
[2] 閆鎮(zhèn)楠,馮紅,劉衛(wèi).血管內(nèi)皮細(xì)胞低氧損傷的分子機制[J].長治醫(yī)學(xué)院學(xué)報,2014,28(1):71-74.
[3] 吳勝春,石曉明,楊永賓,等.低氧狀態(tài)下血管內(nèi)皮細(xì)胞HIF-1α表達(dá)及與細(xì)胞凋亡的關(guān)系[J].中國現(xiàn)代醫(yī)學(xué)雜志,2014,24(10):6-10.
[4] 張洋,馬坤嶺,王桂花,等.血小板微粒活化促進(jìn)糖尿病腎病腎小球內(nèi)皮細(xì)胞損傷[J].中國藥理學(xué)通報,2015,31(B11):109.
[5] 伍俊霞,周蕓.腎小球內(nèi)皮細(xì)胞改變及其在慢性腎臟病發(fā)病機制中的作用研究進(jìn)展[J].國際移植與血液凈化雜志,2015,13(3):5-8.
[6] Haris AL. Hypoxia: a key regulatory factor in tumor growth[J]. Nat Rev Cancer, 2002,2(1): 38247.
[7] Semenza GL, Agani F, Booth G, et al. Structural and functional analysis of hypoxia- inducible factor 1[J]. Kidney Int, 1997,5(4):553.
[8] 張競丹,楊丹鳳,曹燕卿,等.低溫低氧復(fù)合應(yīng)激對大鼠肺微血管內(nèi)皮細(xì)胞的損傷作用研究[J].中國應(yīng)用生理學(xué)雜志,2013,29(3):219-223.
[9] 陳小菊,程德云,樊莉莉.低氧對大鼠肺動脈平滑肌細(xì)胞和肺微血管內(nèi)皮細(xì)胞表達(dá)及分泌fractalkine的影響[J].四川大學(xué)學(xué)報(醫(yī)學(xué)版),2012,43(5):661-665.
[10] 陳朝紅,劉志紅,余晨,等.一種體外研究腎小球內(nèi)皮細(xì)胞通透性的方法[J].腎臟病與透析腎移植雜志,2002,11(5):497-500.
[11] 梁立峰,張惠莉,羅朋立,等.低氧、高糖對腎小球內(nèi)皮細(xì)胞膜表面多糖-蛋白復(fù)合物厚度影響的分析[J].中國糖尿病雜志,2015,23(12):1103-1105.
[12] 何珊,趙儷月,巴曉曄,等.苯妥英鈉對大鼠骨髓間充質(zhì)干細(xì)胞與血管內(nèi)皮細(xì)胞VEGF和SCF分泌的影響[J].西安交通大學(xué)學(xué)報:醫(yī)學(xué)版,2016,37(2):204-208.
[13] 胡義杰,李志平,陳建明,等.低氧誘導(dǎo)肺動脈內(nèi)皮細(xì)胞轉(zhuǎn)分化的初步機制研究[J].局解手術(shù)學(xué)雜志,2013,22(6):594-596.
[14] 王德光,李學(xué)旺,李航,等.胰島素通過激活P13K/mTOR通路誘導(dǎo)人腎小球系膜細(xì)胞血管內(nèi)皮細(xì)胞生長因子轉(zhuǎn)錄[J].中國糖尿病雜志,2009,17(4):308-310.
[15] Mo SJ, Hong J, Chen X, et al. VEGF-mediated NF-κB activation protects PC12 cells from damage induced byhypoxia[J]. Neurosci Lett, 2015,(610):54-59.
[16] Bavil FM, Alipour MR, Keyhanmanesh R, et al. Ghrelin decreases angiogenesis, HIF-1α and VEGF protein levels in chronic hypoxia in lung tissue of male rats[J]. Adv Pharm Bull, 2015,5(3):315-320.
[17] 楊婧,王琛,祝婷婷,等.益氣養(yǎng)血泄?jié)岱▽β阅I功能衰竭大鼠腎組織形態(tài)的影響及VEGF表達(dá)的作用機制[J].中華中醫(yī)藥雜志,2015,30(11):4077-4080.
[18] 劉亞明,鄧君,匡仁銳,等.腎積水后缺氧誘導(dǎo)因子-1、血管內(nèi)皮生長因子、微小RNA-210的動態(tài)表達(dá)[J].重慶醫(yī)學(xué),2015,44(30):4196-4198.
[19] 鮑永霞,呂福禎,馬迎軍.低氧對小鼠缺氧誘導(dǎo)因子-1α、P53 和血管內(nèi)皮生長因子表達(dá)的影響[J].中國康復(fù)醫(yī)學(xué)雜志,2006,21(5):408-411.
[20] Chen T, Chen M, Chen J. Ionizing radiation potentiates dihydroartemisinin-induced apoptosis of A549 cells via a caspase-8-dependent pathway[J]. PLoS One, 2013,8(3):e59827.
青海大學(xué)2013年度中青年科技基金項目(2013-QYY-9)。
10.3969/j.issn.1002-266X.2016.31.009
R692.6
A
1002-266X(2016)31-0031-03
2016-02-24)
- 山東醫(yī)藥的其它文章
- 不同BMI的疑診頸椎病患者頸椎矢狀位磁共振T2WI掃描圖像質(zhì)量對比觀察
- 檢測到耐藥細(xì)菌的重度燒傷患者呼吸道與創(chuàng)面細(xì)菌培養(yǎng)及其藥敏試驗結(jié)果分析
- 多巴絲肼片口服聯(lián)合經(jīng)顱直流電刺激對帕金森病患者非運動癥狀的改善作用
- 吻合器痔上黏膜環(huán)切術(shù)與經(jīng)陰道直腸前壁修補術(shù)、肛管松解術(shù)聯(lián)合應(yīng)用治療直腸前突43例
- 十二指腸間質(zhì)瘤的診斷、治療及預(yù)后影響因素分析
- 患者術(shù)前BMI與胃癌臨床病理參數(shù)、手術(shù)并發(fā)癥及預(yù)后的關(guān)系

