日灼脅迫對枇杷果皮蛋白質組的影響
潘德灼,鄧朝軍,呂曉杰,宋曉敏,邱智敏,龔慧文,蔣際謀,陳 偉*
(1 福建農林大學 生命科學學院,福州 350002;2 福建省農業科學院果樹研究所,福州 350013;3 福建農林大學 林學院,福州 350002)
?
日灼脅迫對枇杷果皮蛋白質組的影響
潘德灼1,鄧朝軍2,呂曉杰1,宋曉敏1,邱智敏3,龔慧文1,蔣際謀2,陳偉1*
(1 福建農林大學 生命科學學院,福州 350002;2 福建省農業科學院果樹研究所,福州 350013;3 福建農林大學 林學院,福州 350002)
為了探討枇杷果皮響應日灼脅迫的差異表達蛋白的變化,以日灼抗性弱的‘金鐘’枇杷和日灼抗性較強的‘紅猴本’枇杷為研究對象,將處于轉色期的枇杷果實在40 ℃下日灼處理90 min,果皮蛋白采用雙向電泳分離和MALDI-TOF/TOF-MS進行鑒定。結果顯示:(1)日灼后枇杷果皮中有64個表達豐度在2倍以上的差異蛋白,其中56個蛋白被成功鑒定,且38個在‘金鐘’中表達,23個在‘紅猴本’中表達。(2)這些蛋白質參與脅迫響應和防御(30.3%)、光合作用(14.3%)、呼吸作用(25.0%)、蛋白質代謝(14.3%)等生理過程。(3)相對于‘紅猴本’枇杷,‘金鐘’枇杷果皮細胞中多種熱激蛋白(HSP)的含量上升,參與呼吸作用的蛋白含量增加以產生更多的能量,但是大部分與光合作用相關的蛋白含量下降,清除活性氧(ROS)酶如抗壞血酸過氧化物酶(APX)和多酚氧化酶(PPO)含量降低,同時PPO酶活性下降。研究表明,要提高枇杷果皮抗日灼性可能需要提高清除ROS酶的含量和活性,需要一定量的HSP,以及保持正常的呼吸作用和光合作用。
枇杷;果皮;日灼;差異蛋白
枇杷(Eriobotryajaponica(Thunb.) Lindl.)是原產于中國南方的薔薇科枇杷屬的亞熱帶果樹,果實成熟于春末夏初,果肉柔軟多汁,富含蛋白質、氨基酸和維生素等營養物質,經濟價值高,同時果實還可入藥,具有潤肺止咳等功效,藥用價值高[1]。2006年,中國枇杷的栽培面積達到了12萬公頃,產量高達45.4萬噸,約占世界總產量的67%[2]。福建是中國枇杷的主產地之一,高居中國枇杷總產量前列[3]。
果實日灼是一種由高溫強光脅迫引起的果實生理病害現象。“溫室效應”的增強造成全球氣溫的升高,而高溫下的強光對許多園藝作物的生產栽培造成了很大的威脅,尤其是果實外觀會出現不同程度的日灼病斑[4-6]。高溫強光脅迫會引起果實果皮的抗氧化能力發生變化。有研究發現,日灼的石榴(PunicagranatumL.)果實無法抵抗氧化脅迫從而造成可見的果皮病斑[6]。蘋果(Malus×domesticaBorkh)果皮受高溫強光脅迫引起活性氧含量的上升,同時抗氧化酶的活性也增強,但是不足以防御光氧化脅迫帶來的損傷,最終導致蘋果果皮日灼病斑的出現[7]。在一定高溫脅迫范圍內,蘋果果皮中抗壞血酸過氧化物酶(APX)活性隨日灼程度的增強而上升,但超過一定限度,其活性明顯下降,這意味著過度的高溫強光會破壞APX的活性從而加大日灼傷害[8]。日灼的柑橘(Citrusreticulata)表皮細胞內活性氧含量劇增,抗氧化系統清除活性氧的能力明顯降低[9]。噴施外源抗氧化劑能顯著提高紅地球葡萄(Vitisviniferacv. Red Globe)果皮過氧化氫酶(CAT)、APX和SOD的活性,增強果皮的抗熱性[10]。此外,高溫強光脅迫還會引起細胞中蛋白質種類和表達量發生變化[11-12],尤其可誘導產生大量熱激蛋白[4]。
枇杷以鮮銷為主,枇杷果皮的日灼極大地影響其果實品質、產量和經濟效益,造成極大的損失,直接制約了枇杷在國際鮮果市場上的占有量[13-14],研究枇杷果實日灼發生的生理分子機制具有重要的意義。目前,學者已明確了枇杷果實日灼發生的敏感時期[15],解析了枇杷果皮日灼發生的生理生化的原因[14],探討了果皮日灼發生時蛋白質表達的變化[11-12],同時提出預防枇杷果皮日灼的套袋等方法[16]。但是對于枇杷果皮日灼發生的分子機制還不清楚。因此,本研究采用雙向電泳(Two-dimentional electrophoresis,2-DE)和MALDI-TOF/TOF-MS技術,以日灼抗性弱的‘金鐘’和日灼抗性較強的‘紅猴本’枇杷品種為研究對象,比較分析這2種枇杷果皮中差異表達的蛋白功能,以揭示調控果皮抗高溫強光脅迫的分子機理,為選育抗日灼枇杷品種提供理論依據,也為防治枇杷日灼提供參考。
1 材料和方法
1.1試驗材料供試枇杷品種為日灼抗性弱的‘金鐘’(JZH)和日灼抗性較強的‘紅猴本’(HHB),均采自福建省農業科學院果樹研究所國家果樹種質福州龍眼枇杷圃。在晴天(光照強度 ≥ 1 100 μmol·m-2·s-1),選擇位于7年樹齡的枇杷樹的樹冠外圍中上部相同方位、結果性狀基本一致、果實大小均一、果皮無損傷、處于轉色期的果穗10穗,使用果實日灼誘導儀進行誘導處理(圖1),誘導溫度40 ℃,誘導時間90 min,以未誘導處理的枇杷為對照組,削取向陽面的果皮,液氮速凍后儲藏于-80 ℃冰箱中備用。
1.2蛋白質的分離與鑒定
1.2.1蛋白質的提取蛋白質的提取采用酚抽提法[17]。取3 g樣品于預冷的陶瓷研缽中,加入少量的石英砂,加入液氮充分研磨至細粉末狀,加入12 mL的蛋白酚抽提取液[100 mmol·L-1Tris-HCl (pH 8.0),50 mmol·L-1抗壞血酸,50 mmol·L-1硼砂,100 mmol·L-1KCl,1% (v/v) Triton-100,2% (v/v) β-巰基乙醇]和12 mL Tris-飽和酚(pH 8.0),混勻后4 ℃、5 500 ×g離心10 min,吸取酚層,加入6倍體積預冷的0.1 mol·L-1乙酸銨甲醇溶液,-20 ℃過夜沉淀蛋白后4 ℃、20 000 ×g離心20 min,棄上清液,沉淀的蛋白先用預冷的甲醇溶液清洗1次,再用預冷的含有0.07% (v/v) β-巰基乙醇的丙酮溶液清洗2次,均置于-20 ℃下靜置1 h;4 ℃、20 000 ×g離心20 min,再用含有0.07%β-巰基乙醇的丙酮溶液清洗1次,均置于-20 ℃下靜置1 h后再以4 ℃、20 000 ×g離心20 min,最后將沉淀的蛋白懸浮于預冷的丙酮中,4 ℃、20 000 ×g離心20 min后所得蛋白沉淀,冷凍干燥后-80 ℃保存備用。

圖1 枇杷果皮的日灼誘導處理Fig. 1 Treatment induced by sunburn on loquat pericarp
1.2.2蛋白質的2-DE分離取3 mg蛋白質干粉溶解于300 μL蛋白裂解液[2% (v/v) Ampholyte pH 4~7,7 mol·L-1尿素,40 mmol·L-1DTT,2 mol·L-1硫脲,40 g·L-1CHAPS]中,37 ℃恒溫水浴2.5 h后20 000 ×g室溫離心15 min,取上清液采用Bradford法[18]測定蛋白質含量,以牛血清蛋白(BSA)為標準品。2-DE參考You等[17]方法,第一向固相pH梯度等電聚焦(IEF)采用Amersham Ettan IPGphor Ⅲ系統(GE Healthcare Amersham Biosciences),上樣量為1.3 mg,IPG膠條為24 cm、pH 4~7的線性膠條,IEF參數的設定為:30 V(12 h)、200 V(1 h)、500 V(1 h)、1 000 V(1 h)、1 000~8 000 V Gradient(30 min)、8 000 V(6 h)、1 000 V(1 h),運行溫度20 ℃,最大電流50 μA。第二向凝膠電泳采用EttanTMDALT Ⅱ垂直板電泳系統(GE Healthcare Amersham Biosciences),凝膠濃度為11%,先設恒定電流15 mA電泳30 min后增大至30 mA,直至溴酚藍遷移至膠底0.5 cm處結束。采用考馬斯亮藍G250染色并脫色后經EPSON PERFECTION 2480 PHOTO儀器掃描,應用ImageMaster 2D platinum 5.0 軟件分析膠圖并找出差異表達2倍以上并且重復性好(P≤ 0.5)的蛋白點。
1.2.3蛋白質的質譜鑒定差異表達的蛋白經trypsin酶解后進行MALDI-TOF/TOF-MS質譜鑒定[19]。質譜所用儀器為5800串聯飛行時間質譜儀(Applied Biosysterms SCIEX,USA),質譜數據通過GPS Explorer 3.6 (Applied Biosysterms SCIEX,USA) 和 MASCOT 軟件(Version 2.1,Matrix Science,London,UK)檢索:數據庫為NCBInr(發布日期:2010.07.01),檢索方式為Combined,最大允許胰蛋白酶漏切位點為1,質譜誤差設置為100 ppm,MS/MS誤差設置為0.6 Da。
1.3果皮膜透性和丙二醛(MDA)含量的的測定
枇杷果皮膜透性的測定參考商宏莉等[20]方法,略作修改。稱取2 g枇杷果皮,剪成長約1 cm小段放入小燒杯中,加入20 mL蒸餾水后,用抽氣機抽氣10 min,室溫靜置20 min后用電導儀測定燒杯中溶液的電導率B;最后將燒杯置于沸水中水浴處理10 min,取出燒杯并室溫靜置20 min后測定枇杷果皮煮沸后的電導率C。另外設空白組,測定蒸餾水的電導率A。根據公式:傷害率(%)=(B-A)/(C-A)×100%,求得傷害率。
MDA含量的測定采用硫代巴比妥酸(TBA)法[21]。稱取1 g枇杷果皮,用液氮磨成粉末,加入8 mL 50 g·L-1三氯乙酸,4 ℃、3 000 ×g離心10 min。取2 mL上清液加入2 mL 6.7 g·L-1TBA,振蕩混勻,沸水浴30 min,迅速冷卻后,3 000 ×g離心10 min,上清液分別在450 nm、532 nm和600 nm下測得OD值,計算單位鮮重葉片組織中MDA的含量,單位表示為μmol·g-1。
1.4多酚氧化酶(PPO)活性的測定
PPO活性的測定采用鄰苯二酚法[22]。稱取0.8 g 枇杷果皮,用液氮磨成粉末,加入4 mL 0.1 mol·L-1(pH 6.5)磷酸緩沖液,4 ℃、8 000 ×g離心15 min,上清液即為待測酶液。常溫條件下,取0.2 mol·L-1鄰苯二酚2.5 mL、0.1 mol·L-1(pH 6.5)磷酸緩沖液4 mL,加入1 mL待測酶液啟動反應,同時以緩沖液(不加酶液)作空白對照,37 ℃保溫3 min后,于410 nm下測定OD值。以每毫升每分鐘吸光度變化0.01為一個酶活力單位(U),酶活性單位表示為U·g-1。
1.5Western blotting驗證分析
枇杷果皮蛋白的免疫印跡分析參考Wang等[19]方法,略作修改。上樣量為50 μg的果皮蛋白經12% SDS-PAGE電泳分離后,采用CDY40C半干轉移系統(北京六一儀器廠)轉移至硝酸纖維膜上,50 g·L-1脫脂奶粉封閉2 h,用TBST緩沖液(0.01 mol·L-1Tris-HCl緩沖鹽溶液,0.1% (v/v) Tween-20,pH 7.6)漂洗后加入按照比例(1∶3 000)稀釋的兔抗HSP 70或cAPX多克隆抗體液體室溫孵育1 h,用TBST緩沖液漂洗后再加入按照比例(1∶1 000)稀釋的HRP偶聯的羊抗兔二抗液體繼續室溫孵育1 h,用TBST緩沖液漂洗后加入DAB(Boster,中國武漢)顯色。免疫印跡相對強度用Quantity軟件(Bio-Rad,USA)分析。
1.6數據分析
所有實驗數據均以平均值±標準差表示,每個實驗均進行3 次生物學重復,采用SPSS 13.0統計軟件進行方差分析,顯著差異為P≤ 0.05,極顯著差異為P≤ 0.01 。
2 結果與分析
2.1日灼枇杷果皮差異蛋白的分離與鑒定
果皮是果實中最先遭受高溫強光脅迫影響的結構組織。枇杷果實在40 ℃下日灼誘導處理90 min,本實驗分別選取處于轉色期的JZH和HHB兩品種枇杷果實的果皮進行2-DE分離,獲得分辨率較高和重復性較好的2-DE圖譜(圖2)。同時,經過ImageMaster軟件對2-DE凝膠圖譜的分析,本實驗于2個品種的枇杷果皮中共得到64個豐度差異變化在2倍以上的蛋白點(圖2)。
通過對64個差異蛋白點的MALDI-TOF/TOF-MS分析,本實驗成功鑒定出56個蛋白,但有8個蛋白未能得到可信的匹配,鑒定成功率為87.5%;同時,對鑒定出的56個蛋白進行功能注釋和分類(表1)。表1顯示,這些蛋白主要分為:(1)脅迫響應與防御蛋白,共有17蛋白點,占所鑒定出的總蛋白的30.3%;(2)光合作用蛋白,共有8個,占14.3%;(3)呼吸作用相關的蛋白,共有14個,占25.0%;(4)與蛋白質代謝相關的蛋白,共有8個,占14.3%;(5)其他蛋白,共有9個,占16.1%。
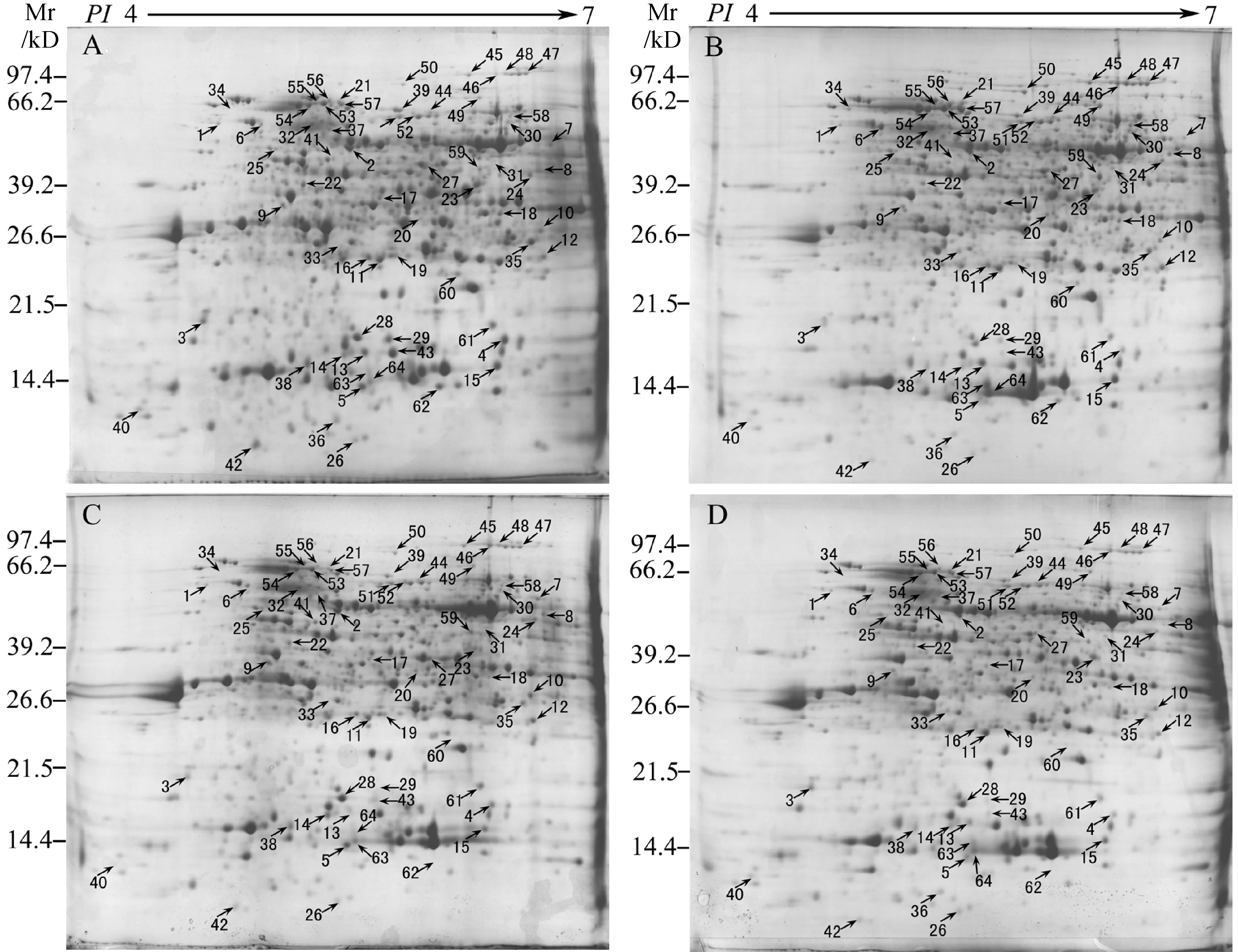
A.‘金鐘’對照組;B.‘金鐘’日灼處理組;C.‘紅猴本’對照組;D.‘紅猴本’日灼處理組圖2 枇杷果皮日灼誘導的蛋白質2-DE圖譜A. Control of JZH; B. Sunburn of JZH; C. Control of HHB; D. Sunburn of HHBFig. 2 2-DE maps of loquat pericarp proteins under sunburn stress
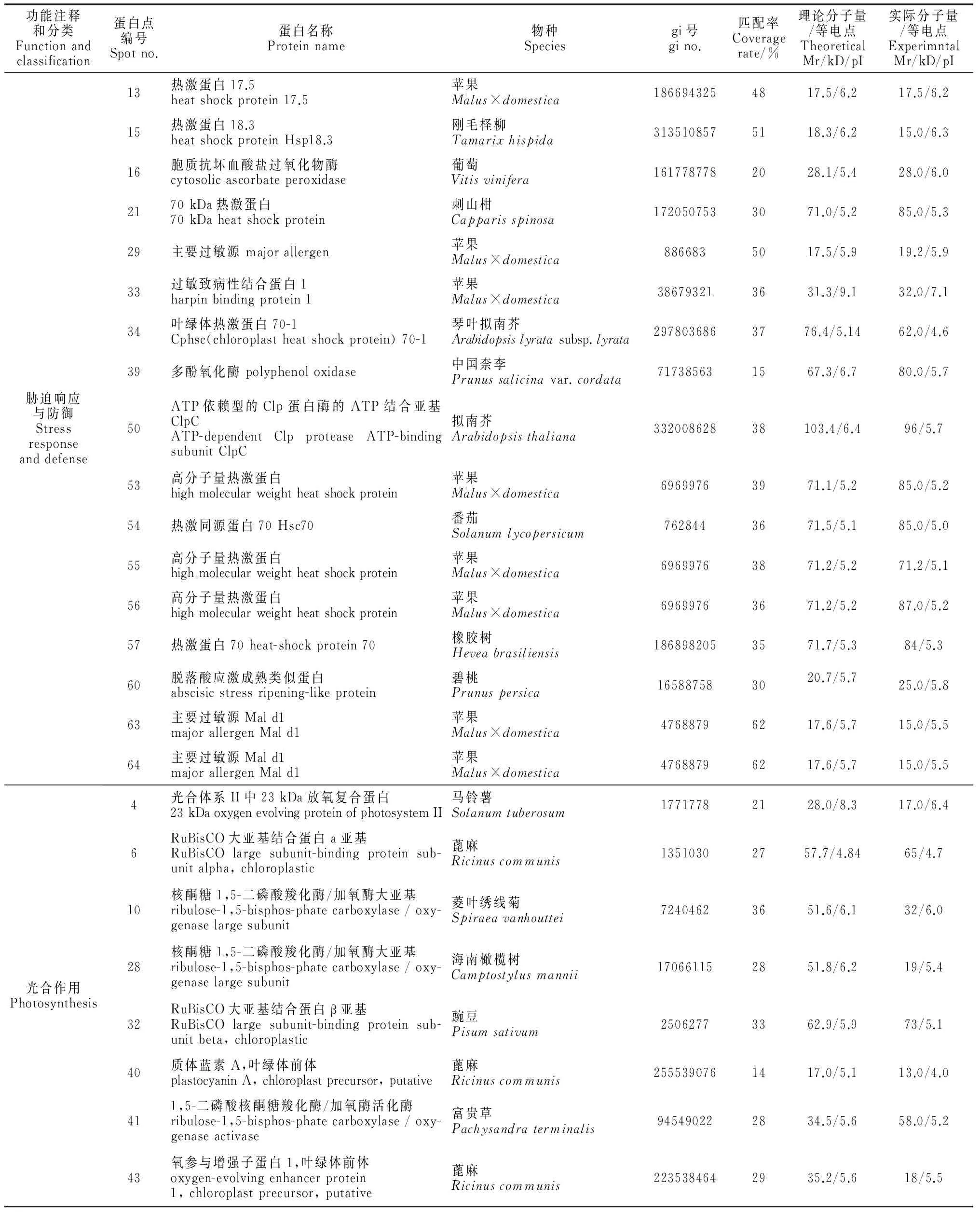
表1 日灼脅迫下兩品種枇杷果皮差異蛋白的MALDI-TOF/TOF-MS鑒定結果Table 1 Identification of differentially expressed proteins in loquat fruits pericarps under sunburn by MALDI-TOF/TOF-MS
續表1Continued Table 1
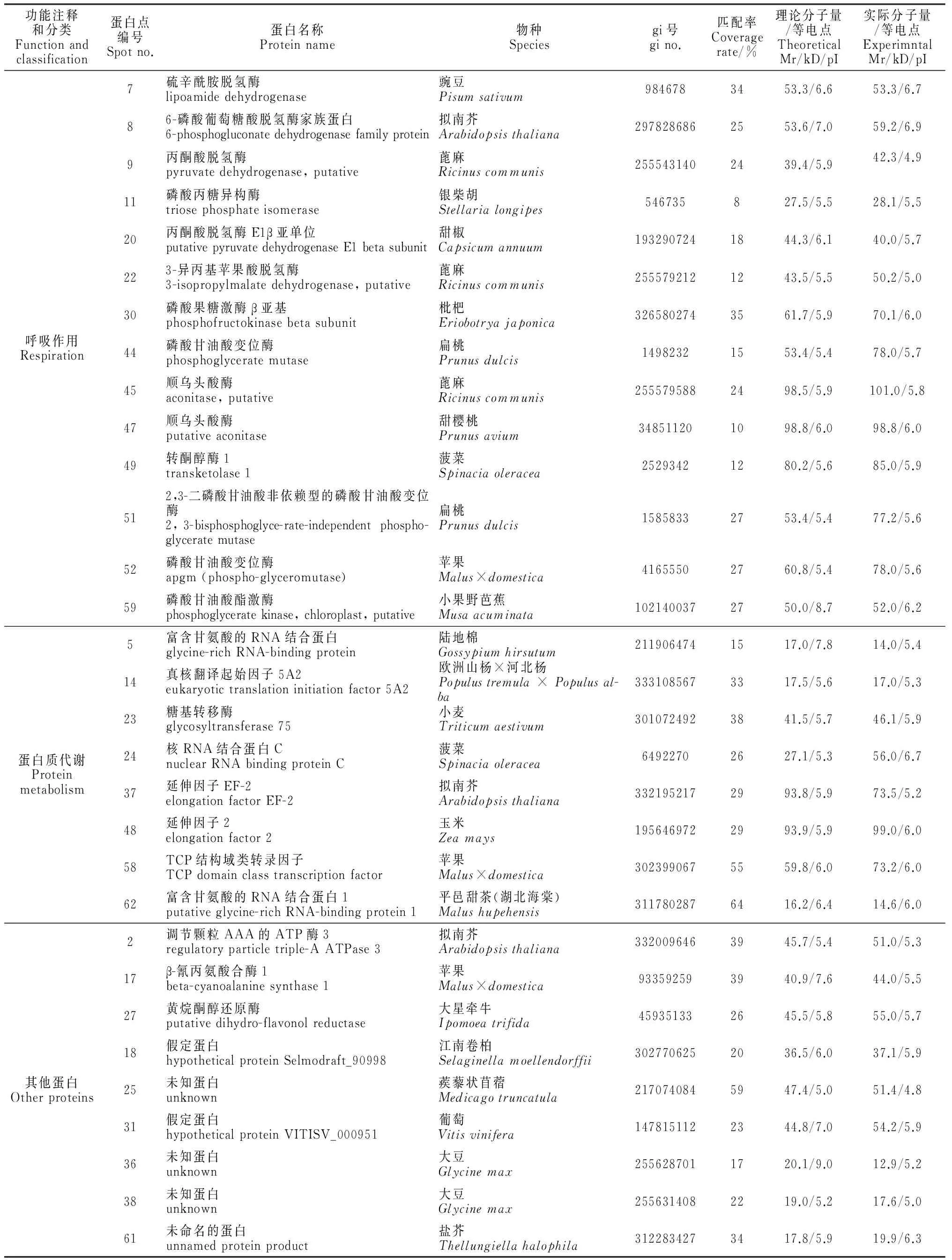
功能注釋和分類Functionandclassification蛋白點編號Spotno.蛋白名稱Proteinname物種Speciesgi號gino.匹配率Coveragerate/%理論分子量/等電點TheoreticalMr/kD/pI實際分子量/等電點ExperimntalMr/kD/pI呼吸作用Respiration7硫辛酰胺脫氫酶lipoamidedehydrogenase豌豆Pisumsativum9846783453.3/6.653.3/6.786-磷酸葡萄糖酸脫氫酶家族蛋白6-phosphogluconatedehydrogenasefamilyprotein擬南芥Arabidopsisthaliana2978286862553.6/7.059.2/6.99丙酮酸脫氫酶pyruvatedehydrogenase,putative蓖麻Ricinuscommunis2555431402439.4/5.942.3/4.911磷酸丙糖異構酶triosephosphateisomerase銀柴胡Stellarialongipes546735827.5/5.528.1/5.520丙酮酸脫氫酶E1β亞單位putativepyruvatedehydrogenaseE1betasubunit甜椒Capsicumannuum1932907241844.3/6.140.0/5.7223-異丙基蘋果酸脫氫酶3-isopropylmalatedehydrogenase,putative蓖麻Ricinuscommunis2555792121243.5/5.550.2/5.030磷酸果糖激酶β亞基phosphofructokinasebetasubunit枇杷Eriobotryajaponica3265802743561.7/5.970.1/6.044磷酸甘油酸變位酶phosphoglyceratemutase扁桃Prunusdulcis14982321553.4/5.478.0/5.745順烏頭酸酶aconitase,putative蓖麻Ricinuscommunis2555795882498.5/5.9101.0/5.847順烏頭酸酶putativeaconitase甜櫻桃Prunusavium348511201098.8/6.098.8/6.049轉酮醇酶1transketolase1菠菜Spinaciaoleracea25293421280.2/5.685.0/5.9512,3-二磷酸甘油酸非依賴型的磷酸甘油酸變位酶2,3-bisphosphoglyce-rate-independentphospho-glyceratemutase扁桃Prunusdulcis15858332753.4/5.477.2/5.652磷酸甘油酸變位酶apgm(phospho-glyceromutase)蘋果Malus×domestica41655502760.8/5.478.0/5.659磷酸甘油酸酯激酶phosphoglyceratekinase,chloroplast,putative小果野芭蕉Musaacuminata1021400372750.0/8.752.0/6.2蛋白質代謝Proteinmetabolism5富含甘氨酸的RNA結合蛋白glycine-richRNA-bindingprotein陸地棉Gossypiumhirsutum2119064741517.0/7.814.0/5.414真核翻譯起始因子5A2eukaryotictranslationinitiationfactor5A2歐洲山楊×河北楊Populustremula×Populusal-ba3331085673317.5/5.617.0/5.323糖基轉移酶glycosyltransferase75小麥Triticumaestivum3010724923841.5/5.746.1/5.924核RNA結合蛋白CnuclearRNAbindingproteinC菠菜Spinaciaoleracea64922702627.1/5.356.0/6.737延伸因子EF-2elongationfactorEF-2擬南芥Arabidopsisthaliana3321952172993.8/5.973.5/5.248延伸因子2elongationfactor2玉米Zeamays1956469722993.9/5.999.0/6.058TCP結構域類轉錄因子TCPdomainclasstranscriptionfactor蘋果Malus×domestica3023990675559.8/6.073.2/6.062富含甘氨酸的RNA結合蛋白1putativeglycine-richRNA-bindingprotein1平邑甜茶(湖北海棠)Malushupehensis3117802876416.2/6.414.6/6.0其他蛋白Otherproteins2調節顆粒AAA的ATP酶3regulatoryparticletriple-AATPase3擬南芥Arabidopsisthaliana3320096463945.7/5.451.0/5.317β-氰丙氨酸合酶1beta-cyanoalaninesynthase1蘋果Malus×domestica933592593940.9/7.644.0/5.527黃烷酮醇還原酶putativedihydro-flavonolreductase大星牽牛Ipomoeatrifida459351332645.5/5.855.0/5.718假定蛋白hypotheticalproteinSelmodraft_90998江南卷柏Selaginellamoellendorffii3027706252036.5/6.037.1/5.925未知蛋白unknown蒺藜狀苜蓿Medicagotruncatula2170740845947.4/5.051.4/4.831假定蛋白hypotheticalproteinVITISV_000951葡萄Vitisvinifera1478151122344.8/7.054.2/5.936未知蛋白unknown大豆Glycinemax2556287011720.1/9.012.9/5.238未知蛋白unknown大豆Glycinemax2556314082219.0/5.217.6/5.061未命名的蛋白unnamedproteinproduct鹽芥Thellungiellahalophila3122834273417.8/5.919.9/6.3
注:表中蛋白點序號與圖2中2-DE凝膠上的蛋白點序號一致
Note: Spot No. in the table corresponds to the 2-DE gel in Figure 2
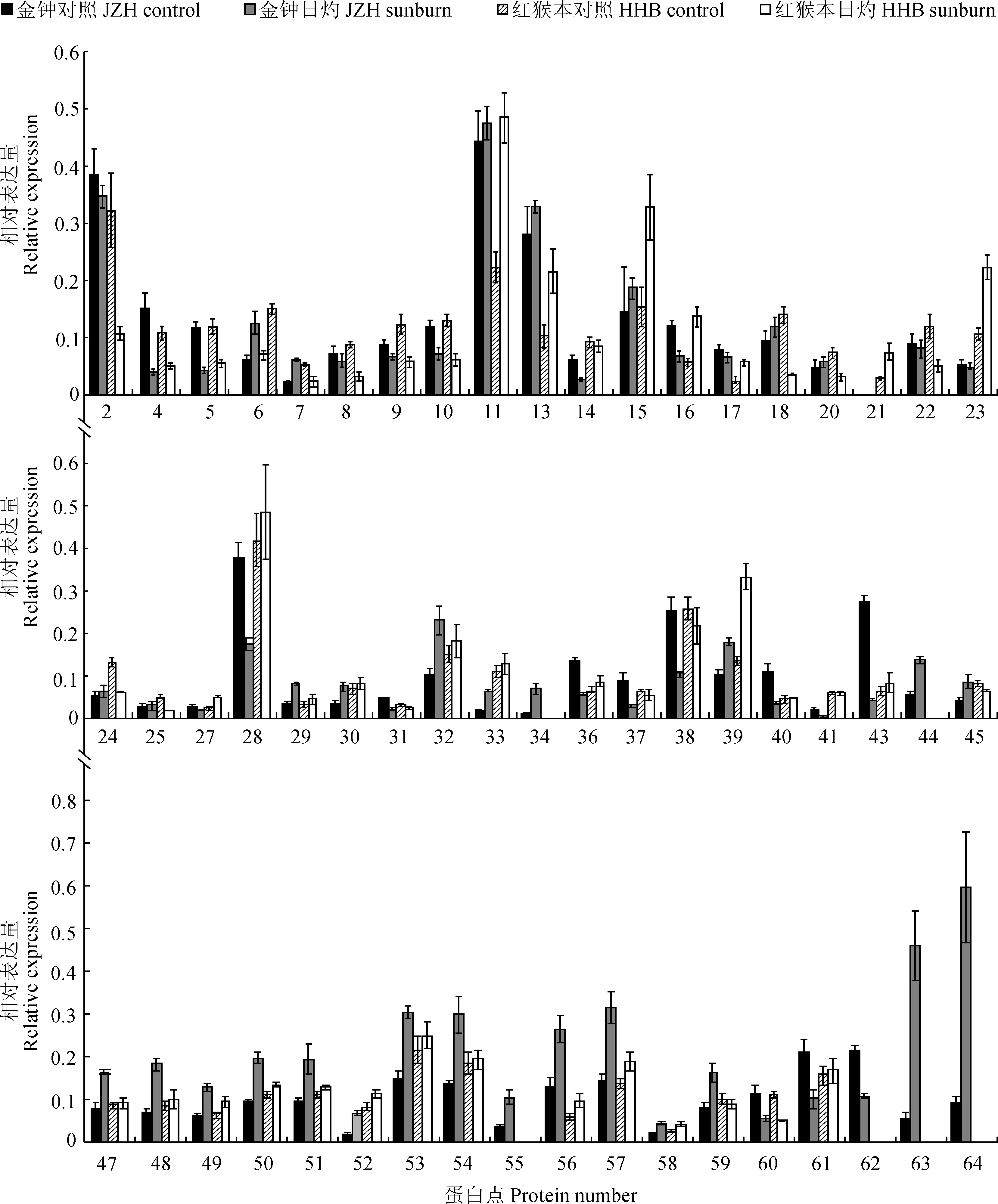
圖中蛋白點序號與圖2中2-DE凝膠上的蛋白點序號一致圖3 枇杷果皮56個差異蛋白相對表達量的變化Spot No. in this figure corresponds to the 2-DE gel in Figure 2Fig. 3 Relative expression quantities of 56 differential expressed proteins in loquat pericarp
同時,這56個差異表達蛋白在JZH和HHB枇杷果皮中的表達模式是不同的(圖3)。其中,5個蛋白在2種枇杷中表達均差異顯著,蛋白點4、5和60在2種枇杷中均下調表達,蛋白點6在2種枇杷中上調表達,而蛋白點7在JZH枇杷中上調表達,在HHB枇杷中下調表達;33個蛋白只在JZH枇杷果皮中的表達差異顯著,有11個蛋白下調表達,22個蛋白上調表達;另外18個蛋白只在HHB枇杷果皮中的表達差異顯著,有9個蛋白下調表達,9個蛋白上調表達。在所有鑒定出的蛋白中,還有6個蛋白未知其功能。
2.2日灼枇杷果皮細胞膜透性以及MDA含量的變化
植物在逆境環境下會發生膜脂過氧化作用,MDA是其產物之一,因此,MDA的含量可以反映出膜質的過氧化程度和植物對逆境反應的強弱。當植物受到逆境脅迫時,細胞膜受到破壞,膜透性會增大。圖4,A顯示,經過90 min日灼誘導處理后,JZH枇杷果皮的膜透性顯著增大,而HHB枇杷果皮的膜透性略微增大。同時,與對照組相比,經過90 min日灼誘導處理后,JZH和HHB枇杷果皮的MDA含量分別增加了2.0倍和0.9倍,差異均達到極顯著水平(圖4,B)。由此可知,日灼脅迫對枇杷果皮細胞膜的損害較大,而且抗日灼能力弱的JZH枇杷的膜傷害程度明顯大于抗性強的HHB。
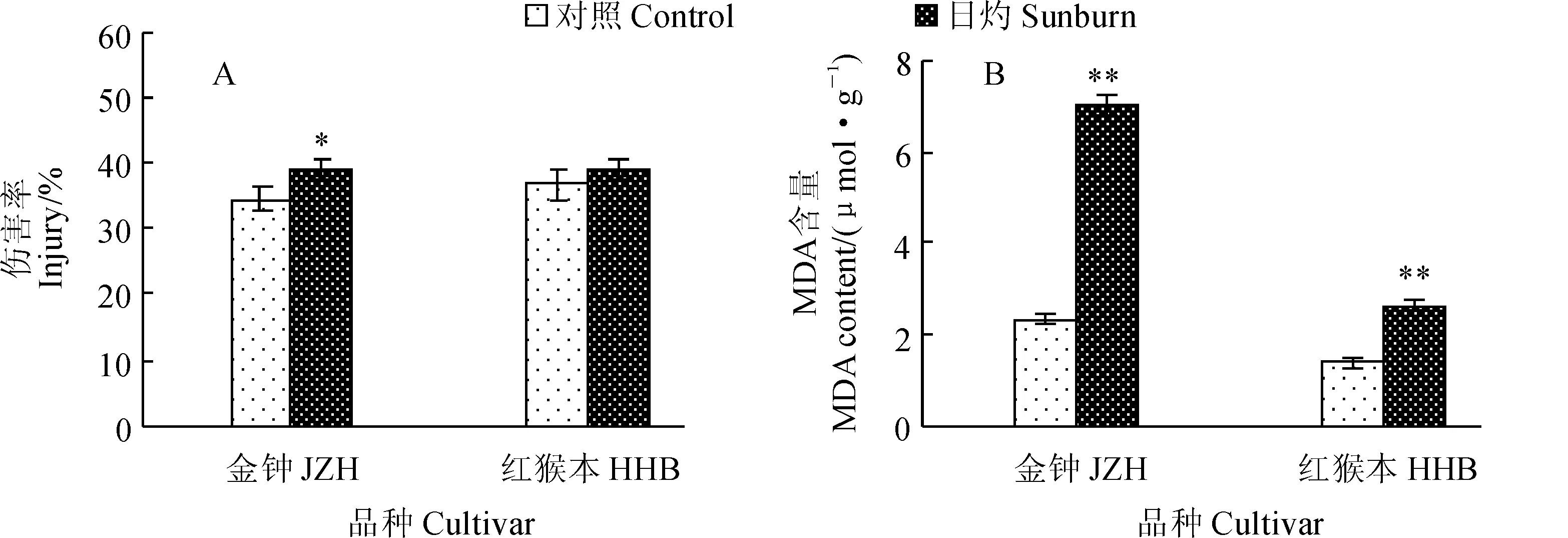
*和**分別表示日灼處理與對照之間在0.05和0.01水平存在顯著性差異;下同圖4 日灼枇杷果皮的細胞膜傷害率(A)和MDA含量(B)*and ** above the bars indicate a significant difference between the sunburn and control at 0.05,and 0.01 level,respectively;The same as belowFig. 4 Membrane injury (A) and MDA content (B) in sunburn loquat pericarp
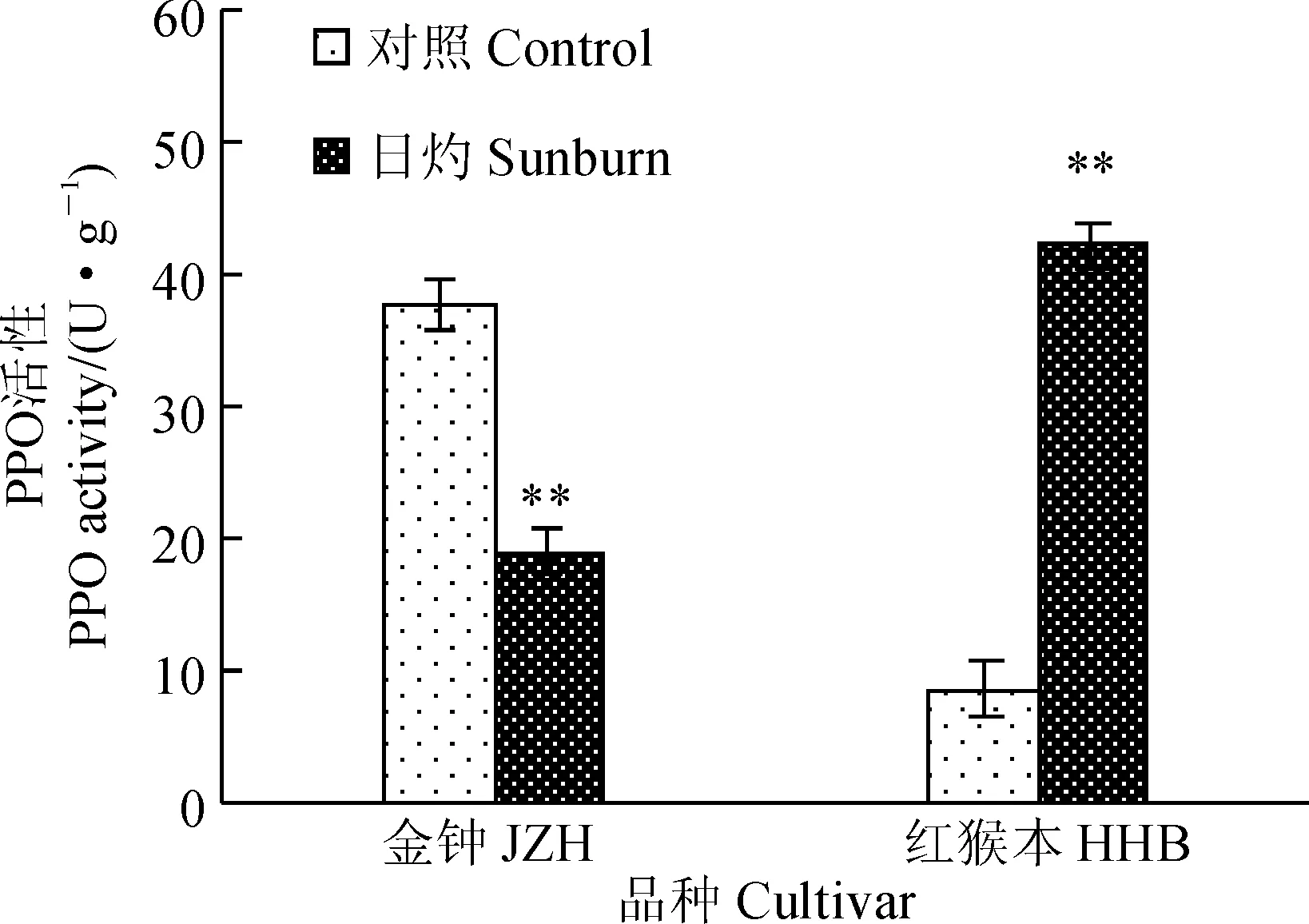
圖5 日灼枇杷果皮PPO活性Fig. 5 PPO activity in loquat pericarp
2.3日灼枇杷果皮多酚氧化酶活力的變化
植物在逆境條件下,多酚氧化酶(PPO)的活性會發生變化。由圖5可知,與對照組相比,經90 min的日灼誘導處理,JZH枇杷果皮細胞中PPO活性降低了50%,而HHB枇杷果皮細胞中PPO活性卻提高了4.0倍。由此可見,抗日灼能力不同的2種枇杷在抵御日灼傷害時所表現出來的PPO活力變化情況正好相反,抗性弱的JZH枇杷果皮中PPO活性極顯著下降,而抗性強的HHB枇杷卻極顯著上升。
2.4日灼枇杷果皮HSP 70和cAPX免疫印跡分析
HSP 70是一種非常重要的熱激蛋白,在植物響應高溫脅迫中起著作用。前面的2-DE結果發現,日灼處理的JZH枇杷果皮的HSP 70含量顯著增加,而日灼HHB枇杷果皮的HSP 70含量略微增加;此外,在日灼處理的JZH枇杷果皮中cAPX蛋白顯著下降,在日灼HHB枇杷果皮中cAPX蛋白卻顯著增加。由圖6可知,經過HSP 70和cAPX抗體的免疫印跡分析,HSP 70蛋白在2個品種日灼處理枇杷果皮中均顯著增加,而cAPX蛋白在JZH枇杷果皮中顯著下降,卻在HHB枇杷果皮中顯著增加,這與2-DE的結果基本一致。
3 討 論
本實驗通過蛋白質組學研究發現在日灼脅迫下JZH枇杷果皮中有38個差異表達蛋白,在HHB枇杷果皮中有23個差異表達蛋白。這些差異蛋白的生物學功能主要涉及到脅迫響應與防御、光合作用、碳水化合物和能量代謝等生理過程。
3.1脅迫響應與防御相關蛋白
高溫強光會引起植物體內活性氧(ROS)含量的增加,植物可通過提高抗氧化酶含量或活性來抵御高溫強光脅迫[23-25]。蘋果、紅地球葡萄果皮中APX活性的提高有助于抗高溫強光能力的增強[8,10]。胞質APX是植物體內重要的脫氫過氧化物酶,參與活性氧的清除,維持細胞內平衡[26]。此外,PPO可參與植物組織的衰老和氧化褐變,同時PPO活性的提高可加速H2O2的清除進而有利于草莓的保鮮[27],PPO對采后油桃中H2O2清除也有直接作用[28]。本研究發現胞質APX和PPO含量在HHB枇杷中均上調表達,而在JZH枇杷中均下調表達,同時PPO酶活性的變化趨勢與此一致。這可能原因是在JZH枇杷受到日灼過程中產生過多的活性氧進而引起細胞膜質過氧化,導致MDA含量增加和膜透性顯著增大,導致了酶活力的下降;相反,在HHB枇杷中這兩種酶為了更好地清除細胞產生的大量活性氧而提高了自身活力,進而維持細胞內環境的活性氧代謝平衡,因而這是一種應激保護。以上結果表明JZH枇杷果皮細胞的抗氧化能力弱于HHB枇杷。
植物在受到逆境脅迫時,細胞中的錯誤折疊蛋白或多肽就會增多,因此植物需要產生多種分子伴侶蛋白(如熱激蛋白HSP)來指導蛋白或多肽的正確折疊。當植物遭受高溫脅迫時,植物細胞就會產生多個高分子量HSP(60~110 kD)和小分子量HSP(15~45 Da)[23, 29]。這些HSP能夠聚合脅迫導致的變性蛋白并且使變性蛋白去折疊,從而恢復其天然的生物學功能[30-31]。本研究發現所有檢測到的HSP在兩種枇杷中均上調表達,其中HHB枇杷中有3個(蛋白點13、15和21),而JZH枇杷中有6個(蛋白點34、53~57),這可能是因為JZH枇杷的抗熱性弱,在日灼處理過程中會形成更多的錯誤蛋白或多肽,因此需要產生更多的HSP來維持細胞蛋白的正常功能從而抵抗熱脅迫。然而,HHB枇杷的抗熱性強,對高溫強光不敏感,在短期日灼處理時未形成過多的錯誤折疊蛋白,因此不需要太多的HSP來維持正常的功能。在JZH枇杷果皮中除了有HSP參與錯誤折疊蛋白或多肽的去折疊外,還有ClpC亞基的參與。有研究表明,Clp是一種非常重要的蛋白酶,用于降解錯誤的蛋白,而ClpC亞基是其主要的調控成分[32]。由此認為,JZH枇杷中ClpC亞基的上調表達可以提高Clp蛋白酶的降解能力,從而加速清除細胞中錯誤折疊的蛋白,這也說明JZH枇杷比HHB枇杷對日灼更敏感。
3.2光合作用相關蛋白
高溫強光脅迫誘導植物的光合作用發生變化。本研究共檢測到8個與光合作用相關的差異表達蛋白,其中JZH枇杷果皮中有6個蛋白(蛋白點4、10、28、40、41和43)均下調表達,只有蛋白6和32上調表達,而HHB枇杷果皮中蛋白6也上調表達,蛋白32略微上調,蛋白4和10下調表達。植物中RuBisCO是光合作用碳反應中重要的羧化酶,由RuBisCO大亞基和小亞基組成[33]。RuBisCO大、小亞基組裝成全酶需要RuBisCO亞基結合蛋白的參與[34]。RuBisCO大亞基結合蛋白α亞基(蛋白點6)在2種枇杷中均顯著上調表達,RuBisCO大亞基結合蛋白β亞基(蛋白點32)在JZH枇杷中顯著上調表達,而在HHB枇杷中略微上調。然而,調控RuBisCO酶活性的RuBisCO活化酶(蛋白點41)以及RuBisCO大亞基(蛋白點10和28)在JZH枇杷中的表達量顯著下降,而在HHB枇杷中變化不明顯。此外,氧參與增強子蛋白1(蛋白點43)是光系統Ⅱ中心的裝配及穩定性的一種必需蛋白[35-36]。質體藍素參與光合過程中電子的傳遞,可以將電子從水傳遞給NADP+,最后形成氧分子。這兩種蛋白在JZH枇杷中均下調表達,而在HHB枇杷中未發生顯著變化。這些表現意味著JZH枇杷對高溫日灼更為敏感,光合作用受到的抑制更加嚴重。
3.3呼吸作用相關蛋白
高溫強光脅迫不僅可以使植物中光合作用和細胞膜的穩定性發生改變,還會影響呼吸作用[37]。其中,與糖酵解途徑相關的磷酸果糖激酶(蛋白點30)、磷酸丙糖異構酶(蛋白點11)和磷酸甘油酸變位酶(蛋白點44、51和52)在JZH枇杷果皮中均顯著上調表達,而在HHB枇杷中只有磷酸丙糖異構酶顯著上調表達,另外2種酶均未發生顯著變化。此外,丙酮酸脫氫酶E1和硫辛酰胺脫氫酶參與了氧化代謝,可將丙酮酸轉化為2個乙酰CoA,其表達量的降低會造成植物三羧酸(TCA)循環障礙[38]。在TCA循環中,順烏頭酸酶能夠摧化檸檬酸轉化為異檸檬酸,而且3-異丙基蘋果酸脫氫酶催化異檸檬酸轉化為2-酮戊二酸。本研究發現丙酮酸脫氫酶(蛋白點9)、丙酮酸脫氫酶E1 β亞基(蛋白點20)、3-異丙基蘋果酸脫氫酶(蛋白點22)和硫辛酰胺脫氫酶(蛋白點7)在HHB枇杷中均下調表達,而在JZH枇杷中順烏頭酸酶(蛋白點45和47)卻上調表達,其他酶無明顯變化。此外,轉酮醇酶1(蛋白點49)在戊糖磷酸途徑中起重要作用,它在JZH枇杷果皮中顯著上升,在HHB枇杷中只是略微上調。我們發現在JZH枇杷果皮中與碳水化合物及能量相關的差異蛋白大部分都上調表達,而在HHB枇杷中只有2個差異蛋白(蛋白點11和49)上調表達,其他均下調表達或無明顯差異。這表明在日灼脅迫條件下JZH枇杷果皮中糖酵解途徑、三羧酸途徑和戊糖磷酸途徑均表現出上調表達,而在HHB枇杷中還是以下調表達為主,這可能是因為抗熱性弱的JZH枇杷需要更多的能量來抵御日灼脅迫。抗性弱的JZH枇杷在呼吸作用上的變化與‘WDYDB’枇杷果皮響應高溫強光脅迫的蛋白質變化模式一致[12]。
3.4蛋白質代謝相關蛋白
在8個與蛋白質代謝相關的差異蛋白中,RNA結合蛋白(蛋白點24)和富含甘氨酸的RNA結合蛋白(蛋白點5和62)參與轉錄后的基因調控,包括前體mRNA的拼接與帶帽、mRNA轉運及翻譯,它們在植物的生長發育以及抗逆境脅迫中具有重要的作用[39]。起始因子5A(蛋白點14)能夠通過控制mRNA核輸出率而選擇性地翻譯蛋白質[40]。延伸因子2(蛋白點37和48)參與新生肽鏈的延伸。糖基轉移酶(蛋白點23)能夠將糖基轉移到蛋白上,對蛋白進行糖基化修飾,進而調節蛋白功能。本研究發現,在JZH枇杷中,這些蛋白的含量總體上呈下降趨勢,而在HHB枇杷中總體上沒有發生顯著變化,這表明抗熱性弱的枇杷因日灼傷害造成蛋白質合成量減少,而抗性強的枇杷所受到的影響較小。
綜上所述,本研究比較了JZH枇杷(日灼抗性弱)和HHB枇杷(日灼抗性較強)果皮在日灼脅迫下的差異蛋白表達模式。相對于HHB枇杷,對日灼抗性較弱的JZH枇杷果皮細胞中多種HSP含量顯著上升,能夠減少因高溫強光脅迫造成的過多錯誤折疊的蛋白質;參與呼吸作用的蛋白含量增加,可以產生更多的能量以維持果皮細胞正常的生理活動;但是大部分與光合作用有關的蛋白質含量下降,說明其光合作用受到嚴重的抑制;清除ROS的酶系統中APX和PPO含量與PPO活性均下降,導致活性氧的增加,脂膜系統受到破壞。根據以上結果我們認為,提高枇杷果皮的抗日灼性,需要較高的清除ROS酶的含量和活性來清除過多的ROS,同時需要一定量的HSP以維持蛋白的正確折疊和正常功能,還需要保持正常的呼吸作用和光合作用以維持細胞物質和能量的正常供應。
[1]余筱潔, 金曉燕, 周存山, 等. 紅肉和白肉枇杷果仁營養成分分析[J]. 浙江農林大學學報, 2011, 28(1): 149-152.
YU X J, JIN X Y, ZHOU C S,etal. Nutritional components for kernels of two loquat cultivars[J].JournalofZhejiangA&FUniversity, 2011, 28(1): 149-152.
[2]張婷婷, 令楨民, 趙旺生. 枇杷的研究現狀和應用前景[J]. 農產品加工·學刊, 2006, 6(70): 50-52.
ZHANG T T, LING Z M, ZHAO W S. Investigation actuality and foreground of loquat[J].AcademicPeriodicalofFarmProductsProcessing, 2006, 6(70): 50-52.
[3]吳文毅. 福建枇杷產業現狀、存在的問題及對策[D], 北京:中國農業大學, 2005.
[4]張建光, 劉玉芳, 孫建設, 等. 嘎拉蘋果高溫處理與果實日灼的關系[J]. 中國農業科學, 2003, 36(6): 731-734.
ZHANG J G, LIU Y F, SUN J S,etal. Acclimation of fruit to high temperatures in relation to sunburn in gala apples[J].ScientiaAgriculturaSinica, 2003, 36(6): 731-734.
[5]SCHRADER L E, KAHN C, ELFVING D C. Sunburn browning decreases at-harvest internal fruit quality of apples (MalusdomesticaBorkh.)[J].InternationanlJournalofFruitScience, 2009, 9(4): 425-437.
[6]WEERALLPDY P, JOBLING J, INFANTE M M V,etal. The effect of maturity, sunburn and the application of sunscreens on the internal and external qualities of pomegranate fruit grown in Australia[J].ScientiaHorticulturae, 2010, 124(1): 57-61.
[7]CHEN L S, LI P, CHENG L. Effects of high temperature coupled with high light on the balance between photooxidation and photoprotection in the sun-exposed peel of apple[J].Planta, 2008, 228: 745-756.
[8]王靜璞, 李英麗, 張建光. 高溫、強光脅迫對蘋果果皮組織APX活性的影響[J]. 華北農學報, 2008, 23(6): 144-147.
WANG J P, LI Y L, ZHANG J G. Effect of high--temperature and excessive-light stress on APX activity in apple peel[J].ActaAgriculturaeBoreali-Sinica2008, 23(6): 144-147.
[9]萬繼鋒, 李娟, 陳杰忠. 柑橘日灼病果皮抗氧化代謝的變化[J]. 園藝學報, 2012, 39(10): 2 009-2 014.
WAN J F, LI J, CHEN J Z. Changes in antioxidant metabolism in the fruit pericarps of citrus during sunburn development[J].ActaHorticulturaeSinica, 2012, 39(10): 2 009-2 014.
[10]王文舉, 王振平. 外源抗氧化劑對高溫脅迫下紅地球葡萄果皮組織CAT、APX和SOD酶活性的影響[J]. 中外葡萄與葡萄酒, 2013, 3: 8-10.
WANG W J, WANG Z P. Effects of exogenous antioxidants on CAT, APX and SOD activity in Red Globe grape skin under high temperature stress[J].Sino-OverseasGrapevine&Wine, 2013, 3: 8-10.
[11]鄧朝軍, 蔣際謀, 龔慧文, 等. 2個枇杷品種果皮日灼傷害差異蛋白質組分析[J]. 福建農業學報, 2012, 27(12): 1 313-1 317.
DENG C J, JIANG J M, GONG H W,etal. Proteome analysis of loquat peel under sunburn in two varieties[J].FujianJournalofAgriculturalSciences, 2012, 27(12): 1 313-1 317.
[12]蔣際謀, 鄧朝軍, 林永祥, 等. 枇杷果皮響應高溫強光脅迫的蛋白質組分析[J]. 熱帶亞熱帶植物學報, 2014, 22(4): 383-390.
JIANG J M, DENG C J, LIN Y X,etal. Proteomic analysis of loquat peels under high temperature and strong light stre-sses[J].JournalofTropicalandSubtropicalBotany, 2014, 22(4): 383-390.
[13]張志其, 曾小明, 白成剛, 等. 枇杷裂果與萎蔫、日灼的防止技術[J]. 柑桔與亞熱帶果樹信息, 2004, 20(8): 32-34.
ZHANG Z Q, ZENG X M, BAI C G,etal. Control technologies for dehiscent fruit and wilting, sunburning of loquat[J].CitrusandSubtropicalFruitTreeInformation, 2004, 20(8): 32-34.
[14]鄧朝軍, 許奇志, 蔣際謀, 等. 高溫脅迫對枇杷果皮熱傷害的抗氧化特性影響[J]. 熱帶亞熱帶植物學報, 2012, 20(5): 439-444.
DENG C J, XU Q Z, JIANG J M,etal. Changes in antioxidant properties induced by heat injury in loquat peel under high temperature stressp[J].JournalofTropicalandSubtropicalBotany, 2012, 20(5): 439-444.
[15]鄧朝軍, 蔣際謀, 張小艷, 等. 枇杷果皮熱傷害發生影響因子研究[J]. 福建農業學報, 2012, 27(10): 1 081-1 086.
DENG C J, JIANG J M, ZHANG X Y,etal. Research on influence factors in heat injury of loquat peel[J].FujianJournalofAgriculturalSciences, 2012, 27(10): 1 081-1 086.
[16]吳萬興, 魯周民, 李文華, 等. 疏花疏果與套袋對枇杷果實生長與品質的影響[J]. 西北農林科技大學學報 (自然科學版), 2001, 32(11): 73-75.
WU W X, LU Z M, LI W H,etal. Effects of eliminating partial flowers and young fruits and bagging on growth and quality of loquat fruit[J].JournalofNorthwestA&FUniversity(Natural Science Edition), 2001, 32(11): 73-75.
[17]YOU X, WANG L, LIANG W,etal. Floral reversion mechanism in longan (DimocarpuslonganLour.) revealed by proteomic and anatomic analyses[J].JournalofProteomics, 2012, 75: 1 099-1 118.
[18]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry, 1976, 72: 248-254.
[19]WANG L, LIU X, LIANG M,etal. Proteomic analysis of salt-responsive proteins in the leaves of mangroveKandeliacandelduring short-term stress[J].PLoSOne, 2014, 9: e83141.
[20]商宏莉, 郭啟高, 宋明, 等, 生姜四倍體抗熱性與抗寒性的初步研究[J]. 西南農業大學學報, 2003, 25(3): 210-211, 233.
SHANG H L, GUO Q G, SONG M,etal. A preliminary study of heat- and cold-resistance of tetraploid ginger (Zingiberofficinale)[J].JournalofSouthwestAgriculturalUniversity, 2003, 25(3): 210-211, 233.
[21]李合生. 植物生理生化實驗原理和技術[M]. 北京: 高等教育出版社, 2000: 164-169.
[22]王學奎. 植物生理生化實驗原理和技術[M]. 北京: 高等教育出版社, 2006: 169-173.
[23]IBA K. Acclimative response to temperature stress in higher plants: approaches of gene engineering for temperature tole-rance[J].AnnualReviewofPlantBiology, 2002, 53(1): 225-245.
[24]CUI L, LI J, FAN Y,etal. High temperature effects on photosynthesis, PSII functionality and antioxidant activity of twoFestucaarundinaceacultivars with different heat susceptibility[J].BotanicalStudies, 2006, 47: 61-69.
[25]DAT J F, LOPEZ-DELGADO H, FOYER C H,etal. Para-llel changes in H2O2and catalase during thermotolerance induced by salicylic acid or heat acclimation in mustard seedlings[J].PlantPhysiology, 1998, 116(4): 1 351-1 357.
[26]FAYROBERT M, MIHR C, BERTIN N,etal. Major proteome variations associated with cherry tomato pericarp development and ripening[J].PlantPhysiology, 2007, 143(3): 1 327-1 346.
[27]李健, 張萌, 李麗萍, 等. 熱處理對草莓品質與活性氧代謝影響的多變量解析[J]. 食品科學, 2013, 34(16): 306-310.
LI J, ZHANG M, LI L P,etal. Multivariate analysis of the effect of postharvest heat shock treatment on fruit quality and reactive oxygen species of strawberry during cold storage[J].FoodScience, 2013, 34(16): 306-310.
[28]楊宏偉, 陳小燕, 張影, 等. 油桃采后衰老與病害發生中品質與活性氧代謝相關性分析[J]. 食品科學, 2011, 32(20): 244-248.
YANG H W, CHEN X Y, ZHANG Y,etal. Analysis of the relationship between quality and active oxygen species meta-bolism in nectarine during postharvest ripening and pathogenesis[J].FoodScience, 2011, 32(20): 244-248.
[29]SCAFARO A P, HAYNES P A, ATWELL B J. Physiological and molecular changes inOryzameridionalisNg., a heat-tolerant species of wild rice[J].JournalofExperimentalBotany, 2010, 61(1): 191-202.
[30]SUNG D Y, KAPLAN F, GUY C L. Plant Hsp70 molecular chaperones: protein structure, gene family, expression and function[J].PhysiologiaPlantarum, 2001, 113(4): 443-451.
[31]MYOUGA F, MOTOHASHI R, KUROMOMORI T,etal. An Arabidopsis chloroplast-targetedHsp101 homologue,APG6, has an essential role in chloroplast development as well as heat-stress response[J].ThePlantJournal, 2006, 48(2): 249-260.
[32]STANNE T M, POJIDAEVA E, ANDERSSON F I,etal. Distinctive types of ATP-dependent Clp proteases in cyanobacteria[J].JournalofBiologicalChemistry, 2007, 282(19): 14 394-14 402.
[33]PATEL M, BERRY J O. Rubisco gene expression in C4plants[J].JournalofExperimentalBotany, 2008, 59(7): 1 625-1 634.
[34]陳根云, 肖元珍, 李立人. 影響豌豆Rubisco組裝的因子及其作用機制[J]. 植物生理學報, 2001, 27(5): 369-374.
CHEN G Y, XIAO Y Z, LI L R. The factors affecting Rubisco assembly and the reaction mechanism in pea[J].ActaPhytophysiologicaSinica, 2001, 27(5): 369-374.
[35]YANG E J, OH Y A, LEE E S,etal. Oxygen-evolving enhancer protein 2 is phosphorylated by glycine-rich protein 3 wall-associated kinase 1 inArabidopsis[J].BiochemicalandBiophysicalResearchCommunications, 2003, 305(4): 862-868.
[36]YI X, MCCHARGUE M, LABORDE S,etal. The manganese-stabilizing protein is required for photosystem II assembly/stability and photoautotrophy in higher plants[J].JournalofBiologicalChemistry, 2005, 280(16): 16 170-16 174.
[37]KUMAR S, KAUR R, KAUR N,etal. Heat-stress induced inhibition in growth and chlorosis in mungbean (PhaseolusaureusRoxb.) is partly mitigated by ascorbic acid application and is related to reduction in oxidative stress[J].ActaPhy-siologiaePlantarum, 2011, 33(6): 2 091-2 101.
[38]劉琳琳, 席景會, 連杰, 等. 擬南芥和甜菜夜蛾相互作用的差異蛋白分析[J]. 高等學校化學學報, 2009, 30(9): 1 767-1 772.
LIU L L, XI J H, LIAN J,etal. Analysis of differential protein expression patterns on interaction betweenArabidopsisthalianaandSpodopteraexigua[J].ChemicalJournalofChineseUniversities, 2009, 30(9): 1 767-1 772.
[39]GLISOVIC T, BACHORIK J L, YONG J,etal. RNA-binding proteins and post-transcriptional gene regulation[J].FEBSLetters, 2008, 582(14): 1 977-1 986.
[40]THOMPSON J E, HOPKINS M T, TAYLOR C,etal. Regulation of senescence by eukaryotic translation initiation factor 5A: implications for plant growth and development[J].TrendsinPlantScience, 2004, 9(4): 174-179.
(編輯:裴阿衛)
Effect of Sunburn Stress on Pericarp Proteomics in Loquat Fruits
PAN Dezhuo1, DENG Chaojun2, Lü Xiaojie1, SONG Xiaomin1, QIU Zhimin3,GONG Huiwen1, JIANG Jimou2, CHEN Wei1*
(1 College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2 Fruit Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 3 College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
The objective of this work was to investigate the changes of differential expressed proteins in response to sunburn stress on loquat pericarp. The fruits of loquat cultivar ‘Jinzhong’ and ‘Honghouben’ sunburned for 90 min at 40 ℃ during color changing period were selected as experiment materials, among which the ‘Jinzhong’ loquat is poorer than ‘Honghouben’ at sunburn resistance. Total proteins in pericarp were separated using two-dimensional electrophoresis and differentially expressed proteins were identified using matrix-assisted laser desorption ionization time-of-flight/time-of-flight mass spectrometry (MALDI-TOF/TOF-MS). (1) Total 64 proteins were changed at least 2-fold differences in abundance, among which 56 proteins were successfully identified with 38 in ‘Jinzhong’ and 23 in ‘Honghouben’. (2) These identified proteins were involved in stress response and defense (accounting for 30.3%), photosynthesis(14.3%), respiration (25.0%), protein metabolism(14.3%)and some other physiological processes. (3) Compared to ‘Honghouben’, the abundance of many heat shock protein (HSP) was increased, and the abundance of proteins participating in respiration was also increased in order to generate more energy in ‘Jinzhong’. But the contents of many proteins related to photosynthesis as well as ascorbic acid peroxidase (APX) and polyphenol oxidase (PPO) removing reactive oxygen species (ROS) were all decreased, otherwise the activity of PPO was declined in ‘Jinzhong’. It is suggested that in order to enhance sunburn resistance in loquat, the content and activity of the enzymes removing ROS may be increased, the amount of HSP may need to some extent, and respiration and photosynthesis might be kept at the normal level.
Eriobotryajaponica(Thunb.) Lindl.; pericarp; sunburn; differential expressed proteins
1000-4025(2016)09-1801-12doi:10.7606/j.issn.1000-4025.2016.09.1801
2016-05-05;修改稿收到日期:2016-09-12
福建省自然科學基金(2014J01099);公益性行業(農業)科研專項經費(201003073)
潘德灼(1982-),男,在讀博士研究生,主要從事植物生理與分子生物學研究。E-mail: pdz_006@163.com
陳偉,教授,博士生導師,主要從事植物生理與分子生物學研究。E-mail: weichen909@163.com
Q945.78; Q591.2
A

