新型吸收制冷工質對CO2-[emim][Tf2N]超額吉布斯自由能的預測
何麗娟 朱超群 梁晶晶(內蒙古科技大學能源與環境學院 包頭 014010)
新型吸收制冷工質對CO2-[emim][Tf2N]超額吉布斯自由能的預測
何麗娟 朱超群 梁晶晶
(內蒙古科技大學能源與環境學院 包頭 014010)
針對氨系、水系、氟利昂系等傳統吸收式制冷工質對的缺陷,提出以[emim][Tf2N]為吸收劑的二元混合體系CO2-[emim][Tf2N]作為新型吸收制冷工質對。通過將PR狀態方程和NRTL活度系數模型結合為一體,并以立方型方程和超額自由能模型結合得到的WS混合規則為紐帶,建立GE-EOS熱力學模型,得到高溫高壓下二元混合體系的超額吉布斯自由能,計算結果表明:當溫度為453.15 K,壓力為13.374 MPa,CO2液相摩爾分數為0.392時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能存在最大值。
CO2-[emim][Tf2N];狀態方程;混合法則;超額吉布斯自由能
吸收制冷循環因其可有效利用低品位能源而備受關注[1-2]。以往研究表明[3-5],合適的吸收制冷工質對吸收制冷循環性能的影響較大,其中溴化鋰吸收制冷工質易腐蝕、易結晶,不能制取0℃以下的冷量;氨可燃有毒,氨水吸收制冷循環需精餾設備;CFC等氟利昂對臭氧層造成破壞[6],因此尋找新型環保的吸收制冷工質對成為關鍵問題。
CO2作為一種具有單位容積制冷量高、良好的傳熱、節流特性等優點[7]的安全環保制冷劑,在19世紀末至20世紀30年代便得到了廣泛的應用,但其研究還限于壓縮式制冷,關于CO2吸收式制冷的研究甚少。隨著學術界對CO2吸收制冷系統的進一步研究,離子液體作為CO2吸收劑的出現解決了吸收制冷工質的弊端。離子液體在室溫下呈液體狀態,具有環境友好、無毒性、幾乎無蒸氣壓,較高的化學穩定性和熱穩定性等優點[8-9]。
Blanchard L A等[10]于1999年最先報道了CO2在高壓下可溶于離子液體,得出了8 MPa下CO2溶解在[bmim][PF6]中的摩爾分數為0.6。Scovazzo P等[11]在2004年研究了CO2在不同陰離子[Tf2N]-、[CF3SO3]-、[Cl]-和[dca]-的離子液體中的溶解性,發現CO2溶解性順序為:[Tf2N]->[dca]->[CF3SO3]->[Cl]-,結果表明[emim][Tf2N]對CO2氣體具有很好的吸收能力,且其溶解性最高為0.10 mol/L。2007年Jacquemin J等[12]研究了CO2在相同陰離子[Tf2N]-,不同陽離子[C4mim]+、[C2mim]+和[N4111]+的離子液體中的溶解性,發現CO2在3種離子液體中的溶解性相似,表明CO2在離子液體中的溶解性主要受陰離子控制,陽離子對其影響較小。2013年王衛[13]利用UNIFAC模型對離子液體-二氧化碳體系進行了研究,分析預測了溫度297.90 ~298.20 K,壓力 0.05~2 MPa范圍內,CO2在[emim][Tf2N]中的溶解度,并將CO2在離子液體中的溶解度文獻值與UNIFAC模型預測值作對比,發現UNIFAC模型預測值和實驗值平均相對偏差不大,說明UNIFAC模型能較好反映CO2在離子液體[emim][Tf2N]中的溶解度及相平衡狀況,在允許的范圍內,誤差值較小,但其研究的實驗條件僅限于低溫低壓。
本文選用對CO2溶解度較大的[emim][Tf2N]作為吸收劑,即選取CO2和離子液體[emim][Tf2N]作為吸收制冷工質。以此為研究對象,依據Schilderman A M等[14]提供的實驗數據,運用WS混合法則、PR狀態方程和NRTL活度系數模型,建立相關相平衡模型,得到了高溫高壓下CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能,有利于進一步研究和發展CO2-[emim][Tf2N]吸收制冷系統。
1 建立模型
相平衡的計算有兩種方法,即狀態方程法和活度系數法。
本文通過PR狀態方程和NRTL活度系數模型結合為一體,并以立方型方程和超額自由能模型結合得到的WS混合規則為紐帶,建立具有預測功能的GEEOS熱力學模型,來關聯CO2-[emim][Tf2N]二元混合體系的氣液相平衡實驗數據,并通過VB語言進行編程,計算CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能。
1.1PR狀態方程
PR狀態方程如式(1)所示:

溫度函數α:

將式(4)、式(5)代入式(3),得到:

1.2NRTL活度系數模型
NRTL方程中的超額吉布斯自由能 GE建立在Scott的雙流體理論基礎上,即假設在二元混合物中有兩種微元,一種以分子1為中心,另一種以分子2為中心,整個混合物等價于這兩種微元所組合成的虛擬混合物。
二元混合體系GE表達式為:

則活度系數表達式為:
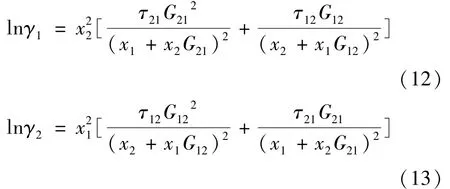
式(12)和式(13)即為NRTL方程。其中,α12= α21。參數α12與溫度及溶液組成無關,只取決于溶液的類型,是溶液的特征函數。Renon H等[15]根據似化學理論將α12值定在0.2~0.47范圍之間。根據溶液類型,本文取α12=0.3。
1.3WS混合規則
一般化Wong-Sandler混合規則如式(14)和式(15)所示,


2 CO2-[emim][Tf2N]二元混合體系超額吉布斯自由能的計算
本文關聯的實驗數據來自于Schilderman A M等[14]利用Cailletet實驗設備測定的CO2和離子液體[emim][Tf2N]二元混合體系的相平衡數據,其壓力變化范圍為0~15 MPa,溫度變化范圍為313.15~453.15 K,二氧化碳液相摩爾分數變化范圍為12.3%~59.3%。
式(20)是實驗數據回歸得到的CO2在離子液體[emim][Tf2N]中的液相摩爾分數與溫度和壓力的經驗關聯式:

式中:T為CO2-[emim][Tf2N]二元混合體系溫度,K;p為CO2-[emim][Tf2N]二元混合體系壓力,MPa,x為CO2在離子液體[emim][Tf2N]中的液相摩爾分數。適用于CO2和離子液體[emim][Tf2N]二元混合體系的溫度、壓力分別在313.15~453.15 K、0.639~14.770 MPa內變化。
超額吉布斯自由能GE根據NRTL模型與WS混合規則關聯得到式(7):

Shiflett M B等[16]利用化工軟件Aspen plus得到了NRTL模型的擬合參數τij、τji,擬合曲線為:

其中,系數見表1。

表1 擬合曲線對應系數Tab.1 Corresponding coefficient of fitting curve
利用PR狀態方程、WS混合法則及NRTL活度系數模型得到CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能的計算結果如圖1~圖4所示。
圖1、圖2分別表示CO2在離子液體[emim][Tf2N]中的液相摩爾分數為定值時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力和隨溫度變化曲線。計算結果表明,當CO2液相摩爾分數為定值時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力的增加而增加,隨溫度的增加而增加。

圖1 CO2-[emim][Tf2N]二元混合體系超額吉布斯自由能隨壓力變化曲線Fig.1 Curve of excess Gibbs free energy of CO2-[emim][Tf2N]binary m ixture system change w ith pressure

圖2 CO2-[emim][Tf2N]二元混合體系超額吉布斯自由能隨溫度變化曲線Fig.2 Curve of excess Gibbs free energy of CO2-[emim][Tf2N]binary m ixture system change w ith tem perature
圖3、圖4分別表示溫度為定值時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力和隨CO2液相摩爾分數的變化曲線。由圖可知,當溫度一定時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力的增大先增加后減少,隨CO2液相摩爾分數的增大先增加后減少。

圖3 CO2-[emim][Tf2N]二元混合體系超額吉布斯自由能隨壓力變化曲線Fig.3 Curve of excess Gibbs free energy of CO2-[emim][Tf2N]binary m ixture system change w ith pressure
計算結果表明,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能受溫度和壓力及CO2液相摩爾分數的耦合影響,在溫度、壓力和CO2液相摩爾分數的影響下,超額吉布斯自由能存在最大值。例如當溫度為453.15 K,壓力為13.374 MPa,CO2液相摩爾分數為0.392時,二元混合體系超額吉布斯自由能存在最大值1 727.888 J/mol,此條件可作為判定 CO2-[emim][Tf2N]吸收式制冷系統最優工況的條件之一。

圖4 CO2-[emim][Tf2N]二元混合體系超額吉布斯自由能隨CO2液相摩爾分數變化曲線Fig.4 Curve of excess Gibbs free energy of CO2-[emim][Tf2N]binary m ixture system change w ith CO2mole fraction in the liquid phase
3 結論
本文以CO2-[emim][Tf2N]作為研究對象,利用PR狀態方程、WS混合法則及NRTL活度系數模型,建立有預測功能的GE-EOS熱力學模型對相平衡實驗數據進行關聯,計算得到,高溫高壓下,與二元混合體系的壓力、溫度以及組分的摩爾分數耦合相關的超額吉布斯自由能熱力學性質參數,為二元混合體系相平衡熱力學性質的研究提供理論依據和基礎數據支持。研究表明:
1)CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能受壓力、溫度以及CO2液相摩爾分數的耦合影響。當 CO2液相摩爾分數為定值時,CO2-
[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力的增加而增加,隨溫度的增加而增加。當溫度一定時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能隨壓力的增大先增加后減少,隨CO2液相摩爾分數的增大先增加后減少。
2)當溫度為453.15 K,壓力為13.374 MPa,CO2液相摩爾分數為0.392時,CO2-[emim][Tf2N]二元混合體系的超額吉布斯自由能存在最大值,表明CO2-[emim][Tf2N]吸收式制冷系統可以進行優化設計。
符號說明
a——PR方程參數
b——PR方程參數
g——分子間相互作用能,J/mol
G——吉布斯自由能,J/mol
Gij——NRTL方程參數
k——雙元系的相互作用參數
p——壓力,kPa
Q——熱量,J
R——摩爾氣體常數,(m3·Pa)/(kmol·K)
T——熱力學溫度,K
V——體積,m3
xi——液相中組分i的摩爾分數
yi——氣相中組分i的摩爾分數
α——溫度函數
γ——活度系數
τ——NRTL方程參數
Ω——狀態方程參數
上標
E——超額性質
*——分子結構特性
下標
b——正常沸點
c——臨界性質
i,j——混合物中組分
m——混合物
本文受內蒙古自然科學基金(2015MS0547)項目資助。(The projectwas supported by the Natural Science Foundation of Inner Mongolia(No.2015MS0547).)
[1] 卞宜峰,何國庚,蔡德華,等.吸收式制冷工質對的研究進展[J].制冷學報,2015,36(6):17-26.(BIAN Yifeng,HE Guogeng,CAI Dehua,et al.Research progress of absorption refrigeration working pairs[J].Journal of Refrigeration,2015,36(6):17-26.)
[2] 李連生.制冷劑替代技術研究進展及發展趨勢[J].制冷學報,2011,32(6):53-58.(LI Liansheng.Research progress on alternative refrigerants and their development trend[J].Journal of Refrigeration,2011,32(6):53-58.)
[3] 陳偉.離子液體吸收式制冷工質對基礎物性與循環特性研究[D].北京:中國科學院大學,2014.
[4] 王建召.吸收式循環構型及含咪唑類離子液體工質對的研究[D].北京:北京化工大學,2009.
[5] 陳曙輝,陳光明,鄭飛.吸收式制冷工質的發展[J].制冷學報,1998,19(2):45-52.(CHEN Shuhui,CHEN Guangming,ZHENG Fei.Development of working pair in absorption refrigeration[J].Journal of Refrigeration,1998,19(2):45-52.)
[6] 楊琴,黃宇,羅二倉,等.以跨臨界CO2-離子液體[bmim]PF6為工質對的吸收式制冷循環性能分析[J].低溫工程,2009(3):5-10.(YANGQin,HUANG Yu,LUO Ercang,etal.Analysis on thermodynamic performance of absorption refrigeration cycle utilizing transition-critical CO2-[bmim]PF6asworking fluid[J].Cryogenics,2009(3): 5-10.)
[7] 張國慶,傅李鵬,吳忠杰,等.環境友好型跨臨界CO2制冷工質的應用與研究進展[J].材料研究與應用,2008,2(4):395-399.(ZHANG Guoqing,FU Lipeng, WU Zhongjie,et al.Progress of research and applications of the environmental friendly transcritical CO2refrigerator [J].Materials Research and Application,2008,2(4): 395-399.)
[8] 張慧,陸建剛,嵇艷,等.離子液分離/固定二氧化碳的研究進展[J].現代化工,2009,29(11):32-38. (ZHANG Hui,LU Jiangang,JI Yan,et al.Progress in CO2separation and fixation by ionic liquids[J].Modern Chemical Industry,2009,29(11):32-38.)
[9] 王冠楠,肖峰,呂學銘,等.離子液體吸收CO2的研究進展[J].化工時刊,2010,24(3):61-69.(WANG Guannan,XIAO Feng,LYU Xueming,et al.Progress in CO2absorption by ionic liquids[J].Chemical Industry Times,2010,24(3):61-69.)
[10]Blanchard L A,Hancu D,Beckman E J,etal.Green processing using ionic liquids and CO2[J].Nature,1999,399(6731):28-29.
[11]Scovazzo P,Kieft J,Finan D A.Gas separations using non-hexafluorophosphate[PF6]anion supported ionic liquid membranes[J].Journal of Membrane Science,2004,238(1):57-63.
[12]Jacquemin J,Husson P,Majer V.Influence of the cation on the solubility of CO2and H2in ionic liquids based on the bis(trifluoromethylsulfonyl)imide anion[J].Journal of Solution Chemistry,2007,36(8):967-979.
[13]王衛.UNIFAC模型用于離子液體-氣體體系的研究[D].北京:北京化工大學,2013.
[14]Schilderman A M,Raeissi S,Peters C J.Solubility of carbon dioxide in the ionic liquid 1-ethyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide[J].Fluid Phase Equilibria,2007,260(1):19-22.
[15]Renon H,Prausnitz JM.Local compositions in thermodynamic excess functions for liquid mixtures[J].American Institute of Chemical Engineers,1968,14(1):135-144.
[16]ShiflettM B,Shiflett A D,Yokozeki A.Separation of tetrafluoroethylene and carbon dioxide using ionic liquids[J]. Separation and Purification Technology,2011,79(3): 357-364.
He Lijuan,female,professor,master tutor,Institute of Energy and Environment,Inner Mongolia University of Science and Technology,+86 13848723950,E-mail:zdlilyhe@163.com.Research fields:low grade heat utilization,heat pump system.
Prediction of Excess Gibbs Free Energy for a New W orking Pair CO2-[emim][Tf2N]in Absorption Refrigeration
He Lijuan Zhu Chaoqun Liang Jingjing
(Institute of Energy and Environment,Inner Mongolia University of Science and Technology,Baotou,014010,China)
In view of the defects of traditional working pairs such as ammonia system,water system and Freon system,a new working pair,CO2-[emim][Tf2N]?,was proposed for the absorption refrigeration cycle.PR equation of state,NRTLmodel,and WSmixing rule which was obtained from cubic equation and the excess free energymodelwere utilized to develop GE-EOS thermodynamicmodel in the paper.The excess Gibbs free energy of binarymixture solution under high pressure and high temperaturewere obtained with themodel.The results showed that the excess Gibbs free energy of the binarymixture solution had maximum when temperature is 453.15 K,pressure is 13.374 MPa and CO2mole fraction in the liquid phase is 0.392.
CO2-[emim][Tf2N];equation of state;mixing rule;excess Gibbs free energy
About the
TB61+2;TB61+1
A
0253-4339(2016)05-0045-05
10.3969/j.issn.0253-4339.2016.05.045
2015年9月21日
簡介
何麗娟,女,教授,碩士生導師,內蒙古科技大學能源與環境學院,13848723950,E-mail:zdlilyhe@163.com。研究方向:低品位熱利用,熱泵系統。

