pH和溶解氧對上海蘊藻浜河道沉積物重金屬的影響
袁時玨+張道方
摘要:通過改變上覆水體pH和溶解氧,并采用改進的由歐共標準測量與檢測局(BCR)提出的連續提取法,研究pH和溶解氧對蘊藻浜沉積物中Cu、Cr釋放的影響,以及沉積物釋放前后Cu、Cr形態的變化,探索沉積物中重金屬釋放的機理.結果表明:隨著pH增加,沉積物中重金屬釋放量下降,可還原態在沉積物中的含量上升,可氧化態與酸可提取態含量均有下降,這主要和H+與重金屬離子的競爭以及沉積物中自然膠體的吸附有關;隨著溶解氧含量增加,沉積物中重金屬釋放量升高,可氧化態含量呈明顯下降趨勢,而可還原態含量略有上升趨勢,這主要與沉積物的還原性、硫化物及鐵錳氧化態重金屬有關.
關鍵詞:pH; 溶解氧; 沉積物; 釋放; Cu; Cr
中圖分類號: X 52 文獻標志碼: A
Abstract:In this paper,effects of pH and dissolved oxygen(DO) on Cu and Cr release in the sediment from Yunzaobang River in Shanghai were studied by adjusting pH and concentration of the dissolved oxygen in the overlying water.The changes of Cu and Cr speciation in Yunzaobang River sediment were also analyzed and compared using the modified BCR sequential extraction method to explore the release mechanism.The results showed that with the increased pH,both Cu and Cr release from the sediment decreased.The percentage of the reducible form increased.But the percentage of the oxidizable form and HAc soluble form reduced,which was related to the competitive relation between H+ and metal ion as well as adsorption of the colloid in the sediment.With the rising concentration of DO,both Cu and Cr release increased.The percentage of the oxidizable form reduced obviously while that of the reducible form rose slightly,owing to the reducibility of the sediment itself as well as the existence of sulfide and FeMn oxides in the sediment.
Keywords:pH; dissolved oxygen; sediment; release; Cu; Cr
上海是具有悠久歷史的工業化大城市,其人口密度高,排污總量大,污染負荷重,水環境問題也尤為突出.河道沉積物是河流生態系統的重要組成部分,也是各類污染物的載體,特別是重金屬污染物的蓄積庫.長期以來,沉積物與水體之間存在著密切的能量和物質交換[1],沉積物的污染狀況也是衡量河道水環境的重要指標.
重金屬主要通過人為來源(生活及工業排污)和自然來源(大氣沉降[2]、海洋來源[3]、陸地風化[4]等地化學活動)進入河道水體.水體中有機質等膠體通過吸附、絡合、絮凝、沉降等作用富集在沉積物中,一旦水體環境條件發生改變,水-沉積物界面的動態平衡會被打破,易使得沉積物中的重金屬發生遷移轉化而引發水體二次污染[5-7].重金屬的遷移轉化機制主要可概括為離子交換作用、溶解作用和解析作用[8],因此,體系中pH、溶解氧等條件的改變都會對重金屬的遷移性以及形態分布產生一定影響.銅(Cu)在水體中的本底值較高,活性較大,可通過水生生物進入食物鏈,長期在人體內積累易引發肝硬化、肝腹水等疾病;鉻(Cr)是水體及沉積物中含量較高的重金屬元素,對水生生物和人體的危害也較大,長期積累會引發蛋白質變性而中毒.
蘊藻浜西起上海嘉定區吳淞江,于吳淞口匯入黃浦江,全長為38 km,是流經寶山工業區的一條主要航道,長期承擔著寶山區調水排污的功能,區域內全長為15.6 km.此外,寶山區向蘊藻浜排污的企業多達181家,主要分布在鋼鐵、化工、機械、食品等行業[9].本文以蘊藻浜作為工業區的代表河道,采用實驗室模擬、控制單因素的方法,研究不同pH和溶解氧(DO)對沉積物中Cu、Cr釋放的影響,并選用改進的由歐共標準測量與檢測局(BCR)提出的連續提取法[10-11]對重金屬形態的變化進行分析.
1 材料與方法
1.1 樣品采集與處理
利用柱狀采樣器在蘊藻浜-滬太路側(東經121°22′和北緯31°20′) 采集表層沉積物樣品,密封于聚乙烯盒中,樣品總量約5 kg.利用水樣采樣器對采樣點上覆水體進行采集,密封于聚乙烯瓶中,水樣總量約20 L.樣品運輸至實驗室后,對于沉積物樣品,將其小部分樣品烘干后,去除大顆粒雜質,研磨過100目篩,裝入密封袋于干燥皿中保存,用于常規指標的檢測;其余大部分樣品,充分混合均勻后,于4 ℃冷藏保存,主要用于模擬釋放實驗.對于水樣,去除大顆粒雜質如水草等后,于4 ℃冷藏保存.
1.2 儀器與試劑
本研究所用的儀器主要包括:電感耦合等離子質譜儀(ICPMS NexION300,美國珀金埃爾默公司)、微波消解儀與趕酸爐(上海屹堯儀器科技發展有限公司)、便攜式水質分析儀(Multi 3410,德國WTW公司)、總有機碳分析儀(Muliti N/C 3100,德國耶拿公司)、激光粒度分布儀(BT9300Z,丹東百特儀器有限公司).實驗設備主要包括:六聯數顯電動攪拌器(金壇市白塔新寶儀器有限公司)、柱狀采樣器與水樣采樣器(武漢軒明宇環保科技有限公司).試劑主要包括:NaAc、NH2OH·HCl、HAc、H2O2、NH4Ac、NaOH、HCl均為分析純,由國藥集團化學試劑有限公司購得;HNO3和HF均為分析純,由德國默克公司購得.去離子水產自MilliQ Advantage超純水系統(美國密理博公司,電阻率18.2 MΩ).實驗所用容器均需在使用前用體積分數為10%的 HNO3溶液浸泡24 h以上,并用超純水沖洗3次以上.
1.3 實驗方法及條件
1.3.1 水體及沉積物理化指標的測定
現場采樣時,需用便攜式水質分析儀對水體的pH、溶解氧、水溫、總懸浮顆粒(TDS)、沉積物氧化還原電位(ORP)進行測定.在選定的河道兩點間,多次記錄漂流物經過時間,求出水流的速度.返回實驗后,需在24 h內對沉積物的pH、有機質含量、含水率、中值粒徑(D50),水體總有機碳(TOC)進行測定.沉積物pH按照泥水質量比1∶2.5混合后測定;有機質含量選用燒失量法,溫度為500 ℃,升溫速度為3 ℃·min-1,恒溫2 h[12].所有指標均需做3個平行樣.
1.3.2 重金屬總量的測定
精確稱取0.10 g充分干燥的沉積物樣品置于聚四氟乙烯消解罐中,將由濃硝酸、氫氟酸、雙氧水按體積比6∶1∶1組成的消解液加至消解罐中進行微波消解.微波消解儀按工作程序參數分別設置為:第一步,溫度160 ℃,壓力1.515×106 Pa,時間2 min;第二步,溫度190 ℃,壓力1.818×106 Pa,時間3 min;第三步,溫度210 ℃,壓力2.222×106 Pa,時間10 min.冷卻后,在溫度150 ℃下趕酸2~3 h,定容,用0.45 μm水溶性過濾頭過濾,采用ICPMS對Cu、Cr的質量濃度進行測定.同時采用水系沉積物國家標準物質GBW07309(GSD9)作為質控樣,與樣品一起消解并檢測,檢驗方法的準確性.該方法的回收率需在80%~120%之間,相對誤差在±10%以內.所有指標均需做3個平行樣.
1.3.3 重金屬形態的測定
采用改進的BCR連續提取法[10]對沉積物中Cu、Cr的形態進行分析.重金屬形態可分為水溶態(F1)、酸可提取態(F2)、可還原態(F3)、可氧化態(F4)和殘渣態(F5).酸可提取態主要包括離子交換態和碳酸鹽結合態,可還原態主要為鐵錳氧化物結合態,而可氧化態為有機質、硫化物結合態[13-14].提取步驟為:
(1) 提取水溶態(F1):準確稱取1.00 g過100目篩的干燥沉積物,置于50 mL聚乙烯離心管內,加入25 mL去離子水,室溫下振蕩2 h后,以轉速4 000 r·min-1離心20 min,分離上清液和殘渣.上清液經0.45 μm水溶性過濾頭過濾后儲存于取樣瓶中,此過程需完成兩次.過濾樣酸化,存放于4 ℃的環境中待測.
(2) 提取酸可提取態(F2):取0.50 g過100目篩的干燥沉積物樣品,置于50 mL聚乙烯離心管內,加入20 mL 摩爾濃度為0.11 mol·L-1 的HAc溶液,室溫下振蕩16 h后,以轉速4 000 r·min-1離心20 min,取5 mL上清液,將其經0.45 μm水溶性過濾頭過濾后儲存于取樣瓶中,酸化,冷藏保存待測.用去離子水洗滌殘渣2次,離心棄去上層清液,此過程每個提取步驟后都要進行.
(3) 提取可還原態(F3):向步驟(2)中裝有殘渣的離心管內加入20 mL 摩爾濃度為0.1 mol·L-1 的NH2OH·HCI溶液,室溫下振蕩16 h,轉速4 000 r·min-1下離心20 min,取5 mL上清液經0.45 μm水溶性過濾頭過濾后儲存于取樣瓶中,酸化,冷藏保存待測.
(4)提取可氧化態(F4):向步驟(3)中裝有殘渣的離心管內加入5 mL 體積分數為30%的 H2O2溶液,置于25 ℃水浴l h,再向管內加入5 mL體積分數為30%的H2O2溶液再置于(85±2)℃水浴加熱l h,水浴蒸發至近干,然后加入25 mL摩爾濃度為1 mol·L-1 的NH4Ac溶液,室溫下振蕩16 h,轉速4 000 r·min-1下離心20 min,取上清液經0.45 μm水溶性過濾頭過濾后儲存于取樣瓶中,酸化,冷藏保存待測.
(5)提取殘渣態(F5):將殘渣于50 ℃充分干燥,研磨過100目篩,準確稱取0.10 g,將由濃硝酸、氫氟酸、雙氧水按體積比6∶1∶1組成的消解液加至聚四氟乙烯消解罐中微波消解.此步驟的提取液及之前四個步驟的水樣均通過ICPMS的檢測.同時,選用水系沉積物國家標準物質GBW07309(GSD9)作為質控樣,與樣品一起進行形態分析并檢測,以檢驗形態,分析方法的準確性.該方法的回收率需在80%~120%之間,相對誤差±10%以內.所有指標均需做3個平行樣.
1.3.4 不同pH和溶解氧條件下重金屬的釋放實驗
根據實際測得的蘊藻浜河水深度與沉積物厚度之比(8∶1),將混合均勻的蘊藻浜沉積物樣品平鋪于2 L燒杯底部,每個燒杯內沉積物厚度為(2±0.1)cm,質量為(500±2)g.沿燒杯壁緩慢加入(2±0.01)L河水,用六聯電動攪拌器模擬實際河道水流流速(攪拌轉速為150 r·min-1).采用單因素控制的方法,檢測不同水體pH和溶解氧條件影響下上覆水體中重金屬Cu、Cr的質量濃度,并分析Cu、Cr形態分布的變化,以探究其釋放機理.
(1) pH條件:在模擬實際河道水溫及流速的同時,采用摩爾濃度為1 mol·L-1的NaOH溶液和HCl溶液調節,使用pH計進行測量,控制pH分別為(3±0.2)、(5±0.2)、(7±0.2)和(9±0.2),DO等其他條件均與常態相同.
(2) DO條件:在模擬實際河道水溫及流速的同時,采樣曝氣和充氮氣的方式調節水體溶解氧,使用便攜式水質分析儀測量,控制DO分別為(0.5±0.2)、(2±0.2)、(4±0.2)、(8±0.2)mg·L-1,pH等其他條件均與常態相同.
取燒杯底部底泥上方3 cm水樣5 mL,用0.45 μm濾頭過濾,滴加硝酸酸化,存放至4 ℃的環境中待測,此測量結果作為釋放的背景初始值.之后,前三天每天采樣,三天后每隔一天對燒杯底部沉積物上方3 cm進行采樣.實驗周期為21 d,每次采樣5 mL至取樣瓶,用0.45 μm濾頭過濾,滴加硝酸酸化,存放至4 ℃的環境中待測Cu、Cr的質量濃度.
2 實驗結果和討論
2.1 蘊藻浜河道水體及沉積物的理化指標
供試水體的基本理化性質為:pH為7.11、DO的質量濃度為2.07 mg·L-1、溫度為13.06 ℃,TDS的質量濃度為558 mg·L-1、TOC的質量濃度為8.50 mg·L-1、水流速度為0.57 m·s-1.沉積物的基本理化性質為:pH為6.87、有機質含量為46.58 mg·g-1、含水率(質量分數)為41.92%、中值粒徑為23.36 μm、氧化還原電位為-123.57 mV.水體中Cu、Cr的質量濃度分別為11.10、13.02 μg·L-1,沉積物中Cu、Cr的質量濃度分別為459.65、418.40 μg·L-1.參考我國《地表水環境質量標準(GB 3838—2002)》[15],蘊藻浜—滬太路側水質滿足Ⅴ類標準,即適用于農業用水區及一般景觀要求水域;參考沉積物氧化還原電位與沉積物特性及控制元素的關系[16],蘊藻浜—滬太路側采樣點沉積物性質為還原性,處于缺氧或厭氧環境,由SO2-4/HS-和S/HS-體系控制;參考烏頓—溫德華氏粒級標準(UddenWentworth grade scale)[17-18],判斷其粒徑類別為粉砂.
2.2 pH對沉積物中重金屬釋放規律的影響
2.2.1 pH對沉積物中Cu、Cr釋放量的影響
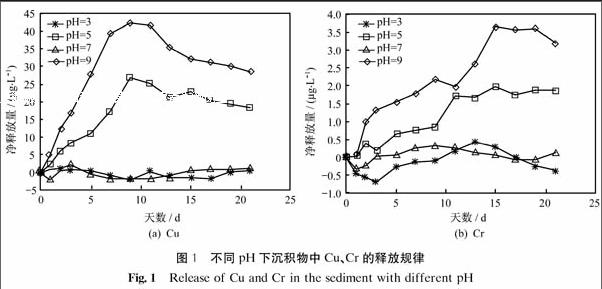
圖1為不同pH下沉積物中Cu、Cr的釋放規律.由圖可以看出,沉積物中Cu、Cr在pH=3~9范圍內釋放量變化很大,Cu的凈釋放量在-5~45 μg·L-1,Cr的凈釋放量在-1~4 μg·L-1.Cu和Cr的釋放量均呈現出隨著pH增大而降低的趨勢,且Cu的釋放速率較快.在pH=3和pH=5兩種實驗條件下,水體處于酸性環境,兩種重金屬的釋放量均較大,且隨著時間增長釋放量先增大,達到峰值后又略有下降并趨于穩定.在pH=7和pH=9兩種實驗條件下,水體處于中性或堿性環境,Cu、Cr的凈釋放量在0 μg·L-1左右波動,不易釋放.其中,pH=7時,水體pH接近常態,在自然水體中重金屬元素本身存在一定的動態平衡,不易有大量的釋放或吸附;pH=9時,水體處于堿性環境,重金屬元素易發生絡合而出現沉淀現象,抑制重金屬元素的釋放.這與Atkinson等[19]的研究結果相符,在弱酸性(pH=6)條件下上覆水體中Zn、Cu、Pb、Cd的含量均明顯高于中性條件(pH=7.2)和弱堿性條件(pH=8.1)的含量.
2.2.2 pH對沉積物中Cu、Cr形態分布的影響
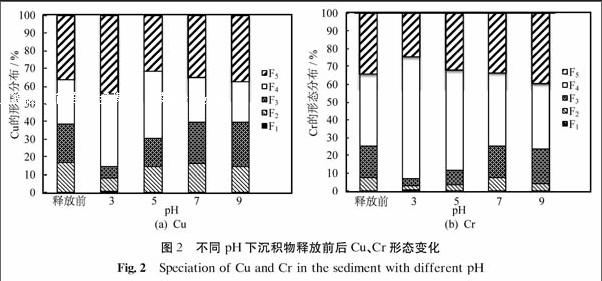
圖2為不同pH下沉積物釋放前后Cu、Cr形態的變化.由圖可以看出,沉積物中Cu、Cr的形態在pH=3~9有明顯變化,其中變化幅度最大的為可還原態(F3)和可氧化態(F4),酸可提取態(F2)和殘渣態(F5)也稍有變化,由于水溶態(F1)本身含量較小,變化不明顯.隨著pH上升,可還原態(F3)在沉積物中含量上升,可氧化態(F4)下降,酸可提取態(F2)略有下降.殘渣態(F5)相對比較穩定,其含量的變化主要是由于其他形態的變化而引起的.Appel等[20]的研究表明:pH是影響重金屬吸附特性的主要因素,其控制著重金屬的水合氧化物、碳酸鹽和磷酸鹽的溶解度,并且也影響著沉積物中重金屬的水解、有機質的溶解、粘土表面電荷的變化以及離子對的形成.
2.2.3 pH影響下沉積物中重金屬釋放的機理
水體pH是引起沉積物中重金屬釋放的一個重要因素,主要表現在制約重金屬的溶解度、控制沉積物對重金屬吸附-解析的過程以及重金屬的賦存形態等方面.從實驗結果得出,酸性環境更有利于沉積物中重金屬的釋放,特別對于其可還原結合態和酸可提取態重金屬的釋放有促進作用.相關吸附-解析機制可概括為:① pH降低,沉積物中碳酸鹽結合態溶解,H+與重金屬離子發生競爭吸附而促進釋放,故在酸性條件下酸可提取態(包含碳酸鹽結合態)呈下降趨勢.② 沉積物中存在著不同類型的自然膠體(鐵錳氧化物等),鐵錳氧化物本身具有兩性的特點,又可作為重金屬的主要吸附劑,其表面電荷和吸附位受pH影響較大[21-22].pH降低,鐵錳金屬水合氧化物析出OH-而帶正電荷,與金屬陽離子競爭吸附位,促使沉積物中金屬離子向水體釋放,同時,Fe(Ⅱ)和Mn(Ⅱ)氧化生成鐵錳氧化物的速率受到抑制而使得吸附重金屬的能力大大下降.pH升高,析出H+而帶負電荷,易吸附金屬陽離子而使得上覆水體中重金屬向沉積物遷移.故隨著pH降低,沉積物中重金屬的可還原態(鐵錳氧化物結合態)含量明顯下降.③ 沉積物中重金屬的釋放還與重金屬本身的性質有關,Cu、Cr在水體及沉積物中的本底值均相近,但低pH影響下Cu的釋放量高達Cr釋放量的10倍.
2.3 DO對沉積物中重金屬釋放規律的影響
2.3.1 DO對沉積物中Cu、Cr釋放量的影響
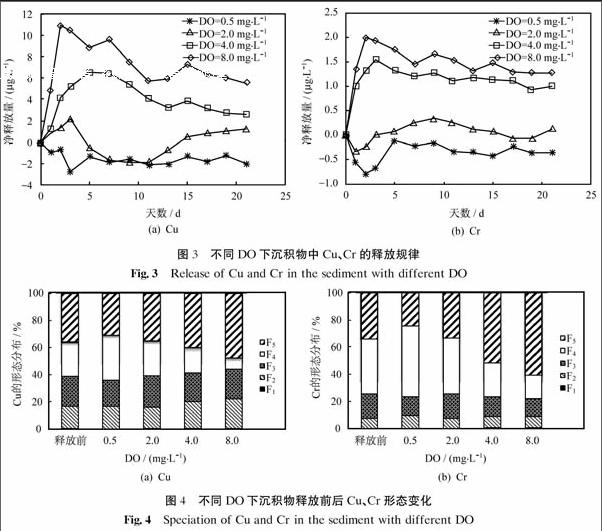
圖3為不同DO下沉積物中Cu、Cr的釋放規律.由圖可以看出,沉積物中Cu、Cr在DO=0.5~8 mg·L-1范圍內釋放量變化很大,Cu的凈釋放量在-5~11 μg·L-1,Cr的凈釋放量在-1~2 μg·L-1.Cu、Cr的釋放量均隨著DO的增大而升高,釋放速率也相近.在DO分別為4、8 mg·L-1時,隨著DO上升,釋放量的上升趨勢較為明顯,均在短時間內隨時間增長釋放量增大,達到峰值,隨后又逐漸下降并趨于平穩;在DO為2 mg·L-1時,接近自然水體常態,重金屬釋放量隨著時間增長在0 μg·L-1附近波動,表明在自然水體中重金屬總量呈動態平衡;在DO為0.5 mg·L-1,水體處于臨界缺氧狀態,重金屬Cu、Cr的凈釋放量均為負值,沉積物處于吸附重金屬狀態,其吸附量隨時間先增大后下降,并趨于平穩.路永正等[23]的研究表明,經過曝氣,沉積物中Pb、Cd、Cu、Zn均會有所釋放,其重金屬形態由相對穩定的形態轉化為較為活躍的結合態,大大加重了生物毒性.
2.3.2 DO對沉積物中Cu和Cr形態分布的影響
圖4為不同DO下沉積物釋放前后Cu、Cr形態變化.由圖可以看出,沉積物中Cu、Cr的形態在DO為0.5~8 mg·L-1之間有明顯變化,其中變化幅度最大的為可氧化態(F4),其次為殘渣態(F5)、酸可提取態(F2)和可還原態(F3).隨著DO上升,可氧化態(F4)在沉積物中含量呈明顯下降趨勢,而可還原態(F3)含量略有上升.殘渣態(F5)在沉積物中較為穩定,其含量的變化主要是由于其他形態的變化而引起的.Kelderman等[24]的相關研究表明,隨著河道水體溶解氧含量的升高,Cu、Zn、Pb的酸可提取態含量隨之升高,可氧化態隨之下降,而對于可還原態,Cu有明顯升高趨勢,Pb則下降.
2.3.3 DO影響下沉積物中重金屬釋放的機理
水體溶解氧是影響沉積物中重金屬活性的又一重要因素.對于蘊藻浜沉積物而言,沉積物為還原型,Cu、Cr的釋放量與DO呈正相關,其可氧化態和可還原態受DO的影響較為明顯.相關吸附-解析機制可概括為:① 與沉積物的本身性質及硫化物有關.在還原性沉積物中,氧化還原電位低,由硫系控制,硫酸鹽易與重金屬結合生成難溶性的金屬硫化物,重金屬的可氧化態為主要的賦存形態.DO升高,硫化物結合態的重金屬易發生氧化反應生成硫酸鹽,并釋放出重金屬從而使得上覆水體重金屬含量升高.② 與重金屬的可還原態有關.DO下降至臨界缺氧狀態,沉積物中鐵錳水合氧化物被還原,引起重金屬離子的釋放,故Cu的可還原態含量略有下降趨勢.DO升高,由于體系中存在FeS和MnS等硫化物,隨著DO升高被氧化而釋放出的Fe(II)和Mn(II)又迅速在高溶解氧條件下形成鐵錳(氫)氧化物膠體.這種膠體又易吸附上覆水體中的重金屬,而使得在高溶解下重金屬先釋放至峰值后共沉降[25].
3 結 論
本文以蘊藻浜滬太路側沉積物為對象,研究不同pH和DO對沉積物中Cu、Cr的釋放規律以及形態分布的影響,并探討其釋放機理.結果表明:
(1) 沉積物中Cu、Cr的酸可提取態、可還原態和可氧化態含量之和較大,遷移能力較高,易在環境條件發生改變時向水體遷移從而形成二次污染.
(2) 上覆水體pH和DO對沉積物中Cu、Cr的活動性有顯著的影響.對于蘊藻浜還原型沉積物而言,酸性條件和高溶解氧條件較有利于Cu、Cr向水體的釋放,這主要與沉積物的性質、硫化物結合態和鐵錳氧化物結合態的特性,以及離子間的競爭吸附有關.
(3) 沉積物中重金屬Cu的釋放能力、最大釋放量及釋放速率均大于Cr,兩種重金屬的釋放過程較為相似.
參考文獻:
[1] MORIN S,DUONG T T,DABRIN A,et al.Longterm survey of heavymetal pollution,biofilm contamination and diatom community structure in the Riou Mort watershed,SouthWest France[J].Environmental Pollution,2008,151(3):532-42.
[2] 馬建軍,田林鋒,馬春梅,等.基于統計的石嘴山市工業園區大氣污染物及其重金屬分布特征[J].環境化學,2013,32(1):164-165.
[3] 彭修強,項立輝,郭娜,等.南黃海南部海域表層沉積物重金屬來源解析及風險評價[J].環境科學學報,2015,35(11):3628-3638.
[4] 謝麗,張振克.長江北支口門圓陀角附近潮灘沉積物重金屬來源及污染評價[J].地理科學,2015(3):380-386.
[5] 賈英,方明,吳友軍,等.上海河流沉積物重金屬的污染特征與潛在生態風險[J].中國環境科學,2013,33(1):147-153.
[6] 徐慶,錢瑾,張毓祥,等.上海市黃浦江表層沉積物重金屬污染評價[J].中國環境監測,2011,27(3):89-92.
[7] 張兆永,吉力力·阿不都外力,姜逢清.艾比湖表層沉積物重金屬的來源、污染和潛在生態風險研究[J].環境科學,2015,36(2):490-496.
[8] 呂繼濤.顫蚓生物擾動對沉積物中重金屬釋放及形態分布的影響[D].長春:吉林大學,2009.
[9] 王旭.上海蘊藻浜沿岸生態適宜性評價[D].上海:上海交通大學,2013.
[10] VANK A,GRYGAR T,CHRASTNY V,et al.Assessment of the BCR sequential extraction procedure for thallium fractionation using synthetic mineral mixtures[J].Journal of Hazardous Materials,2010,176(1-3):913-918.
[11] URE A M,QUEVAUVILLER P,MUNTAU H,et al.Speciation of heavy metal in soils and sediments.An account of the improvement and harmonization of extraction techniques undertaken under the auspices of the BCR of the Commission of the European Communities[J].International Journal of Environmental Analytical Chemistry,1993,51(1-4):135-151.
[12] 胡彩莉,馬玉貞,郭超,等.燒失量法測定土壤有機質含量的實驗條件探究[J].地球與環境,2016,44(1):110-118.
[13] 馮素萍,鞠莉,沈永,等.沉積物中重金屬形態分析方法研究進展[J].化學分析計量,2006,15(4):72-74.
[14] 王國莉,陳孟君,范紅英,等.四種土壤重金屬形態分析方法的對比研究[J].浙江農業學報,2015,27(11):1977-1983.
[15] 國家環境保護總局.GB 3838—2002 地表水環境質量標準[S].北京:中國標準出版社,2002.
[16] 吳金浩,劉桂英,王年斌,等.遼東灣北部海域表層沉積物氧化還原電位及其主要影響因素[J].沉積學報,2012,30(2):333-339.
[17] WENTWORTH C K.A scale of grade and class terms for clastic sediments[J].The Journal of Geology,1922,30(5):377-392.
[18] UDDEN J A.Mechanical composition of clastic sediments[J].Geological Society of America Bulletin,1914,25(1):655-744.
[19] ATKINSON C A,JOLLEY D F,SIMPSON S L.Effect of overlying water pH,dissolved oxygen,salinity and sediment disturbances on metal release and sequestration from metal contaminated marine sediments[J].Chemosphere,2007,69(9):1428-1437.
[20] APPEL C,MA L.Concentration,pH,and surface charge effects on cadmium and lead sorption in three tropical soils[J].Journal of Environmental Quality,2002,31(2):581-589.
[21] 毛竹,王浩.土壤重金屬形態分布特性及其影響因素[J].科技資訊,2013(8):163-164.
[22] 章驊,何品晶,呂凡,等.重金屬在環境中的化學形態分析研究進展[J].環境化學,2011,30(1):130-137.
[23] 路永正,董德明,沈秀娥,等.曝氣對河流沉積物中重金屬Cu,Pb,Zn和Cd釋放的影響[J].吉林大學學報:理學版,2005,43(6):877-881.
[24] KELDERMAN P,OSMAN A A.Effect of redox potential on heavy metal binding forms in polluted canal sediments in Delft(The Netherlands)[J].Water Research,2007,41(18):4251-4261.
[25] CAETANO M,MADUREIRA M J,VALE C.Metal remobilisation during resuspension of anoxic contaminated sediment:Shortterm laboratory study[J].Water,Air,and Soil Pollution,2003,143(1-4):23-40.

