無乳鏈球菌sodA基因的克隆、序列分析及原核表達載體構建
王松艷,蔡雙虎,魯義善,簡紀常,吳灶和
(1.廣東海洋大學水產學院 // 2.廣東省水產經濟動物病原生物學及流行病學重點實驗室暨水產經濟動物病害控制廣東省普通高等學校重點實驗室,廣東 湛江 524088)
無乳鏈球菌sodA基因的克隆、序列分析及原核表達載體構建
王松艷1,2,蔡雙虎1,2,魯義善1,2,簡紀常1,2,吳灶和2
(1.廣東海洋大學水產學院 // 2.廣東省水產經濟動物病原生物學及流行病學重點實驗室暨水產經濟動物病害控制廣東省普通高等學校重點實驗室,廣東 湛江 524088)
無乳鏈球菌(Streptococcus agalactiae)是引起我國南方羅非魚鏈球菌病的主要病原之一,SodA是無乳鏈球菌重要的毒力因子之一。根據鏈球菌sodA基因保守區設計引物,采用PCR擴增sodA基因部分序列,反向PCR和巢式PCR擴增其側翼序列,成功獲得無乳鏈球菌sodA基因。無乳鏈球菌sodA基因序列全長為699 bp,含開放閱讀框609 bp,可編碼202個氨基酸,演繹的SodA蛋白主要由α螺旋和不規則卷曲構成。BLAST 分析表明,該蛋白氨基酸序列與犬鏈球菌(S.canis)及副乳房鏈球菌(S.parauberis)相應蛋白的氨基酸序列相似性分別高達 80%和 79%。將 sodA基因克隆至原核表達載體 pET28a上成功構建了重組質粒 pET28a-sodA,導入Escherichia coli BL21(DE3),誘導表達的重組蛋白質分子質量約為24 ku,主要以包涵體形式存在于表達菌中。
無乳鏈球菌;sodA基因;克隆;原核表達
無乳鏈球菌(Streptococcus agalactiae)是一種革蘭陽性菌,屬于B族鏈球菌,該菌可引起新生兒患腦膜炎、肺炎和敗血癥等疾病,也是近年來我國南方地區羅非魚(Oreochromis)鏈球菌病的主要病原菌之一[1-2],給我國羅非魚產業造成巨大經濟損失。
超氧化物歧化酶(Superoxide Dismutase,SOD)主要功能是催化超氧陰離子發生歧化反應生成H2O2和 O2,可消除超氧陰離子自由基對細胞膜的損傷,是生物體抗氧防御系統的第一道防線[3]。研究表明,鏈球菌含有 sodA基因編碼蛋白,該蛋白具有結合錳的超氧化物歧化酶(MnSOD)的特性,可迅速清除吞噬細胞釋放的超氧化物,中和超氧化物陰離子自由基O2-和NO自由基[5],達到提升鏈球菌在宿主吞噬細胞內的存活作用[4-5]。
目前,對sodA基因的研究報道主要集中在與人類或獸醫疾病相關鏈球菌上,而對羅非魚鏈球菌病主要病原無乳鏈球菌中該基因序列、功能等詳細信息知之甚少,不利于揭開羅非魚鏈球菌病的致病機理。本研究以sodA基因在鏈球菌屬中的保守序列設計引物,以普通PCR、反向PCR和巢式PCR技術克隆無乳鏈球菌sodA基因,并構建sodA基因原核表達載體,為該基因功能研究提供基礎資料。
1 材料與方法
1.1 菌株、質粒及主要試劑
無乳鏈球菌 ZQ0910,分離自患病羅非魚(O.niloticus)。原核表達載體 pET28a和大腸桿菌Escherichia coli BL21(DE3)、DH5α保存于廣東省水產經濟動物病原生物學及流行病學重點實驗室。BHI培養基和LB培養基購自廣東環凱微生物科技有限公司。質粒pMD18-T、限制性內切酶、PCR相關試劑、MiniBEST細菌基因組提取試劑盒及MiniBEST切膠回收試劑盒購自寶生物工程(大連)有限公司。
1.2 無乳鏈球菌基因組制備
將無乳鏈球菌ZQ0910接種于BHI 培養基中活化,用MiniBEST細菌基因組提取試劑盒提取無乳鏈球菌基因組DNA,于- 20℃冰箱保存,備用。
1.3 sodA基因部分序列擴增
根據Genbank 中鏈球菌屬細菌sodA基因序列保守區設計引物S1:5′ -TGATGCGCTTGAGCCACA TA-3′,S2:5′ -AACAACAAGCCAAGCCCAAC-3′,用PCR擴增sodA基因部分序列。反應體系為25 μL,反應條件為:94℃ 5 min ;94℃ 1 min ,55℃ 1 min,72℃ 1.5 min ,30個循環;72℃ 10 min。用MiniBEST切膠回收試劑盒回收產物后,克隆至pMD18-T中,然后轉入E.coli DH5α感受態細胞,采用氨芐青霉素(Amp)與β-半乳糖苷酶實驗篩選含重組質粒PMD18T-sodA陽性菌落,在LB液體培養基中擴大培養后送生工生物工程(上海)股份有限公司(下稱“上海生工”)測序。
1.4 sodA基因側翼序列擴增
將無乳鏈球菌ZQ0910基因組DNA用限制性內切酶HphI進行完全酶切,滅活內切酶活性后用酚-氯仿抽提,再用無水乙醇沉淀,將沉淀物重溶于雙蒸水中,T4 DNA連接酶連接后作為反向PCR的模板保存于- 20℃冰箱中備用。根據sodA基因部分序列測序結果,設計擴增sodA基因側翼序列反向引物P1:5′-CAGCAGCAACAGGACGTTTT-3′ ,P2:5′-GGTTAAGATGTCCACCACCG-3′巢式 PCR引物T1:5′-ACAGGACGTTTTGGTTCAGGT-3′,T2:5′-GAAACATCAGCTAAGAGCGCC-3′。反向PCR反應體系為25 μL,具體條件為:94℃ 5 min;94℃ 1 min,54℃ 1 min ,72℃1.5 min,35個循環;72℃10 min。取1 μL反向PCR產物,稀釋50倍后作為隨后的巢式PCR反應模板。巢式PCR擴增條件:94℃ 5 min;94℃ 1 min ,55℃ 1 min ,72℃ 1.5 min,共30個循環;72℃ 10 min。回收巢式PCR產物,克隆至pMD18-T后送上海生工測序。
1.5 sodA基因序列的拼接與生物信息學分析
應用DNAStar軟件的Seqman模塊對sodA基因部分序列和側翼序列進行拼接。采用ORF Finder( http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 和ProtParam(http://web.expasy.org/protparam/)預測序列開放閱讀框(ORF)、演繹氨基酸序列、分子質量計算值和理論等電點等。應用Blast和ClustalX進行同源序列比對。通過在線分析軟件SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP)預測信號肽序列。
1.6 sodA原核表達載體構建
根據 sodA基因完整序列設計引物(F1:5′-CATGCCATGGCAATTATTTTACCAG-3′,F2:5′-CCGCTCGAGAGCTTTAGCAGCTTGGT-3′),其中引物F1和F2分別包含NcoI和XhoI酶切位點,PCR擴增sodA基因完整ORF。PCR反應體系為25 μL,反應條件為:94℃ 5 min ;94℃ 1 min,55℃ 1 min,72℃ 1.5 min,30個循環;72℃ 10 min。PCR產物回收后克隆至pMD18-T,用NcoI和XhoI雙酶切,經8 mg/mL瓊脂糖凝膠電泳,切膠回收。同樣將質粒pET28a用NcoI和XhoI雙酶切,經瓊脂糖凝膠電泳,切膠回收。應用T4 DNA連接酶將已雙酶切的質粒pET28a與已雙酶切的 sodA基因完整ORF連接起來。連接產物轉入E.coli DH5α感受態細胞,采用Amp與β-半乳糖苷酶實驗篩選含重組質粒的陽性菌落,然后用菌落PCR進一步篩選。擴大培養含重組質粒pET28a-sodA的E.coli DH5α,提取重組質粒pET28a-sodA,用通用引物M13測序,以檢測重組質粒中sodA基因讀碼框是否正確。
1.7 重組質粒的誘導表達
將重組質粒 pET28a-sodA轉入表達菌 E.coli BL21(DE3)后,接種于含有Amp的LB固體平板,37℃下培養 12~16 h,從平板上挑取單菌落于含Amp的LB液體培養基至D(600nm)為0.6~1.0,取2mL接種至50mL含Amp的LB液體培養基中,于37℃搖床培養3 h,至D(600nm)為0.6,加入100mmol/L IPTG儲液至IPTG終濃度為1mmol/L,于37℃下誘導培養4 h。誘導培養結束后,取菌液1mL離心,收集沉淀的菌體,在沉淀中加入PBS,用超聲破碎儀破碎細菌,取破碎后的菌液全細胞離心后的上清液和沉淀進行SDS-PAGE電泳檢測。
2 結 果
2.1 sodA基因克隆
用引物 S1和S2成功擴增出大小約為370 bp片段(圖1,泳道1)。測序后Blast分析發現,與其他鏈球菌sodA相似性高,由此判定該擴增產物為無乳鏈球菌sodA基因片段。反向PCR擴增出1條清晰的1.6 kb DNA片段(圖1,泳道2);以反向PCR產物為模板的巢式PCR擴增出一條約1.34 kb的DNA片段(圖1,泳道3)。巢式PCR 產物經測序后與前面測序的sodA基因部分序列拼接,獲得699 bp包含 sodA基因完整 ORF的序列,提交GenBank,登錄號為KU598928。
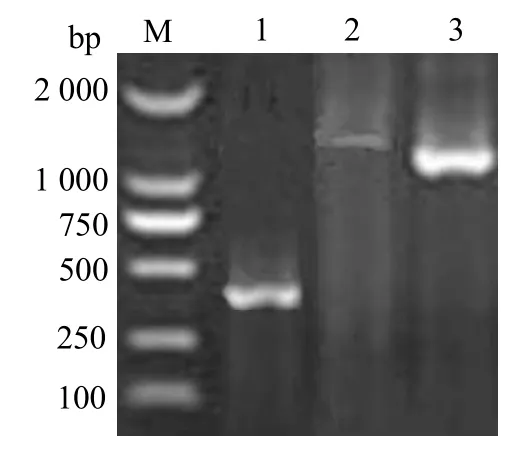
圖1 無乳鏈球菌sodA基因PCR擴增電泳結果Fig.1 Electrophoretic results of cloning sodA gene sequence from S.agalactiae
2.2 sodA基因序列分析
經ORF Finder分析發現,無乳鏈球菌sodA基因ORF由609 bp組成,編碼202個氨基酸(圖2),該基因5′ 上游未發現原核生物基因,應具備-35區和-10區序列。用Blast對sodA基因進行同源性分析發現,無乳鏈球菌 sodA基因與犬鏈球菌(S.canis)ATCC 43496及副乳房鏈球菌(S.parauberis)KCTC 11537相關基因相似性分別高達80%和79%。

圖2 無乳鏈球菌sodA基因序列及其演繹的氨基酸序列Fig.2 Complete gene sequence and deduced amino acids of sodA gene from S.agalactiae
分析表明,SodA蛋白分子質量為22.7 ku,等電點為4.73,為酸性蛋白;其N端未見信號肽序列,表明該蛋白可能僅在胞內執行功能。該蛋白有4個活性位點,分別是His27,81,167和Asp163,這些位點可能是該蛋白折疊成的關鍵氨基酸殘基;活性位點中His27,81,167被磷酸化,可能對維持 SodA 蛋白活性至關重要。Swiss-Model預測表明,SodA 蛋白三級結構中含約41.47%的α螺旋、14.94%的β轉角、8.38%的延伸串和35.21%的不規則卷曲(圖3)。
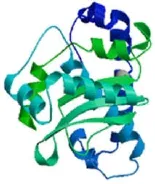
圖3 無乳鏈球菌SodA蛋白三級結構的預測。Fig.3 Predicting results of tertiary structure of SodA from S.agalactiae
2.3 無乳鏈球菌SodA蛋白同源性分析Blast比對分析表明,無乳鏈球菌SodA蛋白與其他鏈球菌有較高相似性;與豬鏈球菌(S.suis)、野生鏈球菌(S.ferus)、表兄鏈球菌(S.sobrinus)及乳房鏈球菌(S.uberis)相關蛋白相似性分別為88%、87%、87%、85%。對上述各鏈球菌SodA蛋白進行多重序列同源比對,發現該蛋白N端的氨基酸序列保守性較強,12個氨基酸殘基中有11個完全保守;而在C末端氨基酸序列差異較大,12個氨基酸殘基中僅7個完全保守(圖4)。

圖4 無乳鏈球菌SodA蛋白的氨基酸序列相似性分析Fig.4 Putative amino sequence alignment of SodA among S.agalactiae and other Streptococcus
2.4 重組質粒誘導表達
重組質粒pET28a-sodA經測序后,翻譯表明,sodA基因在重組質粒pET28a-sodA中讀碼框正確,表明它可在質粒pET28a-sodA中表達出正確的肽鏈及C末端6×His標簽。重組質粒pET28a-sodA轉入表達菌 E.coli BL21(DE3),經 IPTG誘導后,SDS-PAGE電泳可見,在破碎后菌液全細胞的沉淀中觀察到一條分子質量約為24 ku的誘導表達蛋白條帶,與重組SodA蛋白的理論分子質量相符(圖5,泳道3),而經IPTG誘導包含空載體pET28a和未經誘導的包含重組質粒pET28a-sodA的表達菌的全細胞液中均未發現該蛋白條帶(圖5),表明重組質粒pET28a-sodA誘導后表達為重組SodA蛋白。
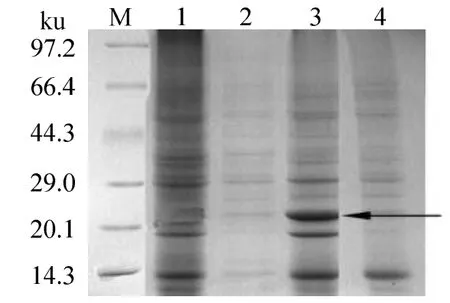
圖5 表達的SodA的SDS-PAGE圖譜Fig.5 SDS-PAGE analysis of the expressed SodA
3 討 論
本研究采用反向 PCR和巢式PCR擴增無乳鏈球菌的sodA基因片段側翼序列,然后與sodA基因部分序列拼接后獲得該基因全長,與程海燕等[6]用反向 PCR獲得溶藻弧菌的acfA基因全序列相比,本研究中sodA在鏈球菌中保守性更高,避免了可能因設計簡并性引物或應用Touchdown-PCR而增加的實驗失敗風險,方法更實用和簡單。當然,反向PCR還存在環化反應難以控制、線狀串聯體成為副產物甚至是主要產物,導致非特異性擴增及酶切片段太長而降低擴增效率等缺陷,使該擴增方法的應用受到一定限制[7]。本研究中,無乳鏈球菌sodA基因序列5′ 端上游無典型的-35區和-10區序列,表明該基因可能與其他基因在基因組上串聯成一個基因簇,在轉錄時共用一個啟動子轉錄成一個長的mRNA,翻譯的多肽經剪切后形成各獨立的蛋白。SignalP分析未發現演繹的SodA蛋白在N末端有信號肽序列,表明該蛋白不能通過細胞膜轉運至細胞外[8]。
pET載體系列由于其高效的表達和純化工藝的簡便而受到科研人員的青睞,本研究選擇該系列的pET28a載體。重組蛋白SodA在37℃時表達效果較好,表達的SodA蛋白僅存在于破碎的表達菌沉淀中,表明該表達蛋白以不溶性的包涵體形式存在。包涵體的形成是由多種因素決定的。或由于重組蛋白在折疊中缺乏某些輔助因子,或由于環境因素的不適:如大量外源表達蛋白的出現對宿主細胞產生毒性,宿主為保護自身細胞而產生一種機制包裹外源蛋白,致使外源蛋白形成包涵體,從而減少外源蛋白對其產生的毒性[9-10]。但是重組蛋白以包涵體形式存在有利于蛋白的分離純化,不易為蛋白酶水解破壞,進而可獲得較高含量的目的蛋白。
細菌的黏附、侵襲和抗吞噬功能在致病過程中起關鍵作用。B族鏈球菌的SodA主要作用是催化在吞噬細胞中由呼吸爆發所釋放的超氧化離子,從而保護鏈球菌不被吞噬細胞損失和吞噬[11-13]。本研究克隆和原核表達無乳鏈球菌 sodA基因,將為研究其保守區域、抗原決定簇組成、金屬Mn2+受體結合部位及催化釋放超氧化離子的活性部位等,最終為揭示無乳鏈球菌對羅非魚的致病機制奠定基礎。
[1]王蓓,李桂歡,王培,等.羅非魚源無乳鏈球菌溶血素基因體外表達及其免疫原性[J].漁業科學進展,2014,35(6): 60-67.
[2]CHEN M,WANG R,LUO F G,et al.Streptococcus agalactiae isolates of serotypes Ⅰa,ⅠⅠⅠ and V from human and cow are able to infect tilapia [J].Veterinary Microbiology,2015,180(1/2): 129-135.
[3]GAⅠLLOT O,POYART C,BERCHE P,et al.Molecular characterization and expression analysis of the superoxide dismutase gene from Streptococcus agalactiae [J].Gene,1997,204(1/2): 213-218.
[4]BRUNO-BáRCENA J M,AZCáRATE-PERⅠL M A,KLAENHAMMER T R,et al.Marker-free chromosomal integration of the manganese superoxide dismutase gene(sodA)from Streptococcus thermophilus into Lactobacillus gasseri [J].FEMS Microbiology Letter,2005,246(1): 91-101.
[5]TANG Y,ZHANG X Y,WU W,et al.Ⅰnactivation of the sodA gene of Streptococcus suis type 2 encoding superoxide dismutase leads to reduced virulence to mice [J].Veterinary Microbiology,2012,158(3/4): 360-366.
[6]程海燕,龐歡瑛,魯義善,等.溶藻弧菌acfA基因克隆與生物信息學分析[J].廣東海洋大學學報,2014,34(1):9-14.
[7]GARCⅠA-SANCHEZ A,CERRATO R,LARRASA J,et al.Characterisation of an extracellular serine protease gene(nasp gene) from Dermatophilus congolensis [J].FEMS Microbiology Letter,2004,231(1): 53-57.
[8]EGNELL P,FLOCK J Ⅰ.The subtilisin Carlsberg pro-region is a membrane anchorage for two fusion proteins produced in Bacillus subtilis [J].Gene,1991,97(1): 49-54.
[9]DEMONTE D,DUNDAS C M,PARK S.Expression and purification of soluble monomeric streptavidin in Escherichia coli[J].Applied Microbiology and Biotechnology,2014,98(14): 6 285-6 295.
[10]YUASA N,KOYAMA T,FUJⅠTA-YAMAGUCHⅠ Y.Purification and refolding of anti-T-antigen single chain antibodies(scFvs) expressed in Escherichia coli as inclusion bodies [J].Bioscience Trends,2014,8(1): 24-31.
[11]YESⅠLKAYA H,KADⅠOGLU A,GⅠNGLES N,et al.Role of manganese-containing superoxide dismutase in oxidative stress and virulence of Streptococcus pneumoniae [J].Ⅰnfection and Ⅰmmunity,2000,68(5): 2819-2826.
[12]POYART C,PELLEGRⅠNⅠ E,GAⅠLLOT O,et al.Contribution of Mn-cofactored superoxide dismutase(SodA) to the virulence of Streptococcus agalactiae [J].Ⅰnfection and Ⅰmmunity,2001,69(8): 5 098-5 106.
[13]ANDRUS J M,BOWEN S W,KLAENHAMMER T R,et al.Molecular characterization and functional analysis of the manganese-containing superoxide dismutase gene(sodA)from Streptococcus thermophilus AO54 [J].Archives of Biochemistry and Biophysics,2003,420(1): 103-113.
(責任編輯:劉慶穎)
Cloning and Bioinformatics Analysis of sodA Gene from Streptococcus agalactiae and Constructing pET28a-sodA Plasmid
WANG Song-yan1,2,CAI Shuang-hu1,2,LU Yi-shan1,2,JIAN Ji-chang1,2,WU Zao-he2
(1.Fisheries College of Guangdong Ocean University // 2.Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals & Key Laboratory of Control for Diseases of Aquatic Economic Animals of Guangdong Higher Education Institutes,Zhanjiang 524088,China)
Streptococcus agalactiae is one of the most important pathogens with a virulence factor SodA causing Streptococcal diseases of cultured Tilapia in South China.Based on the sequences of the highly conserved sequence of the sodA gene among Streptococcus sp,primers for PCR were designed.The partial sequence of the gene was amplified by PCR,and the flanking sequence was amplified by inverse PCR and nested PCR.The complete cDNA sequence of sodA gene was 699 bp with an ORF of 609 bp encoding a 202-peptide.Analysing of the structure SodA protein showed it mainly consisted of α-helix and random coil.Blast analysis indicated the deduced amino acid sequence of SodA from S.agalactiae showing 80% and 79% high similarity with S.canis and S.parauberis respectively.The sodA was cloned into the plasmid pET28a to express in Escherichia coli.The pET28a-sodA were efficiently expressed in host bacterium E.coli BL21(DE3) following induction with IPTG.SDS-PAGE analysis showed the molecular weight of the recombinant protein was 24 ku and the expressed SodA was expressed as inclusion bodies in E.coli.
Streptococcus agalactiae; sodA gene;Cloning;Prokaryotic expression
Q78;Q939.1
A
1673-9159(2016)03-0015-05
10.3969/j.issn.1673-9159.2016.03.003
2016-01-09
國家自然科學基金(31302226)
王松艷(1989-),女,碩士研究生,從事水產動物病害防控研究。E-mail: 1184015027@qq.com
蔡雙虎,男,教授。Tel:0759-2383509,E-mail:cshcai@163.com

