平菇疏水蛋白Po.hyd基因RNAi載體構建及轉化
劉媛媛,馬愛民*(華中農業大學食品科學技術學院,湖北 武漢 430070)
平菇疏水蛋白Po.hyd基因RNAi載體構建及轉化
劉媛媛,馬愛民*
(華中農業大學食品科學技術學院,湖北 武漢 430070)
為研究平菇疏水蛋白基因Po.hyd的功能,首次構建了Po.hyd的RNAi載體,并通過根癌農桿菌介導獲得了平菇轉化子。通過聚合酶鏈式反應(polymerase chain reaction,PCR)擴增Po.hyd序列,利用Golden Gate克隆法構建了干擾載體p1302-GG-ihyd,將其導入根癌農桿菌GV3101中,并在乙酰丁香酮的誘導下完成根癌農桿菌對平菇幼嫩菌絲的介導轉化。轉化子經PCR檢測、熒光顯微鏡觀察、實時定量熒光PCR技術(real-time PCR)以及Southern雜交等技術進行驗證。結果顯示,本研究最終獲得1 株可穩定遺傳的平菇轉化子,該轉化子具有潮霉素抗性,且在熒光顯微鏡下可檢測到綠色熒光信號,Po.hyd基因的表達量為野生型的43%,干擾載體T-DNA片段以單拷貝的形式整合在轉化子基因組內。
糙皮側耳;疏水蛋白;RNAi;根癌農桿菌介導
疏水蛋白(hydrophobin)是表面活性最高的蛋白之一,具有可在臨界面形成兩性親和蛋白膜的特殊性質,在食品生產及保藏領域具有廣闊的應用前景[1-2]。2009年Cox等[3]將里氏木霉(Trichoderma reesei)的Ⅱ型疏水蛋白HFBⅡ加入到巧克力奶昔中,改善了奶昔泡沫的穩定性,該研究認為是疏水蛋白在奶昔氣泡的表面形成了穩固的兩親蛋白膜,從而防止了氣泡的歧化與合并。2010年Stübner等[4]將黃色鐮刀菌(Fusarium culmorum)的Ⅱ型疏水蛋白FcHyd5p基因導入到畢赤酵母(Pichia pastoris)中,結果顯示添加疏水蛋白FcHyd5p的碳酸溶液發生了液體迸出現象,而對照組并無此現象產生。2012年Niu Baolong等[5]克隆了T. reesei的疏水蛋白基因HFBI并將其導入至P. pastoris中進行異核表達,啤酒曝氣實驗的結果證實,疏水蛋白是啤酒迸出現象的強誘導因子,也說明了疏水蛋白作為乳化劑和啤酒爆瓶預測因子的可行性。近年來疏水蛋白在食品領域的應用已成為研究熱點,然而對于疏水蛋白基因功能的研究少有報道。
RNAi技術[6],稱轉錄后基因沉默技術(post transcriptional gene silencing,PTGS),已被廣泛應用于香菇(Lentinula edodes)[7]、糙皮側耳[8-9]、灰蓋鬼傘(Coprinus cinereus)[10]、雙孢蘑菇(Agaricus bisporus)[11]、雙色蠟蘑(Laccaria bicolor)[12]等食用菌的基因功能研究中。RNAi技術的核心是RNAi載體的構建,構建方法主要有:酶切連接法[13]、重疊延伸聚合酶鏈式反應技術(overlap extension- polymerase chain reaction,OE-PCR)[14]、自主連接克隆法(ligation-independent cloning,LIC)[15]、Gateway法[16]以及Golden Gate克隆法[17]。其中,Golden Gate克隆法通過酶切與連接同步進行的方式來形成頸環結構,具有高效、省時和經濟等優點[18]。
平菇(Pleurotus ostreatus)是我國最主要的人工栽培食用菌之一[19]。本實驗室前期克隆了平菇疏水蛋白基因Po.hyd[20],并構建了根癌農桿菌介導的平菇轉化體系[21]。本研究采用Golden Gate技術構建Po.hyd干涉載體并進行轉化,為后續Po.hyd基因功能的研究提供基礎,并為RNAi技術在其他大型真菌中的應用提供參考。
1 材料與方法
1.1 菌株與質粒
平菇739、根癌農桿菌GV3101為華中農業大學食品科學技術學院微生物實驗室保存。
質粒pCAMBIA1302-GUS(具有潮霉素hph基因、綠色熒光蛋白GFP、以及GUS標記)為華中農業大學食品科學技術學院微生物實驗室改造并保存;質粒pRNAi-GG為中國熱帶農業科學院熱帶生物技術研究所言普研究員贈送。
1.2 試劑與培養基
Taq酶、限制性內切酶HindⅢ、SacⅠ 日本TaKaRa公司;限制性內切酶BsaⅠ New England Biolabs公司;T4 DNA Ligase、M-MLV Reverse Transcriptase美國Promega公司;凝膠回收試劑盒和質粒提取試劑盒 美國Axygen公司;Fast Start Universal SYBR Green Master 羅氏公司;DH5α感受態細胞、pEASY-Blunt載體、Fast-Pfu DNA聚合酶 北京全式金生物技術有限公司;Southern雜交試劑盒 美國GE公司。
PDA培養基:馬鈴薯200 g、葡萄糖20 g、瓊脂粉15 g, ddH2O 1 000 mL;LB培養基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,ddH2O 1 000 mL,加瓊脂粉15 g即LB固體培養;基本培養基(minimal medium,MM):20×磷酸鹽緩沖液10 mL、鹽溶液10 mL,HCl調pH值至7.0;誘導培養基(IM):20×MM培養基5 mL、50%甘油1 mL、1 mol/L葡萄糖溶液l mL、1 mol/L MES緩沖液4 mL、20 mmol/L AS溶液1 mL,無菌ddH2O至100 mL。共培養培養基(Co-CM):瓊脂粉1.5 g、與IM等量的各成分(葡萄糖減半)、ddH2O 80 mL。
1.3 儀器與設備
尼康80i熒光顯微鏡 日本尼康公司;ABI ViiA7 Real-time PCR儀 美國Applied Biosystem公司。
1.4 引物設計
根據已發表的Po.hyd(GenBank登錄號AF331452)、載體pCAMBIA1302序列(GenBank登錄號AF234298)利用軟件Primer 5進行引物設計,熒光定量PCR反應的內參基因引物為βtub-S與βtub-AS[22],引物序列見表1。

表1 所用引物序列Table 1 Primers used in this study
1.5 總RNA的提取
參照TaKaRa RNAisoTMplus說明書進行操作。
1.6 cDNA第一鏈的合成與Po.hyd基因編碼區序列擴增
參照M-MLV Reverse Transcriptase反轉錄酶說明書合成cDNA的第一鏈。Po.hyd基因PCR擴增體系如下:Fast-pfu DNA聚合酶(10 U/μL)0.2 μL、cDNA模板2 μL、Po.hyd上下游引物(10 μmol/L)各1 μL、dNTP(2.5 mmol/L)2 μL、5×Fast-pfu Buffer 5 μL、ddH2O補至25 μL。擴增條件:95 ℃ 5 min,95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,循環數為32 個,72 ℃ 7 min。PCR產物連接pEASY-Blunt載體并測序,并用BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)進行序列分析與比對。
1.7 干擾載體pRNAi-GG-ihyd及p1302-GG-ihyd的構建
干擾載體pRNAi-GG-ihyd的構建參照pRNAi-GG載體說明書進行。選用RNAi-AS與M13F、RNAi-AS與M13R兩對引物進行菌落PCR鑒定,延伸時間為別為40 s以及90 s,其他擴增條件同1.5節。
p1302-GG-ihyd載體構建步驟:HindⅢ與SacⅠ雙酶切載體pRNAi-GG-ihyd與pCAMBIA1302-GUS,分別回收片段和載體骨架,回收產物進行連接反應并轉化DH5α感受態,經Po.hyd基因菌落PCR,與HindⅢ與SacⅠ雙酶切進一步確定陽性質粒。p1302-GG-ihyd構建策略如圖1所示。
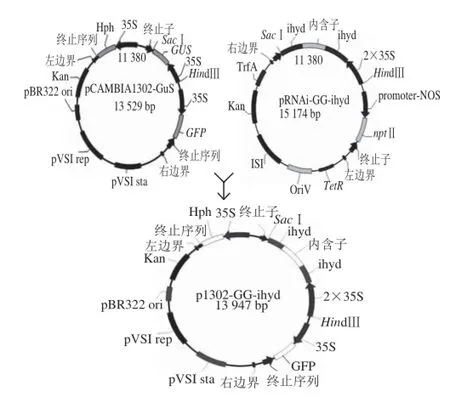
圖1 p1302-GG-ihyd載體構建策略Fig. 1 p1302-GG-ihyd vector construction strategy
1.8 根癌農桿菌介導菌絲轉化
參照華中農業大學食品科學技術學院微生物實驗室構建的農桿菌介導體系進行操作[12]。
1.9 轉化子的PCR初步鑒定
十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,CTAB)法提取轉化子菌絲DNA并作為模板,分別擴增hph和GFP基因片段,反應體系如1.6節所述,57 ℃退火30 s,72 ℃分別延伸70 s與30 s,其他擴增條件見1.6節。
1.10 轉化子的熒光顯微鏡鑒定
將1.9節步驟中認定為陽性的轉化子轉接至PDA培養基中央,于培養基中插入若干無菌玻璃片,25 ℃避光倒置培養7 d,用于觀察菌絲綠色熒光蛋白表達情況。
1.11 平菇轉化子real-time PCR檢測Po.hyd基因干擾效率
轉化子Po.hyd基因熒光定量PCR參照Fast Start Universal SYBR Green Master說明書進行。Po.hyd基因的Ct值以及表達量參照公式ΔΔCt法進行計算。

式中:Ct1為待測樣本中Po.hyd基因的Ct值;Ct2為待測樣本中內標基因的Ct值;Ct1’為對照樣本中Po.hyd基因的Ct值;Ct2’為對照樣本中內標基因的Ct值。
1.12 Southern雜交鑒定T-DNA插入拷貝數
擴大培養1.10節中能夠觀測到綠色熒光信號的轉化子,提取其基因組DNA經HindⅢ酶切過夜,以潮霉素基因Hyg作為探針進行雜交,具體實驗操作按GE公司雜交試劑盒進行。
2 結果與分析
2.1 Po.hyd基因DNA序列克隆與分析
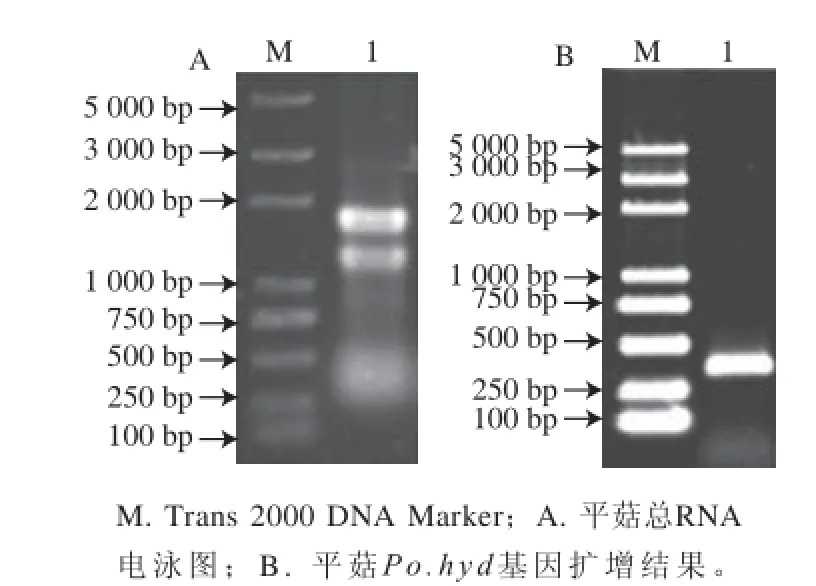
圖2 平菇菌絲總RNNAA與Poo..hhyydd基因PCR擴增結果電泳圖Fig. 2 Electrophoresis of total RNA and PCR amplifi ed products of the Po.hyd gene from P. ostreatus
平菇RNA的電泳檢測結果如圖2A所示,28S rRNA條帶與18S rRNA條帶亮度比例約為2∶1,表明提取的總RNA較完整,質量符合要求。Po.hyd基因編碼區cDNA序列擴增結果,如圖2B所示,擴增得大小為330 bp左右的單一條帶,與預期大小一致,結合測序結果,表明所獲得基因片段與GenBank中Po.hyd的序列相同。
2.2 重組質粒pRNAi-GG-ihyd、p1302-GG-ihyd的構建
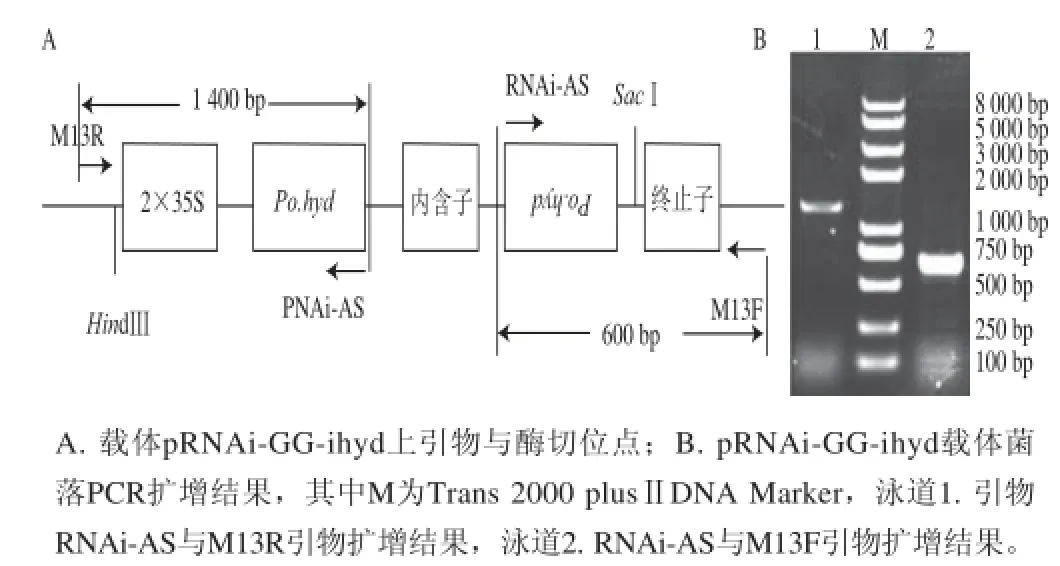
圖3 質粒pRNAi-GG-ihyd引物與酶切位點及菌落PCR擴增結果Fig. 3 Restriction enzyme cleavage sites of pRNAi-GG-ihyd vector and colony PCR products of pRNAi-GG-ihyd
重組質粒pRNAi-GG-ihyd引物結合位點與酶切位點圖如3A所示,菌落PCR結果如圖3B所示,其中引物RNAi-AS與M13R(泳道1)所擴基因1 400 bp、RNAi-AS與M13F(泳道2)所擴基因600 bp均與預期結果一致,結合測序結果,進一步證明載體pRNAi-GG-ihyd構建成功。
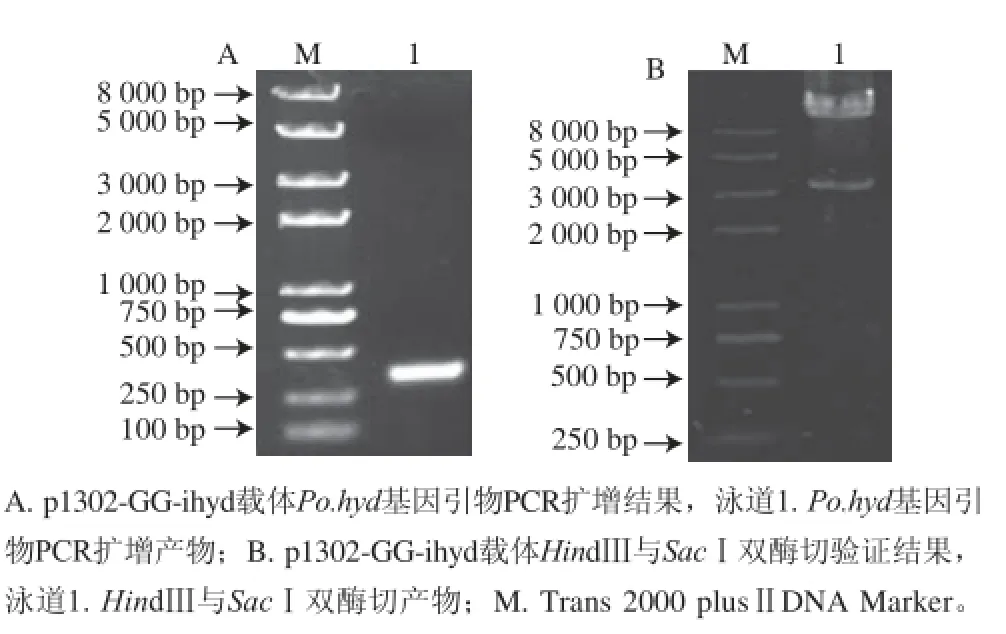
圖4 p1302-GG-ihyd載體PCCRR及HHiinnddⅢ與SSaaccⅠ雙酶切結果Fig. 4 PCR products and double enzyme digestion of p1302-GG-ihyd vector with Po.hyd gene using HindⅢ and SacⅠ
p1302-GG-ihyd載體的菌落PCR驗證結果如圖4A所示,擴增結果為單一條帶,大小330 bp與預期一致,而HindⅢ與SacⅠ雙酶切驗證結果(圖4B),目的條帶約3 200 bp符合預期,證明干擾載體p1302-GG-ihyd構建成功,可用于平菇菌絲轉化實驗。
2.3 轉化子潮霉素選擇性培養
圖5A為平菇菌絲與農桿菌共培養60 h菌絲的生長情況,菌絲在農桿菌共培養的情況下菌絲生長良好,菌落于濾紙片四周分布均勻,菌絲長度與密度相對均衡。圖5B為潮霉素選擇性培養的菌落生長情況,可見在潮霉素抗性選擇壓力下,濾紙片四周的菌落分布不均勻,菌絲長度及密度差異較大,其中未轉化成功的菌絲不具備潮霉素抗性,呈現出不生長或者死亡狀態,而轉化成功的菌絲獲得了潮霉素抗性,菌絲在抗性篩選的情況下菌絲萌發伸長,呈現出生長趨勢。用接種針將具有潮霉素抗性的菌落轉接至新的潮霉素培養平板中,菌絲生長狀況如圖5C所示,可見菌絲雖較為稀疏但仍可正常生長,同時將野生型菌株置于潮霉素平板中培養作為對照,結果如圖5D所示,可見野生型菌株在潮霉素平板中不生長。初步認定在潮霉素抗性培養基中可以正常生長的菌株為擬轉化子,經后續實驗的篩選確定為轉化子。

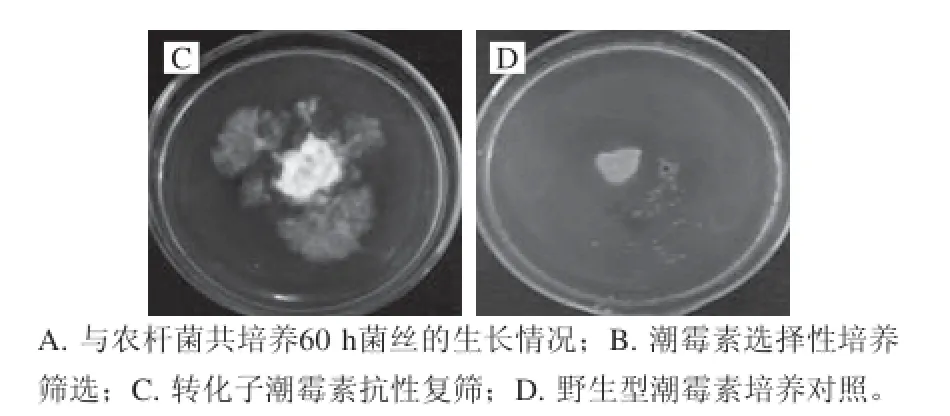
圖5 根癌農桿菌介導轉化各階段菌絲的生長狀態Fig. 5 Growth status of the mycelia of transformants via Agrobacterium tumefaciens mediation
2.4 轉化子的PCR鑒定
以擬轉化子DNA作為模板,利用hph及GFP引物進行PCR鑒定,檢測hph基因PCR結果如圖6A所示,潮霉素擴增結果為單一的且大小為1 000 bp左右的條帶,結合測序結果,證明潮霉素基因已經成功插入至轉化子DNA中,如圖6B為GFP基因PCR擴增結果,擴增結果為500 bp單一條帶,結合測序結果證明7 株擬轉化子有5 株能同時擴出潮霉素hph及GFP基因,初步認證獲得5 株轉化子。
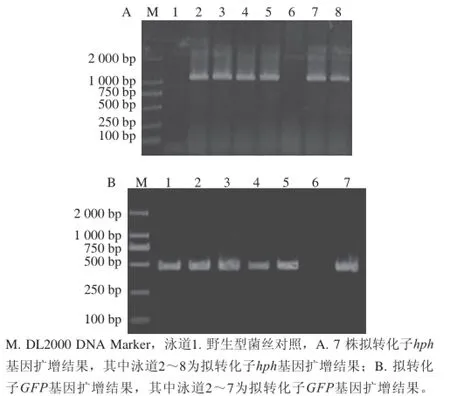
圖6 擬轉化子hhpphh基因與GGFFPP基因PCRR擴增結果Fig. 6 PCR products of the hph gene and the GFP gene from putative transformants
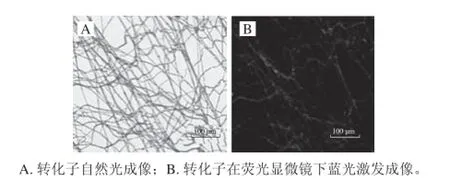
圖7 轉化子的熒光檢測、real-time PCR及Southern雜交分析Fig. 7 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants
2.5 轉化子的熒光檢測熒光顯微鏡觀察轉化子的綠色熒光蛋白表達情況,圖7A為5號轉化子的自然光與熒光顯微成像。圖7B為5號菌絲的熒光顯微成像圖,可見在藍光激發下可發出清晰的綠色熒光,證明綠色熒光蛋白GFP在轉化子中獲得表達,說明轉化實驗獲得成功。
2.6 平菇轉化子real-time PCR檢測Po.hyd基因干擾效率選取3 株能檢測出綠色熒光信號的轉化子,進行real-time PCR分析。由圖8可知,5號和14號菌株Po.hyd基因的表達明顯被抑制,9號菌株的Po.hyd基因表達量變化不大。轉化子中Po.hyd基因被抑制的效果存在較大差異,是由于干擾載體的T-DNA區隨機整合在基因組中的位置不同造成,插入位點附近的基因復雜性導致了啟動子的啟動效率差異,進而導致基因的干擾效率表現不一致。

圖8 野生型及轉化子的熒光檢測、real-time PCR及Southern雜交分析Fig. 8 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants and the wild-type strain
2.7 轉化子Southern雜交結果分析
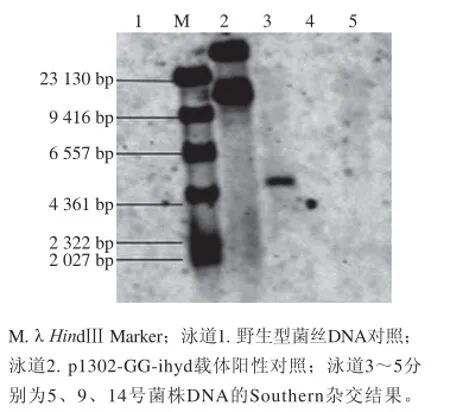
圖9 轉化子的熒光檢測、real-time PCR及Southern雜交分析Fig. 9 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants
對3 個陽性轉化子進行Southern雜交,結果如圖9所示,只有5號菌株獲得了單條雜交信號,9號與14號轉化子與野生型菌未獲得雜交信號。導致這種現象的原因尚不明確,這種轉化子遺傳性狀不穩定的現象在Peng等[23]研究聚乙二醇介導平菇雙核菌絲原生質體的轉化實驗中也曾出現過,該研究也獲得了具有潮霉素抗性的轉化子,但轉化子的抗性于3~6 周后消失。轉化子表型不穩定可能與啟動子的選擇或外源片段隨機插入宿主基因組中的位置有關,也可能是高等真核生物基因自主修復的結果,但造成轉化子抗性丟失這種現象的分子機制尚未得到具體解釋。
3 結 論
本研究獲得1 株可穩定遺傳的轉化子,其基因組DNA可以檢測到外源hph基因與GFP基因,在熒光顯微鏡下可檢測出綠色熒光,Southern雜交為單一條帶,轉化子表達量結果顯示,Po.hyd基因表達量為野生型的43%,說明RNAi載體構建與農桿菌介導平菇的遺傳轉化獲得成功,外源基因以單拷貝形式插入轉化子基因組中,與Ding Yi等[21]構建的根癌農桿菌介導平菇菌絲轉化體系相符。
對于real-time PCR檢測結果出現的Po.hyd基因表達量變化差異較大的現象,這一方面與以及T-DNA的插入位點有關。外源片段隨機插入到轉化子的染色體中有關,不同插入位點的轉化子基因結構復雜性有所不同,致使外源插入基因與宿主基因之間的互作方式各不相同,故而表現出不同的基因干擾效率。Southern雜交結果顯示,部分轉化子多次傳代后出現了抗性基因丟失的現象,這與啟動子的選擇有關,啟動子是負責調控基因轉錄的相關上游元件,對基因的表達水平具有決定性的影響,有研究指明內源強啟動子可以減少基因的甲基化現象,有助于維持轉化子遺傳性狀的穩定以及外源基因的高效表達[24-25]。而本實驗選用的35S啟動子,雖然是真核生物的組成型啟動子,但在平菇內的啟動效率可能不如內源啟動子穩定,不能夠高效并穩定的表達潮霉素基因。另外,值得說明的是轉化子遺傳性狀相對穩定,還與農桿菌種類、載體的結構、抗性基因的選擇以及轉化方法等因素有關[21,25]。
后續的研究將對Po.hyd RNAi轉化子進行基因功能方面的驗證,同時結合Po.hyd的超表達載體與反義RNA載體來共同研究該基因的功能。
[1] BURKE J, COX A, PETKOV J, et al. Interfacial rheology and stability of air bubbles stabilized by mixtures of hydrophobin and β-casein[J]. Food Hydrocolloids, 2014, 34: 119-127. DOI:10.1016/ j.foodhyd.2012.11.026.
[2] GREEN A J, LITTLEJOHN K A, HOOLEY P, et al. Formation and stability of food foams and aerated emulsions: hydrophobins as novel functional ingredients[J]. Current Opinion in Colloid & Interface Science, 2013, 18(4): 292-301. DOI:10.1016/j.cocis.2013.04.008.
[3] COX A R, ALDRED D L, ANDREW B R, et al. Exceptional stability of food foams using class II hydrophobin HFBII[J]. Food Hydrocolloids, 2009, 23(2): 366-376. DOI:10.1016/ j.foodhyd.2008.03.001.
[4] STüBNER M, LUTTERSCHMID G, VOGEL R F, et al. Heterologous expression of the hydrophobin FcHyd5p from Fusarium culmorum in Pichia pastoris and evaluation of its surface activity and contribution to gushing of carbonated beverages[J]. International Journal of Food Microbiology, 2010, 141(1/2): 110-115. DOI:10.1016/ j.ijfoodmicro.2010.03.003.
[5] NIU Baolong, WAN Dandan, YANG Yanyan, et al. Heterologous expression and characterization of the hydrophobin HFBI in Pichia pastoris and evaluation of its contribution to the food industry[J]. Amino Acids, 2012, 43(2): 763-771. DOI:10.1007/s00726-011-1126-5.
[6] FIRE A, XU S Q, MONTGOMERY M K, et al. Potent and specifi c genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391: 806-811. DOI:10.1038/35888.
[7] NAKADE K, WATANABE H, SAKAMOTO Y, et al. Gene silencing of the Lentinula edodes lcc1 gene by expression of a homologous inverted repeat sequence[J]. Microbiological Research, 2011, 166(6): 484-493. DOI:10.1016/j.micres.2010.09.004.
[8] SALAME T M, YARDEN O, HADAR Y, et al. Pleurotus ostreatus manganese-dependent peroxidase silencing impairs decolourization of Orange II[J]. Microbial Biotechnology, 2010, 3(1): 93-106. DOI:10.1111/j.1751-7915.2009.00154.x.
[9] SALAME T M, KNOP D, LEVINSON D, et al. Redundancy amongst manganese-peroxidases in Pleurotus ostreatus[J]. Applied and Environmental Microbiology, 2013, 79(7): 2405-2415. DOI:10.1128/ AEM.03849-12.
[10] HENEGHAN M N, COSTA A M S B, CHALLEN M P, et al. A comparison of methods for successful triggering of gene silencing in Coprinus cinereus[J]. Molecular Biotechnology, 2007, 35(3): 283-296. DOI:10.1007/s12033-007-9008-5.
[11] EASTWOOD D C, CHALLEN M P, ZHANG Cunjin, et al. Hairpinmediated down-regulation of the urea cycle enzyme argininosuccinate lyase in Agaricus bisporus[J]. Mycological Research, 2008, 112(6): 708-716.
[12] KEMPPAINEN M J, PARDO A G. pHg/pSILBAγ vector system for efficient gene silencing in homobasidiomycetes: optimization of ihpRNA-triggering in the mycorrhizal fungus Laccaria bicolor[J]. Microbial Biotechnology, 2010, 3(2): 178-200. DOI:10.1016/ j.mycres.2008.01.009.
[13] MANAMOHAN M, SHARATH CHANDRA G, ASOKAN R, et al. One-step DNA fragment assembly for expressing intron-containing hairpin RNA in plants for gene silencing[J]. Analytical Biochemistry, 2013, 433(2): 189-191. DOI:10.1016/j.ab.2012.09.034.
[14] HECKMAN K L, PEASE L R. Gene splicing and mutagenesis by PCR-driven overlap extension[J]. Nature Protocols, 2007, 2(4): 924-932. DOI:10.1038/nprot.2007.132.
[15] XU G, SUI N, TANG Y, et al. One-step, zero-background ligation independent cloning intron-containing hairpin RNA constructs for RNAi in plants[J]. New Phytologist, 2010, 187(1): 240-250. DOI:10.1111/j.1469-8137.2010.03253.x.
[16] EAMENS A L, WATERHOUSE P M. Vectors and methods for hairpin RNA and artificial microRNA-mediated gene silencing in plants[J]. Methods in Molecular Biology, 2011, 701: 179-197. DOI:10.1007/978-1-61737-957-4_10.
[17] 言普, 沈文濤, 黎小瑛. 植物hpRNA干擾載體構建的研究進展[J]. 生物技術通報, 2013(9): 7-12.
[18] YAN Pu, SHENG Wentao, GAO Xinzheng, et al. High-throughput construction of intron-containing hairpin RNA vectors for RNAi in plants[J]. PLoS ONE, 2012, 7(5): e38186. DOI:10.1371/journal. pone.0038186.
[19] SáNCHEZ C. Cultivation of Pleurotus ostreatus and other edible mushrooms[J]. Applied Microbiology and Biotechnology, 2010, 85(5): 1321-1337. DOI:10.1007/s00253-009-2343-7.
[20] MA A, SHAN L, WANG N, et al. Characterization of a Pleurotus ostreatus fruiting body-specific hydrophobin gene, Po.hyd[J]. Journal of Basic Microbiology, 2007, 47(4): 317-324. DOI:10.1002/ jobm.200710317.
[21] DING Yi, LIANG Shen, LEI Jinghang, et al. Agrobacterium tumefaciens mediated fused egfp-hph gene expression under the control of gpd promoter in Pleurotus ostreatus[J]. Microbiological Research, 2011, 166(4): 314-322. DOI:10.1016/j.micres.2010.07.001.
[22] SALAME T M, KNOP D, LEVINSON D, et al. Inactivation of a Pleurotus ostreatus versatile peroxidase-encoding gene (mnp2) results in reduced lignin degradation[J]. Environmental Microbiology, 2014, 16(1): 265-277. DOI:10.1111/1462-2920.12279.
[23] PENG M, SINGH N K, LEMKE P A, et al. Recovery of recombinant plasmids from Pleurotus ostreatus transformants[J]. Current Genetics, 1992, 22(1): 53-59. DOI:10.1007/BF00351742.
[24] 董曉雅. 平菇遺傳轉化體系和轉漆酶工程菌株的構建[D]. 鄭州: 河南農業大學, 2010.
[25] 師亮. 根癌農桿菌介導的靈芝遺傳轉化體系的建立及其在靈芝三萜生物合成研究中的應用[D]. 南京: 南京農業大學, 2012.
Construction of RNAi Vector and Transformation of Hydrophobin Gene Po.hyd in Pleurotus ostreatus
LIU Yuanyuan, MA Aimin*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
RNAi vector for Pleurotus ostreatus hydrophobin gene, Po.hyd, was constructed and transformants were obtained by Agrobacterium tumefaciens mediated transformation. Po.hyd was cloned by PCR method using the Golden Gate technology to build the interference vector p1302-GG-ihyd, which had a neck ring structure. Finally, this vector was transferred into A. tumefaciens GV3101 under the induction of acetosyringone (AS), the young mycelia were mediated by A. tumefaciens, and the transformants were detected and identifi ed by PCR amplifi cation, fl uorescence microscopy, real-time PCR and Southern blot technique. One genetically stable P. ostreatus transformant was obtained, which was hygromycin resistant. The green fl uorescence signal could be detected under a fl uorescence microscope, and the expression of Po.hyd was 43% compared with the wild type strain. The exogenous DNA was integrated into the genome in a single copy. This result will lay the preliminary foundation for further studies on the function of Po.hyd.
Pleurotus ostreatus; hydrophobin; RNAi; Agrobacterium tumefaciens mediated transformation
10.7506/spkx1002-6630-201611015
Q78
A
1002-6630(2016)11-0084-06
劉媛媛, 馬愛民. 平菇疏水蛋白Po.hyd基因RNAi載體構建及轉化[J]. 食品科學, 2016, 37(11): 84-89. DOI:10.7506/ spkx1002-6630-201611015. http://www.spkx.net.cn
LIU Yuanyuan, MA Aimin. Construction of RNAi vector and transformation of hydrophobin gene Po.hyd in Pleurotus ostreatus[J]. Food Science, 2016, 37(11): 84-89. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611015. http://www.spkx.net.cn
2015-08-23
國家自然科學基金面上項目(31172011;30771502)
劉媛媛(1988—),女,碩士研究生,研究方向為食品生物技術。E-mail:lyy0425@foxmail.com
*通信作者:馬愛民(1965—),男,教授,博士,研究方向為食品生物技術。E-mail:aiminma@mail.hzau.edu.cn

