姜黃素通過IGF-1/Akt/FoxO3a通路保護(hù)多巴胺能神經(jīng)元細(xì)胞
鄭世茹,白宏英,程寶倉
?
姜黃素通過IGF-1/Akt/FoxO3a通路保護(hù)多巴胺能神經(jīng)元細(xì)胞
鄭世茹,白宏英,程寶倉
目的觀察姜黃素對(duì)魚藤酮致帕金森(PD)大鼠黑質(zhì)多巴胺能神經(jīng)元的保護(hù)作用及其機(jī)制。方法清潔級(jí)(SPF)雄性SD大鼠80只,隨機(jī)分為溶劑對(duì)照組(空白組)、姜黃素對(duì)照組(對(duì)照組)、魚藤酮模型組(模型組)、姜黃素治療組(治療組),每組20只。空白組和對(duì)照組頸、背部皮下注射葵花油,其余兩組在相同部位注射魚藤酮建立帕金森模型,連續(xù)28 d,造模后觀察各組大鼠行為學(xué)改變并評(píng)分。此后對(duì)照組和治療組每天給予姜黃素灌胃,其余兩組等量二甲基亞砜灌胃,連續(xù)28 d,后將大鼠全部處死。采用原位雜交、免疫印跡(Western blot)法檢測黑質(zhì)部IGF-1、Akt、FoxO3a的表達(dá),采用免疫組化染色法檢測黑質(zhì)部酪氨酸羥化酶(tyrosine hydroxylase,TH)陽性細(xì)胞數(shù)。結(jié)果模型組大鼠TH、IGF-1、磷酸化的Akt(p-Akt)、磷酸化的FoxO3a(p-FoxO3a)表達(dá)較空白組和姜黃素組顯著降低(P<0.05);姜黃素治療組TH、IGF-1、p-Akt、p-FoxO3a表達(dá)高于模型組(P<0.05)。結(jié)論姜黃素可抑制帕金森大鼠多巴胺能神經(jīng)元凋亡,其抗凋亡機(jī)制可能與激活I(lǐng)GF-1/Akt/FoxO3a通路有關(guān)。
帕金森病;魚藤酮;細(xì)胞凋亡;姜黃素
近來研究發(fā)現(xiàn)魚藤酮可透過血腦屏障并抑制腦組織線粒體復(fù)合物Ⅰ的活性,使呼吸鏈功能缺陷、能量生成障礙引起細(xì)胞內(nèi)環(huán)境紊亂以及引發(fā)脂質(zhì)過氧化和大量自由基的產(chǎn)生、細(xì)胞內(nèi)鈣超載,最終引起細(xì)胞凋亡,導(dǎo)致多巴胺能神經(jīng)元變性缺失從而出現(xiàn)PD癥狀[1,2]。當(dāng)Akt途徑被抑制時(shí),F(xiàn)oxO3a去磷酸化,在細(xì)胞核內(nèi)大量表達(dá),調(diào)節(jié)不同的凋亡靶目標(biāo),導(dǎo)致細(xì)胞凋亡;而PI3K-Akt通路激活后,F(xiàn)oxO3a磷酸化,核內(nèi)表達(dá)減少,神經(jīng)細(xì)胞凋亡減少,表明FoxO3a的磷酸化受PI3K-Akt通路調(diào)節(jié)。IGF-1是該信號(hào)通路的上游調(diào)節(jié)因子[3,4]。目前國內(nèi)外文獻(xiàn)對(duì)此信號(hào)通路在帕金森病中的研究較為少見。作者在建立魚藤酮致帕金森大鼠模型的基礎(chǔ)上通過觀察大鼠中腦黑質(zhì)類胰島素一號(hào)增長因子(insulin-like growth factor 1,IGF-1)、磷酸化的蛋白激酶B(PKB、又稱Akt)、磷酸化的FoxO3a(一種Forkhead轉(zhuǎn)錄因子O亞家族的同源蛋白)表達(dá)水平以及中腦黑質(zhì)區(qū)酪氨酸羥化酶(throsine hydroxylase,TH)陽性細(xì)胞數(shù)的變化,并應(yīng)用姜黃素干預(yù)后對(duì)其表達(dá)的影響,探討姜黃素可能的發(fā)揮多巴胺能神經(jīng)元保護(hù)作用的分子機(jī)制。
1 材料與方法
1.1實(shí)驗(yàn)動(dòng)物及試劑清潔級(jí)健康雄性SD大鼠80只,體質(zhì)量(200~220)g[山西醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心提供,許可證號(hào):SCXK(晉)20150001]。室溫(2 5±2) ℃飼養(yǎng),自然光照。魚藤酮、姜黃素均購自美國 Sigma 公司,兔抗鼠IGF-1抗體、p-AKT抗體、p-Foxo3a抗體和TH抗體均購自美國Santa cruz公司。
1.2模型制備方法所有實(shí)驗(yàn)動(dòng)物適應(yīng)性飼養(yǎng)5 d確認(rèn)無異常后,80只隨機(jī)分為4組:空白組、對(duì)照組、模型組、治療組,每組20只。模型組與治療組大鼠采用頸背部皮下注射魚藤酮法(將1.5 mg/kg溶解于葵花油,濃度1.5 mg/ml)制備模型,1次/d,連續(xù)注射28 d[5]。空白組及對(duì)照組造模方法同模型組,但只單純注射等量葵花油。在造模28 d后的同一時(shí)間點(diǎn),觀察大鼠異常形態(tài)及行為,并參照Chen[6]等的評(píng)分標(biāo)準(zhǔn)評(píng)分。行為學(xué)評(píng)分2分以上為造模成功,最后每組均以酪氨酸羥化酶(tyrosine hydroxylase,TH)免疫組化法作組織學(xué)鑒定。對(duì)照組及治療組在造模成功24 h后予姜黃素(40 mg/kg/d)灌胃治療,1次/天,連續(xù)治療28 d。空白組與模型組同步每日等量二甲基亞砜灌胃,28 d后將大鼠全部處死。
1.3酪氨酸羥化酶免疫組化染色在最后1 d實(shí)驗(yàn)結(jié)束24 h后,10%水合氯醛(35 mg/100 g體質(zhì)量)大鼠腹腔注射麻醉,4%多聚甲醛心臟灌注內(nèi)固定,取腦,在冰盤上分離出中腦黑質(zhì);石蠟包埋切片,脫蠟、水化、抗原修復(fù),PBS反復(fù)沖洗,加入封閉血清、一抗(1∶200),4 ℃過夜;PBS沖洗,加二抗,PBS沖洗,滴加鏈霉卵白液,PBS沖洗,3-氨基-9-乙基卡唑(AEC)顯色,蘇木精染色,脫水,中性樹膠封片。陰性對(duì)照:以正常兔血清代替一抗。正常腦組織與魚藤酮損傷后腦組織對(duì)比后再次驗(yàn)證了造模成功。
1.4免疫印跡(Western blot)檢測在最后1 d實(shí)驗(yàn)結(jié)束24 h后,大鼠給予10%水合氯醛(35 mg/100 g體質(zhì)量)腹腔注射麻醉,取腦,生理鹽水沖洗,在冰盤上快速分離出中腦黑質(zhì),-80 ℃保存。將腦組織剪碎,放于勻漿器中,加入蛋白裂解液,冰水勻漿裂解1 min,裂解液14000 r/min離心5 min;吸取上清液稀釋,加入緩沖液,混勻后在沸水浴中煮沸5 min。聚丙烯酰胺凝膠電泳,轉(zhuǎn)膜,封閉,分別加入IGF-1(1∶1000)、p-Akt(1∶1000)、p-FoxO3a(1∶1000)抗體,4 ℃搖床低速搖動(dòng)過夜孵育,緩沖液洗滌,加二抗(1∶4000),37 ℃恒溫?fù)u床上,低速搖動(dòng)孵育45 min,緩沖液洗滌,ECL顯色,圖像分析。
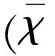
2 結(jié) 果
2.1大鼠中腦黑質(zhì)區(qū)IGF-1、Akt、FoxO3a的表達(dá)變化Western blot法檢測大鼠中腦黑質(zhì)IGF-1、p-Akt、p-FoxO3a的結(jié)果顯示,模型組IGF-1、p-Akt、p-FoxO3a的表達(dá)較空白組和對(duì)照組均顯著降低(P<0.05);治療組IGF-1、p-Akt、p-FoxO3a的表達(dá)較模型組均顯著升高(P<0.05)(見表1、圖1)。
2.2大鼠中腦黑質(zhì)區(qū)陽性細(xì)胞數(shù)變化 免疫組化染色結(jié)果顯示,與空白組和姜黃素組相比,模型組大鼠中腦黑質(zhì)區(qū)TH陽性細(xì)胞數(shù)顯著減少;經(jīng)姜黃素治療后,與模型組相比,治療組大鼠中腦黑質(zhì)區(qū)TH陽性細(xì)胞數(shù)顯著增加(見表2、圖2)。

表1 各組大鼠黑質(zhì)區(qū)IGF-1、p-Akt、p-FoxO3a的表達(dá)
與空白組、對(duì)照組比較*P<0.05;與模型組比較#P<0.05

表2 各組大鼠黑質(zhì)區(qū)TH陽性細(xì)胞數(shù)變化±s)
與空白組、對(duì)照組比較*P<0.05;與模型組比較#P<0.05

1:空白組2:對(duì)照組3:模型組4:治療組
圖1Western-blot法測定各組大鼠黑質(zhì)區(qū)IGF-1、p-Akt、p-FoxO3a表達(dá)情況

A:空白組;B組:對(duì)照組 C組:模型組;D組:治療組
3 討 論
目前對(duì)PD病因和病理機(jī)制的認(rèn)識(shí)在不斷深入,主要涉及遺傳因素、免疫炎癥反應(yīng)、α-突觸核蛋白的集聚、氧化應(yīng)激學(xué)說、鈣失衡、線粒體功能障礙、興奮性氨基酸學(xué)說和細(xì)胞凋亡等。研究證據(jù)顯示,神經(jīng)毒性損毀作用在導(dǎo)致DA能神經(jīng)元損傷中,細(xì)胞凋亡是重要形式[7,8],凋亡蛋白caspase的激活是中腦黑質(zhì)DA能神經(jīng)元丟失的早期信號(hào)[9]。
PI3K/Akt通路是介導(dǎo)細(xì)胞存活的一條經(jīng)典通路[10]。IGF-1可激動(dòng)PI3K/Akt通路,活化的PI3K通過3-磷酰化磷酸肌醇酯和磷酸肌醇依賴性激酶(PDK)共同作用而激活A(yù)kt,活化的Akt可進(jìn)一步激動(dòng)促存活因子的轉(zhuǎn)錄從而抑制凋亡。研究發(fā)現(xiàn),激活PKA和MAPK信號(hào)轉(zhuǎn)導(dǎo)通路,可以對(duì)DA能神經(jīng)元凋亡產(chǎn)生有效的抑制作用;另一基因產(chǎn)物P13K/PKB信號(hào)轉(zhuǎn)導(dǎo)通路的磷酸化AKT水平保持持續(xù)穩(wěn)定,則明顯增加DA能神經(jīng)元的細(xì)胞活性[11,12]。FoxO3a是PI3K-Akt信號(hào)通路重要的下游轉(zhuǎn)錄因子,磷酸化的PI3K激活A(yù)kt,Akt直接磷酸化FoxO3a,使其與胞核內(nèi)結(jié)構(gòu)蛋白特異性結(jié)合,由細(xì)胞核轉(zhuǎn)運(yùn)至細(xì)胞質(zhì),其介導(dǎo)的促凋亡過程得到抑制,從而促進(jìn)細(xì)胞存活。
大量的研究證明,姜黃素具有抗氧化、抗炎、降血脂、抗腫瘤、以及對(duì)神經(jīng)系統(tǒng)等多方面藥理作用,還因其具有多靶點(diǎn)作用途經(jīng)以及毒性低、安全性好、不良反應(yīng)小、藥源廣、價(jià)格低廉等潛在優(yōu)勢,受到越來越多地重視。姜黃素可通過Bax/Bcl-2、NF-κB、ICAM-1、p38MAPK、JNK/SAPK和ERK1/2信號(hào)轉(zhuǎn)導(dǎo)通路等多種機(jī)制,調(diào)節(jié)中樞神經(jīng)系統(tǒng)內(nèi)多種信號(hào)級(jí)聯(lián),發(fā)揮神經(jīng)元細(xì)胞保護(hù)作用;但姜黃素是否能夠通過激活I(lǐng)GF-1/Akt/FoxO3a通路,最終減少DA能神經(jīng)元的變性丟失,報(bào)道較少。
本實(shí)驗(yàn)結(jié)果顯示,環(huán)境毒素魚藤酮在損傷黑質(zhì)多巴胺能神經(jīng)元的同時(shí),抑制了大鼠黑質(zhì)細(xì)胞P13K/PKB信號(hào)轉(zhuǎn)導(dǎo)途徑中的IGF-1、Akt、FoxO3a等多個(gè)關(guān)鍵分子的表達(dá),并使酪氨酸羥化酶陽性細(xì)胞數(shù)顯著減少,提示IGF-1/Akt/FoxO3a信號(hào)通路轉(zhuǎn)導(dǎo)異常可能介導(dǎo)了模型大鼠黑質(zhì)多巴胺能神經(jīng)元的變性死亡;而姜黃素治療能增強(qiáng)模型大鼠黑質(zhì)細(xì)胞P13K/PKB信號(hào)轉(zhuǎn)導(dǎo)通路中的IGF-1、Akt、FoxO3a的表達(dá),并能減少模型大鼠黑質(zhì)多巴胺能神經(jīng)元數(shù)量的丟失;提示姜黃素可保持P13K/PKB信號(hào)轉(zhuǎn)導(dǎo)通路的磷酸化AKT水平持續(xù)穩(wěn)定,明顯增加DA能神經(jīng)元的細(xì)胞活性,抑制DA能神經(jīng)元變性死亡。帕金森病是在多因素交互作用下通過線粒體功能障礙、細(xì)胞凋亡等多種機(jī)制最終導(dǎo)致DA神經(jīng)元細(xì)胞的大量變性丟失。本研究以抑制細(xì)胞凋亡為切入點(diǎn),探討姜黃素對(duì)DA神經(jīng)元細(xì)胞的保護(hù)作用及作用機(jī)制,為姜黃素對(duì)帕金森病的治療研究以及如何提高中腦黑質(zhì)IGF-1、Akt、FoxO3a的表達(dá)治療帕金森病提供了新的思路與途徑。
綜上所述,本研究結(jié)果表明姜黃素可對(duì)多巴胺能神經(jīng)元細(xì)胞起保護(hù)作用,干預(yù)PD的發(fā)生和發(fā)展,其作用機(jī)制可能與其能提高黑質(zhì)部IGF-1、Akt、FoxO3a的表達(dá)水平,通過該信號(hào)通路調(diào)控細(xì)胞凋亡參與組織細(xì)胞的發(fā)生和修復(fù),減少多巴胺能神經(jīng)元的變性丟失有關(guān)。然而,姜黃素如何通過IGF-1/Akt/FoxO3a信號(hào)轉(zhuǎn)導(dǎo)通路調(diào)控細(xì)胞凋亡還需要深入的研究證實(shí)。
[1]Arthur CR,Morton SL,Dunham LD,et al.Parkinson’s disease brain mitochondria have impaired respirasome assembly,age-related increases indistribution of oxidative damage to mtDNA and no differences in heteroplasmic mtDNA mutation abundance[J].Mol Neurodegener,2009,4:37.
[2]Kitajima-Ihara T,Yagi T.Rotenone-insensitive internal NADH-quinone oxidoreductase of Saccharomyces cerevisiae mitochondria:the enzyme expressed in Escherichia coli acts as a member of the respiratory chain in the host cells[J].FEBS Lett,1998,421(1):37-40.
[3]Peng K,Li Y,Long L,et al.Knockdown of FoxO3a induces increased neuronal apoptosis during embryonic development in zebrafis[J].Neurosci Lett,2010,484(2):98-103.
[4]Jover-Mengual T,Miyawaki T,Latuszek A,et al.Acute estradiol protects CA1 neurons from ischemia-induced apoptotic cell death via the PI3K/Akt pathway[J].Brain Res,2010,1321:1-12.
[5]張如意,張麗,吳燕川,等.不同劑量魚藤酮對(duì)擬帕金森病模型大鼠行為學(xué)及紋狀體多巴胺含量的影響[J].中國比較醫(yī)學(xué)雜志,2013,23(9):1-5.
[6]Chen Y,Constantini S,Trembovler V,et al.An experimental model of closed head injury in mice:pathophysiology,histopathology,and cognitive deficits[J].J Neurotrauma,1996,13(10):557-568.
[7]Ferro MM,Bellissimo ML,Anselmo-Franci JA,et al.Comparison of bilaterally 6-OHDA and MPTP-lesioned rats as models of the early phase of Parkinson’s disease:histological,neuro-chemical,motor and memory alterations[J].J Neurosci Methods,2005,148(1):78.
[8]Kobayashi H,Oikawa S,Umemura S,et al.Mechanism of metal-mediated DNA damage and apoptosis induced by 6-hydroxydopamine in neuroblastoma SH-SY5Y cells[J].Free Radic Res,2008,42(7):651-660.
[9]吳建軍,肖清,劉凱,等. 細(xì)胞凋亡學(xué)說在帕金森病發(fā)病機(jī)制的理論探索[J].中國老年學(xué)雜志,2009,29(16):2135-2137.
[10]趙靈芝,銀巍,蘇興文,等.IGF-1經(jīng)PI3K/Akt依賴性途徑保護(hù)苯妥英誘導(dǎo)的小腦顆粒神經(jīng)元凋亡[J].中國藥理學(xué)通報(bào),2005,21(1):53-57.
[11]Pan J,Wang G,Yang HQ,et al.K252a prevents nigral dopaminergic cell death induced by 6-hydroxydopamine through inhibition of both mixed-lineage kinase 3/c-Jun NH2-terminal kinase 3 (JNK3) and apoptosis-inducing kinase 1/JNK3 signaling pathways[J].Mol Pharmacol,2007,72(6):1607-1618.
[12]Wang G,Qi C,Fan GH,et al.PACAP protects neuronal differentiated PC12 cells against the neurotoxicity induced by a mitochondrial complex I inhibitor,rotenone[J].FEBS Lett,2005,579(18):4005-4011.
Curcumin prevents dopaminergic neurons through IGF-1/Akt/FoxO3a singaling pathway
ZHENGShiru,BAIHongying,CHENGBaocang.
(DepartmentofNeurology,TheSecondAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450014,China)
ObjectiveTo observe the protecetive effect of curcumin on substantia nigra dopaminergic neurons of rotenone-induced Parkinsin’s disease(PD) in SD rats and study their possible mechanism.Methods80 male SD mice under SPF condition with average body weight of 210 g were randomly allocated to four groups(n=20,each) of solvent control group(blank group),curcumin control group(control group),rotenone-induced PD group(PD group)and curcumin treatment group(treatment group).Curcumin (1.5 mg/kg) (versus 1 ml sun-flower oil in blank group and control group) were subcutaneously injected in neck-back skin in PD group and treatment group in order to establish the model of PD.The preparation of model was given once day for continuous 28 days.After the model establishment,the ethology changes were observed and scored.Subsequently,the rats in control group and treatment group received daily curcumin(40 mg/kg) (versus same volume dimethyl sulfoxide in blank group and PD group) orally.The treatment was given once a day for continuous 28 days.All rats in four groups were sacrificed on 29th day.Their brain tissues were taken and tested.The expressions of IGF-1,Akt and FoxO3a proteins in substantia nigra tissues were measured by Western blotting.The changes of tyrosine hydroxylase (TH) positive cells in the substantia nigras were evaluated by immunohistochemical staining.ResultsThe expressions of TH,IGF-1,p-Akt and p-FoxO3a in substantia nigra tissues were significantly lower in model group than in blank group and control group(bothP<0.05).The expressions of TH,IGF-1,p-Akt and p-FoxO3a in substantia nigra tissues were significantly higher in treatment group than in model group (bothP<0.05).ConclusionsCrcumin can inhibit rotenone-induced apoptosis of dopaminergic neurons in rats.The anti-apoptotic mechanism might be associated with activation of IGF-1/Akt/FoxO3a signaling pathway.
Parkinson's disease;Rotenone;Apoptosis;Curcumin
1003-2754(2016)04-0299-04
2016-02-18;
2016-03-30
河南省基礎(chǔ)與前沿技術(shù)研究計(jì)劃項(xiàng)目(No.142300410461)
(鄭州大學(xué)第二附屬醫(yī)院神經(jīng)內(nèi)科,河南 鄭州 450014)
白宏英,E-mail:hybai@126.com
R742.5
A

