家庭烹調對鱘魚中脂肪酸和膽固醇的影響
蘭曉芳,阮光鋒,范志紅,,李楠楠,王 順
(1.中國農業(yè)大學食品科學與營養(yǎng)工程學院,北京 100083;2.北京市水產科學研究所,北京 100068)
家庭烹調對鱘魚中脂肪酸和膽固醇的影響
蘭曉芳1,阮光鋒1,范志紅1,*,李楠楠1,王 順2
(1.中國農業(yè)大學食品科學與營養(yǎng)工程學院,北京 100083;2.北京市水產科學研究所,北京 100068)
對雜交鱘魚(Acipenser baeriihA. schrenckii)進行了清蒸、油煎、微波、微波烤、烤箱烤和壓力鍋煎6 種家庭烹調處理,測定其脂肪和膽固醇含量、脂肪氧化指標和各脂肪酸含量的變化。結果表明,所有烹調方法均降低了n-3/n-6多不飽和脂肪酸含量的比值,其中壓力烹調比值最高(0.85),清蒸次之(0.83),而烤箱烤最低(0.73)。膽固醇保存率以清蒸和壓力鍋煎最高,兩種處理間無顯著差異。烹調后樣品酸價和硫代巴比妥酸值上升而過氧化值下降,并與樣品的膽固醇含量相關。清蒸和壓力烹調中脂肪酸和膽固醇變化相對較少,可能與其密閉烹調條件造成氧化程度較低有關。
鱘魚;家庭烹調;膽固醇;脂肪酸;氧化
魚類營養(yǎng)價值豐富,是n-3不飽和脂肪酸的重要來源之一[1]。膳食中n-3與n-6脂肪酸的比值是多種癌癥及冠心病的風險因素,特別是與血栓形成及心臟病發(fā)作密切相關[2-3]。相關研究證實[4-5],增加富含二十碳五烯酸(eicosapentaenoic acid,EPA,C20∶5n-3)和二十二碳六烯酸(docosahexaenoic acid,DHA,C22∶6n-3)的水產品攝入能降低多種疾病及心臟病發(fā)作的風險。
魚類經烹調食用能提高安全性,并改善魚肉質地、增強風味[6],但也會影響其營養(yǎng)價值[7],其中的不飽和脂肪酸如EPA和DHA極易受到氧化破壞[8-9]。有報道油煎后魚肉中的n-6與n-3脂肪酸比值大幅升高,銀鯰魚(silver catfish)由0.13升至8.33[7],新西蘭大鮭魚(New Zealand king salmon)由0.68升至1.78[10],大西洋馬鮫(Indo-Pacific king mackerel)由0.54升至1.28[11]。因此,評價食物中膳食脂肪酸攝入時,有必要考慮到烹調因素的影響[12]。魚類烹調過程中的膽固醇氧化問題也受到關注[7,13],因為脂肪酸的氧化往往伴隨著膽固醇氧化,這一過程使食物中的膽固醇含量有所下降[14],而膽固醇氧化產物(cholesterol oxidation products,COPs)具有細胞毒性,會導致細胞凋亡及炎癥反應,還與動脈粥樣硬化及神經退行性病變的發(fā)生有關[14-15]。
鱘魚刺少質嫩,是深受歡迎的淡水魚類之一。有報道它的n-3脂肪酸含量十分豐富,達24.3%[16],總脂肪酸含量達30.9%[17],但不同品種間的測定數據差異較大[16-21],有關鱘魚烹調后脂肪及膽固醇成分變化的相關報道更十分有限[7,10]。本研究意圖探究鱘魚烹調后脂肪和膽固醇含量及脂肪酸成分的變化,以及烹調后的脂肪氧化評價,為鱘魚的合理烹調提供參考依據。
1 材料與方法
1.1 材料及烹調方法
本實驗中所用雜交鱘魚(Acipenser baeriihA. schrenckii)由北京市水產研究所提供,經過凈膛、去頭、水洗,保存在-18 ℃的冰箱中。實驗前,將魚背部的肉切成1.5 cm的厚片,均勻分成6 份,每份100 g,進行實驗。每個實驗設3 個平行。
本實驗所用的6 種家庭常用烹調方法如表1所示。
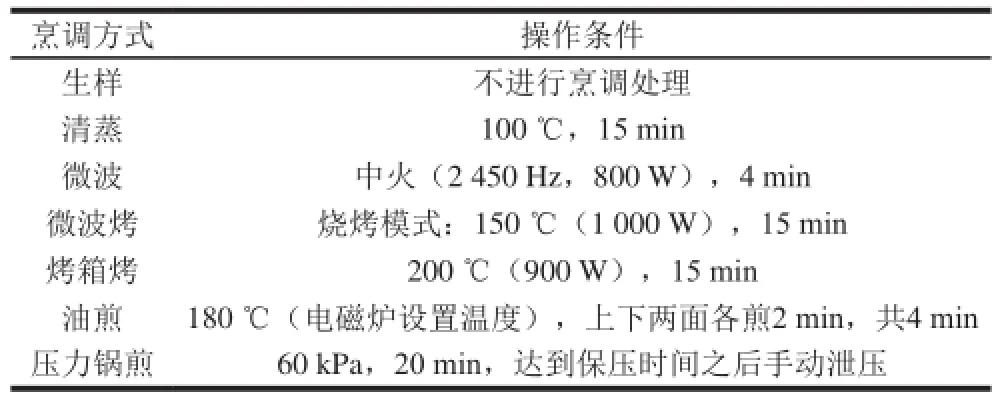
表1 烹調的具體操作條件Table 1 Cooking treatments for sturgeon samples
烹調結束后,將樣品冷卻至室溫,用預先稱過質量的紙巾吸干樣品表面的油和水。將紙巾再次稱質量,并用于分析油脂在烹調過程中的變化。放涼的樣品放置于冷凍袋中,保存在-18 ℃冰箱中用于后續(xù)測定,并于1 周內完成全部測定工作。測定項目包括魚肉的pH值、酸價(acid value,AV)、過氧化值(peroxide value,PV)和硫代巴比妥酸值(thiobarbituric acid reactive substances,TBARS)。
1.2 試劑與儀器
硫酸、硼酸、乙醇、氫氧化鈉、五水合硫酸銅、硫酸鉀、甲基紅、次甲基藍、乙醚、石油醚(沸程60~90 ℃)均為分析純 北京化工廠。
BS210S萬分之一電子天平 德國Sartorius公司;pH計 瑞士梅特勒-托利多公司;KND-102F自動定氮儀、SZC-D脂肪測定儀 上海纖檢有限公司;HP6820氣相色譜儀 美國Agilent公司;L-2000高效液相色譜日本日立公司;高壓鍋、EG823LA6-NS微波爐 美的生活電器集團。
1.3 分析步驟
1.3.1 基礎成分測定
鱘魚生樣和烹調后樣品分別進行3 次平行測定,基礎成分測定項目包括水分、粗蛋白、脂肪和灰分。pH值測定參考Martínez-Alvarez等[22]方法,水分、粗蛋白、脂肪和灰分的測定均參照國標方法[23-26]。
1.3.2 脂肪氧化分析
用AV值、PV值和TBARS值評價魚肉脂肪的氧化程度。AV和PV值的測定方法參考國標[27-28],TBARS的提取參考S?rensen等[29]方法,并依據Raghavan等[30]方法對氧化過程中的副產物丙二醛(OHCüCH2üCHO)進行測定。丙二醛在水溶液中以烯醇(CHOH=CHüCHüHO)形式存在,酸性條件下蒸出后與硫代巴比妥酸試劑TBA作用生成紅色化合物,可在530 nm波長處測定其吸光度。
1.3.3 脂肪酸含量測定
采用氯仿-甲醇-水的混合溶液提取脂肪[31]。加入三氟化硼、苯、甲醇等試劑,三氟化硼-甲醇溶液、苯、甲醇體積比為25∶20∶55,釋放出脂肪酸,并在BF3催化劑存在下酯化[32],生成脂肪酸甲酯,然后進樣分析。
氣相色譜分析條件如下:毛細管色譜柱:HP-INNOWax(30 mh0.32 mm,0.25 μm);載氣:氮氣,流量1.6 mL/min。柱頭壓:14 psi。柱箱溫度:起始溫度200 ℃,維持2 min,以2 ℃/min升溫至240 ℃,保持5 min。進樣方式:分流比10∶1,進樣口250 ℃,進樣量1 μL。檢測器:FID,275 ℃。用脂肪酸標準品的保留時間定性,根據樣品與標準品的氣相色譜峰面積比值,得到脂肪酸相對含量。
參照Ulbricht等[33]的方法對脂肪酸質量進行評價,用下述公式計算致動脈粥樣硬化指數(atherogenic index,AI)和致血栓指數(thrombogenicity index,TI)。

式中:MUFA為單不飽和脂肪酸(monounsaturated fatty acid);PUFA為多不飽和脂肪酸(polyunsaturated fatty acid)。
1.3.4 膽固醇含量測定
參照國家標準GB/T 22220ü2008《食品中膽固醇的測定 高效液相色譜法》[34]方法測定,用氫氧化鉀溶液將樣品皂化后,乙醚-石油醚混合液提取。液相色譜參數設定為:預柱:Security Guard ODS C18(4.0 mmh3.0 mm,10 μm);分析柱:Diamonsil C18(150 mmh4.6 mm,5 μm);流動相:100%甲醇;檢測波長:205 nm;柱溫:38 ℃;進樣量:10 μL。
1.4 數據分析
每個實驗重復3 次,用單因素方差分析(analysis of variance,ANOVA)對烹調前后鱘魚的基礎成分、脂肪酸組分、脂肪氧化產物進行分析。設置顯著水平為P<0.05,用IBM SPSS 19.0軟件進行統計分析。
2 結果與分析
2.1 基礎成分分析
烹調后樣品的水分、灰分、粗蛋白和脂肪含量如表2所示。鱘魚生樣的測定結果與Vaccaro[17]和Badiani[18-19]等對人工養(yǎng)殖雜交鱘魚的測定結果近似。烹調過程中,鱘魚的水分含量下降,使其他成分含量有不同程度的上升。在6 種烹調方法中,清蒸引起的水分損失最小,而壓力鍋煎造成的水分損失最大。
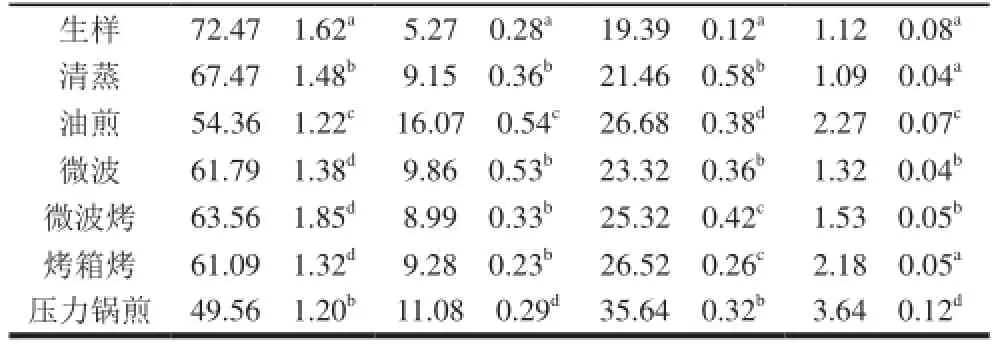
表2 烹調后鱘魚基礎成分的含量變化Table 2 Proximate composition of raw and cooked sturgeon samples g/100 g
油煎和壓力鍋煎使鱘魚脂肪含量大幅升高,這與國外的研究結果一致[13]。油煎后,鱘魚脂肪含量高達生樣的3 倍,這與Weber[7]和Sioen[12]等研究結果相似。Puwastien等[1]發(fā)現,煮制后的鱘魚脂肪含量變化并不大。因此推測,油煎后干物質含量上升的主要原因很可能是吸收了添加的大豆油。中式烹調魚類經常采用油煎,容易造成食材脂肪含量的上升。采用烤制或壓力鍋煎時,因水分蒸發(fā),進而使油滲透進食材當中,也會使烹調后的脂肪含量上升[35]。
2.2 pH值
pH值可以反映樣品的化學品質及貯藏穩(wěn)定性。據報道,鱘魚生樣的pH值為5.88[36],人工養(yǎng)殖的鱘魚pH值在6.10~6.29之間[19]。由圖1可知,鱘魚生樣pH值為6.12,與前人研究結果一致[19]。不管采用哪種烹調方法,都會使pH值上升,這可能與脂肪和蛋白質的氧化以及蛋白質分解產物胺類的形成有關[37-38]。6 種烹調方法中,以壓力鍋煎和清蒸后pH值上升幅度最小,可能是因為這兩種烹調方法造成的脂肪氧化程度較小,蛋白質分解也較少。
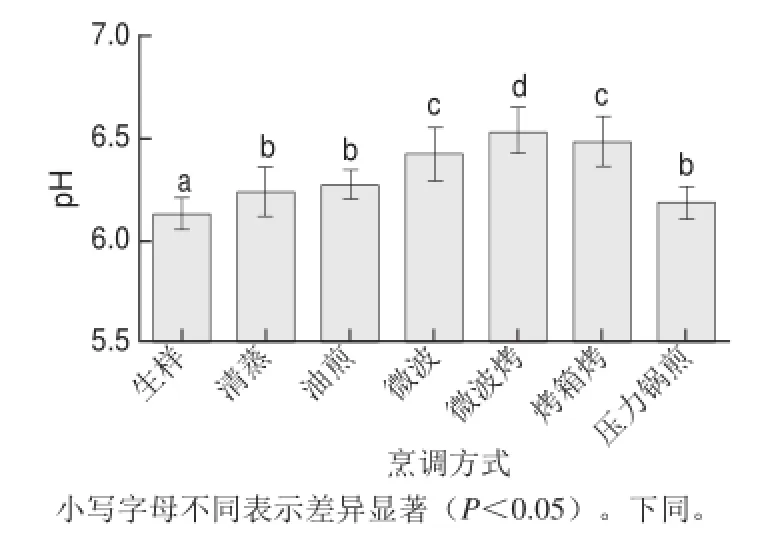
圖1 烹調后鱘魚的pH值變化Fig.1 Change in pH in sturgeon fillets with different cooking treatments
2.3 脂肪氧化分析
2.3.1 酸價
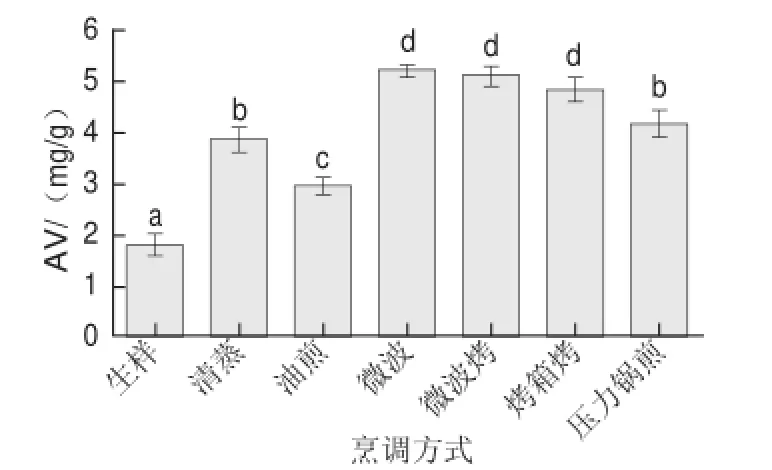
圖2 烹調后鱘魚酸價變化Fig.2 Change in acid value (AV) in sturgeon fillets with different cooking treatments
由圖2可知,6 種烹調均會造成魚肉酸價上升,推測這可能與脂肪的水解和氧化過程相關。和油煎、清蒸相比,在高溫空氣中長時間暴露的烹調方法(烤箱烤、微波、微波烤)使酸價升高程度更大,Weber等[7]的研究也得到了類似結果。清蒸和壓力鍋煎的酸價上升較少,可能是因為有水蒸氣保護,脂肪氧化程度較小,同時游離脂肪酸析出較少[7]。
2.3.2 過氧化值
由圖3可知,烹調后,鱘魚過氧化值顯著降低。盡管有研究顯示[39],油炸后沙丁魚的過氧化物含量幾乎不變,但有研究報道[40]鯉魚(common carp)和鯖魚(mackerel)在微波加熱后,過氧化值有所下降;波羅的海鯡魚(Baltic herring fillets)油炸后的過氧化值顯著下降[41]。隨溫度升高,脂肪氧化過程變快,氫過氧化物的形成和分解速率加快,導致過氧化值下降[8,35]。Saghir等[42]對不同烹調處理的牛肉進行研究,發(fā)現過氧化值與烹調時間和汁液損失成負相關關系。本研究也發(fā)現,烹調時間最長的樣品過氧化值下降程度最大。
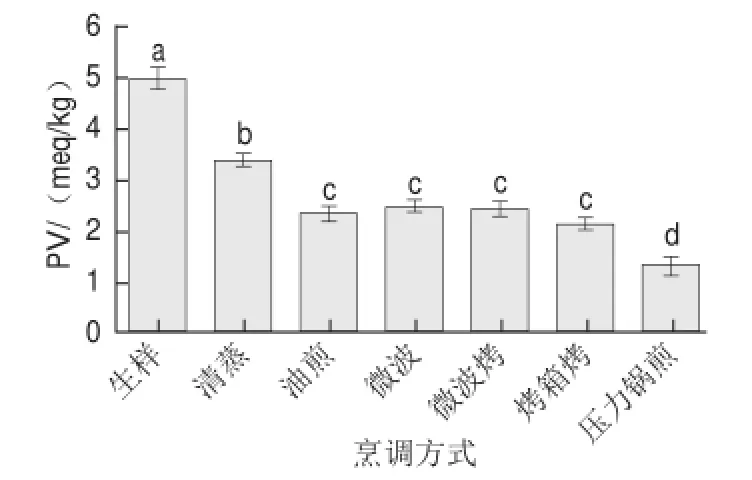
圖3 烹調后鱘魚過氧化值變化Fig.3 Change in PV in sturgeon fillets with different cooking treatments
2.3.3 TBARS值
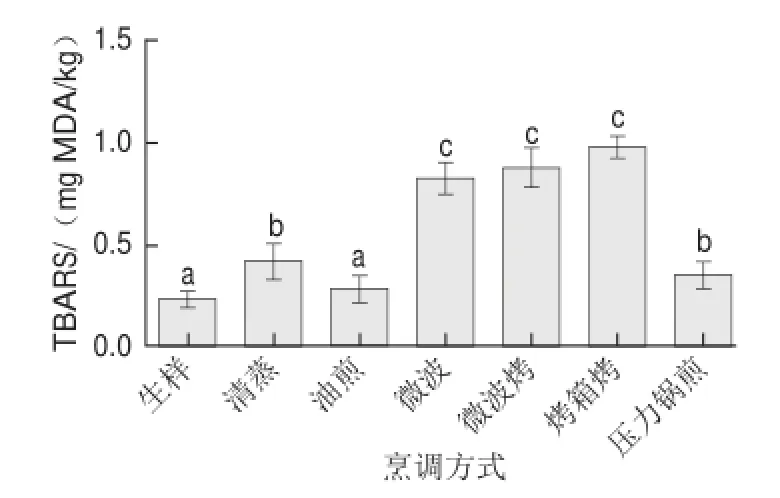
圖4 烹調后鱘魚TBARS值變化Fig.4 Change in TBARS value in sturgeon fillets with different cooking treatments
TBARS值可表示脂肪氧化的終產物之一——丙二醛的濃度,用以評價脂肪氧化的后期反應。由圖4可知,烤箱烤、微波和微波烤都會使樣品的TBARS值顯著上升,可能是處理過程中高溫和充足的氧氣加劇了脂質過氧化反應,生成了大量丙二醛。而壓力鍋煎和清蒸的TBARS值上升程度小,與pH值和酸價的變化趨勢一致。油煎處理與生樣相比未見顯著差異,可能是因為油炸后形成的丙二醛一部分溶入油中,或與蛋白質形成交聯產物[7]。
2.3.4 pH值與氧化程度指標間的相關性分析
各烹調方法樣品的pH值與AV、PV、TBARS值的相關關系如表3所示,AV與pH值成顯著正相關關系,TBARS值與pH值成極顯著正相關關系(P=0.001<0.01),決定系數R2=0.891。在現有研究條件下,未發(fā)現PV與pH值的線性相關關系。這一結果提示,可以用pH值這個較易測得的指標對魚肉烹調后的脂肪氧化程度進行評價。

表3 各烹調方法樣品的pH值與AV、PV、TBARS值的方程及相關關系Table 3 Correlation between pH and AV, PV or TBARS
2.4 膽固醇含量
Badiani等[18-19]測得人工養(yǎng)殖的鱘魚膽固醇含量為61.4~70.4 mg/100 g,遠小于本研究測得的153 mg/100 g水平(圖5)。烹調后膽固醇含量下降可能是由于膽固醇氧化的原因[43]。清蒸和壓力鍋煎在一定程度上減少了烹調過程中氧氣與魚表面的接觸,因此這兩種烹調方法造成的膽固醇氧化損失較少。微波、油煎、烤箱烤和微波烤4 種烹調方法之間未見顯著差異。暴露在空氣中高溫加熱會促進富含多不飽和脂肪酸的烹調油發(fā)生脂肪氧化,從而引發(fā)和加速膽固醇的氧化[44]。

圖5 烹調后鱘魚膽固醇含量變化Fig.5 Change in cholesterol in sturgeon fillets with different cooking treatments
考慮到膽固醇損失也是脂肪氧化的結果之一,將其與pH值、AV、PV、TBARS值指標進行線性相關分析,結果如表4所示。膽固醇含量與pH值和AV成顯著負相關關系,與PV成顯著正相關關系。這提示,pH值、AV和PV的變化可以反映出鱘魚烹調后的膽固醇保留情況。雖然未發(fā)現膽固醇與TBARS值有顯著的線性相關,但存在負相關的變化趨勢。

表4 膽固醇含量與pH值、AV、PV、TBARS值指標的線性相關分析Table 4 Linear correlation between cholesterol content and pH, AV, PV or TBARS
2.5 脂肪酸組分的變化
鱘魚生樣和烹調后的脂肪酸組成如表5所示,生樣中飽和脂肪酸(saturated fatty acid,SFA)、MUFA、PUFA含量比為1∶1.4∶1.4,與Kaya等[45]測定的SFA 33.61%、MUFA 32.46%、PUFA 21.03%結果有所不同。Vaccaro等[17]研究發(fā)現,人工養(yǎng)殖雜交鱘魚的脂肪酸組成中,PUFA占比最大,達44.5%,SFA和MUFA含量相當,分別為28.7%和26.9%。測定數據間的差異可能源自魚的品種和飼料不同,Kaya等[45]所用的鱘魚品種Huso huso L. 1758,Vaccaro等[17]所用的品種是Acipenser naccarihA. baerii。

表5 烹調后鱘魚脂肪酸組成Table 5 Fatty acid profiles of sturgeon samples with different cooking treatments %
由表5可知,在PUFAs中,亞油酸(C18∶2n-6)是含量最高的n-6脂肪酸,DHA(C22∶6n-3)和EPA(C20∶5n-3)是含量最高的n-3脂肪酸。作為一種淡水魚,鱘魚能提供較為豐富的EPA和DHA。在6 種烹調處理后,樣品的SFA均有所上升,可能原因是高溫長時加熱條件下,不飽和脂肪酸易發(fā)生氧化反應,含量有所下降。此外,其中,壓力鍋煎的樣品單不飽和脂肪酸含量最高。
不飽和脂肪酸熱穩(wěn)定性差,且隨著不飽和程度的增加,穩(wěn)定性下降[12]。熱處理會提高n-3 PUFA的熱敏性。心血管相關的健康研究證實,魚類能否發(fā)揮對心血管的有益作用與其采用的烹調方法密切相關[4]。有研究顯示[5],缺血性中風的發(fā)病風險與烤魚的攝入成負相關關系,與炸魚、魚肉三明治的攝入成正相關關系。
油煎處理保留的n-6脂肪酸和PUFA總量和較多,可能是因為烹調用油滲入到了樣品中。清蒸和壓力鍋煎保留的PUFA含量最高,n-3脂肪酸含量也最高,說明這兩種烹調方法對不飽和脂肪酸有較好的保護作用,一方面可能是因為水蒸氣的保護作用,同時壓力鍋煎為密閉過程,可能阻礙了n-3脂肪酸的氧化過程。有豆類烹調實驗發(fā)現[46],相比其他烹調方法,壓力烹調在抗氧化物質的保留方面存在明顯優(yōu)勢。Xu等[47]也通過實驗證實,蒸豆子中的多酚類物質保留率最高。
鱘魚生樣中,n-6/n-3脂肪酸的比值為1.10∶1,烹調后這一比例均有上升,其中烤箱烤的比例最高,為1.36∶1。Nikoo等[13]研究發(fā)現,油炸后鱘魚的n-6/n-3脂肪酸的比值由1.922上升至3.125;煙熏處理后,這一比例從0.2上升至2.63[45]。可見,在討論膳食中n-6/n-3脂肪酸的比值時,不僅要考慮食材,更要考慮烹調方法。由于脂肪酸組分的變化,6 種烹調處理對鱘魚的AI值和TI值均有影響,其中清蒸和壓力鍋煎的值最小,烤箱烤的值最高。
3 結 論
油煎、清蒸、壓力鍋煎、烤箱烤、微波、微波烤都會對鱘魚的基礎成分、氧化指標、膽固醇含量和脂肪酸組成有所影響。在脂肪氧化的各指標中,TBARS值和AV值與樣品pH值有顯著相關關系,膽固醇含量的變化很可能與脂肪氧化指標和pH值相關。
6 種烹調方法中,清蒸對鱘魚基礎成分的影響最小,壓力鍋煎對n-6/n-3脂肪酸的比值影響最小。值得注意的是,在氧化穩(wěn)定性、脂肪酸組成和膽固醇穩(wěn)定性方面,清蒸和壓力鍋煎相較于其他烹調方法顯示出了較大優(yōu)越性,提示這兩類烹調方法可能有利于保持魚類食材對心腦血管疾病的預防作用。由于本研究中清蒸的時間,以及壓力烹調的壓力和時間,均超過烹熟魚類的實際需要,在以后的研究中,還可以考慮適當降低烹調壓力,縮短烹調時間,以便更好地發(fā)揮這兩種烹調方法的健康優(yōu)勢。
[1] PUWASTIEN P, JUDPRASONG K, KETTWAN E, et al. Proximate composition of raw and cooked Thai freshwater and marine fish[J]. Journal of Food Composition and Analysis, 1999, 12(1): 9-16. DOI:10.1051/0004-6361:20040190.
[2] LOMBARDO Y B, HEIN G, CHICCO A. Metabolic syndrome: effects of n-3 PUFAs on a model of dyslipidemia, insulin resistance and adiposity[J]. Lipids, 2007, 42(5): 427-437. DOI:10.1016/ j.jnutbio.2005.08.002.
[3] LOMBARDO Y B, CHICCO A G. Effects of dietary polyunsaturated n-3 fatty acids on dyslipidemia and insulin resistance in rodents and humans: a review[J]. The Journal of Nutritional Biochemistry, 2006,17(1): 1-13. DOI:10.1016/j.jnutbio.2005.08.002.
[4] MOZAFFARIAN D, LEMAITRE R N, KULLER L H, et al. Cardiac benefits of fish consumption may depend on the type of fish meal consumed the cardiovascular health study[J]. Circulation, 2003,107(10): 1372-1377. DOI:10.1161/01.CIR.0000055315.79177.16.
[5] MOZAFFARIAN D, LONGSTRETH W T, LEMAITRE R N, et al. Fish consumption and stroke risk in elderly individuals: the cardiovascular health study[J]. Archives of Internal Medicine, 2005, 165(2): 200-206.
[6] BOGNAR A. Comparative study of frying to other cooking techniques influence on the nutritive value[J]. Grasasy Aceites, 1998, 49(3/4): 250-260.
[7] WEBER J, BOCHI V C, RIBEIRO C P, et al. Effect of different cooking methods on the oxidation, proximate and fatty acid composition of silver catfish (Rhamdia quelen) fillets[J]. Food Chemistry, 2008, 106(1): 140-146. DOI:10.1016/ j.foodchem.2007.05.052.
[8] FRANKEL E N. Lipid oxidation[J]. Progress in Lipid Research, 1980,19(1/2): 1-22.
[9] KUL?S E, ACKMAN R G. Different tocopherols and the relationship between two methods for determination of primary oxidation products in fish oil[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 1724-1729.
[10] LARSEN D, QUEK S Y, EYRES L. Effect of cooking method on the fatty acid profile of New Zealand King Salmon (Oncorhynchus tshawytscha)[J]. Food Chemistry, 2010, 119(2): 785-790. DOI:10.1016/j.foodchem.2009.07.037.
[11] BAKAR J, RAHIMABADI E Z, MAN Y B C. Lipid characteristics in cooked, chill-reheated fillets of Indo-Pacific king mackerel(Scomberomorous guttatus)[J]. LWT-Food Science and Technology,2008, 41(10): 2144-2150. DOI:10.1016/j.lwt.2007.12.004.
[12] SIOEN I, HAAK L, RAES K, et al. Effects of pan-frying in margarine and olive oil on the fatty acid composition of cod and salmon[J]. Food Chemistry, 2006, 98(4): 609-617. DOI:10.1016/ j.foodchem.2005.06.026.
[13] NIKOO M, RAHIMABADI E Z, SALEHIFAR E. Effects of fryingchilling-reheating on the lipid content and fatty acid composition of cultured sturgeon (Huso huso, Beluga) fillets[J]. Journal of Aquatic Food Product Technology, 2010, 19(2): 120-129. DOI:10.1080/104988 50.2010.493267.
[14] OTAEGUI-ARRAZOLA A, MENENDEZ-CARRE?O M, ANSORENA D, et al. Oxysterols: a world to explore[J]. Food and Chemical Toxicology, 2010, 48(12): 3289-3303. DOI:10.1016/ j.fct.2010.09.023.
[15] VEJUX A, LIZARD G. Cytotoxic effects of oxysterols associated with human diseases: induction of cell death (apoptosis and/or oncosis),oxidative and inflammatory activities, and phospholipidosis[J]. Molecular Aspects of Medicine, 2009, 30(3): 153-170. DOI:10.1016/ j.mam.2009.02.006.
[16] CHEN I C, CHAPMAN F A, WEI C, et al. Differentiation of cultured and wild sturgeon (Acipenser oxyrinchus desotoi) based on fatty acid composition[J]. Journal of Food Science, 1995, 60(3): 631-635. DOI:10.1111/j.1365-2621.1995.tb09844.x.
[17] VACCARO A M, BUFFA G, MESSINA C M, et al. Fatty acid composition of a cultured sturgeon hybrid (Acipenser naccarii× A. baerii)[J]. Food Chemistry, 2005, 93(4): 627-631. DOI:10.1016/ j.foodchem.2004.09.042.
[18] BADIANI A, ANFOSSI P, FIORENTINI L, et al. Nutritional composition of cultured sturgeon (Acipenser spp.)[J]. Journal of Food Composition and Analysis, 1996, 9(2): 171-190. DOI:10.1006/ jfca.1996.0024.
[19] BADIANI A, STIPA S, NANNI N, et al. Physical indices, processing yields, compositional parameters and fatty acid profile of three species of cultured sturgeon (Genus acipenser)[J]. Journal of the Science of Food and Agriculture, 1997, 74(2): 257-264.
[20] PALEARI M A, BERETTA G, GRIMALDI P, et al. Composition of muscle tissue of farmed white sturgeon (Acipenser transmontanus)with particular reference to lipidic content[J]. Journal of Applied Ichthyology, 1997, 13(2): 63-66. DOI:10.1111/j.1439-0426.1997. tb00102.x.
[21] GARCíA-GALLEGO M, SANZ A, DOMEZAIN A, et al. Age-size influences on tissue-lipid quality of the sturgeon Acipenser naccarii from intensive culture[J]. Journal of Applied Ichthyology, 1999,15(4/5): 261-264. DOI:10.1111/j.1439-0426.1999.tb00247.x.
[22] MARTíNEZ-ALVAREZ O, LóPEZ-CABALLERO M E, GóMEZGUILLéN M C, et al. The effect of several cooking treatments on subsequent chilled storage of thawed deepwater pink shrimp(Parapenaeus longirostris) treated with different melanosis-inhibiting formulas[J]. LWT-Food Science and Technology, 2009, 42(8): 1335-1344. DOI:10.1016/j.lwt.2009.03.025.
[23] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB 5009.3ü2010 食品中水分的測定[S]. 北京: 中國標準出版社, 2010.
[24] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 5009.5ü2010食品中蛋白質的測定[S]. 北京: 中國標準出版社, 2010.
[25] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 9695.7ü2008肉與肉制品 總脂肪的測定[S]. 北京:中國標準出版社, 2008.
[26] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 5009.4ü2010食品中灰分的測定[S]. 北京: 中國標準出版社, 2010.
[27] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 5530ü2005 動植物油脂 酸值和酸度測定[S]. 北京: 中國標準出版社, 2005.
[28] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 5538ü2005 動植物油脂 過氧化值測定[S]. 北京:中國標準出版社, 2005.
[29] S?RENSEN G, J?RGENSEN S S. A critical examination of some experimental variables in the 2-thiobarbituric acid (TBA) test for lipid oxidation in meat products[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung, 1996, 202(3): 205-210.
[30] RAGHAVAN S, HULTIN H O. Model system for testing the efficacy of antioxidants in muscle foods[J]. Journal of Agricultural and Food Chemistry, 2005, 53(11): 4572-4577.
[31] FOLCH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[32] HARTMAN L, LAGO R C. Rapid preparation of fatty acid methyl esters from lipids[J]. Laboratory Practice, 1973, 22: 475-476.
[33] ULBRICHT T L V, SOUTHGATE D A T. Coronary heart disease: seven dietary factors[J]. The Lancet, 1991, 338: 985-992.
[34] 中華人民共和國國家質量監(jiān)督檢驗檢疫總局. GB/T 22220ü2008 食品中膽固醇的測定 高效液相色譜法[S]. 北京: 中國標準出版社, 2008.
[35] SAGUY I S, DANA D. Integrated approach to deep fat frying: engineering, nutrition, health and consumer aspects[J]. Journal of Food Engineering, 2003, 56(2): 143-152. DOI:10.1016/S0260-8774(02)00243-1.
[36] üNAL ?ENG?R G F, ALAKAVUK D ü, TOSUN ? Y, et al. The chemical and sensory quality of smoked sturgeon (Huso huso): a case study[J]. Journal of Aquatic Food Product Technology, 2010, 19(3/4): 310-317. DOI:10.1080/10498850.2010.520422.
[37] BRAGGINS T J. Effect of stress-related changes in sheepmeat ultimate pH on cooked odor and flavor[J]. Journal of Agricultural and Food Chemistry, 1996, 44(8): 2352-2360.
[38] OZ F, KABAN G, KAYA M. Effects of cooking techniques and levels on the formation of heterocyclic aromatic amines in chicken and fish[J]. Journal of Animal and Veterinary Advances, 2010, 9: 1259-1264.
[39] SANCHEZ-MUNIZ F J, VIEJO J M, MEDINA R. Deep-frying of sardines in different culinary fats. Changes in the fatty acid composition of sardines and frying fats[J]. Journal of Agricultural and Food Chemistry, 1992, 40(11): 2252-2256.
[40] El-MONEIM E A, Vá J D, DOLE? M. Oxidative changes of lipids during microwave heating of minced fish flesh in catering[J]. Czech Journal of Food Sciences, 2009, 27(Suppl 6): 17-19.
[41] ARO T, TAHVONEN R, MATTILA T, et al. Effects of season and processing on oil content and fatty acids of baltic herring (Clupea harengus membras)[J]. Journal of Agricultural and Food Chemistry,2000, 48(12): 6085-6093.
[42] SAGHIR S, WAGNER K H, ELMADFA I. Lipid oxidation of beef fillets during braising with different cooking oils[J]. Meat Science,2005, 71(3): 440-445. DOI:10.1016/j.meatsci.2005.03.021.
[43] XU G, SUN J, LIANG Y, et al. Interaction of fatty acids with oxidation of cholesterol and β-sitosterol[J]. Food Chemistry, 2011, 124(1): 162-170. DOI:10.1016/j.foodchem.2010.06.003.
[44] BRONCANO J M, PETRóN M J, PARRA V, et al. Effect of different cooking methods on lipid oxidation and formation of free cholesterol oxidation products (COPs) in Latissimus dorsi muscle of Iberian pigs[J]. Meat Science, 2009, 83(3): 431-437. DOI:10.1016/ j.meatsci.2009.06.021.
[45] KAYA Y, TURAN H, EMIN ERDEM M. Fatty acid and amino acid composition of raw and hot smoked sturgeon (Huso huso, L. 1758)[J]. International Journal of Food Sciences and Nutrition, 2007, 59(7/8): 635-642.
[46] ROCHA-GUZMáN N E, GONZáLEZ-LAREDO R F, IBARRAPéREZ F J, et al. Effect of pressure cooking on the antioxidant activity of extracts from three common bean (Phaseolus vulgaris L.)cultivars[J]. Food Chemistry, 2007, 100(1): 31-35. DOI:10.1016/ j.foodchem.2005.09.005.
[47] XU B J, CHANG S K C. Total phenolic content and antioxidant properties of eclipse black beans (Phaseolus vulgaris L.) as affected by processing methods[J]. Journal of Food Science, 2008, 73(2): H19-H27. DOI:10.1111/j.1750-3841.2007.00625.x.
Impact of Domestic Preparation on Fatty Acids and Cholesterol of Cultured Hybrid Sturgeon
LAN Xiaofang1, RUAN Guangfeng1, FAN Zhihong1,*, LI Nannan1, WANG Shun2
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Beijing Fisheries Research Institute, Beijing 100068, China)
The effect of six cooking methods on changes in fat components of cultured hybrid sturgeon (Acipenser baerii × A. schrenckii) was studied with respect to fat and cholesterol contents, lipid oxidation parameters and fatty acid profiles. All cooking treatments, steaming, pan frying, microwave roasting, oven roasting and pressure frying, decreased the ratio of n-3 to n-6 polyunsaturated fatty acids (PUFA) in samples. The n-3/n-6 ratio of pressure fried samples was the highest (0.85), followed by the steamed samples (0.83), and the oven-roasted samples exhibited the lowest level (0.73). The retention of cholesterol was the highest in steamed and pressure fried samples with no significant difference between both treatments. The acid value increased while the peroxide value decreased after all cooking treatments, which correlated significantly to cholesterol contents of the treated samples. These results suggest that the relatively smaller change of PUFA and cholesterol in pressure cooking may be explained by less oxidation in sealed pressure cooker during heating.
sturgeon; domestic preparation; cholesterol; fatty acid; oxidation
10.7506/spkx1002-6630-201607004
TS254.4
A
1002-6630(2016)07-0016-07
蘭曉芳, 阮光鋒, 范志紅, 等. 家庭烹調對鱘魚中脂肪酸和膽固醇的影響[J]. 食品科學, 2016, 37(7): 16-22. DOI:10.7506/ spkx1002-6630-201607004. http://www.spkx.net.cn
LAN Xiaofang, RUAN Guangfeng, FAN Zhihong, et al. Impact of domestic preparation on fatty acids and cholesterol of cultured hybrid sturgeon[J]. Food Science, 2016, 37(7): 16-22. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607004. http://www.spkx.net.cn
2015-06-03
“十一五”國家科技支撐計劃項目(2008BAD91B01)
蘭曉芳(1992—),女,碩士研究生,研究方向為食品營養(yǎng)。E-mail:tapeti@126.com
*通信作者:范志紅(1966—),女,副教授,博士,研究方向為食物營養(yǎng)。E-mail:daisyfan@vip.sina.com

