魔芋葡甘低聚糖對大鼠腸道環(huán)境的影響
王 敏,帥天罡,秦清娟,鐘 耕,2,
(1.西南大學(xué)食品科學(xué)學(xué)院,重慶 400715;2.重慶市特色食品工程技術(shù)研究中心,重慶 400716)
魔芋葡甘低聚糖對大鼠腸道環(huán)境的影響
王 敏1,帥天罡1,秦清娟1,鐘 耕1,2,*
(1.西南大學(xué)食品科學(xué)學(xué)院,重慶 400715;2.重慶市特色食品工程技術(shù)研究中心,重慶 400716)
目的:研究以半干法酶解制備的魔芋葡甘低聚糖(konjac oligosaccharides,KOS)對大鼠腸道環(huán)境的影響。方法:將KOS摻入到飼料中飼喂Sprague-Dawley(SD)大鼠,30 d后測定大鼠盲腸內(nèi)容物各項(xiàng)指標(biāo)和盲腸、小腸的理化指標(biāo)。結(jié)果:KOS可以明顯增加大鼠糞便含水率及盲腸壁表面積、小腸的拉伸性能、盲腸內(nèi)容物中雙歧桿菌和乳酸菌的數(shù)量;降低盲腸內(nèi)容物pH值及含水率、游離氨及揮發(fā)性醛類和含氮類物質(zhì)含量;抑制大腸桿菌和梭狀芽孢桿菌的生長,增加短鏈脂肪酸的產(chǎn)生量。結(jié)論:KOS可以調(diào)節(jié)大鼠腸道菌群組成,改善腸道環(huán)境,促進(jìn)腸道健康,是一種優(yōu)良的益生元。
魔芋葡甘低聚糖;腸道環(huán)境;盲腸內(nèi)容物;益生元
魔芋葡甘聚糖(konjac glucomannan,KGM)又被稱為魔芋多糖,是從魔芋塊莖中提取的儲(chǔ)備性多糖[1-2]。它是由D-甘露糖和D-葡萄糖按物質(zhì)的量比1.6∶1或1.69∶1通過β-1,4糖苷鍵聚合成的[3]。KGM具有良好的吸水性、成膜性、增稠性、可塑性、乳化性、結(jié)構(gòu)性、保水性和賦形性等多種性質(zhì)[4-5],其獨(dú)特的流變和凝膠性能使其在功能性食品領(lǐng)域被廣泛應(yīng)用[6-7]。同時(shí)它還具有提高機(jī)體免疫力、清潔胃腸道、減肥、降血脂、防止糖尿病、抗衰老等多種生理功效[8]。但目前KGM的應(yīng)用也存在較大問題,如KGM相對分子質(zhì)量較高,黏度大,難以工業(yè)化生產(chǎn),因此選取一種優(yōu)良工藝,獲取利于應(yīng)用的產(chǎn)品成為了人們關(guān)注的焦點(diǎn)。
魔芋葡甘低聚糖(konjac oligosaccharide,KOS)味微甜,有魔芋特有的香味,且口感純正。有研究者通過實(shí)驗(yàn)得出KOS對致病菌如金黃色葡萄球菌和鼠傷寒沙門氏菌有明顯抑制作用[9],并能抑制淀粉老化、清除自由基、對益生菌如乳酸菌有促進(jìn)和增殖作用[10-11]。目前,KOS的制備方法主要集中在物理法[12-13]、化學(xué)法[14-15]和生物酶法[16-17]。本實(shí)驗(yàn)擬采取半干酶法制備KOS,即以β-甘露聚糖酶處理KGM,通過微波加熱滅酶制備KOS。該方法具有反應(yīng)條件溫和、污染小、能耗低、得率高、提純方法簡單等特點(diǎn)[18],并且避免了KGM相對分子質(zhì)量大、黏度高、溶解度小等缺陷。
有研究表明,在體外發(fā)酵實(shí)驗(yàn)中KOS表現(xiàn)出良好的腸道益生性能,明顯增加腸道益生菌數(shù)量和短鏈脂肪酸含量[18],而其在動(dòng)物體內(nèi)能否表現(xiàn)出這種功能尚且不知。因此,本實(shí)驗(yàn)以Sprague-Dawley(SD)大鼠為受試體,研究KOS對其腸道環(huán)境的影響,為KOS作為益生元及其進(jìn)一步開發(fā)利用提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 動(dòng)物、材料與試劑
清潔級SD大鼠80 只,體質(zhì)量(180f10)g,大鼠及飼料均購自重慶騰鑫比爾實(shí)驗(yàn)動(dòng)物銷售有限公司,許可證號(hào):SCXK(渝)2012-0003;動(dòng)物房溫度22~25 ℃,每天12 h明暗輪換(7:00ü19:00),實(shí)驗(yàn)動(dòng)物環(huán)境設(shè)施合格證:普通級環(huán)境。
KOS粉末為自制[19-20],外觀呈粉狀,白色,無臭無味,易溶于水,不溶于乙醇、乙醚等有機(jī)溶劑;經(jīng)液相色譜和飛行質(zhì)譜聯(lián)用分析,可推導(dǎo)出該低聚糖是一種吡喃型葡甘露低聚糖。該低聚糖中相對分子質(zhì)量最小的為甘露二糖,最大的為甘露十糖,表明該KOS粉末為葡甘二糖~葡甘十糖及少量單糖的混合物[21]。
乙酸、丙酸、丁酸、正戊酸、異戊酸(色譜純)阿拉丁試劑(上海)有限公司;RR820A熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)擴(kuò)增試劑盒、SYBR Premix Ex TaqTM、9763 DNA提取試劑盒日本TaKaRa公司。
1.2 儀器與設(shè)備
HH-4數(shù)字恒溫水浴鍋 金壇市富華儀器有限公司;JTI0001電子天平 上海精天電子儀器有限公司;DHG-9070A電熱鼓風(fēng)干燥箱 上海奇欣科學(xué)儀器有限公司;DSC4000差示掃描量熱儀 美國Perkin Elmer公司;DHR-1流變儀 美國TA公司;MVAG803202微型快速黏度儀 德國Brabender GmbH公司;CT-3質(zhì)構(gòu)儀美國Brookfield公司。
1.3 方法
1.3.1 動(dòng)物分組及處理
健康SD大鼠80 只,隨機(jī)分為4 組,每組20 只,雌雄各半。兩只同性別的大鼠放于一籠,自由進(jìn)食進(jìn)水,普通飼料預(yù)養(yǎng)1 周,觀察實(shí)驗(yàn)動(dòng)物對環(huán)境的適應(yīng)情況。將含低(0.625 g/(kg·d))、中(1.250 g/(kg·d))、高(2.500 g/(kg·d))3 個(gè)不同劑量KOS粉碎樣品的飼料分別給予3 組大鼠,另設(shè)給予不含樣品的同種飼料的空白對照組。連續(xù)喂養(yǎng)30 d,自由進(jìn)水,待實(shí)驗(yàn)結(jié)束后斷頭處死大鼠,解剖測定相關(guān)指標(biāo)。
1.3.2 大鼠糞便含水率測定
實(shí)驗(yàn)開始后,每周的后3 d收集空白對照組和KOS不同劑量組大鼠糞便,稱量各組大鼠新鮮糞便質(zhì)量。然后將大鼠糞便放入60 ℃鼓風(fēng)干燥箱中干燥12 h,按照公式(1)計(jì)算糞便含水率[22]。

1.3.3 盲腸物理指標(biāo)測定
1.3.3.1 盲腸內(nèi)容物質(zhì)量測定
取出盲腸,稱量盲腸總質(zhì)量,計(jì)為m1;刮出盲腸內(nèi)容物,用無菌生理鹽水清洗腸壁,稱取盲腸壁凈質(zhì)量,計(jì)為m2;按照公式(2)計(jì)算盲腸內(nèi)容物質(zhì)量。
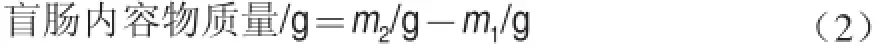
1.3.3.2 盲腸壁表面積測定
參照劉慶慶等[23]的方法:將清洗干凈的盲腸壁完全展開固定到A4紙上,勾出其輪廓,待紙完全干燥后將盲腸壁輪廓復(fù)印到打印紙上,然后將紙上的盲腸壁輪廓圖剪切下來,稱量其質(zhì)量,計(jì)為m3;另外準(zhǔn)確稱取25 cm2打印紙質(zhì)量,計(jì)為m4,按照公式(3)計(jì)算盲腸壁表面積。
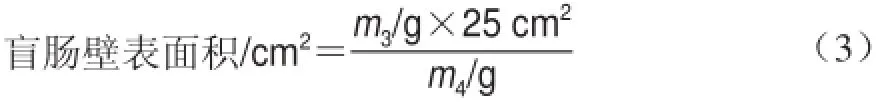
1.3.3.3 盲腸內(nèi)容物pH值測定
取新鮮盲腸內(nèi)容物于去離子水處理過的離心管中,加入10 倍質(zhì)量的去離子水(V/m),放于漩渦振蕩器上混合均勻,靜置,用精密pH計(jì)測定上清液的pH值。
1.3.3.4 盲腸內(nèi)容物含水率測定
取0.3 g左右盲腸內(nèi)容物,放于恒質(zhì)量的稱量皿中,放于60 ℃鼓風(fēng)干燥箱中干燥12 h,計(jì)算烘干前后盲腸內(nèi)容物質(zhì)量的差值[22],按公式(4)計(jì)算盲腸內(nèi)容物含水率。

1.3.4 盲腸內(nèi)容物游離氨含量測定
標(biāo)準(zhǔn)曲線的繪制:稱取1.004 5 g無水NH4Cl溶于800 mL蒸餾水中,用稀釋的鹽酸調(diào)節(jié)pH值至2.0,再用蒸餾水定容至1 L,即質(zhì)量濃度320 mg/L的貯備液。用貯備液配制成320、160、80、40、20、10、0 mg/L的標(biāo)準(zhǔn)溶液,制作標(biāo)準(zhǔn)曲線[24]。
取0.5 g盲腸內(nèi)容物加入10 倍質(zhì)量的蒸餾水(V/m),漩渦振蕩器混合均勻,4 000 r/min離心后取上清液40 μL,依次加入2.5 mL含有0.001 mol/L亞硝基鐵氰化鈉的0.500 mol/L苯酚溶液、2 mL含有0.625 mol/L氫氧化鈉的0.030 mol/L次氯酸鈉溶液。將上述混合液混勻,60 ℃保溫5 min,于625 nm波長處測定吸光度(A625nm)。
1.3.5 盲腸內(nèi)容物短鏈脂肪酸含量的測定
準(zhǔn)確稱取各組大鼠盲腸內(nèi)容物0.5 g,溶于5 mL蒸餾水中,將其放到漩渦振蕩儀上使盲腸內(nèi)容物呈均勻懸浮液,靜置10 min,4 000 r/min離心10 min。移取2 mL上清液于5 mL離心管中,加入2 mL無水乙醚,混勻,密封,于4 ℃冰箱中靜置30 min,使乙醚和發(fā)酵液分層。移取上層乙醚溶液,過0.45 μm濾膜,用于有機(jī)酸的測定。
參照賈益群等[25]的方法測定大鼠盲腸內(nèi)容物中的短鏈脂肪酸含量:用氣相色譜法測定發(fā)酵液中乙酸、丙酸、丁酸、戊酸及總酸含量。其中總酸含量為以上各種酸含量的總和。取乙酸、丙酸、正丁酸、異丁酸、正戊酸及異戊酸制備標(biāo)準(zhǔn)品貯備液,再按6 個(gè)稀釋梯度的標(biāo)準(zhǔn)液制作標(biāo)準(zhǔn)曲線。
氣相色譜條件:進(jìn)樣量1 μL;進(jìn)樣口溫度220 ℃;柱流量0.95 mL/min,柱溫90 ℃、平衡時(shí)間0.5 min,以5 ℃/min的速率升溫至150 ℃,保留時(shí)間7 min;檢測器溫度230 ℃;氫氣流量40 mL/min,空氣流量400 mL/min,尾吹流量40 mL/min。
1.3.6 盲腸內(nèi)容物微生物數(shù)量測定
1.3.6.1 細(xì)菌基因組DNA提取
分別取各組大鼠盲腸內(nèi)容物0.3 g,用5 mL無菌磷酸鹽緩沖溶液稀釋,3 000 r/min低速離心5 min,取上清,12 000 r/min離心3 min,棄上清液。按照DNA提取試劑盒說明書進(jìn)行細(xì)菌基因組總DNA提取,提取的DNA經(jīng)微量紫外分光光度計(jì)測得A260nm/A280nm為1.8~2.0,說明DNA純度較高,可以作為熒光定量PCR的DNA模板。
1.3.6.2 熒光定量PCR
盲腸內(nèi)容物中微生物數(shù)量的測定采用SYBR GreenⅠ染料法,在定量PCR儀上進(jìn)行。反應(yīng)體系:SYBR GreenⅠ染料10 μL、上下游引物1 μL、DNA模板4 μL,最后以雙蒸水補(bǔ)足20 μL;反應(yīng)程序:95 ℃ 1 min,95 ℃ 5 s,56 ℃ 30 s,72 ℃ 1 min,40 個(gè)循環(huán)。循環(huán)結(jié)束后進(jìn)行熔解,熔解程序:95 ℃ 5 s,65 ℃ 15 s,95 ℃ 0.1 ℃/s降溫至65 ℃。用定量PCR得出的Ct值,采用2-ΔΔCt法[26]計(jì)算大腸桿菌、雙歧桿菌、擬桿菌、梭狀桿菌、乳酸菌的相對數(shù)量,相關(guān)引物見表1。其中-ΔΔCt=(Ct目標(biāo)菌-Ct總細(xì)菌)實(shí)驗(yàn)組-(Ct目標(biāo)菌-Ct總細(xì)菌)對照組。不同細(xì)菌DNA引物見表1。

表1 細(xì)菌DNA引物對照表Table 1 Bacterial DNA primers used in fluorescence quantitative PCR
1.3.7 盲腸內(nèi)容物揮發(fā)性成分含量測定
盲腸內(nèi)容物中揮發(fā)性成分含量采用氣相色譜-質(zhì)譜聯(lián)用儀測定[27-28]:在20 mL樣品瓶中加入0.5 g盲腸內(nèi)容物,加入5 mL無菌緩沖溶液,在漩渦振蕩器上振蕩均勻,于60 ℃條件下頂空萃取30 min,250 ℃解吸5 min。
氣相色譜-質(zhì)譜條件:毛細(xì)管柱DB-5MS(30 mh0.25 μm,膜厚0.25 μm);柱升溫程序:起始溫度40 ℃,保持1 min,以20 ℃/min升至140 ℃,再以3 ℃/min升至155 ℃,保持1 min,然后以2 ℃/min升至190 ℃,保持1 min,最后以25 ℃/min升至250 ℃,保持5 min;汽化室溫度:250 ℃;載氣(He)流速:1.0 mL/min;進(jìn)樣方式:不分流進(jìn)樣。
1.3.8 小腸物理性質(zhì)測定
小腸長度測定:將整段小腸(從胃根部算起,下至盲腸根部)剪下,自然拉直,用米尺測量小腸長度。
小腸系數(shù)測定:用分析天平測定小腸凈質(zhì)量,按照公式(5)計(jì)算大鼠小腸系數(shù)。

小腸拉伸性能采用質(zhì)構(gòu)儀測定:取下小腸中段10 cm,用于測定拉伸性。質(zhì)構(gòu)儀參數(shù)設(shè)定如下:探頭TA3/100,夾具TA-RT-KIT,觸發(fā)點(diǎn)負(fù)載0.02 N,測試速率0.5 mm/s,100%形變。
1.4 數(shù)據(jù)處理
2 結(jié)果與分析
2.1 大鼠糞便含水率變化
實(shí)驗(yàn)過程中,各組大鼠糞便形狀、大小均一,無黏連或稀便現(xiàn)象。其中KOS低、中劑量組大鼠糞便較其他各組表面更顯光滑。如圖1所示,各組大鼠在實(shí)驗(yàn)第1~4周內(nèi)糞便含水率變化不大。比較各組可以發(fā)現(xiàn),KOS各劑量組大鼠糞便含水率均高于空白對照組,其中雌性大鼠的KOS低、中劑量組和雄性大鼠的KOS中劑量組(第2~4周)糞便含水率均顯著高于空白對照組(P<0.05)。以上結(jié)果說明飼喂KOS可增加大鼠糞便含水率。
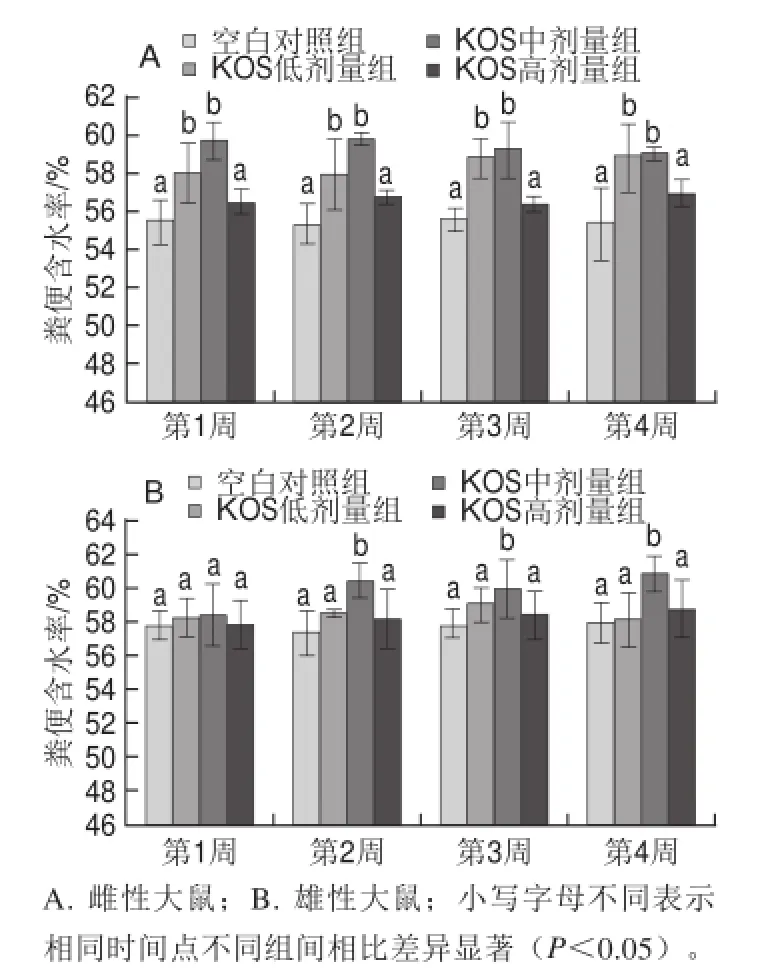
圖1 KOS對大鼠糞便含水率的影響Fig.1 Effect of KOS on fecal moisture content from rats
2.2 大鼠盲腸物理指標(biāo)變化
表2 KOS對大鼠盲腸內(nèi)容物質(zhì)量、盲腸壁凈質(zhì)量和盲腸表面積的影響()Table 2 Effect of KOS on cecal content weight, cecal wall weight and cecal wall area in rats ()

表2 KOS對大鼠盲腸內(nèi)容物質(zhì)量、盲腸壁凈質(zhì)量和盲腸表面積的影響()Table 2 Effect of KOS on cecal content weight, cecal wall weight and cecal wall area in rats ()
注:*.與空白對照組(相同性別)相比差異顯著(P<0.05)。表6同。
指標(biāo) 大鼠性別 空白對照組 KOS低劑量組KOS中劑量組KOS高劑量組盲腸內(nèi)容物質(zhì)量/g雌 1.37f0.13 1.41f0.14 1.51f0.16 1.48f0.14雄 1.53f0.26 1.56f0.19 1.57f0.17 1.46f0.21盲腸壁凈質(zhì)量/g雌 22.24f1.64 25.21f1.24*24.45f1.06*26.64f1.50*雄 24.33f1.57 28.63f1.77*28.82f1.71*27.86f1.73*雌 0.73f0.12 0.77f0.10 0.72f0.09 0.82f0.13雄 1.06f0.18 0.93f0.10 1.02f0.18 0.93f0.15盲腸壁表面積/cm2
由表2可知,各組大鼠盲腸內(nèi)容物質(zhì)量和盲腸壁凈質(zhì)量均無顯著差異(P>0.05),而KOS各劑量組大鼠的盲腸壁表面積均顯著大于空白對照組(P<0.05)。這可能是由于KOS對小鼠腸道產(chǎn)生了刺激作用,增大了盲腸壁表面積,加強(qiáng)了大鼠盲腸對營養(yǎng)物質(zhì)的吸收所致。
2.3 大鼠盲腸內(nèi)容物pH值變化
腸道pH值是腸道健康的一個(gè)重要指標(biāo)。如圖2所示,KOS各劑量組大鼠盲腸內(nèi)容物pH值較空白對照組均有所降低,且隨著KOS劑量的增加,大鼠盲腸內(nèi)容物pH值呈現(xiàn)先降低后升高的趨勢,其中KOS中劑量組大鼠盲腸內(nèi)容物pH值最低。KOS各劑量組大鼠盲腸內(nèi)容物pH值均下降的現(xiàn)象與KOS體外發(fā)酵實(shí)驗(yàn)結(jié)果趨勢一致[18],即KOS可以降低盲腸內(nèi)容物pH值。

圖2 KOS對大鼠盲腸內(nèi)容物pH值的影響Fig.2 Effect of KOS on pH of cecal contents in rats
2.4 大鼠盲腸內(nèi)容物含水率變化
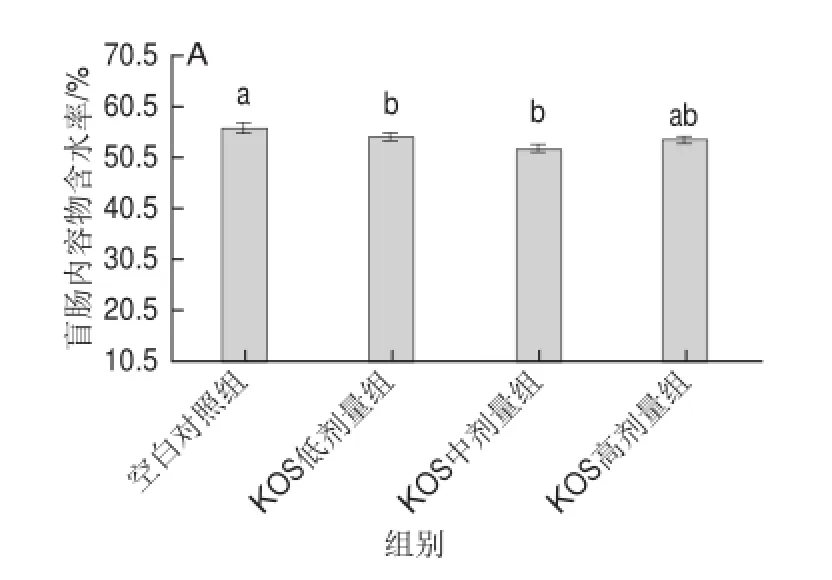
如圖3所示,比較發(fā)現(xiàn),雌、雄兩個(gè)性別大鼠的盲腸內(nèi)容物含水率均在45%以上,KOS各劑量組大鼠盲腸內(nèi)容物含水率明顯低于空白對照組,且隨著KOS劑量的增加,大鼠盲腸內(nèi)容物含水率先降低后稍有增加,在雌、雄兩個(gè)性別大鼠中都有此規(guī)律。
2.5 大鼠盲腸內(nèi)容物游離氨含量變化
游離氨是造成腸道內(nèi)容物氣味、對腸道健康不利的主要物質(zhì)。如圖4所示,KOS各劑量組大鼠盲腸內(nèi)容物中游離氨含量顯著低于空白對照組(P<0.05),但KOS高劑量組大鼠盲腸內(nèi)容物中游離氨含量卻有升高的趨勢,原因目前尚不明確,還有待進(jìn)一步研究。由此可以看出KOS可以顯著降低盲腸中游離氨含量,這正好與盲腸內(nèi)容物pH值變化趨勢吻合。
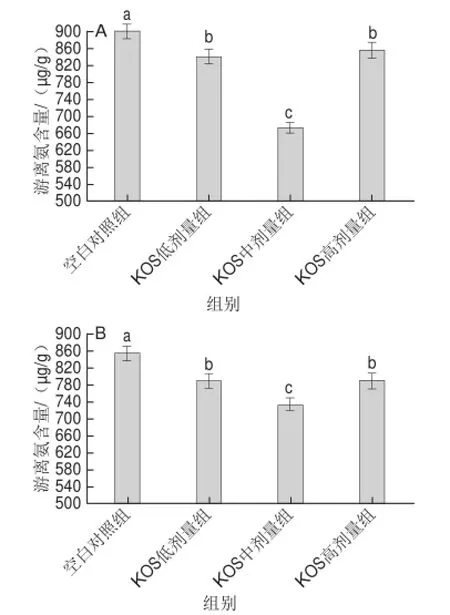
圖4 KOS對大鼠盲腸內(nèi)容物游離氨含量影響Fig.4 Effect of KOS on the free ammonia content of cecal contents in rats
2.6 大鼠盲腸內(nèi)容物中微生物數(shù)量變化
如表3所示,KOS各劑量組大鼠盲腸內(nèi)容物中乳酸菌和雙歧桿菌數(shù)量均顯著高于空白組(P<0.05),且隨著KOS劑量的增加,乳酸菌和雙歧桿菌數(shù)量均呈現(xiàn)出先增加后降低的趨勢。而梭狀芽孢桿菌和大腸桿菌數(shù)量均顯著降低(P<0.05),且與乳酸菌和雙歧桿菌呈現(xiàn)相反的趨勢;而KOS各劑量組大鼠盲腸內(nèi)容物中擬桿菌數(shù)量與空白對照組均無顯著差異(P>0.05)。KOS對大鼠腸道乳酸菌、雙歧桿菌和梭狀芽孢桿菌的作用與體外發(fā)酵結(jié)果一致[18],而對大腸桿菌的影響不同,這可能是因?yàn)轶w外發(fā)酵條件難以控制,從而造成的實(shí)驗(yàn)誤差較大所致。
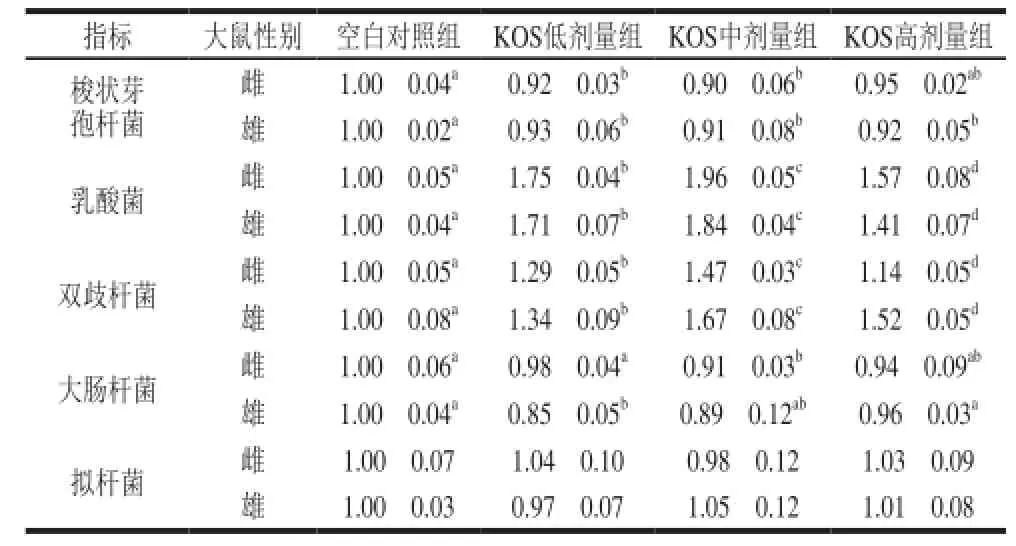
表3 KOS對盲腸內(nèi)容物微生物相對數(shù)量的影響(x±s,n=10)Table 3 Effect of KOS on bacterial counts in cecal contents in rats (x± s,n= 10)
2.7 KOS對大鼠盲腸內(nèi)容物短鏈脂肪酸含量的影響
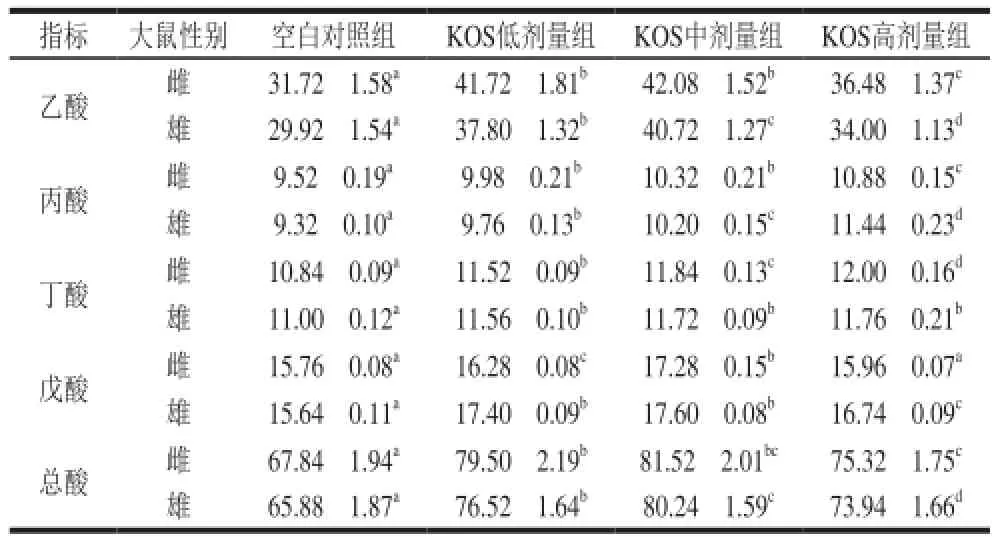
表4 KOS對大鼠盲腸內(nèi)容物中短鏈脂肪酸含量的影響(x±s,n=10)Table 4 Effect of KOS on cecal SCFAs in rats (x± s,n = 10) mmol/g
如表4所示,在飼料中添加KOS后,雌、雄大鼠盲腸中乙酸和戊酸含量均顯著升高(P<0.05),且隨著KOS劑量的增加呈現(xiàn)先升高后降低的趨勢,這與腸道益生菌數(shù)量的變化趨勢相同;同時(shí)也使大鼠盲腸中丙酸和丁酸含量顯著增加(P<0.05),且變化趨勢與KOS添加量成正相關(guān)。KOS各劑量組大鼠盲腸中總酸含量顯著高于空白對照組(P<0.05),且與乙酸含量具有相同的變化趨勢,KOS中劑量組總酸含量最高,這與體外發(fā)酵實(shí)驗(yàn)結(jié)果趨勢一致[18]。
2.8 大鼠盲腸內(nèi)容物揮發(fā)性物質(zhì)種類和含量變化
如表5所示,共檢測出醛類、酮類、醇類和吲哚類總計(jì)15 種揮發(fā)性物質(zhì),還有部分烷烴類。其中變化最明顯的是吲哚類物質(zhì),與空白對照組相比,攝入KOS的大鼠盲腸內(nèi)容物中吲哚的相對含量明顯降低。另外,有較大變化的揮發(fā)性物質(zhì)還有月桂醇、豆蔻醇、肉豆蔻醛和香葉基丙酮等。這種現(xiàn)象同樣與體外發(fā)酵實(shí)驗(yàn)揮發(fā)性物質(zhì)測定結(jié)果相符[18],由此可以推斷KOS可以減少大鼠盲腸中刺激性物質(zhì)的產(chǎn)生。
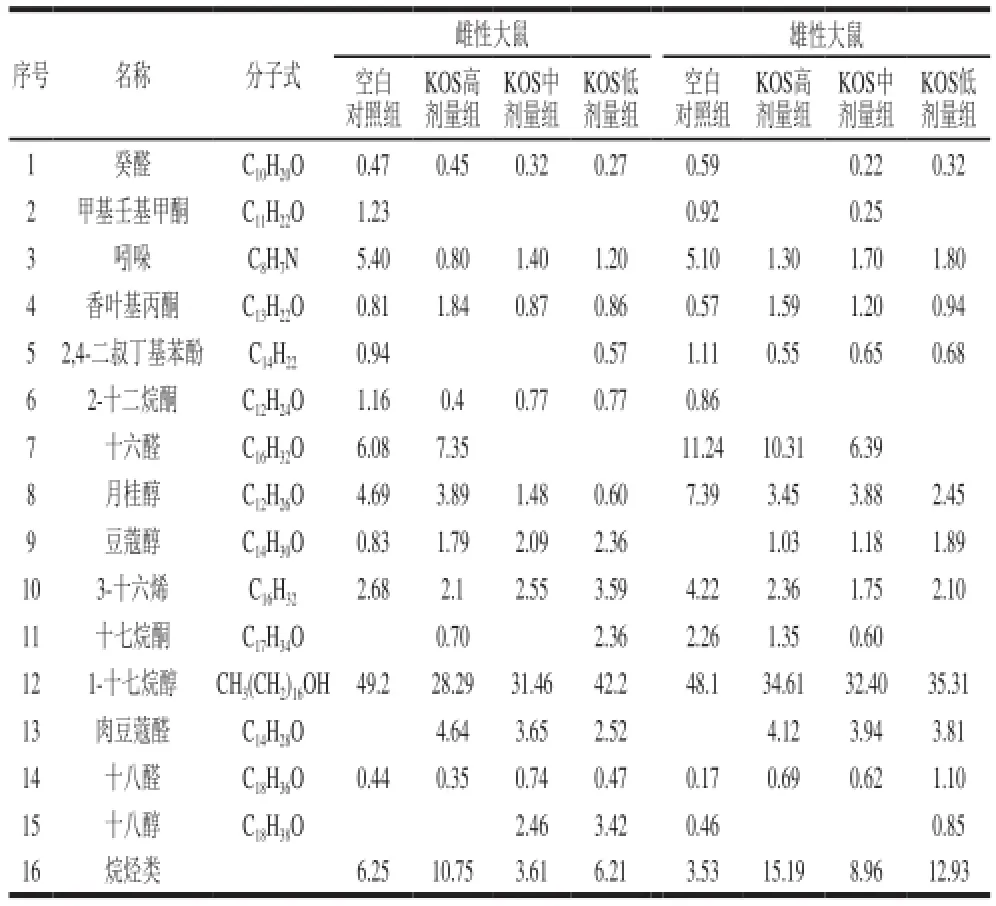
表5 KOS對大鼠盲腸內(nèi)容物揮發(fā)性物質(zhì)含量的影響(x±s,n=10)Table 5 Effect of KOS on the volatile substance contents of cecal contents in rats (x± s,n= 10) %
腸道中的游離氨、揮發(fā)性物質(zhì)中的吲哚等有害物質(zhì)主要是由腸道中有害菌的生長代謝產(chǎn)生。KOS抑制了大鼠腸道中有害菌的生長,從而減少了盲腸內(nèi)容物中游離氨和吲哚的含量。
2.9 大鼠小腸物理性質(zhì)變化
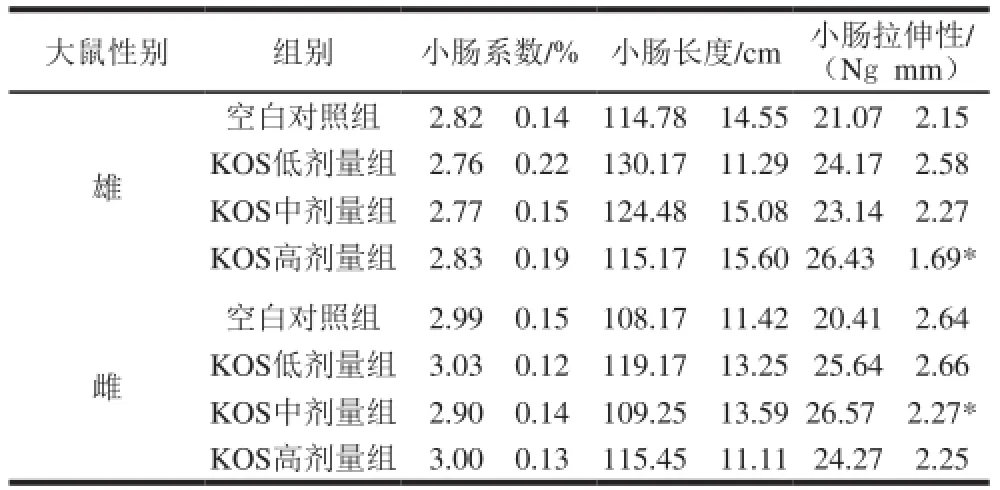
表6 KOS對大鼠小腸物理性質(zhì)的影響(x±s,n=10)Table 6 Effect of KOS on small intestinal parameters in rats (x± s,n= 10)
如表6所示,KOS各劑量組大鼠的小腸系數(shù)和小腸長度變化不明顯,而小腸拉伸性均高于空白對照組,其中雄性KOS高劑量組和雌性KOS中劑量組與空白對照組相比存在顯著差異(P<0.05),但是不存在明顯的劑量-效應(yīng)關(guān)系。上述結(jié)果表明KOS可以增加小腸的拉伸性能。目前,小腸黏膜下基質(zhì)(small intestinal submucosa,SIS)作為一種新型的生物衍生支架材料正在得到更多關(guān)注。SIS在心血管、泌尿系統(tǒng)、胃腸類等管狀組織的治療的恢復(fù)中有良好作用。但SIS作為一種組織工程化血管生物材料,必須具有適當(dāng)?shù)牧W(xué)特性如彈性,才能保證其植入宿主體內(nèi)后提供暫時(shí)的機(jī)械支撐力。因此增強(qiáng)小腸的拉伸性能可為新材料的應(yīng)用提供有利條件[29-30],而本實(shí)驗(yàn)結(jié)果表明KOS具有增加大鼠小腸拉伸性能的良好作用。
3 結(jié) 論
本實(shí)驗(yàn)通過測定大鼠糞便含水率,盲腸壁凈質(zhì)量、表面積,盲腸內(nèi)容物質(zhì)量、pH值、游離氨含量、短鏈脂肪酸含量、微生物數(shù)量、揮發(fā)性物質(zhì)種類和含量等項(xiàng)目檢測KOS對大鼠腸道健康的影響,結(jié)果表明KOS可以明顯增加大鼠糞便含水率,降低盲腸內(nèi)容物pH值和含水率;增加大鼠盲腸壁表面積,加強(qiáng)小腸的拉伸性能;增加大鼠盲腸內(nèi)容物中雙歧桿菌和乳酸菌的數(shù)量、短鏈脂肪酸的產(chǎn)生量,抑制大腸桿菌和梭狀芽孢桿菌的生長;降低大鼠盲腸內(nèi)容物中游離氨及揮發(fā)性含氮類物質(zhì)含量。
此外,從大鼠盲腸內(nèi)容物pH值、短鏈脂肪酸含量、微生物數(shù)量和揮發(fā)性物質(zhì)含量等指標(biāo)的變化趨勢可以看出,KOS體內(nèi)實(shí)驗(yàn)和體外發(fā)酵實(shí)驗(yàn)結(jié)果趨勢基本相同。由此可以推斷,KOS可以調(diào)節(jié)大鼠腸道菌群組成,改善腸道環(huán)境,促進(jìn)腸道健康,是一種優(yōu)良的益生元。
[1] LI Bin, XIE Bijun, KENNEDY J F. RETRACTED: Studies on the molecular chain morphology of konjac glucomannan[J]. Carbohydrate Polymers, 2006, 64(4): 510-515. DOI:10.1016/j.carbpol.2005.11.001.
[2] 唐貴丹, 杜小兵, 張興國, 等. 酸性乙醇法純化魔芋葡甘聚糖的研究[J].食品科學(xué), 2008, 29(12): 308-311.
[3] KATO K, WATANABE T, MATSUDA K. Studies on the chemical structure of konjac mannan: part II. Isolation and characterization of oligosaccharides from the enzymatic hydrolyzate of the mannan[J]. Agricultural and Biological Chemistry, 1970, 34(4): 532-539. DOI:10. 1080/00021369.1970.10859645.
[4] ZHANG Yingqing, XIE Bijun, GAN Xin. Advance in the applications of konjac glucomannan and its derivatives[J]. Carbohydrate Polymers,2005, 60(1): 27-31. DOI:10.1016/j.carbpol.2004.11.003.
[5] ALONSO-SANDE M, TEIJEIRO-OSORIO D, REMU?áNLóPEZ C, et al. Glucomannan, a promising polysaccharide for biopharmaceutical purposes[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2009, 72(2): 453-462. DOI:10.1016/ j.ejpb.2008.02.005.
[6] LIU Jinjin, ZHU Kunkun, YE Ting. Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J]. Food Research International, 2013, 51(2): 437-443. DOI:10.1016/ j.foodres.2013.01.002.
[7] 夏朝紅, 高山俊. 魔芋葡甘聚糖的物理化學(xué)性能及生理學(xué)應(yīng)用[J].武漢大學(xué)學(xué)報(bào)(醫(yī)學(xué)版), 2011, 32(5): 700-704.
[8] 金靈紅, 朱偉云. 魔芋葡甘聚糖功能及其應(yīng)用研究進(jìn)展[J]. 畜牧與獸醫(yī), 2014, 46(2): 97-99.
[9] AL-GHAZZEWI F H, TESTER R F, ALVANI K. The synbiotic effects of konjac glucomannan hydrolysates (GMH) and lactobacilli on the growth of Staphylococcus aureus and Salmonella typhimurium[J]. Nutrition & Food Science, 2012, 42(2): 97-101.
[10] AL-GHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2012, 92(11): 2394-2396. DOI:10.1002/jsfa.5678.
[11] 張琳. 魔芋低聚糖的制備及其性質(zhì)研究[D]. 長春: 吉林大學(xué), 2013:15-17.
[12] 丁金龍, 孫遠(yuǎn)明, 楊幼慧, 等. 魔芋葡甘聚糖機(jī)械力化學(xué)降解研究[J]. 現(xiàn)代食品科技, 2008, 24(7): 621-623. DOI:10.3969/ j.issn.1673-9078.2008.07.001.
[13] 黃永春, 謝清若, 何仁, 等. 微波輔助H2O2降解魔芋葡甘聚糖的研究[J].食品科學(xué), 2005, 26(8): 197-200.
[14] 羅清楠, 譚玉榮, 劉宏, 等. 響應(yīng)曲面法優(yōu)化酸法魔芋葡甘露聚糖水解工藝[J]. 食品科學(xué), 2012, 33(6): 119-122.
[15] 婁廣慶, 林向陽, 彭樹美, 等. 臭氧降解魔芋葡甘露聚糖的效果研究[J].食品科學(xué), 2009, 30(20): 203-206.
[16] 張迎慶, 干信, 謝筆鈞. 纖維素酶制備魔芋葡甘低聚糖[J]. 吉首大學(xué)學(xué)報(bào)(自然科學(xué)版), 2003, 21(3): 42-44. DOI:10.3969/ j.issn.1007-2985.2003.03.011.
[17] 李劍芳, 鄔敏辰, 夏文水, 等. 黑曲霉酸性β-甘露聚糖酶及制備魔芋低聚糖研究[D]. 無錫: 江南大學(xué), 2007: 23-26.
[18] 秦清娟, 徐小青, 張媛, 等. 魔芋葡甘低聚糖毒理學(xué)及腸道益生性評價(jià)[J]. 食品科學(xué), 2014, 35(21): 244-248. DOI:10.7506/spkx1002-6630-201421048.
[19] YASUHIRO K, AKIKO Y, KIRIKO H, et al. Convenient synthesis of a sialylglycopeptide-thioester having an intact and homogeneous complex-type disialyl-oligosaccharide[J]. Carbohydrate Research,2006, 341(10): 1333-1340. DOI:10.1016/j.carres.2006.04.037.
[20] 秦清娟, 張媛, 劉倍毓, 等. 半干法酶解制備魔芋葡甘低聚糖工藝及其抗氧化性能研究[J]. 食品工業(yè)科技, 2013, 34(24): 186-191.
[21] 汪建明, 趙征, 王勇志. 低聚糖的分離與鑒定[J]. 食品研究與開發(fā),2000, 21(3): 3-5. DOI:10.3969/j.issn.1005-6521.2000.03.001.
[22] 吳怡. 大黃敷臍對慢傳輸型便秘小鼠影響的實(shí)驗(yàn)研究[D]. 杭州: 浙江中醫(yī)藥大學(xué), 2014.
[23] 劉慶慶, 任文瑾, 呂嬌, 等. 花椒精灌胃劑量對去勢大鼠腸道健康的影響[J]. 食品科學(xué), 2013, 34(17): 241-245. DOI:10.7506/spkx1002-6630-201317051.
[24] 周笑犁. 大豆寡糖對腸道微生態(tài)與免疫功能的調(diào)控作用及機(jī)制研究[D]. 南昌: 南昌大學(xué), 2013: 5-6.
[25] 賈益群, 葉福媛, 王雙, 等. 生物樣品中短鏈脂肪酸的快速提取與分析方法[J]. 實(shí)驗(yàn)室研究與探索, 2012, 31(7): 262-264.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262. DOI:10.1006/meth.2001.1262.
[27] 孟凌玉. 蝦頭酶解產(chǎn)物微生物混合發(fā)酵工藝及其風(fēng)味成分的變化[D].湛江: 廣東海洋大學(xué), 2013: 32-34.
[28] 徐永霞, 劉瀅, 姜程程, 等. 固相微萃取及其在水產(chǎn)品風(fēng)味分析中的應(yīng)用[J]. 食品與發(fā)酵工業(yè), 2013, 39(8): 176-181.
[29] 冷曄, 丁祖泉, 龔璐璐. 小腸黏膜下基質(zhì)彈性模量的測定[J].中國修復(fù)重建外科雜志, 2006, 20(3): 292-294. DOI:10.3321/ j.issn:1002-1892.2006.03.026.
[30] 楊凱, 張育敏, 張乃麗, 等. 小腸黏膜下層在組織修復(fù)重建中的應(yīng)用研究進(jìn)展[J]. 中國修復(fù)重建外科雜志, 2013, 27(9): 1138-1143.
Effect of Konjac Oligosaccharides on Rat Intestinal Environment
WANG Min1, SHUAI Tiangang1, QIN Qingjuan1, ZHONG Geng1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Engineering Research Center of Regional Food, Chongqing 400716, China)
Objective: To evaluate the effect of konjac oligosaccharides (KOS), prepared by semi-drying enzymatic hydrolysis, on the rat intestinal environment. Methods: The cecal contents, cecal parameters and small intestinal parameters of Sprague-Dawley rats were measured to evaluate the safety of KOS after 30 days of dietary incorporation with KOS. Results: KOS could significantly increase the moisture content of rat feces and the surface area of the cecum wall, the tensile strength of the small intestine, the total amounts of beneficial bacteria such as Bifidobɑcterium spp., Lactobacillus and reduce pH and moisture, volatile aldehydes and nitrogenous substances contents of the cecal contents. In addition, KOS inhibited the growth of Escherichia coli and Bacterium fusiformis and increased the total amount of short-chain fatty acids (SCFAs). Conclusion: KOS can adjust the intestinal microflora, improve the intestinal environment and promote intestinal health as an excellent prebiotic.
konjac oligosaccharides (KOS); intestinal environment; cecal contents; prebiotic
10.7506/spkx1002-6630-201607036
TS201.4
A
1002-6630(2016)07-0197-07
王敏, 帥天罡, 秦清娟, 等. 魔芋葡甘低聚糖對大鼠腸道環(huán)境的影響[J]. 食品科學(xué), 2016, 37(7): 197-203. DOI:10.7506/ spkx1002-6630-201607036. http://www.spkx.net.cn
WANG Min, SHUAI Tiangang, QIN Qingjuan, et al. Effect of konjac oligosaccharides on rat intestinal environment[J]. Food Science, 2016, 37(7): 197-203. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607036. http://www.spkx.net.cn
2015-05-13
重慶市“121”科技支撐示范工程項(xiàng)目(cstc2014zktjccxyyBX0032);重慶市前沿與應(yīng)用基礎(chǔ)研究計(jì)劃一般項(xiàng)目(cstc2014jcyjA80040)
王敏(1991—),女,碩士研究生,研究方向?yàn)槭称房茖W(xué)。E-mail:414008142@qq.com
*通信作者:鐘耕(1964—),男,教授,博士,研究方向?yàn)榧Z食、油脂、植物蛋白。E-mail:zhongdg@126.com

